红托竹荪矿质元素和氨基酸需求特性研究
2022-12-22欧胜平黄万兵龚光禄刘宏宇朱国胜
欧胜平,桂 阳,黄万兵,龚光禄,刘宏宇,朱国胜
(1.贵州师范大学生命科学学院,贵阳 550001;2.贵州省农作物品种资源研究所,贵阳 550006;3.贵州省食用菌育种重点实验室,贵阳 550006;4.贵州省食用菌现代农业产业技术体系资源育种功能实验室,贵阳 550006;5.贵州省食用菌工程技术研究中心资源育种实验室,贵阳 550006)
红托竹荪(Phallusrubrovolvatus)又名竹笙、竹参,因在自然界常生长在竹子残体周边的腐殖土上且菌托呈紫红色而得名[1-2]。红托竹荪野生资源主要分布于贵州、云南、江西、四川和浙江等省[3-4],目前人工规模化栽培主要在贵州[5]。研究表明,红托竹荪富含可溶性蛋白质、游离氨基酸、VC、多糖和矿质元素[6-7],品质优于长裙竹荪和棘托竹荪[8],具有抗肿瘤、抗氧化和保护酒精性肝损伤等功能[9-11],市场空间广阔。

表1 仪器设备Table 1 Instruments and equipment
目前关于红托竹荪的研究大多局限于对常见碳氮源的筛选方面[12-13],长期以来菌丝生长缓慢的问题一直难有突破,导致在实际生产中存在菌种衰退、多次传代后生长受限和栽培周期长等问题,严重阻碍了产业发展。红托竹荪菌丝在原生境竹林中生长状况良好,在同一地点可持续出菇,未见衰退[14-15]。因此,本研究以原生境中主要伴生植物金竹、苦竹、慈竹和楠竹的根、茎、叶和蔸作为培养基质,并结合不同竹子根、茎、叶和蔸的营养成分分析,通过菌丝宏观形态评价,以期找到与红托竹荪菌丝生长相关的关键物质,并进一步验证,为红托竹荪菌丝生长培养基配方优化研究提供参考。
1 材料与方法
1.1 供试菌株
菌种Yzs 020(P.rubrovolvatus)来自贵州省农作物品种资源研究所。
1.2 试 剂
硝酸:国药集团化学试剂有限公司;钙、镁、锌、铁、铜、锰和硒7种元素标准溶液:国家有色金属及电子材料分析测试中心;17种氨基酸标准品:源叶生物;色谱级甲醇:Tedia公司;七水硫酸锌(ZnSO4·7 H2O):分析纯,成都金山化学试剂有限公司;无水硫酸铜(CuSO4):分析纯,天津市大茂化学试剂厂;无水三氯化铁(FeCl3)和无水氯化钙(CaCl2)均为分析纯,上海阿拉丁生化科技股份有限公司;无水硫酸锰(MnSO4):分析纯,上海麦克林生化科技有限公司。L-谷氨酸:分析纯,北京索莱宝科技有限公司;D-丙氨酸、L-苏氨酸、DL-丝氨酸、L-天冬酰胺和L-天门冬氨酸均为分析纯,上海阿拉丁生化科技股份有限公司。
1.3 主要设备
主要仪器设备见表1。
1.4 培养基
1.4.1菌种活化培养基
木屑50 g,马铃薯200 g,葡萄糖5 g,果糖25 g,蛋白胨2.5 g,硫酸铵2.5 g,琼脂10 g,马铃薯切片加适量纯水煮20 min后取滤液,最后纯水定容1 000 mL。
1.4.2竹子根、茎、叶、蔸培养基
以不同竹子的根、茎、叶和蔸4个不同器官为主料,烘干至恒重后粉碎过80目筛,分别单独称取不同竹子的不同器官材料50 g、琼脂10 g倒入锅中煮开后纯水定容1 000 mL,最后分装灭菌,共15种培养基,各培养基成分和编号见表2。
1.4.3矿质元素和氨基酸验证基础培养基
葡萄糖20 g,胰蛋白胨2.0 g,维生素B140 mg, 琼脂粉10 g,纯水定容1 000 mL。
1.5 实验方法
1.5.1竹子根、茎、叶、蔸培养红托竹荪实验
将灭菌的竹材料培养基置于超净工作台上,分装于平皿中,使用菌丝刚长满的活化平皿,3 mm打孔器从菌落周围打取菌片,菌丝面朝上,置25 ℃恒温培养箱中培养,每个实验处理3个重复。待菌落直径达到0.5 cm后,采用十字交叉法在菌落边缘画起始线,继续培养到菌丝生长最快的培养基即将长满平皿时,取出所有平皿画终止线,用游标卡尺测量起始线到终止线之间的距离(L),记录画线的天数(d),菌丝生长速度。菌丝长势用“+”的数量表示好,“+”数量越多表示菌丝长势越好,反之则越少(表3)。

表2 培养基Table 2 Culture medium
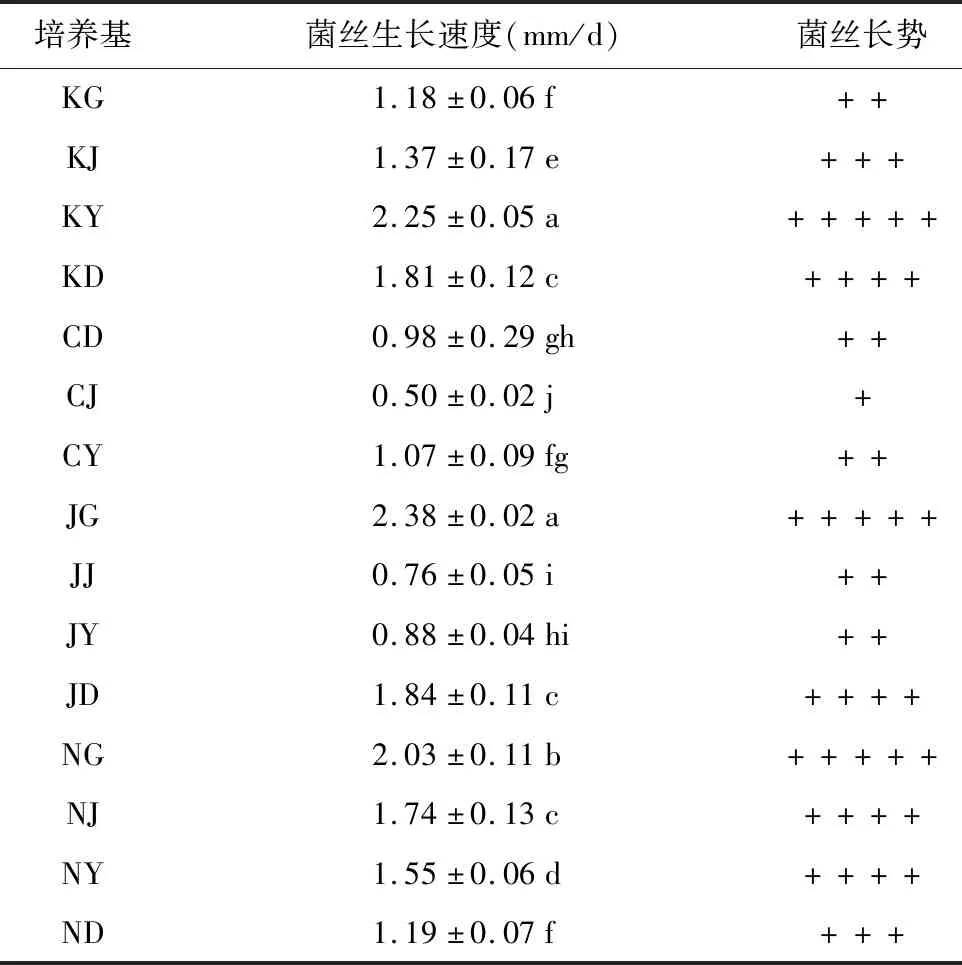
表3 竹子不同器官对红托竹荪菌丝生长差异分析Table 3 Variation analysis of different organs of bamboo on mycelial growth of P. rubrovolvatus
1.5.2竹子根、茎、叶、蔸中矿质元素和氨基酸含量与红托竹荪菌丝生长相关性实验
竹子根、茎、叶中矿质元素含量测定参照文献[16]的方法,氨基酸含量测定方法参照标准GB/T 30987-2020[17]。使用软件SPSS 24.0中的双变量相关分析法对红托竹荪菌丝生长速度与竹子中物质含量之间进行相关性分析。
1.5.3矿质元素验证实验
在基础培养基中分别添加Zn2+(ZnSO4·7 H2O为添加剂,Zn2+浓度为2 μmol/L、20 μmol/L、200 μmol/L、2 000 μmol/L、20 000 μmol/L),Fe3+(以FeCl3为添加剂,Fe3+的浓度为1 μmol/L、10 μmol/L、100 μmol/L、1 000 μmol/L、10 000 μmol/L),Mn2+(以MnSO4为添加剂,Mn2+的浓度为1 μmol/L、10 μmol/L、100 μmol/L、1 000 μmol/L),Ca2+(以CaCl2为添加剂,Ca2+的浓度为1 mmol/L、10 mmol/L、100 mmol/L、1 000 mmol/L)。接种、培养、记录和测量等同1.5.1项。
1.5.4氨基酸验证实验
在基础培养基中分别添加D-丙氨酸浓度为0.1 mg/L、1 mg/L、10 mg/L、100 mg/L、1 000 mg/L;DL-丝氨酸浓度为1 mg/L、10 mg/L、100 mg/L、1 000 mg/L;L-苏氨酸浓度为0.1 mg/L、1 mg/L、10 mg/L、100 mg/L、1 000 mg/L;L-谷氨酸浓度为0.1 mg/L、1 mg/L、10 mg/L、100 mg/L、1 000 mg/L。L-天门冬氨酸浓度为0.1 mg/L、1 mg/L、10 mg/L、100 mg/L、1 000 mg/L;L-天冬酰胺浓度为0.1 mg/L、1 mg/L、10 mg/L、100 mg/L、1 000 mg/L。接种、培养、记录和测量等同1.5.1项。
1.6 数据处理
数据统计在SPSS 24.0软件和Excel软件中进行。
2 结果与分析
2.1 新鲜竹子根、茎、叶、蔸对红托竹荪菌丝生长速度的影响
不同竹子培养基中菌丝生长速度和长势见表3。从菌丝生长速度来看,4种新鲜竹子的根、茎、叶、蔸对菌丝生长影响差异较大。在所有竹子培养基中,红托竹荪菌丝在金竹根(JG)培养基中生长速度最快,生长速度为2.38 mm/d,苦竹叶(KY)培养基次之,生长速度为2.25 mm/d,这两种培养基的菌丝生长速度差异不显著,但和其他13个竹子培养基中菌丝生长速度比较都存在显著差异,而金竹茎(JJ)和慈竹茎(CJ)培养基中菌丝生长最慢,生长速度分别为0.76 mm/d和0.50 mm/d。 15个竹子培养基中菌丝生长速度依次为:金竹根(JG)>苦竹叶(KY)>楠竹根(NG)>金竹蔸(JD)>苦竹蔸(KD)>楠竹茎(NJ)>楠竹叶(NY)>苦竹茎(KJ)>楠竹蔸(ND)>苦竹根(KG)>慈竹叶(CY)>慈竹蔸(CD)>金竹叶(JY)>金竹茎(JJ)>慈竹茎(CJ)。从菌丝长势和菌落形态来看(图1),苦竹叶(KY)培养基中菌丝洁白、浓密粗壮,长势最好;金竹根(JG)培养基中菌丝长势好,但菌丝却较为稀疏、纤细;慈竹茎(CJ)培养基中菌丝长势最差,菌丝稀疏纤细。

图1 菌落形态(20 days)Fig.1 Colony morphology (20 days)

表4 竹子矿质元素含量Table 4 Mineral element content of bamboo 单位:mg/kg
同一种器官不同竹子进行比较可知,竹叶培养中菌丝生长速度依次为:苦竹叶(KY)>楠竹叶(NY)>慈竹叶(CY)>金竹叶(JY),4种不同竹叶之间显著差异明显;竹茎中菌丝生长速度依次苦竹茎(KJ)>楠竹茎(NJ)>金竹茎(JJ)>慈竹茎(CJ),4种不同竹茎之间都存在显著差异;竹蔸中菌丝生长速度依次为,苦竹蔸(KD)>金竹蔸(JD)>楠竹蔸(ND)>慈竹蔸(CD),4种不同竹篼之间显著差异明显;竹根中菌丝生长速度依次为,金竹根(JG)>楠竹根(NG)>苦竹根(KG),3种不同竹篼之间都存在显著差异;从菌丝长势来看,竹叶培养中苦竹叶(KY)长势最好,楠竹叶(NY)次之,第三是慈竹叶(CY),最差的是金竹叶(JY);竹茎培养基中,苦竹茎(KJ)长势最好,楠竹茎(NJ)次之,第三是金竹茎(JJ),最差的为慈竹茎(CJ);竹蔸培养基中,苦竹蔸(KD)长势最好,金竹蔸(JD)次之,第三是楠竹蔸(ND),最差的为慈竹蔸(CD);在竹根培养基中,金竹根(JG)和楠竹根(NG)最好,苦竹根(KG)长势较差。

表5 红托竹荪菌丝生长速度与矿质元素相关性分析Table 5 Correlation analysis between mycelial growth and mineral elements of P. rubrovolvatus

表6 竹子氨基酸含量Table 6 Amino acid content of bamboo 单位:μg/g
整体上来看,菌丝生长速度和长势在苦竹中表现要优于其他3种竹子、楠竹次之,其次为金竹,慈竹中菌丝表现最差,不同竹不同器官菌丝生长表现无明显规律。
2.2 不同竹子根、茎、叶中矿质元素含量与红托竹荪菌丝生长速度的相关性
不同竹子根、茎、叶中矿质元素含量测定结果见表4。12种竹子材料都含有7种矿质元素,不同材料中矿质元素含量差异较大,整体来看七种矿质元素的总体趋势为Ca>Mg>Fe>Mn>Zn>Cu>Se。
对不同竹子根、茎、叶中矿质元素含量与红托竹荪菌丝生长速度之间进行相关性分析,结果(表5)表明,红托竹荪菌丝生长速度与Ca、Mn、Zn和Fe四种矿质元素含量呈显著正相关,相关性强弱从大到小依次为Mn、Ca、Zn和Fe,而与Mg、Cu和Se三种元素含量的相关性不显著。
2.3 不同竹子根、茎、叶中氨基酸含量与红托竹荪菌丝生长速度的相关性
不同竹子根、茎、叶中氨基酸含量测定结果见表6,12种竹子材料都含有17种氨基酸,不同材料中氨基酸含量差异较大,总体看竹子中17种氨基酸含量较高的有天冬酰胺、天门冬氨酸、谷氨酸和丙氨酸4种氨基酸。
对不同竹子根、茎、叶中氨基酸含量与红托竹荪菌丝生长速度之间进行相关性分析,结果(表7)表明,天冬酰胺、天门冬氨酸、谷氨酸、丙氨酸、苏氨酸和丝氨酸与红托竹荪菌丝生长速度呈显著的正相关,相关性强弱从大到小依次为丙氨酸、天冬酰胺、天门冬氨酸、谷氨酸、丝氨酸和苏氨酸。
2.4 矿质元素验证实验
由表8和图2可知,在基础培养基中添加不同浓度的ZnSO4·7 H2O对红托竹荪菌丝生长影响差异大,从菌丝生长速度来比较,在基础培养基中添加浓度20~2 000 μmol/L的ZnSO4·7 H2O时,对红托竹荪菌丝生长有促进作用,其中添加浓度为20 μmol/L时对菌丝生长促进效果最明显,与除200 μmol/L外的其他实验组相比都存在显著差异,而当基础培养基中添加ZnSO4·7 H2O的浓度达到20 000 μmol/L时菌丝不生长,与其他添加浓度相比都存在显著差异。在基础培养基中添加ZnSO4·7 H2O时,随着添加浓度的增加菌丝生长速度呈先上升后下降的变化趋势。而从菌丝长势和菌落形态来看,在基础培养基中添加浓度20~2 000 μmol/L的ZnSO4·7 H2O时菌丝长势优于对照组,其中添加浓度为20 μmol/L时菌落特征表现最佳,其菌落菌丝洁白浓密。

表7 红托竹荪菌丝生长速度与氨基酸相关性分析Table 7 Correlation analysis between mycelial growth and amino acids of P. rubrovolvatus

表8 Zn2+对红托竹荪菌丝生长速度和长势的影响Table 8 Effect of Zn2+ on mycelial growth rate of P. rubrovolvatus

图2 菌落形态(20 d, Zn2+)Fig.2 Colony morphology (20 days, Zn2+)
由表9和图3可知,在基础培养基中添加不同浓度的FeCl3对红托竹荪菌丝生长影响差异大,从菌丝生长速度来比较,在基础培养基中添加浓度10~100 μmol/L 的FeCl3时,对红托竹荪菌丝生长有促进作用,与除了添加100 μmol/L的其他实验组相比都存在显著差异,而当基础培养基中添加FeCl3的浓度达到10 000 μmol/L时菌丝死亡。在基础培养基中添加FeCl3时,随着添加浓度的增加菌丝生长速度呈先上升后下降的变化趋势,超过极限耐受浓度菌丝死亡。而从菌丝长势和菌落形态来看,在基础培养基中添加浓度10~100 μmol/L的FeCl3时,菌落菌丝的色泽和长势都要优于对照组,其中添加浓度为10 μmol/L时菌落特征表现最佳,其菌落边缘整齐、菌丝洁白浓密。

表9 Fe3+对红托竹荪菌丝生长速度和长势的影响Table 9 Effect of Fe3+ on mycelial growth rate and growth of P. rubrovolvatus

图3 菌落形态(20 d, Fe3+)Fig.3 Colony morphology (20 days, Fe3+)
由表10和图4可知,在基础培养基中添加不同浓度的MnSO4对红托竹荪菌丝生长影响差异大,从菌丝生长速度来比较,在基础培养基中添加浓度1~100 μmol/L的MnSO4时,对红托竹荪菌丝生长有促进作用,其中添加浓度为100 μmol/L时对菌丝生长促进效果最明显,与除了添加10 μmol/L的其他实验组相比都存在显著差异,而当基础培养基中添加MnSO4的浓度达到1 000 μmol/L时抑制菌丝的生长,与其他添加浓度相比都存在显著差异。在基础培养基中添加MnSO4时,随着添加浓度的增加菌丝生长速度呈先上升后下降的变化趋势。而从菌丝长势和菌落形态来看,在基础培养基中添加浓度1~1 000 μmol/L的MnSO4时,菌落菌丝的色泽和长势都要优于对照组,其中添加浓度为100 μmol/L时菌落特征表现最佳,其菌落边缘整齐、菌丝洁白浓密。
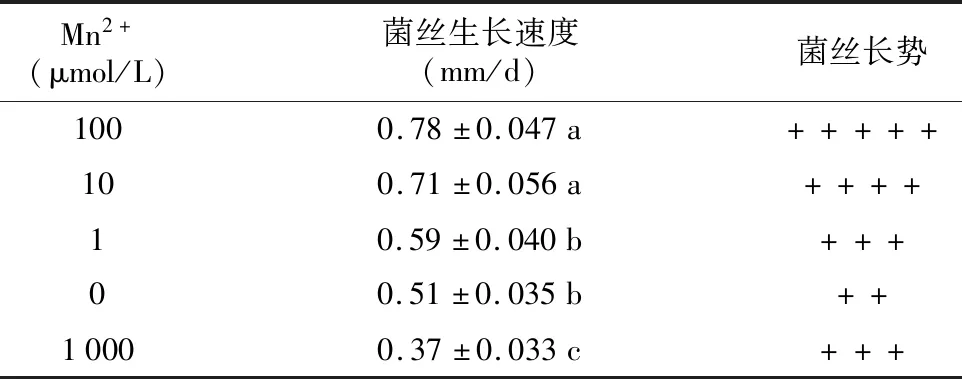
表10 Mn2+对红托竹荪菌丝生长速度和长势的影响Table 10 Effect of Mn2+ on mycelial growth rate and growth of P. rubrovolvatus

图4 菌落形态(20 d, Mn2+)Fig.4 Colony morphology (20 days, Mn2+)
由表11可知,在基础培养基中添加浓度10~100 mmol/L的CaCl2时,对红托竹荪菌丝生长有促进作用,其中添加浓度为10 mmol/L时对菌丝生长促进效果最明显,与除了添加100 mmol/L的其他实验组相比都存在显著差异,而当基础培养基中添加CaCl2的浓度达到1 000 mmol/L时抑制菌丝的生长,与其他添加浓度相比都存在显著差异。在基础培养基中添加CaCl2时,随着添加浓度的增加,菌丝生长速度呈先上升后下降的变化趋势。从菌丝长势和菌落形态可知(图5),在基础培养基中添加浓度1~10 mmol/L的CaCl2时,菌落边缘整齐,菌丝浓密度和长势都要优于对照组,而当其中添加浓度为100~1 000 mmol/L时菌落特征表现出边缘不整齐。

表11 Ca2+对红托竹荪菌丝生长速度和长势的影响Table 11 Effect of Ca2+ on mycelial growth rate and growth of P. rubrovolvatus

图5 菌落形态(20 d, Ca2+)Fig.5 Colony morphology (20 days, Ca2+)
2.5 氨基酸验证实验
由表12可知,在基础培养基中添加浓度为10 mg/L时,D-丙氨酸对红托竹荪菌丝生长促进作用最明显,与其他添加浓度的菌丝生长速度相比都存在显著差异,D-丙氨酸添加浓度为0.1 mg/L、1 mg/L、100 mg/L和1 000 mg/L时菌丝生长速度都低于对照组。由图6可知,在基础培养基中添加不同浓度D-丙氨酸对菌落特征的影响不明显。
由表13可知,在基础培养基中添加浓度为10~100 mg/L时,DL-丝氨酸对红托竹荪菌丝生长有促进作用,其中添加浓度为10 mg/L时对菌丝生长促进作用最明显,与除了添加100 mg/L的其他实验组菌丝生长速度相比都存在显著差异。而当基础培养基中添加DL-丝氨酸的浓度大于100 mg/L时,菌丝生长速度下降。由图7可知,在基础培养基中添加低浓度DL-丝氨酸时,菌落边缘整齐,而添加浓度达到1 000 mg/L时菌落边缘不整齐。

图6 菌落形态(20 d, D-丙氨酸)Fig.6 Colony morphology (20 days, D-alanine)

表12 D-丙氨酸对红托竹荪菌丝生长速度和长势的影响Table 12 Effect of D-alanine on mycelial growth rate and growth of P. rubrovolvatus

表13 DL-丝氨酸对红托竹荪菌丝生长速度和长势的影响Table 13 Effect of DL-serine on mycelial growth rate and growth of P. rubrovolvatus

图7 菌落形态(20 d, DL-丝氨酸)Fig.7 Colony morphology (20 days,DL-serine)
由表14可知,在基础培养基中添加L-苏氨酸的浓度在10~1 000 mg/L的范围内,L-苏氨酸对红托竹荪菌丝生长有促进作用,其中添加浓度为100 mg/L时对菌丝生长促进效果最明显,与其他添加浓度相比都存在显著差异,而当添加浓度大于100 mg/L时,菌丝生长速度开始下降。从菌丝长势和菌落形态来看(图8),在基础培养基中添加浓度为100 mg/L的 L-苏氨酸时,菌落的气生菌丝要最多,菌丝长势最好。
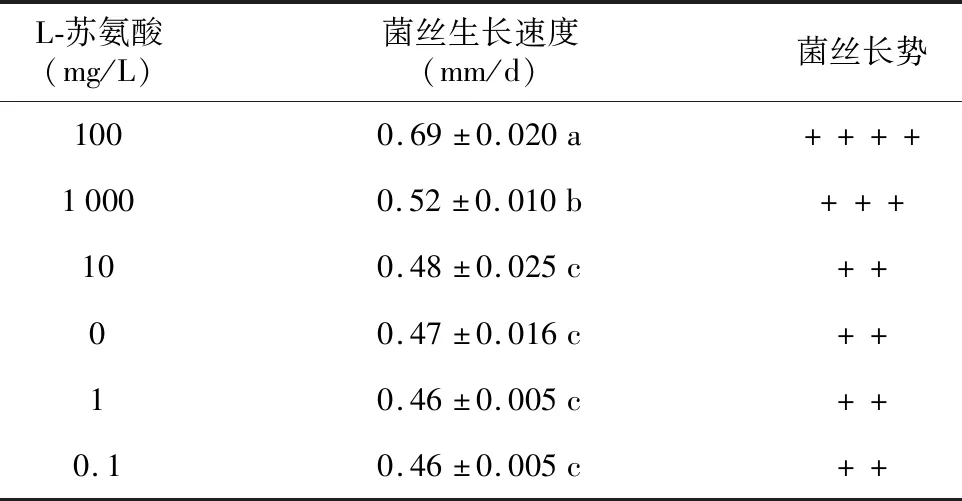
表14 L-苏氨酸对红托竹荪菌丝生长速度和长势的影响Table 14 Effect of L-threonine on mycelial growth rate and growth of P. rubrovolvatus

图8 菌落形态(20 d, L-苏氨酸)Fig.8 Colony morphology (20 days, L-threonine)
由表15可知,在基础培养基中添加L-谷氨酸,添加浓度小于100 mg/L时,对菌丝生长促进作用不明显,而当添加L-谷氨酸的浓度为100 mg/L时,L-谷氨酸对红托竹荪菌丝生长有促进作用,与其他添加浓度相比都存在显著差异,添加浓度超过100 mg/L菌丝生长速度开始下降。从菌丝长势和菌落形态来看(图9),在基础培养基中添加浓度100~1 000 mg/L 的L-谷氨酸时,菌落菌丝的色泽和长势都要优于对照组,其中添加浓度为100 mg/L时菌落特征表现最佳,菌丝长势旺盛、洁白浓密。
由表16可知,在基础培养基中添加L-天门冬氨酸的浓度在0.1~10 mg/L范围内,L-天门冬氨酸对红托竹荪菌丝生长有促进作用,其中添加浓度为1 mg/L时对菌丝生长促进效果最明显,与其他添加浓度相比都存在显著差异,而当基础培养基中添加L-天门冬氨酸的浓度达到1 000 mg/L时菌丝生长受到抑制。在基础培养基中添加L-天门冬氨酸,随着添加浓度的增加菌丝生长速度呈先上升后下降的变化趋势。从菌丝长势和菌落形态来看(图10),在基础培养基中添加浓度0.1~10 mg/L的L-天门冬氨酸时,菌落菌丝的色泽和长势都要优于对照组,其中添加浓度为1 000 mg/L时菌丝稀疏、长势弱,同时菌落开始变红。

表15 L-谷氨酸对红托竹荪菌丝生长速度和长势的影响Table 15 Effect of L-glutamic acid on mycelial growth rate and growth of P. rubrovolvatus

图9 菌落形态(20 d, L-谷氨酸) Fig.9 Colony morphology (20 days, L-glutamic acid)

表16 L-天门冬氨酸对红托竹荪菌丝生长速度和长势的影响Table 16 Effect of L-aspartic acid on mycelial growth rate and growth of P. rubrovolvatus

图10 菌落形态(20 d, L-天门冬氨酸)Fig.10 Colony morphology (20 days, L-aspartic acid)
由表17可知在基础培养基中添加L-天冬酰胺,随着添加浓度的增加菌丝生长速度呈先上升后下降的变化趋势。基础培养基中添加L-天冬酰胺的浓度在0.1~100 mg/L范围内,L-天冬酰胺对红托竹荪菌丝生长有促进作用,其中添加浓度为100 mg/L时对菌丝生长促进效果最明显,与其他添加浓度的菌丝生长速度相比都存在显著性差异。从菌丝长势和菌落形态来看(图11),在基础培养基中添加浓度10~100 mg/L的L-天冬酰胺时,菌落菌丝的浓密度和长势都要优于其他添加浓度,其中添加浓度为100 mg/L时菌落特征表现最佳,菌丝长势旺盛、洁白浓密。
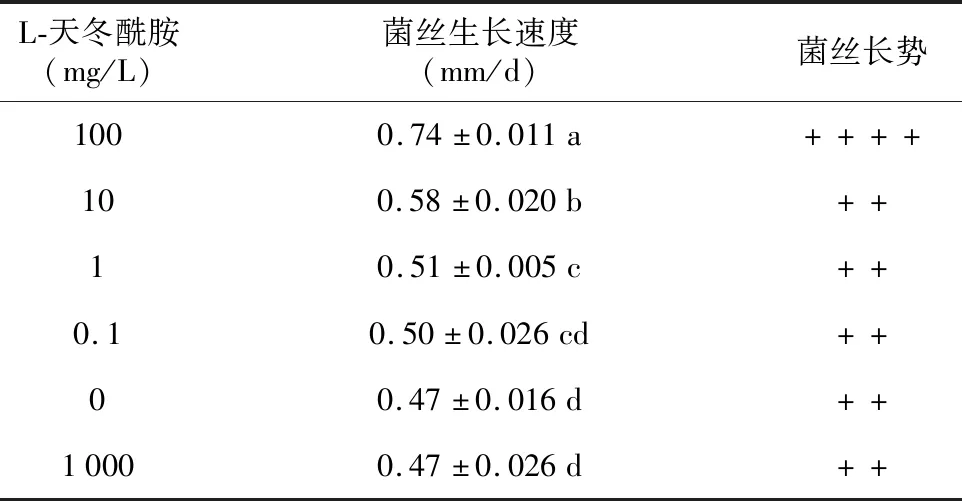
表17 L-天冬酰胺对红托竹荪菌丝生长速度和长势的影响Table 17 Effect of L-asparagine on mycelial growth rate and growth of P. rubrovolvatus
3 结论和讨论
通过研究原生境中不同竹子的根、茎、叶对红托竹荪菌丝生长的影响,并结合根、茎、叶中矿质元素和氨基酸含量分析,结果发现,4种矿质元素(Ca、Mn、Zn、Fe)及6种氨基酸(天冬酰胺、天门冬氨酸、谷氨酸、丙氨酸、苏氨酸和丝氨酸)与红托竹荪菌丝生长速度呈显著正相关;进一步采用单因素试验分别验证相关性物质对菌丝生长的影响,结果表明,在基础培养基中添加一定浓度相关性物质对菌丝生长均有促进作用,Zn2+的最适添加浓度为20 μmol/L,Fe3+的最适添加浓度为10 μmol/L,Mn2+的最适添加浓度为100 μmol/L,Ca2+的最适添加浓度为10 mmol/L,D-丙氨酸的最适浓度为10 mg/L,DL-丝氨酸的最适添加浓度为10 mg/L,L-苏氨酸的最适添加浓度为100 mg/L,L-谷氨酸的最适添加浓度为100 mg/L,L-天门冬氨酸的最适添加浓度为1 mg/L,L-天冬酰胺的最适添加浓度为100 mg/L。

图11 菌落形态(20 d, L-天冬酰胺)Fig.11 Colony morphology (20 days, L-asparagine)
矿质元素可作为酶的组成部分并维持酶的活性,冯光志等[18]在对平菇的研究中发现,在培养基中添加Zn2+可通过调节羟甲基纤维素酶的分泌来促进菌丝生长;胡越等[19]对糙皮侧耳的研究发现,在培养基中添加适量的Mn2+可提高漆酶和锰过氧化物酶的活性;而漆酶、锰过氧化物酶和羟甲基纤维素酶主要降解木质纤维素[20-22]。本研究发现,竹子培养基中Mn、Zn的含量与红托竹荪菌丝生长速度存在显著相关性,由此推测红托竹荪菌丝生长可能受锰过氧化物酶、漆酶和羟甲基纤维素酶等胞外酶分解利用竹子木质纤维素的影响。另外,添加适量的Fe3+、Ca2+对红托竹荪菌丝生长有促进作用,具体生理生化响应机制尚不明确。潘维新,付庭治[23]的研究发现,铁元素能增加食用菌菌丝细胞膜的透性,促进细胞膜脂透入,再与细胞膜内的蛋白质、多糖结合,形成蛋白铁或多糖铁。在高植物研究中通过添加外源Ca2+可提高体内活性氧清除酶活性并降低丙二醛的含量,缓解盐胁迫对植物细胞膜的损害,从而维持细胞膜的稳定性和功能性[24];丁晓[25]的研究发现,添加外源Ca2+对香菇菌丝生长有同样的作用。本研究发现,在基础培养基中添加一定浓度Ca2+、Zn2+、Fe3+和Mn2+均能促进红托竹荪菌丝的生长,低浓度时,菌丝生长速度随矿质元素添加浓度的增加而升高,而当添加浓度达到一定高浓度时菌丝生长受到抑制,甚至死亡,与糙皮侧耳[26]、真姬菇[27]和金针菇[28]等食用菌研究的结果类似。矿质元素除了作为酶的组成部分并维持酶的活性外,还能调节细胞的渗透压,培养基中矿质元素含量过高,必然造成食用菌生长环境的高渗透压,而大部分食用菌在高渗透的培养基上代谢活动降低,从而导致菌丝生长受抑制[29]。
氨基酸是构成蛋白质的基本单位,是生物体不可缺少的重要营养之一,本研究结果表明,红托竹荪菌丝可以很好地吸收利用D-丙氨酸、DL-丝氨酸、L-天门冬氨酸、L-苏氨酸、L-天冬酰胺这六种氨基酸,菌丝生长都呈现先促进后抑制的趋势,这与添加外源氨基酸对黑木耳和黑牛肝菌等食用菌菌丝生长影响的研究结果类似[30-31]。常婷婷[32]研究表明,添加丙氨酸、丝氨酸和天冬酰胺3种外源氨基酸复配溶液能明显提高香菇菌丝转氨酶活性并减少丙二醛的积累;转氨酶是氨基酸代谢中的重要酶,其活性的高低可以反映生物体氮代谢的强弱,从而影响生物体的蛋白质代谢和生长发育;另外聚天门冬氨酸同源多肽分子末端的氨基和羧酸官能团与金属离子配位结合形成植物易吸收的形式[33],从而提高了植物对矿质元素的利用。本课题组前期研究表明,矿质元素对红托竹荪菌丝生长影响显著,推测氨基酸对红托竹荪菌丝生长的影响可能与矿质元素的吸收利用有关。NADPH氧化酶是一个多亚基构成的蛋白复合物,可催化胞外O2生成超氧阴离子,并以此为基础产生活性氧(reactive oxygen species,ROS)[34],ROS 在细胞中发挥着双重作用:适量的ROS可防御调节细胞受到的胁迫,过量则会造成细胞组分的损伤,影响细胞正常生命活动的进行[35];李银凤,刘晓柱[36]对平菇和双色腊蘑2种食用菌中NADPH氧化酶A蛋白结构分析发现,A蛋白质中存在着大量丝氨酸和苏氨酸的磷酸化位点。外源丝氨酸和苏氨酸是否通过调节NADPH氧化酶的活性来影响红托竹荪菌丝生长有待进一步研究。
