过量表达NtCAF1基因对烟草腺毛密度的影响
2022-12-22宫沛文吴秀双孟淑真吴拥军
宫沛文,吴秀双,孟淑真,陈 曦,吴拥军
(贵州大学生命科学学院/农业生物工程研究院,山地植物资源保护与种质创新教育部重点实验室,贵阳 550025)
烟草是主要的经济作物之一,在世界各地均有大面积栽培[1]。植物腺毛对植物抗逆境胁迫、植物病虫害防治等有很大影响。烟草的长柄腺毛是二萜和糖脂合成的重要场所,二萜和糖脂不仅是重要香气物质前体,对蚜虫抗性也有较大影响。而短柄腺毛是叶面抗性蛋白的合成场所,叶面抗性蛋白在抑制孢子萌发和抵抗真菌侵染中起重要作用[2]。腺毛主要分布在植物茎、叶的表面,其发育受多种植物激素等内部信号及光、温等环境信号的调控[3]。多种内外因素通过影响转录因子的水平,进而影响腺毛发育相关基因的表达,进而调控腺毛发育。
在本氏烟草的一系列研究中发现了与烟草腺毛发育相关的基因和转录因子:C 2 H 2锌指转录因子NbGIS能导致烟草增加腺毛[4-5]。NbGIS由赤霉素(GA)诱导并作用于GA生物合成基因的下游,通过下游的R 2 R 3-MYB类转录因子NbMYB123-like(AtMYB123的同源物)正向调控烟草腺毛状体的启动[5]。Wu等[6]克隆了两个烟草基因,即NbCycB2和NbWo(SlCycB2和SlWo的同源物),并证明NbWo蛋白通过结合启动子区域中的L 1-like框直接调节NbCycB2的表达。该研究还表明NbCycB 2蛋白可以通过结合NbWo蛋白的LZ结构域来抑制毛状体的起始,这是在烟草中发现的一种相互调节的新机制。虽然拟南芥表皮毛发育模型已被逐步阐明[7],但烟草腺毛调控模型还未建立,与腺毛发育相关的几个基因刚被研究发现,腺毛发生的分子机制还有待研究。
前期研究发现,转ChIFN-γ烟草的腺毛密度增加了一倍以上[8]。通过Agilent基因芯片检测差异基因,筛选到NtCAF1,分析可能与烟草腺毛的起始和发育有关。CCR 4-associated factor 1(CAF 1),是CCR 4-NOT复合体的关键亚基,是一种进化保守的蛋白质复合体,参与控制转录和mRNA去腺苷化和RNA降解。有研究证实CAF 1与细胞周期激酶(DBF 2)相互作用,直接参与细胞的周期调控及细胞代谢调控[9-10]。在番茄中异源过表达辣椒CaCAF1后表现出生长显著增强,叶片厚度增加及对卵菌致病菌疫霉的抗性增强,其中参与多胺生物合成、防御反应和细胞壁器官发生的基因上调[11-12]。拟南芥过量表达AtCAF1A对PST DC 3000(PseudomonassyringaepvtomatoDC 3000)病原体的抗性增强[13]。盐生杜氏藻DsCAF 1响应高渗、低渗、冷、热或紫外线的胁迫环境[14]。以上研究结果表明,CAF1在植物的生长发育和防御病原体方面发挥着重要作用。在烟草中,NtCAF1是否参与腺毛起始和发育,NtCAF1是否影响激素合成。迄今为止,烟草腺毛发育的分子机制仍不清楚。本研究以过表达NtCAF1烟草为实验材料,研究NtCAF1对烟草腺毛发育的影响,可为深入解析烟草腺毛发育的信号转导机制奠定基础。
1 材料与方法
1.1 材 料
所用烟草品种为三星烟草(Nicotianatabacumcv. Xanthin),由贵州大学烟草学院提供。pSH 737植物过表达载体、农杆菌LBA 4404由贵州大学农业生物工程研究院提供。
1.2 方 法
1.2.1基因表达模式分析
取3周龄且长势一致的烟草根、茎、叶和12周的花各1 g,经液氮速冻后保存于-80 ℃冰箱。取0.1 g植物组织提取RNA,提取程序参照TAKARA公司的植物RNA提取试剂盒说明书进行。取1 μg RNA反转录,程序参照GeneStar公司的反转录试剂盒说明书进行。根据NtCAF1的ORF序列设计引物F 1和R 1(表1),以烟草EF-1α为内参基因(引物为F 2和R 2),按照GeneStar公司的2×RealStar Green Fast Mixture试剂盒说明书进行实时荧光定量PCR反应(qRT-PCR)。20 μL反应体系:2×RealStar Green Fast Mixture with ROX Ⅱ10.0 μL,上、下游引物(10.0 μmol/L)各0.5 μL,cDNA 1.0 μL,RNase-free H2O 8.0 μL。反应条件为95 ℃ 2 min;95 ℃ 15 s、60 ℃ 15 s、72 ℃ 30 s、40次循环。每个反应重复3次,采用2-ΔΔCt法[15]进行分析。
1.2.2载体构建
实验前期已获得将NtCAF1克隆连接到pGEM-T质粒上[16],以pGEM-T-NtCAF1模板PCR扩增NtCAF1片段(引物为F 3和R 3),胶回收纯化基因片段产物。限制性内切酶Xba Ⅰ和Sma Ⅰ同时酶切胶回收片段和pSH 737质粒,使用PlasmidMini Kit Ⅰ试剂盒纯化pSH 737质粒酶切产物,用DNA LigationKit连接纯化后的基因片段与载体,将NtCAF1基因插入到表达载体pSH 737中,重组载体暂命名为pSH 737-NtCAF1。将连接产物转化入大肠杆菌DH 5α感受态细胞中,通过菌落PCR、质粒PCR和测序验证表达载体后,通过冻融法转化到农杆菌LBA 4404。
1.2.3烟草遗传转化与鉴定
烟草转基因采用叶盘转化法参考王关林[17]的方法。GUS染色程序参照北京华越洋生物科技有限公司的GUS染色试剂盒说明书进行。植物DNA提取参照OMEGA公司的SP Plant DNA Kit试剂盒说明书提取抗性苗叶片DNA,进行基因组PCR反应(引物为F 4和R 4),PCR扩增产物经1%琼脂糖凝胶电泳,筛选阳性转基因株系。利用F 1和R 1引物对过表达抗性株系进行qRT-PCR。检测分析方法同1.2。

表1 引物信息Table 1 Primer information
1.2.4烟草叶片腺毛形态观察
烟草叶片腺毛组织化学染色法参考Zhang等[18]的方法。利用超景深显微镜(VHR-7000)对叶片表面进行观察,并在上表皮中随机选择3个视野进行腺毛密度统计分析。
1.2.5烟草叶片激素含量测定
样品前处理:取过表达NtCAF1基因烟草和野生型烟草从上至下第4~5个叶片。迅速置于灭菌的研钵中(提前用液氮预冷)研磨,称量0.400 g粉碎后的样品于玻璃试管中。参考周幼成等[19]的方法处理。取上清用氮吹机吹干,用400 μL含0.1%甲酸的甲醇溶液溶解,混匀,滤膜过滤,待测(植物激素不稳定,提取过程应全程保持在冰盒上操作)。
检测方法:色谱条件参考翁文昕等[20]的方法。梯度洗脱程序0~9 min 20%~80%A、9~10.5 min 80%A、10.5~10.6 min 80%~20%A、10.6~13.5 min 20%A。质谱条件参考莫文娟等[21]的方法。测定烟草叶片中茉莉酸(JA)、脱落酸(ABA)、GA3的含量。
1.2.6数据处理和统计方法
所有数据使用GraphPad Prism 8.0软件进行整理并进行显著性分析,数据处理采用T-Test检验分析。质谱数据使用Analyst软件处理、分析。
2 结果与分析
2.1 NtCAF1表达模式分析
qRT-PCR结果表明,NtCAF1在烟草的根、茎、叶、花中均有表达,其中叶片中的表达水平最高,是花的8.0倍(图1)。NtCAF1表达水平在根和花中较低。说明NtCAF1主要在烟草叶片中富集表达。

注:“*”,“**”分别表示相对于花差异显著(p<0.05)和极显著(p<0.01)。图1 NtCAF1基因表达模式分析Fig.1 Analysis of NtCAF1 gene expression pattern
2.2 烟草NtCAF1基因的植物表达载体构建
PCR扩增NtCAF1目的片段,经琼脂糖凝胶电泳后在855 bp左右处有亮带,条带大小与预期相符(图2 A),随机挑取5个单克隆经F 4和R 4引物菌落PCR验证,电泳结果均为阳性单克隆(图2 B)。提取1号和2号菌液质粒,经F 4和R 4引物质粒PCR验证,其结果与菌落PCR结果一致,均特异性扩增到了符合预期大小的目的片段(图1 C),证明成功将NtCAF1基因构建到pSH 737载体。并将质粒送上海生工测序检测。测序结果表明,NtCAF1基因已经重组到pSH 737载体上,且没有碱基序列突变,pSH 737-NtCAF1载体构建成功。
2.3 pSH 737-NtCAF1载体在烟草中的遗传转化与鉴定
采用叶盘转化法遗传转化烟草叶片。取烟草生根苗幼叶进行GUS染色(图3),提取幼叶基因组DNA,经F 4和R 4引物PCR检测阳性转基因植株(图4)。最终获得转空载和过表达NtCAF1基因烟草的阳性植株分别为4株和19株。

注:1为DL 2 000 Marker;A为2~3:NtCAF1片段PCR产物;B为2~6:NtCAF1过表达载体菌落PCR产物;C为2~3:NtCAF1过表达载体质粒PCR产物。图2 植物表达载体构建Fig.2 Construction of plant expression vector
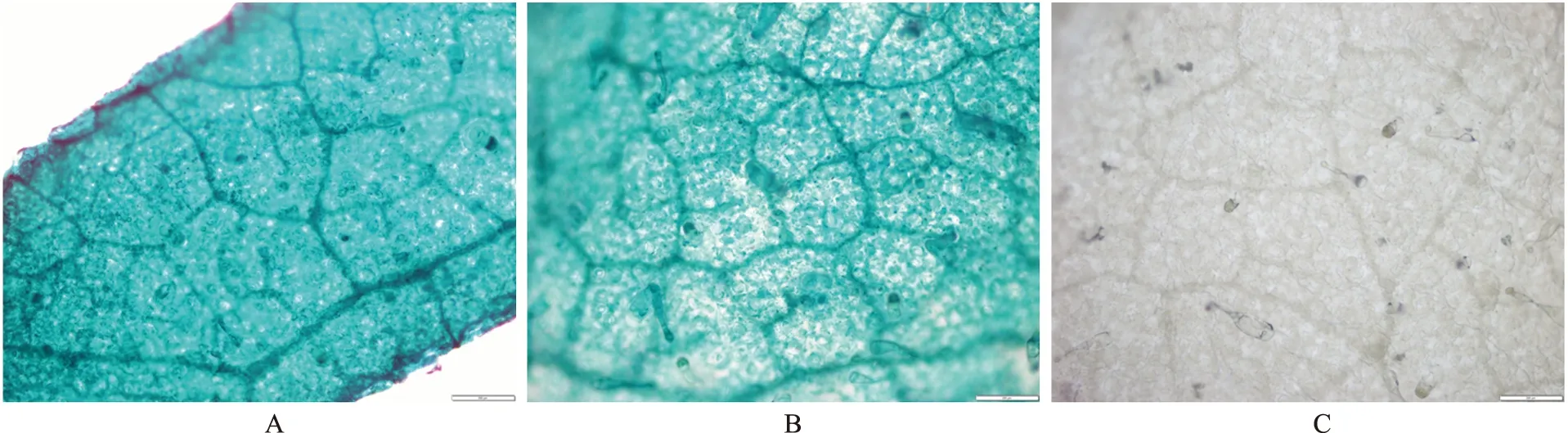
注:A为过表达NtCAF1烟草;B为转空载烟草;C为野生型烟草。图3 转基因植株的叶片细丝GUS染色显微镜观察Fig.3 GUS staining microscope observation of leaf filaments of transgenic plants
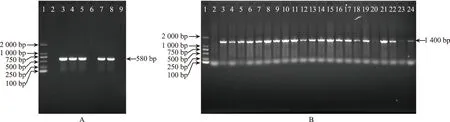
注:1为DL 2 000 Marker;2为野生型烟草(阴性对照);A为3:pSH 737载体质粒PCR产物(阳性对照);4~8为转空载烟草;B为3:pSH 737-35 S-NtCAF1载体质粒PCR产物(阳性对照);4~24为过表达NtCAF1烟草。图4 转基因植株的基因组PCR验证Fig.4 Genome PCR validation of transgenic plants
2.4 转基因烟草中 NtCAF1基因分析
提取组培烟草生根苗幼叶总RNA,qRT-PCR结果表明(图5),以野生型烟草(WT)为参考,转空载体烟草为阴性对照(ck),烟草NtCAF1基因转化到烟草植株中均极显著高表达,相对表达量最高的株系是23号、27号和28号,这3个株系用于后续实验的分析。

注:A,C为野生型烟草叶片腺毛;B,D为过表达NtCAF1烟草叶片腺毛;图6 野生型烟草和过表达NtCAF1烟草叶片腺毛Fig.6 Glandular trichomes of leaves of WT and NtCAF1overexpression tobacco

注:“**”表示相对于野生型烟草差异极显著(p<0.01)。图5 不同株系NtCAF1的表达水平分析Fig.5 Analysis of expression level of NtCAF1 with different lines
2.5 过表达NtCAF1基因烟草植株的腺毛密度分析
将表达量较高的23号、27号和28号过表达NtCAF1烟草植株和野生型植株移栽,2周后观察统计单位面积叶片腺毛数量,并进行显著性差异分析。发现与野生型相比,过表达NtCAF1烟草的腺毛形态没有明显变化(图6),整个植株呈现多毛状态,其长腺毛、短腺毛均显著增多(图7),转NtCAF1烟草的长腺毛密度是野生型烟草的1.57倍,短线毛密度是野生型烟草的1.83倍,总腺毛密度是野生型烟草的1.70倍。表明NtCAF1能够促进烟草腺毛密度增加。
2.6 烟草叶片激素水平分析
通过HPLC-MS/MS检测了过表达NtCAF1和野生型烟草植株叶片内源JA、ABA、GA3的含量。结果显示(图8),与野生型烟草相比,过表达NtCAF1烟草植株叶片的内源ABA和GA3含量显著升高,JA无显著变化。因此NtCAF1可能通过ABA、GA3激素调节的途径影响烟草腺毛的密度。

注:A为总腺毛密度;B为长腺毛密度;C为短腺毛密度;“*”表示相对于野生型烟草差异显著(p<0.05)。图7 野生型烟草和过表达NtCAF1烟草叶片不同种类腺毛的密度Fig.7 Density of glandular trichomes of leaves in different species of WT and overexpression tobacco with NtCAF1
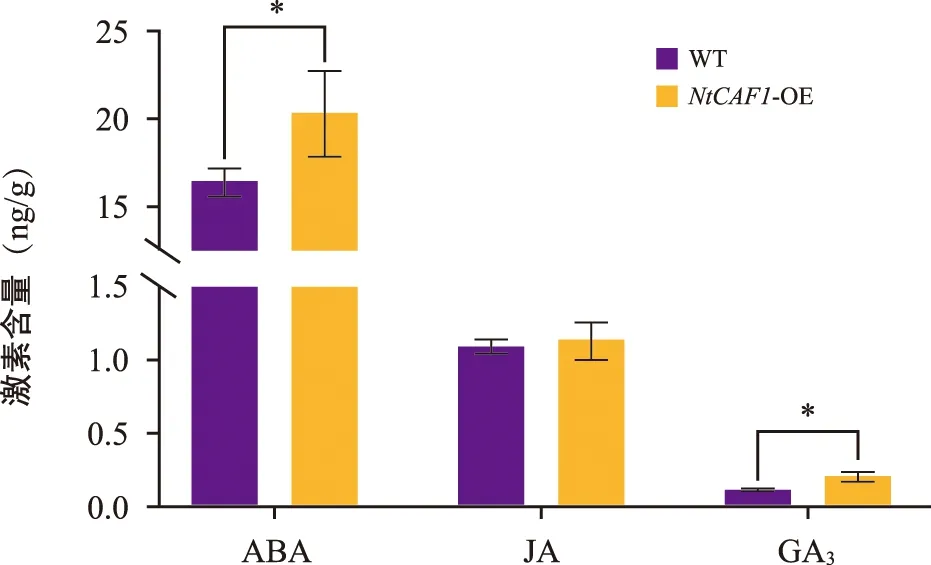
注:“*”为相对于野生型烟草差异显著(p<0.05)。图8 野生型烟草和过表达NtCAF1烟草叶片中内源激素的含量Fig.8 Contents of endogenous hormones in leaves of WT and overexpression tobacco with NtCAF1
3 讨 论
3.1 过表达NtCAF1对烟草腺毛密度的影响
植物毛状体的数量和分泌能力不仅影响植物对生物、非生物胁迫的抗性,同时其次级代谢产物对人类具有极大的价值。栽培烟草(N.tabacum)的腺毛富含次级代谢物,其含量接近叶片干重的10%[22]。例如由烟草腺毛合成的西柏烯类化合物,是一类烟草中非常重要的香味前体物质,在烟草调制老化的过程中,西柏烯类化合物发生降解,产生的香味化合物种类有60多种[23]。查宏波等[24]研究表明,不同烟草品种间,腺毛密度越高,腺毛分泌物含量越高,因此可以通过增加烟草腺毛密度改良烟叶品质。实验室前期研究,筛选到NtCAF1基因,分析可能与烟草腺毛的起始和发育有关。因此,本文为阐明NtCAF1对烟草腺毛起始和发育的影响,对该基因进行了过表达研究。通过形态观察发现,NtCAF1过表达植株总腺毛密度呈现显著增多的趋势,且长、短腺毛密度均显著提高,表明NtCAF1可以促进烟草腺毛的密度提高。
3.2 植物激素JA、ABA、GA3对烟草腺毛密度的影响
在拟南芥中,CAF1基因可以被ABA、JA、茉莉酸甲酯(MeJA)等激素和外界胁迫(例如低温和物理创伤)诱导,并快速表达[25]。因此推测NtCAF1可能通过激素的途径影响烟草腺毛的起始和发育。实验结果表明,NtCAF1可能通过ABA、GA3激素调节的途径影响烟草腺毛的密度提高。在薄荷中,GA的外源应用导致毛状体密度和腺体直径增加,表明GA能促进薄荷毛状体的起始和发育[26]。有研究表明,外源喷施GA3可以促进本氏烟草腺毛起始,GA通过激活参与毛状体发育的转录因子C 2 H 2锌指蛋白GIS的信号传导,参与植物调节毛状体发育[27]。pGbEXPA 2启动子在纤维和幼叶的毛状体中特异性启动,该启动子受GA和ABA信号传导的调节[28]。已发现NbCycB2能抑制本氏烟草中NbWo蛋白的活性,通过CycB 2-Wo反馈回路影响毛状体的形成[7],同时NtCycB2是受ABA介导的高盐抗性的负调节因子[29]。HST突变体的毛状体密度降低,当用GA3处理时,突变体植物上的茎毛部分恢复[30]。因此ABA、GA激素调节对植物毛状体发育有重要作用。虽然有文献报道,在种子中早期萌发时ABA与GA起拮抗作用的关系[31],但ABA和GA3均可以通过促进AaSAP1的表达量,促进了青蒿中腺毛的发育[32]。因此植物激素ABA与GA间受植物的发育时期和性状等因素影响,表现出不同的作用关系。虽然JA被报道可促进烟草腺毛密度增加[33],但过表达NtCAF1促进烟草叶片腺毛密度增加并未使烟草叶片内源JA的含量产生显著变化。有文献报道GA通过阻遏DELLAs来促进JAZ蛋白合成,而JAZ蛋白抑制JA反应基因的转录[31],因此推测可能是GA含量增加的同时抑制了JA的生物合成。为证明过表达NtCAF1对烟草的农艺性状和应对生物、非生物胁迫的抗性以及次级代谢产物合成有无影响,还需进行田间比较试验。本研究结果可为提升农业种植烟草的品质质量奠定基础。
4 结 论
NtCAF1主要在烟草叶片中富集表达。通过叶盘法获得过表达NtCAF1烟草19个株系,NtCAF1基因均极显著高表达,其腺毛密度显著提高,腺毛发育形态正常。表明NtCAF1能够显著促进烟草腺毛密度增加。过表达NtCAF1烟草植株叶片的内源ABA和GA3含量显著升高,JA无显著变化。表明NtCAF1可能通过ABA、GA3激素调节的途径影响烟草腺毛密度变化。
