尾矿固氮菌的分离筛选及其植物促生效应研究
2022-12-21郭丽芳杨瑞孙蔚旻
郭丽芳 ,杨瑞,孙蔚旻*
1. 佛山科学技术学院食品科学与工程学院,广东 佛山 528000;2. 广东省科学院生态环境与土壤研究所/华南土壤污染控制与修复国家地方联合工程研究中心/广东省农业环境综合治理重点实验室,广东 广州 510650
尾矿是采矿过程中产生的细粒沙,含有大量重金属、硫酸盐及其他盐类和矿物质,被认为是大陆侵蚀的主要人为来源之一(Li et al.,2015;Sun et al.,2016)。在长期堆存时会产生有毒有害物质,严重污染邻近环境,破坏农作物的生长,使地面水体和地下水源受到污染,毒害水生生物,造成严重的环境问题(Jana et al.,2012;Sultana et al.,2012)。而尾矿中含有大量的砷、锑、铬、锌和铜等重金属物质,不仅对周边环境造成污染,导致土地退化和沙漠化,而且会对动植物体产生危害,甚至危害人体健康,故迫切需要对尾矿进行适当的管理和处理(Sun et al.,2016)。生物修复是尾矿修复的一种潜在方法。然而,恶劣的环境条件,如高浓度金属离子和贫营养(缺氮),往往阻碍了生物修复的进行(Moynahan et al.,2002)。
氮是植物和微生物所必需的一种重要的营养素,参与叶绿素、核苷酸和蛋白质的合成,是影响作物产量的一个重要元素(Sun et al.,2018)。尾矿中的氮缺乏影响着微生物和植物的生长(Sun et al.,2020),是限制尾矿生物修复的主要因素(Lin et al.,2012)。虽然氮肥的施用可以有效缓解氮素缺乏,但也可能对周围环境造成二次污染。相比之下,在这种缺氮生境中固氮微生物大量存在,可为尾矿污染地区的植物和微生物生长提供可利用氮(Titus et al.,2014)。然而与其他生态系统相比,人们对栖息在尾矿栖息地的固氮菌的活动情况尚不了解(Zhan et al.,2012)。目前,只有少数研究对尾矿的固氮菌群落组成进行了分析。例如,在一个铜矿尾矿中,发现变形杆菌门(Proteobacteria)、拟杆菌门(Firmicutes)等主要的固氮生物(Huang et al.,2011),从尾矿中的植物根瘤中分离出了一些固氮菌(Navarro-Noya et al.,2012)。与土壤相比,尾矿是寡营养环境,有机碳和氮的可用性有限(Li et al.,2015)。通常会存在一些自养生物和固氮生物作为先驱者在生态系统中生存,提供营养物质,促进尾矿环境植物的生长(Mendez et al.,2008)。但尾矿环境条件恶劣,常用固氮生物很难在这样的条件下生存并发挥作用,同时微生物功能存在种间差异,因此筛选高效土著固氮生物对尾矿修复具有重要作用。
本研究假设在寡营养和重金属的尾矿环境中可能存在固氮生物。采集湖南怀化溆浦县黄家尾矿样品进行固氮菌的分离实验,并结合盆栽试验探究固氮菌的促生潜力。这项研究的目的是:(1)分离鉴定尾矿环境中的固氮菌株;(2)研究尾矿环境中的固氮生物对植物的促生作用。
1 材料与方法
1.1 土壤样品的采集
本实验的尾矿样品采自于湖南怀化溆浦县黄家尾矿(28°00'N,110°50'E)。
1.2 主要仪器和试剂
气相色谱仪-7890B(安捷伦公司);实时荧光定量PCR仪(北京赛百奥科技有限公司);紫外可见分光光度计和ICP OES,用于测定土壤各重金属总质量分数;高纯乙炔,佛山德力气体公司配送;固氮菌固体培养基(Jensen’s Medium、Luria-Bertani)和液体培养基(Jensen’s Broth、Luria-Bertani)为HiMedia生产,其主要成分见表1。

表1 培养基成分Table 1 Media composition g·L-1
1.3 分离与培养条件
尾矿样品用 0.9%的盐水逐步稀释,于 10-3、10-4、10-5梯度浓度的盐水中各取100 μL菌悬液,用一次性涂布棒涂布在无氮Jensen固体培养基上,每个浓度处理3个平行,将培养基置于生化培养箱中30 ℃下培养24—48 h。
观察培养24—48 h后平板上菌落的生长情况,挑取生长的单菌落采用末端稀释划线法接种到 LB固体培养基上,置于生化培养箱中 30 ℃下培养24—48 h,直至菌纯化,再将纯化菌置于-20 ℃冰箱中冷藏保存。
1.4 固氮酶活性的测定
将菌株接种在 30 mL LB培养基中,置于37 ℃ 200 r·min-1摇床上培养过夜。离心收集沉淀物,用灭菌水清洗 3次,重新悬浮于盛有 30 mL Jensen’s Broth液体培养基的血清瓶中(每菌株 5个重复);通入3 mL乙炔气体,结合安捷伦气相色谱仪(7890B),监测乙烯的产生,由此确定菌株的固氮活性。
采用下列公式计算固氮酶活性大小(谭志远等,2012):

式中:
hx——样品峰值;
hs——标准C2H4峰值;
c——标准 C2H4的物质的量浓度(nmol·mL-1);
V——培养容器体积(mL);
t——样品的培养时间,即C2H4的反应时间(h);
N——C2H4的生成速率(nmol·mL-1·h-1)。
1.5 固氮菌的形态特征
将菌株接种在LB固体培养基上,置于生化培养箱中30 ℃下培养24—48 h后,观察菌落的颜色、大小、形状、质地、生长速度等。
1.6 16S rRNA基因序列分析和系统发育树的构建
取50 μL LB固体培养基于八连管中;用灭菌枪头挑取单菌落于管中搅拌后取出;80 ℃热变性 15 min,低速离心,取2 μL裂解后的上清液作为PCR反应的模板。使用细菌通用引物 27F(5′-AGAGTTTGATCCTGG CTCAG-3′)和 1492R(5′-TACCTTGTTACGACTT-3′)进行 PCR扩增。PCR产物纯化与基因序列分析委托生工生物工程(上海)股份有限公司进行。将获得的16S rRNA序列与NCBI数据库所有已测定的原核生物序列进行比对,应用MEGA 3.0软件绘制系统发育树。
1.7 最适pH的筛选
将菌株接种在 5 mL LB液体培养基中,置于37 ℃ 200 r·min-1摇床上培养过夜;取 100 μL菌液于50 mL具有不同pH值梯度的LB液体培养基中,置于200 r·min-1摇床中振荡培养,4 h后测定菌株的生长状况(OD600nm,指600 nm波长处的细菌浓度)。
1.8 生理生化特征测定
1.8.1 IAA的定性分析
在 LB 培养基中加入待测菌菌悬液,每株菌株设置3个平行,摇床中30 ℃培养24—72 h后,加入吲哚试剂于培养物的液面上。若在液体交界处呈现红色环则为阳性,否则为阴性。若显色不明显,加入几滴乙醚摇匀,静置片刻,使乙醚层浮于培养物的液面,再加入吲哚试剂,观察液面结果。
1.8.2 固氮菌金属抗性测定
在LB固体培养基中加入一定量的亚砷酸钠标准液,使固体平板中As(III)物质的量浓度为40×10-3mol·L-1,并将单菌株接种到该浓度平板上,每个菌株培养2—3 d,观察其生长情况。
1.8.3 铁载体测定
将0.048 g刃天青溶于40 g超纯水中,然后与8 mL 1 mmol·L-1氯化铁混匀,将0.06 g十六烷基三甲基溴化铵(HDTMA)溶于32 mL超纯水中,加入 10×MM9盐溶液(磷酸氢钠 30 g,磷酸二氢钾1.5 g,氯化钠2.5 g,氯化铵15 g,超纯水500 mL)80 mL、哌嗪二乙醇磺酸24.16 g、琼脂12.8 g,调节 pH 至 6.8,加入 1 mmol·L-1氯化钙 0.8 mL、1 mmol·L-1七水硫酸镁 16 mL、20%葡萄糖 8 mL、10%酪水解酪素24 mL,摇匀,即得蓝色定性检测培养基,按每皿20 mL倒入培养皿中;用灭菌枪头挑取单菌落划线在平板上,置于 30 ℃培养箱中培养,观察菌落周围变色圈。
1.9 盆栽试验
为进一步探究尾矿固氮菌对鬼针草(Bidens pilosa)生长的促生潜力,进行了盆栽试验。将菌株接种于150 mL LB培养基上,于37 ℃ 200 r·min-1摇床上培养过夜。培养后,以 6000 r·min-1离心 5 min,收获菌株,并用无菌水清洗3—4次。
鬼针草的种子用次氯酸钠消毒10 min,并用消毒水清洗3次,采用黄家尾矿中的尾矿渣与蛭石1∶2混合后的土样设置盆栽试验。预设加菌液、不加菌液两个处理。每个处理设10个重复。种植完成后,每隔4天向盆栽中接种菌液50 mL,共浇菌4次。两个月收获后,测定植株茎长、根长、鲜质量、干质量、总氮含量。
应用RStudio和Origin 2021进行统计分析、绘图,不同处理的平均值采用最小显著性差异法(LSD)进行比较(α=0.05)。
2 结果与分析
2.1 固氮菌分离鉴定
以湖南怀化溆浦县黄家尾矿为样品,在无氮固体培养基培养48 h得到7株菌株:L45、G6、G18、L2+2、L31、G15、PC-3,并将菌株接种在LB固体培养基上培养观察其表观形状。结果表明(表2),部分菌落呈黄色且不透明,圆形,中间隆起、边缘较整齐,表面光滑湿润,易于挑取;另一部分菌株呈现淡黄色、透明,边缘整齐、光滑,不易挑取。

表2 不同菌株的菌落特征Table 2 Colony characteristics of the different strains
2.2 酶活性测定
尾矿中的氮贫乏经常制约着微生物和植物的生长(Sun et al.,2020),生物固氮是尾矿微生物群落所需的基本生态系统功能,固氮微生物的存在为尾矿植物的生长提供可利用的氮(Titus et al.,2014)。本实验中,使用无氮培养基从尾矿样本中分离出7株菌株,并利用乙炔还原法测定菌株的酶活性,结果如图1所示,可以看出7个菌落显示出不同的固氮酶活性,其中 PC-3的固氮酶活性最高(7133.71 μmol·h-1·mL-1),L31、G15、G6 菌株亦具有较高的酶活性。

图1 不同菌株的固氮酶活性Figure 1 Nitrogen fixing enzyme activity of different strains of bacteria
2.3 菌株生长的最适pH筛选
如图2所示,G6、G18、PC-3、L45和L2+2菌株在pH 6—9条件下生长较好,G15、L31菌株在pH 7—9条件下生长较好。随着pH值的升高,菌株的生长趋势呈先强后弱,其中L45、G6、G18、L3的最适生长pH为7,但G6、L2+2菌株则在pH=9条件下生长最好。

图2 不同pH值对菌落生长的影响Figure 2 Effect of different pH values on colony growth
2.4 生理生化特性
由表3可知,G6、L2+2、L31和PC-3具有产IAA特性。铁载体实验结果表明,G18、G6、G15和PC-3都具备铁载体能力,这极有可能促进了微生物固氮过程。金属抗性(As)实验表明(表3),大部分的菌株可以在砷环境中生存(除G18),表明这些菌株具有一定的砷耐受能力。

表3 不同菌株的生理生化特性Table 3 Physiological and biochemical properties of the different strains
2.5 菌株的测序结果及系统进化树的构建
基于16S rRNA序列构建了系统发育树,由图3可知,7株新分离的菌株分别归类为:短波单胞菌属(Brevundimonas)2株:G15、G18,黄色杆菌属(Xanthobacter)1株:L31,鞘脂菌属(Sphingobium)1株:L2+2,假单胞菌属(Pseudomonas)1株:PC-3,分枝杆菌属(Mycobacterium)1株:G6,红球菌属(Rhodococcus)1 株:L45。
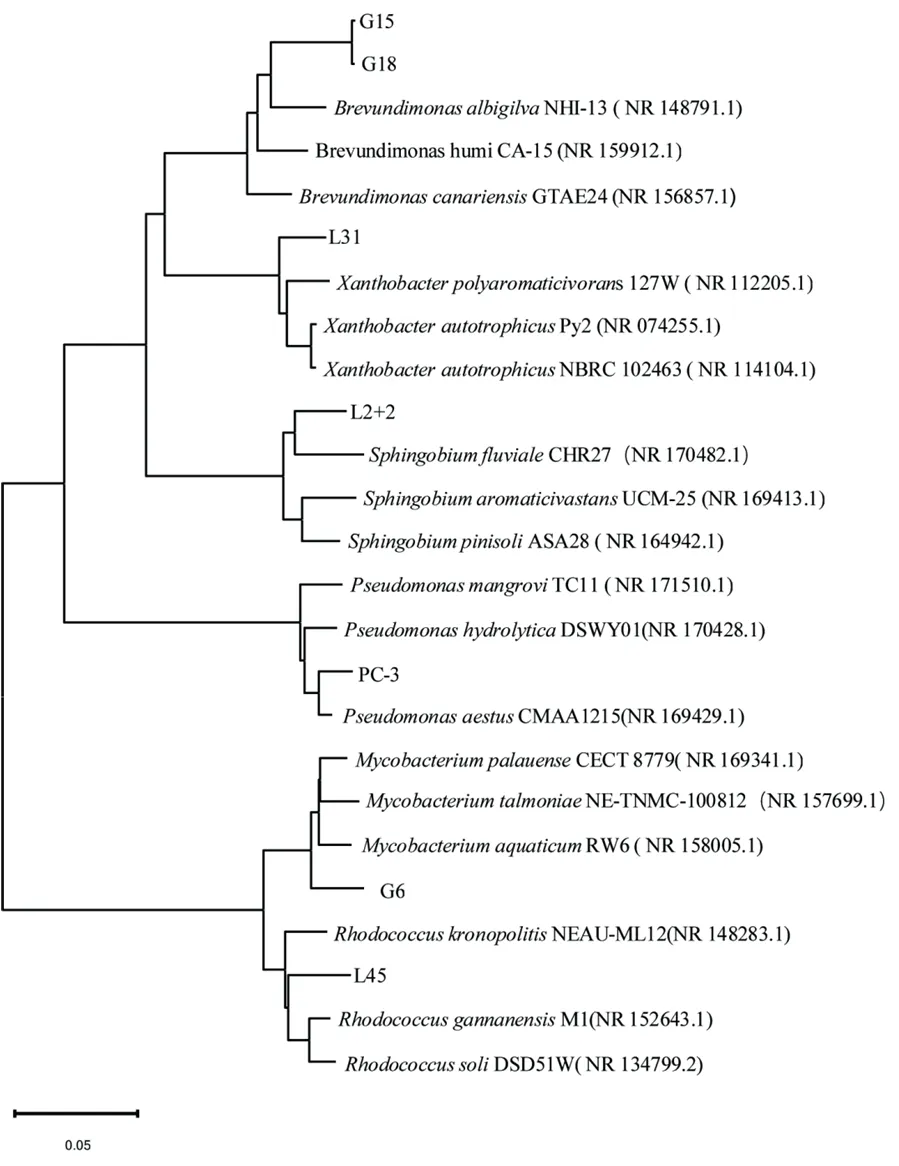
图3 根据16S rRNA序列分析构建的系统发育树Figure 3 Phylogenetic tree constructed from 16S rDNA sequence analysis
2.6 盆栽试验结果
本实验进一步探究了尾矿固氮菌对鬼针草生长的促生潜力,在植物中接种菌株可以促进植物生长(图4和图5)。与空白对照相比,接种L2+2、L31、L45和PC-3菌株对鬼针草根长的影响不尽相同,接种了L31的根长增幅最大(图4a),其次是L45和L2+2。接种了L31、G6、G18和L2+2菌株的处理植物茎长显著增加,效果最显著的是L31,增幅达到了93%(图4b)。

图4 接种不同菌株对植物根长和茎长的影响Figure 4 Effect of inoculation with different strains on plant root length and stem length
接种菌株对植物干质量提高也有显著促进作用,与对照组相比,接种L2+2、L31菌株促进植物根干质量增长的效果更显著(图 5a),增幅分别达到了260%、233%。PC-3、L2+2菌株显著提高了植物茎的干质量(图5b)。

图5 接种不同菌株对植物根和茎干质量的影响Figure 5 Effect of inoculation with different strains of bacteria on the dry mass of plant roots and stems
进一步研究了接种菌株对植物氮含量的影响。结果表明,与对照组相比,接种不同的菌株对植物茎和根的氮含量提高有不同程度的促进作用。其中,接种G15、G6、L31、L45菌株对植物根氮含量具有显著的促进作用(图6a),效果最显著的是G6,增幅达到406%;接种L31、L2+2、G6对植物茎氮含量提高亦有显著的促进作用(图6b)。

图6 接种不同菌株对植物根和茎氮含量的影响Figure 6 Effect of inoculation with different strains on the nitrogen concent of plant roots and stems
3 讨论
矿区污染已成为一个全球关注的问题,它以惊人的速度正在不断扩大(Hiller et al.,2012;Wang et al.,2018),在尾矿污染的地点可检测到高浓度铜、锌、砷、镉、锑和铅等金属物质(Sun et al.,2021),不仅对周边环境造成污染,还对动植物体产生危害,甚至危害人体健康。在尾矿的修复工作中,经常考虑的是先锋植物和微生物,主要是因为它们具备成本效益和环保特征(Ojuederie et al.,2017;Xiao et al.,2021),但尾矿环境中缺乏氮,通常不适合植物和微生物生长,影响生物修复效率(Sun et al.,2020)。而生物固氮作为一种经济和生态方法,为植物和微生物提供的生物可利用氮(Titus et al.,2014)。研究表明,固氮菌可以改善土壤成分,为退化生境恢复提供物质基础,对植物根系的生长活动与微生物群落的发展具有相互促进作用。目前关于栖息在尾矿中的固氮生物的研究较少,因此进一步了解尾矿的固氮过程、固氮生物的功能和代谢特征是至关重要的。
本实验通过无氮培养基和稀释涂布分离法培养分离出7株固氮菌株,这些固氮菌可为尾矿环境中的植物提供氮,促进植物的生长和尾矿环境的生态修复。通过系统发育树分析表明,这7株菌株分属于不同的种属,G15和 G18两株菌株为Brevundimonas,同时这株菌株在赣州稀土矿区尾矿环境中被研究发现(龙婉婉等,2020),L31、L2+2、PC-3、L45、G6等5株菌株分别为Xanthobacter、Sphingobium、Pseudomonas、Rhodococcus、Mycobacterium。Mycobacterium、Pseudomonas、Rhodococcus等菌株分别在四川省攀西地区矸石山(程蓉等,2018)、河南省灵宝市平阳镇文西渠金尾矿废弃地(李自刚等,2009)、安徽铜陵杨山冲尾矿库(赵兴青等,2009)等尾矿环境中被报道。然而,Brevundimonas、Xanthobacter目前在尾矿环境中尚未被报道。经研究发现,Mycobacterium(Marassi,2011),Pseudomonas(Pascuan et al.,2015),Rhodococcu(栾敏等,2009)等菌株均被报道具有固氮的功能。同时对菌株的最适pH进行探究,发现大部分的菌株可在中碱性条件下生长,可能与尾矿开采过程中重金属物质和碳酸盐类分解使得游离碱含量上升,导致尾矿浸出液pH值上升有关(朱建平等,2021)。
IAA是一种调节植物生长和发育的主要植物激素,不仅可以促进植物生长,而且能使色氨酸类似物质解毒,减轻其毒害作用,还可以抑制植物防卫系统,使得有益细菌更易定殖于植物体内(周德明等,2012)。本实验对7株菌株进行了IAA的定性实验,可知G6、L2+2、L31和PC-3具有产IAA特性,这些菌株可能具有促进和调节植物生长的能力。而铁离子以及铁离子与蛋白质相结合参与微生物体内DNA的合成、过氧化物的降解、生物固氮等重要的生命活动过程,并且对生物膜的形成起着调节表面运动和稳定多糖基质的作用,在缺铁的生长条件下,微生物表面疏水性降低,导致生物膜的形成受到限制(董子阳等,2019)。本实验中的G18、G6、G15和PC-3菌株都具有含铁载体能力,有可能参与了微生物固氮过程。进一步研究发现L45、G6、L2+2、L31和PC-3都具有金属抗性(As)能力,可能与尾矿开采过程中产生的大量重金属物质有关,而优势固氮菌的存在与它本身存在的金属抗性有关。
经研究表明,菌株Sphingobium、Mycobacterium分别具有促进水稻(Oryza sativa)和万寿菊(Tagetes erecta)幼苗生长的作用(康贻军等,2010),Brevundimonas具有促进马铃薯(Solanum tuberosum)生长的作用(Naqqash et al.,2020),Pseudomonas具有促进植物生长的能力(Liu et al.,2015)。根据IAA特性和固氮酶活性,选择7株菌株接种于鬼针草盆栽中,分析其对植物的促生作用。结果表明,与对照组相比,接种菌株对植物的根茎生长、干质量和氮含量分别具有不同程度的增长效果,其中L31、L2+2、G6效果最佳。
4 结论
从湖南怀化溆浦县黄家尾矿中分离出了7株具有固氮功能的菌株,这些菌株可为植物生长提供可利用性氮,同时具有产生植物激素IAA和含铁载体的能力。通过盆栽试验得知,接种这些菌株可以促进尾矿环境中植物的生长,其中L31、L2+2、G6效果最佳。因此,这3株菌株具有较大的植物促生潜力,在获取营养物质和促进尾矿的生态演替方面发挥重要作用,可作为生物肥料的良好候选菌株,以促进尾矿生态环境的修复。
