吖啶橙-金纳米荧光法测金属硫蛋白
2022-12-21陈思涵周鹏陈云生王永生王汉青
陈思涵,周鹏,陈云生,王永生,王汉青
(1.南华大学 资源环境与安全工程学院,湖南 衡阳 421001;2.南华大学 公共卫生学院,湖南 衡阳 421001;3.建筑环境气载污染物治理与放射性防护国家地方联合工程研究中心,湖南 衡阳 421001)
金属硫蛋白广泛存在于动物肝脏、肾脏、胰腺和小肠等脏器中,具有消除体内自由基、延缓机体衰老、参与微量元素储存、转运和代谢以及对重金属解毒的作用[1]。金属硫蛋白作为内源性细胞保护剂,具有稳定细胞膜、抗脂质过氧化、修复细胞和防止癌症发生有着重要作用[2]。近年来,金属硫蛋白作为主要生物标志物已成为研究热点[3-4]。因此,研究建立一种方便、高效、易普及的金属硫蛋白检测新方法十分必要。本文基于吖啶橙荧光染料与金纳米及金属硫蛋白相互作用[5-6],荧光强度变化在一定条件、范围内呈线性相关的原理,建立了吖啶橙金纳米荧光法测定金属硫蛋白的新方法。
1 实验部分
1.1 试剂与仪器
实验用水为双蒸水(电阻18.25 Ω);金属硫蛋白、金纳米、柠檬酸钠、盐酸、吖啶橙、氯金酸、柠檬酸三钠均为分析纯。
F-4500型荧光分光光度计;UV-2550紫外-可见分光光度计;PB-20(PB-S)型精密酸度计;78-1型磁力加热搅拌器;PrimoR高速低温离心机;SHHW21-60型电热恒温水浴箱;AB204-S电子分析天平;0.22 μm 针头式过滤器。
1.2 溶液配制
1.2.1 金属硫蛋白标准储存液配制 称取3.0 mg金属硫蛋白,用双蒸水溶解后,移至50 mL容量瓶,定容至刻度,得1.00×10-5mol/L金属硫蛋白标准储存液。用时稀释至1.00×10-6mol/L。
1.2.2 CANa3-HCl缓冲液配制 准确称取2.941 0 g柠檬酸钠,加入双蒸水,在烧杯中充分溶解后,移至1 000 mL容量瓶,定容至刻度,得0.1 mol/L柠檬酸钠-盐酸缓冲液标准液,再用同浓度盐酸调节pH至4.0,备用。
1.2.3 吖啶橙标准储备液配制 称取0.302 g吖啶橙于烧杯中,加入双蒸水,充分溶解后,移至 100 mL 容量瓶,定容至刻度,得1.00×10-4mol/L荧光染料-吖啶橙标准储备液。用时稀释至所需浓度1.00×10-5mol/L。
1.2.4 CANa3溶液配制 称取1.001 3 g柠檬酸三钠,用双蒸水溶解后,移至100 mL容量瓶,定容至刻度,得到38.8 ×10-3mol/L的柠檬酸三钠标准应用液。
1.3 金纳米的处理
取一个100 mL磨口锥形瓶,用王水浸泡洗净。依次加入3.3 mL 1%氯金酸和76.7 mL灭菌水,充分混匀,密封后,放置磁力加热搅拌器中,加热至沸腾,加入38.8 ×10-3mol/L柠檬酸三钠12.8 mL,持续加热至溶液呈酒红色,15 min后停止加热,搅拌冷却至室温,用0.22 μm针头式过滤器过滤后备用[7-8]。
1.4 实验方法
1.4.1 空白实验 于2 mL EP管中,加入20 μL柠檬酸钠缓冲液,30 μL吖啶橙标准应用液,40 μL金纳米,加灭菌水定容至400 μL,振荡混匀,常温反应15 min后,进行荧光分光光度计扫描,在最大发射波长526 nm处,得荧光强度值为F0,记为空白管。
1.4.2 样品分析 按空白实验方法,在加双蒸水定容前,分别加入不同量1.00×10-6mol/L金属硫蛋白应用液,再加双蒸水定容至400 μL,振荡混匀,放置反应15 min。测量试验管的荧光强度(F)。可得ΔF=F-F0。仪器调试相关参数,激发狭峰宽度 5 nm,发射狭峰宽度10 nm,光电倍增管负电压是700 V。
2 结果与讨论
2.1 实验机制探讨
荧光传感体系光谱见图1。
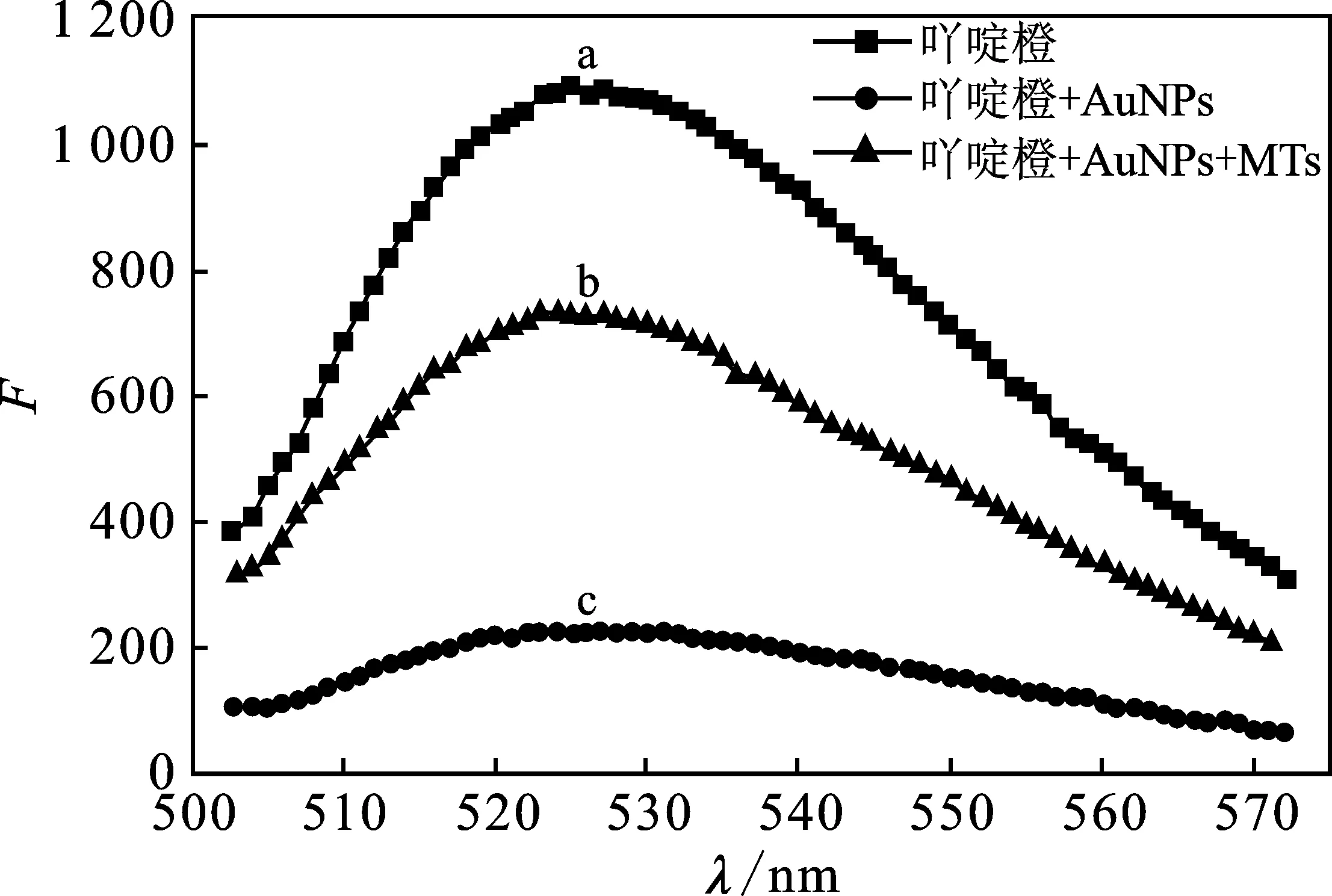
图1 传感系统的荧光光谱图Fig.1 Fluorescence spectra of the sensing system
由图1可知,当体系只加入荧光染料-吖啶橙和缓冲液时(曲线a),体系有较大荧光值,表明荧光染料-吖啶橙在缓冲液中能发出较强荧光。当体系分别加入CANa3-HCl缓冲液、吖啶橙和金纳米时(曲线c),体系有较弱的荧光值,说明吖啶橙通过静电作用结合与带负电的金纳米表面结合,两种物质距离拉近,发生了表面荧光能量转移,致体系荧光猝灭。当体系分别加入CANa3-HCl缓冲溶液、吖啶橙、金纳米和金属硫蛋白时(曲线b),体系有较强的荧光值,表明金属硫蛋白与金纳米有更强的共价作用,破坏了原有体系,金属硫蛋白可与吖啶橙染料竞争结合在金纳米表面,使得吖啶橙远离金纳米粒子,使体系恢复荧光。
2.2 实验条件选择
2.2.1 缓冲体系的优化 在CANa3-HCl缓冲液、Tris-HCl缓冲液及BR缓冲液三类常用缓冲液进行选择,实验结果见图2。
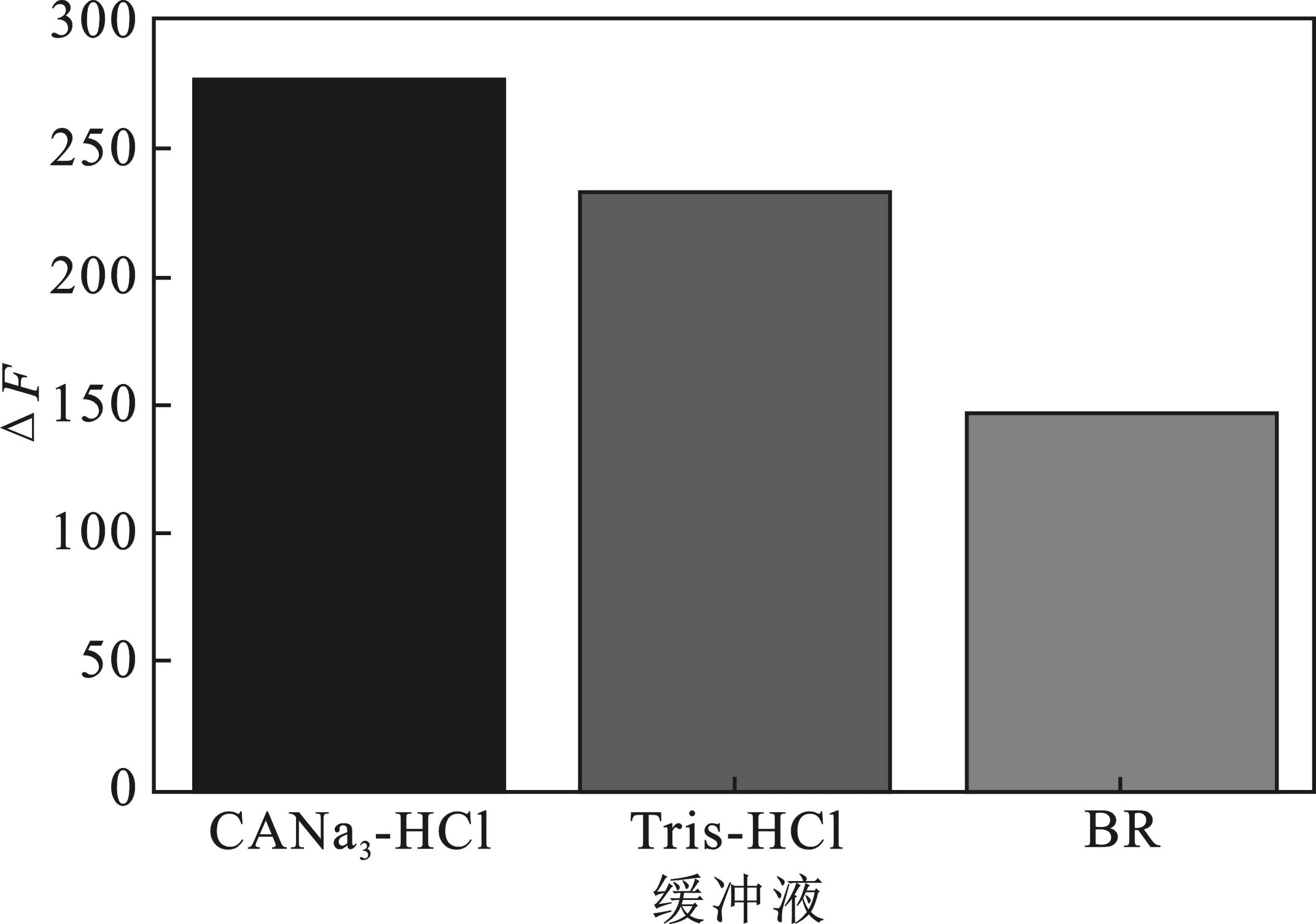
图2 缓冲液的选择Fig.2 The choice of buffer system
由图2可知,CANa3-HCl缓冲液体系中ΔF值最大,故选择CANa3-HCl作为缓冲液。
2.2.2 缓冲液pH的影响 缓冲液pH对实验体系影响见图3。

图3 pH的影响Fig.3 Effect of pH on the system
由图3可知,pH在2.5~4.0时,ΔF值逐渐增大,当pH=4.0时,ΔF值最大。pH在4.0~8.0时,ΔF值则持续递减。故选择pH=4的CANa3-HCl缓冲液作为实验条件。
2.2.3 缓冲溶液加入量的优化 CANa3-HCl缓冲液加入量对体系的影响见图4。

图4 缓冲液加入量的影响Fig.4 Effect of buffer volume on the ΔF of the system
由图4可知,当缓冲液用量不足45 μL时,ΔF值逐步增加,缓冲液用量为45 μL时,体系ΔF值有最大值。当缓冲液用量超过45 μL时,ΔF值则持续降低。故缓冲液的最佳加入量为45 μL。
2.2.4 金纳米用量的优化 金纳米用量对体系的影响见图5。
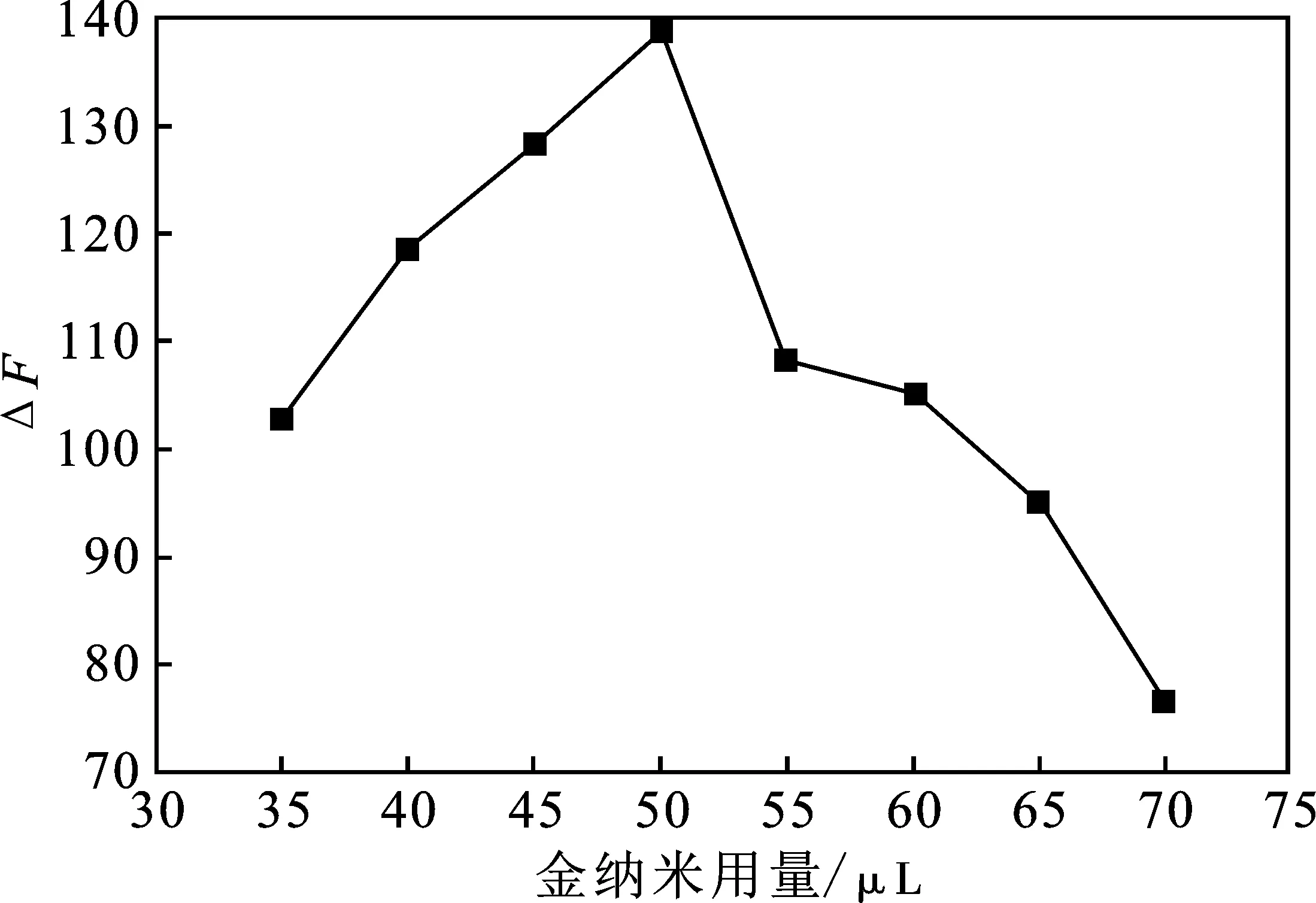
图5 金纳米用量的影响Fig.5 Effect of AuNPs volume on the system
由图5可知,当金纳米加入量不足时,荧光染料猝灭效果不好,导致反应体系本底值高,加入金属硫蛋白后,虽然能使荧光恢复,但ΔF值偏低。当金纳米用量为50 μL时,ΔF值最大。故本实验选择 50 μL 的金纳米为最佳用量。
2.2.5 吖啶橙用量的优化 吖啶橙用量对体系的影响见图6。
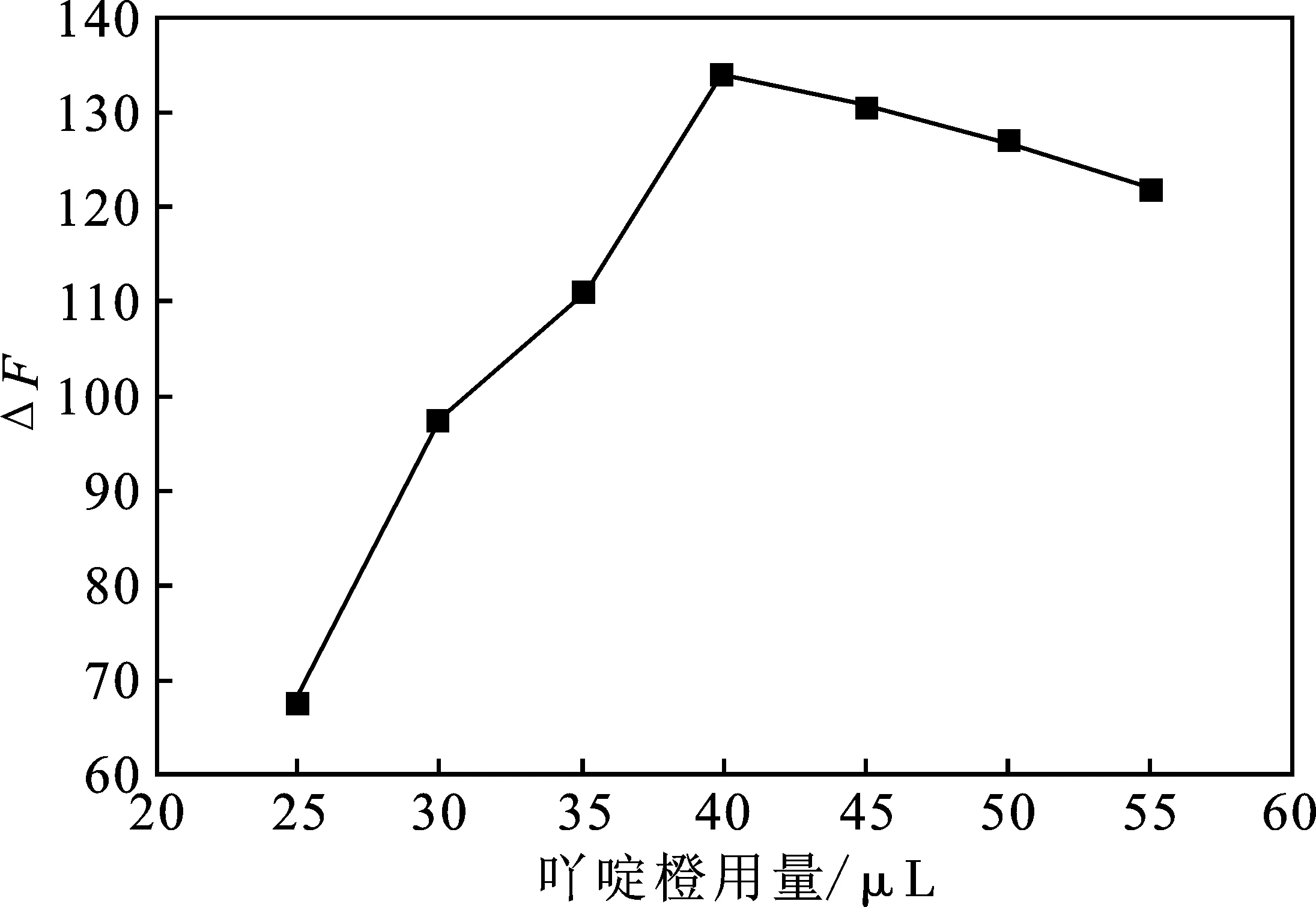
图6 吖啶橙用量对实验体系的影响Fig.6 Effect of AO volume on the system
由图6可知,随着吖啶橙用量的增加,荧光强度随之加强,ΔF值增大,当用量为40 μL时,ΔF值最大,随后继续增加用量,ΔF值持续降低。故吖啶橙实验用量为40 μL。
2.2.6 反应时间对实验的影响 反应时间对实验体系影响见图7。

图7 反应时间的影响Fig.7 Effect of reaction time on the system
由图7可知,随着反应时间增长,ΔF值逐渐增大,反应15 min时,有最大ΔF值,继续延长反应时间,ΔF值持续下降,故实验选择15 min为反应时间。
2.2.7 反应温度对实验的影响 反应温度对实验体系影响见图8。
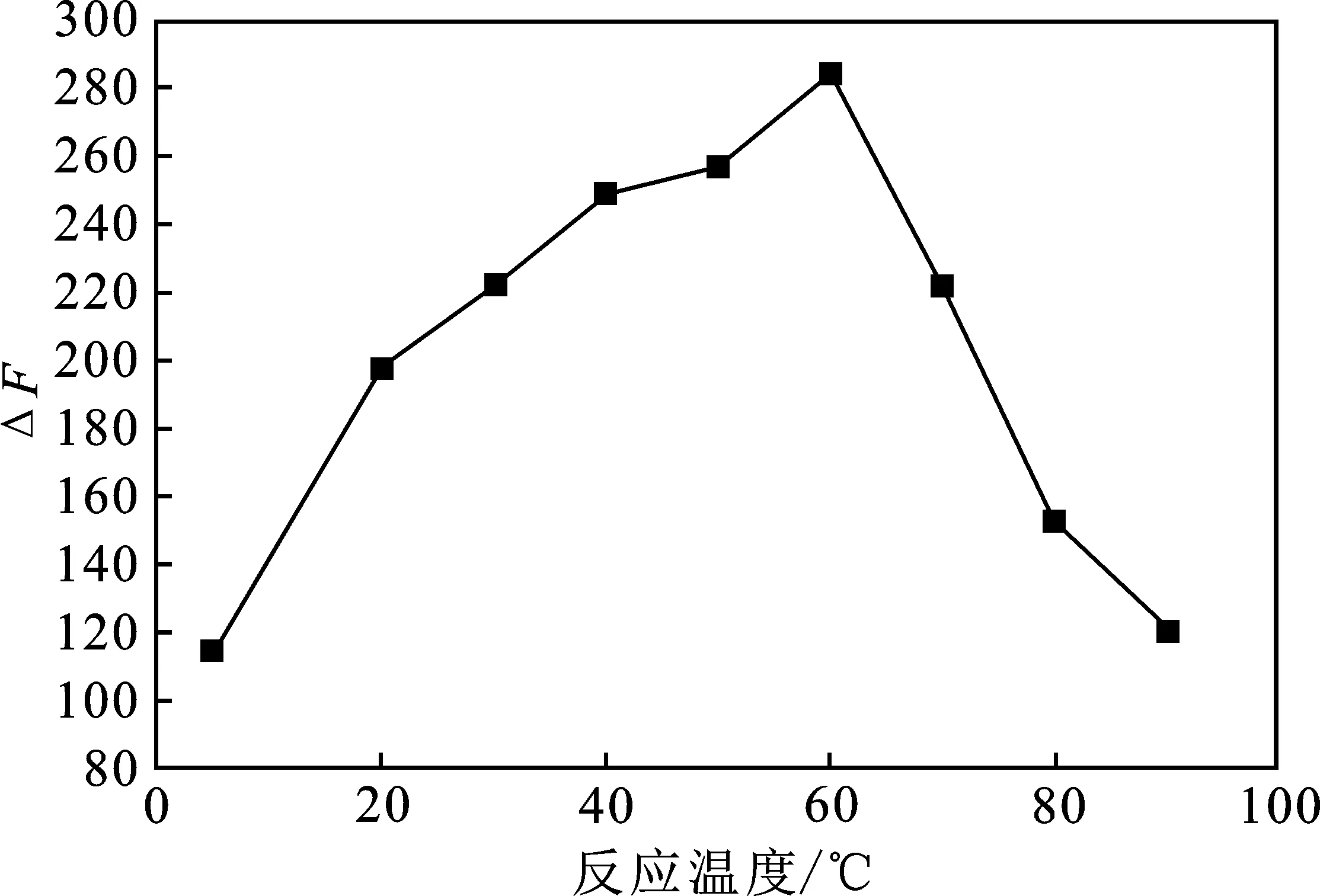
图8 反应温度的影响Fig.8 Effect of temperature on the system
由图8可知,在不到60 ℃时,ΔF值随着温度的升高而增大,60 ℃时ΔF值达到最大,超过60 ℃,则ΔF值逐步下降。故选择60 ℃为实验反应温度。
2.3 干扰物的影响
为验证本方法特异性,取金属硫蛋白浓度为 1.0×10-7mol/L,其他试剂用量均在优化后条件下,检验多种共存干扰物质对测定结果的影响,控制相对误差在±5%以内,结果见表1。
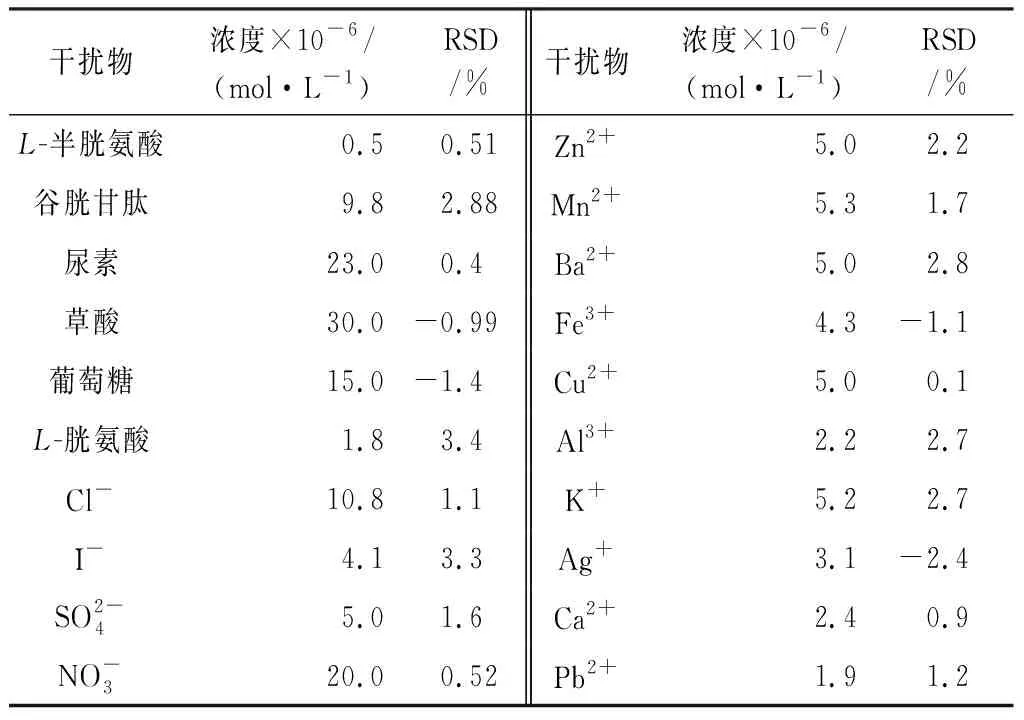
表1 干扰物的影响Table 1 Effect of interferents substance
2.4 标准曲线、检出限及精密度
2.4.1 标准曲线 根据优化实验数据,在最佳条件下,分别于不同EP管中加入不同体积的金属硫蛋白标准应用液测定荧光值(F),以未加金属硫蛋白的为空白管测定其荧光值(F0),用ΔF=F-F0定量测定金属硫蛋白。结果见图9。
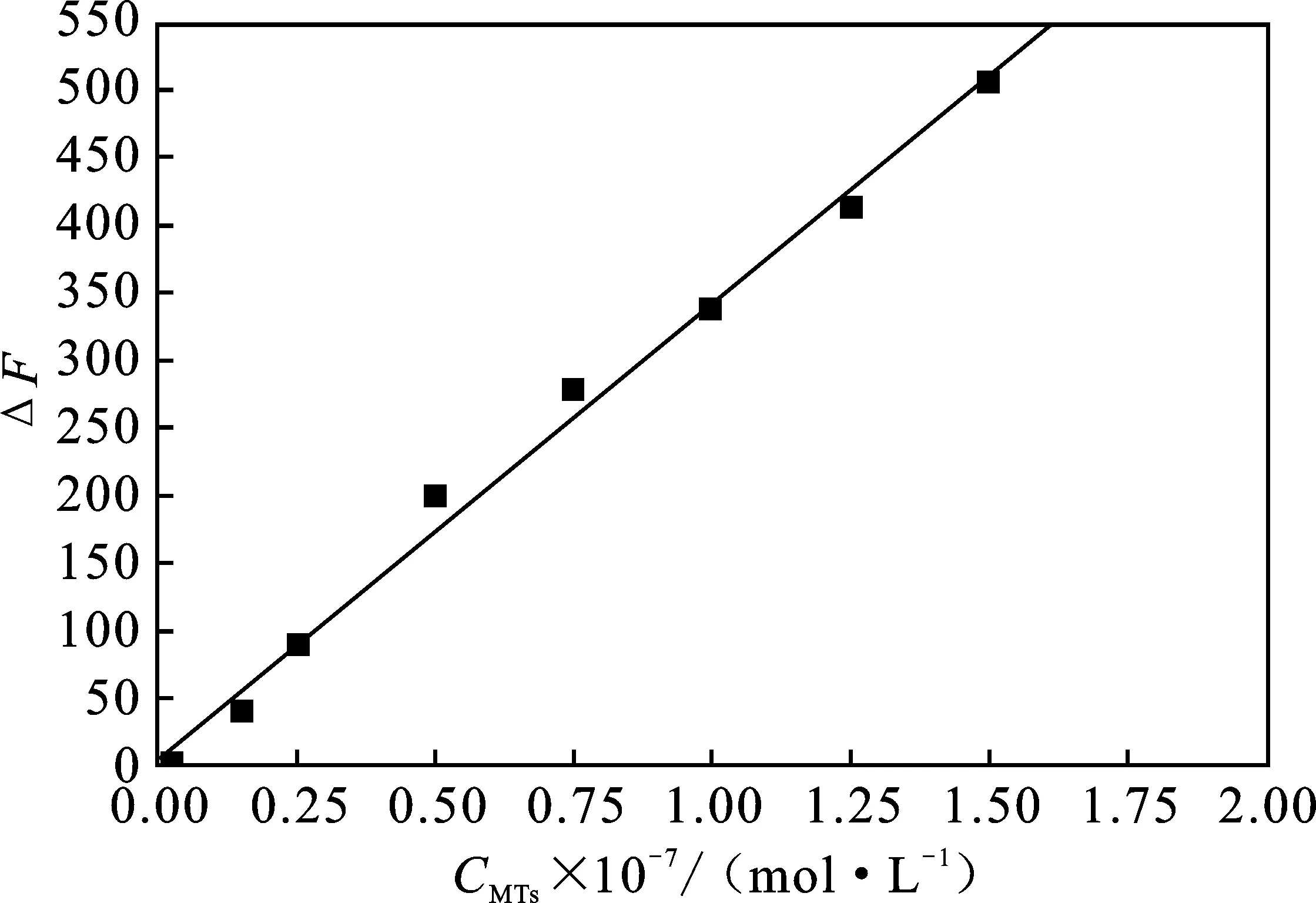
图9 金属硫蛋白标准曲线Fig.9 Calibration curve for determination of MTs
由图9可知,金属硫蛋白浓度在9.3×10-9~1.5×10-7mol/L时,体系ΔF值与金属硫蛋白浓度呈现良好的线性关系,r=0.996 5,回归方程为ΔF=3.798+337.3C(×10-7mol/L)。
2.4.2 精密度实验 分别对0.1倍和0.9倍两种金属硫蛋白浓度为1.5×10-7mol/L标准液进行6次平行测定,测得本实验方法相对标准偏差为 0.39% 和1.29%,说明本实验精密度良好。
2.4.3 检出限测定 根据公式CL=3Sb/k(Sb表示空白液的标准偏差,k表示标准曲线的斜率),平行测定11管空白管荧光值,得到本实验检测金属硫蛋白的检出限为2.79×10-9mol/L。
2.5 样品分析及加标回收率
用清洗干净的聚乙烯瓶收集一次性尿样,样品1、样品2均来自于南华大学的学生。依据金属硫蛋白理化特性和参考有关文献进行尿样处理[7]:①取一定体积尿样,加入相同体积浓度为 0.01 mol/L pH=8.5 的Tris-HCl缓冲液中,混匀,低温离心(4 ℃,4 000 r/min,20 min,条件下同);②取上清液,80 ℃水浴加热10 min,冷却至4 ℃,再离心;③取上清液,加入到3倍体积的预先制冷至-20 ℃无水乙醇中,置-20 ℃保存,12 h后再离心;④取沉淀,溶于一定体积的pH=8.5的 Tris-HCl缓冲液中,离心;⑤重复步骤③,不等待,立即离心;⑥取沉淀,于通风处去除乙醇,溶于一定体积的双蒸水,离心,取上清液100 μL,按1.4.2节进行测定。再取已测定过其浓度的尿样1和尿样2,各加20 μL的1.0×10-6mol/L 金属硫蛋白标准溶液,按1.4.2节进行加标回收实验,平行测定6次,结果见表2。

表2 人体尿样中金属硫蛋白的检测及回收率实验(n=6)Table 2 Determination for MTs of human urine samples and recovery rate test(n=6)
由表2可知,加标回收率在97.09%~99.63%之间,说明实验准确度高。
3 结论
在酸性条件下,金属硫蛋白能与金纳米有更强结合能力吸附在一起,使原来吸附在金纳米表面被猝灭的荧光染料-吖啶橙荧光恢复。建立了荧光传感器测定金属硫蛋白的新方法,优化的实验条件:pH=4的CANa3-HCl缓冲液45 μL,金纳米加入量50 μL,吖啶橙加入量40 μL,在60 ℃下反应 15 min。方法检测范围较宽,在9.3×10-9~1.5×10-7mol/L线性关系好,r=0.996 5;检测限低,达2.79×10-9mol/L;精密度良好,准确度高,抗干扰较好,已用于实际样品的检测,为环境样品中金属硫蛋白的测定提供了一种新的实践。
