lncRNA OIP5-AS1调节miR-942-5p/CHEK1轴对脑胶质瘤细胞生物学行为的影响
2022-12-21陈明武王开宇杨波郑诗豪
陈明武,王开宇,杨波,郑诗豪
脑胶质瘤是人中枢神经系统常见的恶性肿瘤,具有生长快、侵袭力强、病死率高、致残率高等特点[1]。尽管脑胶质瘤的治疗(手术切除、放疗、化疗等)取得了很大进展,但病死率和复发率仍较高[2]。因此,加强对脑胶质瘤分子机制的认识,对其诊断和治疗具有重要意义。长链非编码RNA(long non-coding RNA,lncRNA)在脑胶质瘤中的作用已引起广泛关注[3]。OPA相互作用蛋白5反义转录本1(OPA-interacting protein 5 antisense transcript 1,OIP5-AS1)是一种在包括脑胶质瘤的恶性肿瘤进展中发挥关键作用的lncRNA[4]。据报道,OIP5-AS1在脑胶质瘤组织中上调,与肿瘤的病理分级相关;沉默OIP5-AS1可抑制肿瘤细胞的生长和转移[5-6]。然而,OIP5-AS1在脑胶质瘤中的分子机制尚未阐明。微小RNA(microRNA,miRNA)通过与mRNA的3'-非翻译区(3'-UTR)结合参与多种生物学过程[7]。其中miR-942-5p可在癌症中充当肿瘤启动子或抑制子[8-9]。miR-942-5p在脑胶质瘤中下调,与肿瘤的恶性表型有关[10]。通过生物信息学分析发现,OIP5-AS1和miR-942-5p之间可能存在靶向关系;并且检查点激酶1(checkpoint kinase 1,CHEK1)具有与miR-942-5p结合的位点。CHEK1在脑胶质瘤中上调,与肿瘤的病理分级相关[11];抑制其表达可抑制肿瘤细胞的增殖、迁移和侵袭[12-13]。本研究旨在探讨OIP5-AS1在脑胶质瘤发病中的作用以及OIP5-AS1/miR-942-5p/CHEK1轴在肿瘤形成中的潜在机制。
1 材料与方法
1.1 临床样本收集2019年10月—2021年10月在福建省立医院神经外科33例经病理检查确诊并接受手术切除的胶质瘤患者组织标本。患者术前未接受其他治疗,排除其他恶性肿瘤、严重全身感染及其他严重全身性疾病等并发症。患者年龄25~60岁,平均(46.23±8.50)岁,其中男20例,女13例。根据WHO 2016年公布的中枢神经系统肿瘤病理分类,低级别胶质瘤(Ⅰ/Ⅱ级)14例,包括Ⅰ级6例、Ⅱ级8例,高级别胶质瘤(Ⅲ/Ⅳ级)19例,包括Ⅲ级9例、Ⅳ级10例。非肿瘤性脑组织样本取自33例颅脑损伤成人患者,这些患者接受了部分脑组织切除术以降低颅内压。所有样品都保存在-80℃以供后续试验。所有患者均签署书面知情同意书。实验方案经福建省立医院伦理委员会批准(伦理号:K2019-09-039),符合赫尔辛基宣言。
1.2 细胞人脑胶质瘤细胞系U87、SHG-44、U251和H4均购自武汉普诺赛生命科技有限公司,货号CL-0238、CL-0207、CL-0237、CL-0087;正常人星形胶质细胞NHA购自合肥万物生物科技有限公司,货号QCLL-101299。所有细胞均在含有10%胎牛血清(FBS)、100 U/mL青霉素和100 mg/L链霉素的DMEM培养基中,在37℃、5%CO2的恒温培养箱中培养。
1.3 主要试剂与仪器靶向OIP5-AS1的小分子干扰RNA(siRNA,OIP5-AS1 siRNA,干扰序列:5'-AACCUAAUCAGA⁃CAAGUCCTT-3')、miR-942-5p mimic(5'-UCUUCUCU⁃GUUUUGGCCAUGUG-3')和miR-942-5p inhibitor(5'-CA⁃CAUGGCCAAAACAGAGAAGA-3')及其阴性对照[siRNA NC(5'-ACGUGACACGUUCGGAGAATT-3')、miR-NC(5'-UUU⁃GUACUACACAAAAGUACUG-3')、inhibitor-NC(5'-CAGUA⁃CUUUUGUGUAGUACAAA-3')]由上海基因制药有限公司合成。兔源一抗CHEK1(ab32531,Abcam);人源抗Argonaute2(Ago2)抗体(ab186733,Abcam);MTT细胞增殖及细胞毒性检测试剂盒(C0009S,上海碧云天生物技术有限公司);膜联蛋白V(Annexin-V)-异硫氰酸荧光素(FITC)/碘化丙啶(PI)细胞凋亡检测试剂盒(CA1020,北京Solarbio公司);双荧光素酶测定试剂盒(E1910,美国Promega公司);Magna RIP RNA结合蛋白免疫沉淀试剂盒(17-700,美国Millipore公司)。ABI Prism®7500型实时荧光定量PCR(qPCR)仪(美国Applied Biosystems公司);iMark680多功能酶标仪(美国Bio-Rad公司);FACS Calibur流式细胞仪(美国BD Biosciences公司);Nikon Eclipse Ti-S倒置显微镜(日本Nikon公司)。OIP5-AS1和CHEK1 3'-UTR的野生型(wt)和突变型(mut)双荧光素酶报告载体委托广州锐博生物技术有限公司构建。
1.4 qPCR检测组织和细胞中OIP5-AS1、miR-942-5p和CHEK1 mRNA表达采用TRIzol试剂盒提取组织和细胞的总RNA;引物序列由生工生物工程(上海)股份有限公司合成(表1)。使用逆转录试剂盒将总RNA(2 μg)逆转录为cDNA。随后,使用SYBR Premix Ex TaqⅡ试剂盒扩增cDNA。miR-942-5p以U6为内参基因,OIP5-AS1、CHEK1以GAPDH为内参基因。采用2-ΔΔCt法计算靶基因的相对表达水平。

Tab.1 Primer sequences for qPCR表1 qPCR引物序列
1.5 Western blot检测细胞中CHEK1蛋白表达采用RIPA裂解破坏细胞,并通过用二辛可宁酸(BCA)蛋白质测定法测定蛋白质浓度。然后,通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)实现蛋白质分离,并将蛋白质转移到PVDF膜上。然后,将膜置于冰箱中,与一抗(CHEK1、GAPDH,稀释比例1︰1 000)在4℃下孵育过夜。之后,加入二抗,室温孵育1 h,然后进行化学发光(ECL)试剂显影,Image J软件分析蛋白条带的灰度值,通过与内参(GAPDH)的灰度比,计算CHEK1蛋白的相对表达。
1.6 细胞分组转染实验分为5组:对照(NC)组(未转染细胞)、siRNA阴性对照(si-NC)组(转染siRNA NC序列的细胞)、OIP5-AS1 siRNA(si-OIP5-AS1)组(转染OIP5-AS1 siRNA的细胞)、si-OIP5-AS1+inhibitor阴性对照(si-OIP5-AS1+anti-NC)组(转染OIP5-AS1 siRNA和inhibitor-NC的细胞)、si-OIP5-AS1+miR-942-5p抑制剂(si-OIP5-AS1+antimiR-942-5p)组(用OIP5-AS1 siRNA和miR-942-5p inhibitor转染的细胞)。转染前将U87细胞接种到6孔板中,并将细胞密度调整为2×105个/孔。培养16 h后,采用Lipofectamine 3000试剂进行转染。转染6 h后,将U87细胞在含有10%FBS的培养基中培养48 h。最后,收获细胞并通过qPCR和Western blot检 测 各 组 细 胞 中OIP5-AS1、miR-942-5p和CHEK1 mRNA和蛋白的表达水平,检测步骤同1.4和1.5。
1.7 MTT法测定细胞增殖活性将转染的U87细胞以2 000个/孔的密度接种到96孔板中,培养24、48、72 h。然后,在相应的时间点向每个孔中加入20 μL MTT溶液(5 g/L)孵育4 h。随后,去除孔中的溶液,加入150 μL二甲亚砜(DMSO)溶液以溶解甲臜产物,振荡10 min后,使用酶标仪在570 nm波长下测量每个孔的光密度(OD)值,评估细胞活力。
1.8 流式细胞术检测细胞凋亡转染48 h后,用胰蛋白酶消化转染的U87细胞,PBS洗涤后重新悬浮在1×结合缓冲液中,调整至1×106个/mL。将200 μL细胞悬液转移到试管中,并与5 μL Annexin V-FITC和5 μL PI混合在室温下避光反应15 min。最后,在1 h内用流式细胞仪分析细胞凋亡。
1.9 Transwell迁移和侵袭实验对于侵袭分析,将转染的U87细胞重悬于无血清培养基中,然后取100 μL悬液(3×105个细胞)接种在预涂有Matrigel(孔径8 μm)的Transwell上室中。对于迁移分析,将转染的U87细胞(3×105个/孔)接种在未 包被Matrigel的Transwell上 室。之后,将500 μL含 有10%FBS的DMEM培养基添加到下室。37℃孵育24 h后,使用棉签去除上室膜表面的基质胶和细胞,下室膜表面的细胞用4%多聚甲醛固定,0.1%结晶紫染色30 min。最后,在倒置显微镜下拍照,并在Image J软件下计数随机读取的5个显微视野中穿膜细胞数,取平均值。
1.10 双荧光素酶报告基因检测使用StarBase v2.0数据库(https://starbase.sysu.edu.cn/index.php)预 测OIP5-AS1和miR-942-5p之间以及CHEK1和miR-942-5p之间的结合位点。将U87细胞接种到24孔板中(1×105个/孔),并采用Lipofectamine 3000将50 nmol/L OIP5-AS1-wt(CHEK1-wt)或OIP5-AS1-mut(CHEK1-mut)与50 nmol/L miR-NC或miR-942-5p mimic共转染至细胞。在转染后24 h收获和裂解细胞,使用双荧光素酶报告基因检测系统测量荧光素酶活性。萤火虫荧光素酶活性被标准化为相应的海肾荧光素酶活性。
1.11 miR-942-5p过表达或敲低对CHEK1表达的影响将U87细胞以2×105个/孔的密度接种到6孔板中,分为miR-NC组、miR-942-5p mimic组、inhibitor-NC组、miR-942-5p inhibitor组。采用Lipofectamine 3000将miR-942-5p mimic、miR-942-5p inhibitor及其阴性对照miR-NC、inhibitor-NC分别转染至U87细胞中。转染48 h后,收获细胞并通过qPCR和Western blot检测各组细胞中CHEK1的mRNA和蛋白表达。
1.12 RNA免疫沉淀(RNA immunoprecipitation,RIP)实验使用Magna RIP RNA结合蛋白免疫沉淀试剂盒进行RIP实验。使用完全RIP裂解缓冲液裂解U87细胞,并将100 μL全细胞提取物与含有与人源抗Ago2抗体(1︰50)缀合的磁珠在4℃下孵育6~8 h。正常小鼠IgG抗体(1︰100)用作阴性对照。随后,将样品用洗涤缓冲液洗涤,并与蛋白酶K在55℃下孵育30 min,以从磁珠中分离RNA-蛋白质复合物。然后,提取免疫沉淀的RNA并进行qPCR分析。
1.13 统计学方法 采用GraphPad Prism 8.0软件进行数据分析。计量数据用均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间多重比较采用SNK-q检验;2组间比较采用t检验。采用Pearson法分析脑胶质瘤组织中OIP5-AS1、miR-942-5p和CHEK1 mRNA表达水平的相关性。以P<0.05为差异有统计学意义。
2 结果
2.1 人脑胶质瘤组织中OIP5-AS1、miR-942-5p和CHEK1表达与正常组织相比,脑胶质瘤组织中OIP5-AS1、CHEK1 mRNA水平显著升高,miR-942-5p水平显著降低(P<0.05),见表2。相关性分析结果显示,脑胶质瘤组织中OIP5-AS1与miR-942-5p的表达水平呈负相关(r=-0.936,P<0.01);miR-942-5p与CHEK1 mRNA的表达水平呈负相关(r=-0.931,P<0.01),OIP5-AS1与CHEK1 mRNA的表达水平呈正相关(r=0.935,P<0.01)。此外,OIP5-AS1、CHEK1 mRNA在高级别胶质瘤组织中的表达明显高于低级别组织(P<0.01),而高级别胶质瘤中的miR-942-5p水平明显低于低级别组织(P<0.01),见表3。
Tab.2 Comparison of expression levels of OIP5-AS1,miR-942-5p and CHEK1 mRNA between the two groups表2 2组研究对象中OIP5-AS1、miR-942-5p和CHEK1 mRNA表达水平比较 (n=33,±s)
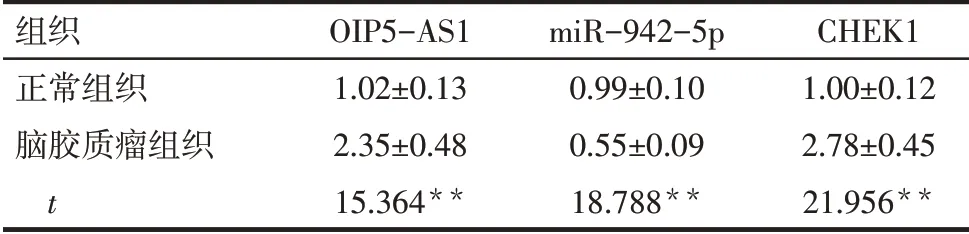
Tab.2 Comparison of expression levels of OIP5-AS1,miR-942-5p and CHEK1 mRNA between the two groups表2 2组研究对象中OIP5-AS1、miR-942-5p和CHEK1 mRNA表达水平比较 (n=33,±s)
**P<0.01。
组织正常组织脑胶质瘤组织t OIP5-AS1 1.02±0.13 2.35±0.48 15.364**miR-942-5p 0.99±0.10 0.55±0.09 18.788**CHEK1 1.00±0.12 2.78±0.45 21.956**
Tab.3 Comparison of expression levels of OIP5-AS1,miR-942-5p and CHEK1 mRNA between gliomas of different pathological grades表3不同病理级别胶质瘤中OIP5-AS1、miR-942-5p和CHEK1 mRNA表达水平比较 (±s)

Tab.3 Comparison of expression levels of OIP5-AS1,miR-942-5p and CHEK1 mRNA between gliomas of different pathological grades表3不同病理级别胶质瘤中OIP5-AS1、miR-942-5p和CHEK1 mRNA表达水平比较 (±s)
**P<0.01。
肿瘤级别低级别胶质瘤高级别胶质瘤t n 14 19 OIP5-AS1 1.83±0.20 2.73±0.36 8.423**miR-942-5p 0.71±0.10 0.43±0.08 8.938**CHEK1 2.05±0.29 3.32±0.56 7.734**
2.2 不同脑胶质瘤细胞系中OIP5-AS1、miR-942-5p和CHEK1表达与NHA细胞相比,脑胶质瘤细胞 系U87、SHG-44、U251和H4中OIP5-AS1、CHEK1 mRNA和CHEK1蛋白水平升高;miR-942-5p mRNA水平降低(P<0.05);其中,U87细胞中OIP5-AS1、CHEK1 mRNA和CHEK1蛋白水平较高,miR-942-5p mRNA水平较低,因此选择U87细胞进行后续实验;见图1、表4。

Fig.1 Expression of CHEK1 protein in different glioma cells图1不同脑胶质瘤细胞中CHEK1蛋白表达
Tab.4 Comparison of OIP5-AS1,miR-942-5p and CHEK1 levels between different glioma cells表4不同脑胶质瘤细胞中OIP5-AS1、miR-942-5p和CHEK1水平比较 (n=6,±s)
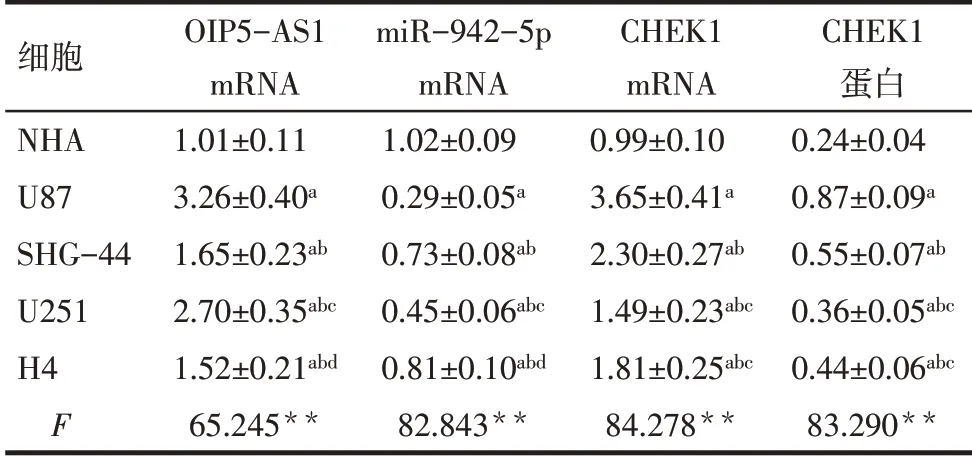
Tab.4 Comparison of OIP5-AS1,miR-942-5p and CHEK1 levels between different glioma cells表4不同脑胶质瘤细胞中OIP5-AS1、miR-942-5p和CHEK1水平比较 (n=6,±s)
**P<0.01;a与NHA细胞比较,b与U87细胞比较,c与SHG-44细胞比较,d与U251细胞比较,P<0.05。
细胞NHA U87 SHG-44 U251 H4 F OIP5-AS1 mRNA 1.01±0.11 3.26±0.40a 1.65±0.23ab 2.70±0.35abc 1.52±0.21abd 65.245**miR-942-5p mRNA 1.02±0.09 0.29±0.05a 0.73±0.08ab 0.45±0.06abc 0.81±0.10abd 82.843**CHEK1 mRNA 0.99±0.10 3.65±0.41a 2.30±0.27ab 1.49±0.23abc 1.81±0.25abc 84.278**CHEK1蛋白0.24±0.04 0.87±0.09a 0.55±0.07ab 0.36±0.05abc 0.44±0.06abc 83.290**
2.3 各 组U87细 胞 中OIP5-AS1、miR-942-5p和CHEK1表达与NC组相比,si-NC组OIP5-AS1、miR-942-5p、CHEK1 mRNA和CHEK1蛋白表达水平差异无统计学意义(P>0.05);与NC组、si-NC组相比,si-OIP5-AS1组OIP5-AS1、CHEK1 mRNA和CHEK1蛋白水平降低,miR-942-5p水平升高(P<0.05);与si-OIP5-AS1组相比,si-OIP5-AS1+anti-NC组上述指标水平差异无统计学意义(P>0.05);与si-OIP5-AS1组、si-OIP5-AS1+anti-NC组相比,si-OIP5-AS1+anti-miR-942-5p组CHEK1 mRNA和蛋白水平升高,miR-942-5p mRNA水平降低(P<0.05);见图2、表5。

Fig.2 CHEK1 protein expression in U87 cells in each group图2各组U87细胞中CHEK1蛋白表达
2.4 沉默OIP5-AS1降低U87细胞增殖活力转染后24、48、72 h时,与NC组相比,si-NC组细胞活力差异无统计学意义(P>0.05);与NC组、si-NC组相比,si-OIP5-AS1组细胞活力显著降低(P<0.05);与si-OIP5-AS1组相比,si-OIP5-AS1+anti-NC组细胞活力差异无统计学意义(P>0.05);与si-OIP5-AS1组、si-OIP5-AS1+anti-NC组 相 比,si-OIP5-AS1+anti-miR-942-5p组细胞活力显著升高(P<0.05)。见表6。
Tab.5 Comparison of OIP5-AS1,miR-942-5p and CHEK1 levels between the five groups of U87 cells表5各组U87细胞中OIP5-AS1、miR-942-5p和CHEK1水平比较 (n=6,±s)

Tab.5 Comparison of OIP5-AS1,miR-942-5p and CHEK1 levels between the five groups of U87 cells表5各组U87细胞中OIP5-AS1、miR-942-5p和CHEK1水平比较 (n=6,±s)
**P<0.01;a与NC比较,b与si-NC组比较,c与si-OIP5-AS1组比较,d与si-OIP5-AS1+anti-NC组比较,P<0.05。
组别NC组si-NC组si-OIP5-AS1组si-OIP5-AS1+anti-NC组si-OIP5-AS1+anti-miR-942-5p组F OIP5-AS1 mRNA 0.99±0.10 1.02±0.11 0.28±0.05ab 0.26±0.04ab 0.30±0.05ab 165.157**miR-942-5p mRNA 1.00±0.12 1.01±0.10 3.54±0.39ab 3.60±0.41ab 1.32±0.20cd 142.939**组别NC组si-NC组si-OIP5-AS1组si-OIP5-AS1+anti-NC组si-OIP5-AS1+anti-miR-942-5p组F CHEK1 mRNA 1.00±0.11 0.98±0.09 0.39±0.05ab 0.36±0.06ab 0.87±0.09cd 88.736**CHEK1蛋白0.82±0.09 0.84±0.10 0.32±0.05ab 0.30±0.04ab 0.72±0.08cd 75.734**
2.5 沉默OIP5-AS1促进U87细胞凋亡与NC组相比,si-NC组细胞凋亡率差异无统计学意义(P>0.05);与NC组、si-NC组相比,si-OIP5-AS1组细胞凋亡率显著升高(P<0.05);与si-OIP5-AS1组相比,si-OIP5-AS1+anti-NC组细胞凋亡率差异无统计学意义(P>0.05);与si-OIP5-AS1组、si-OIP5-AS1+anti-NC组相比,si-OIP5-AS1+anti-miR-942-5p组细胞凋亡率显著降低(P<0.05)。见图3。
Tab.6 Comparison of the viability of U87 cells between the five groups表6各组U87细胞活力比较(n=6,±s)

Tab.6 Comparison of the viability of U87 cells between the five groups表6各组U87细胞活力比较(n=6,±s)
**P<0.01;a与NC比较,b与si-NC组比较,c与si-OIP5-AS1组比较,d与si-OIP5-AS1+anti-NC组比较,P<0.05。
组别NC组si-NC组si-OIP5-AS1组si-OIP5-AS1+anti-NC组si-OIP5-AS1+anti-miR-942-5p组F细胞活力(OD570)24 h 0.36±0.05 0.38±0.06 0.23±0.04ab 0.21±0.03ab 0.34±0.05cd 16.568**48 h 0.58±0.07 0.60±0.07 0.37±0.05ab 0.36±0.05ab 0.55±0.06cd 17.730**72 h 0.95±0.11 0.94±0.12 0.56±0.07ab 0.58±0.06ab 0.89±0.10cd 25.820**
2.6 沉默OIP5-AS1抑制U87细胞迁移和侵袭与NC组相比,si-NC组迁移和侵袭细胞的数量差异无统计学意义(P>0.05);与NC组、si-NC组相比,si-OIP5-AS1组迁移和侵袭细胞的数量显著降低(P<0.05);与si-OIP5-AS1组相比,si-OIP5-AS1+anti-NC组迁移和侵袭细胞的数量差异无统计学意义(P>0.05);与si-OIP5-AS1组、si-OIP5-AS1+anti-NC组相比,si-OIP5-AS1+anti-miR-942-5p组迁移和侵袭细胞的数量显著升高(P<0.05),见表7、图4。
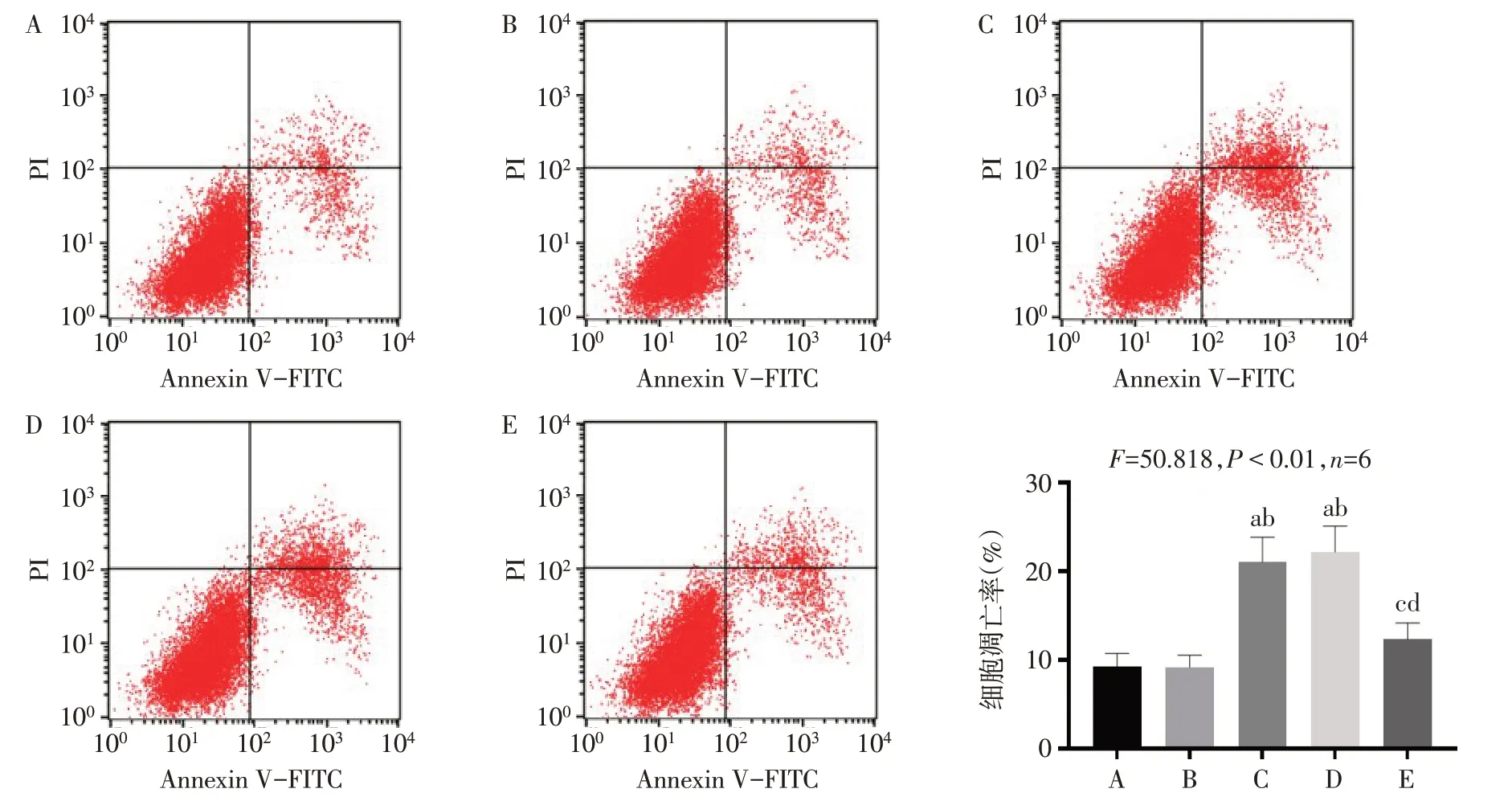
Fig.3 Comparison of apoptosis levels of U87 cells in each group图3各组U87细胞凋亡水平比较
Tab.7 Comparison of migration and invasion numbers of U87 cells between the five groups表7各组U87细胞迁移、侵袭的数量比较(n=6,个/视野,±s)

Tab.7 Comparison of migration and invasion numbers of U87 cells between the five groups表7各组U87细胞迁移、侵袭的数量比较(n=6,个/视野,±s)
**P<0.01;a与NC比较,b与si-NC组比较,c与si-OIP5-AS1组比较,d与si-OIP5-AS1+anti-NC组比较,P<0.05。
组别NC组si-NC组si-OIP5-AS1组si-OIP5-AS1+anti-NC组si-OIP5-AS1+anti-miR-942-5p组F迁移细胞数143.20±18.57 150.36±20.14 62.81±9.56ab 59.44±7.12ab 127.13±15.08cd 52.220**侵袭细胞数86.72±10.31 91.06±12.15 45.54±6.78ab 42.93±7.12ab 83.60±9.45cd 38.177**
2.7 OIP5-AS1靶向miR-942-5p通过StarBase v2.0在线软件对OIP5-AS1潜在结合的miRNA进行生物信息学分析,发现OIP5-AS1含有与miR-942-5p区域互补的结合序列,见图5A。双荧光素酶实验结果显示,与miR-NC组相比,miR-942-5p过表达可显著降低含OIP5-AS1-wt报告载体细胞的荧光素酶活性(P<0.01),对含OIP5-AS1-mut报告载体细胞的荧光素酶活性无明显影响(P>0.05),见图5B。RIP检测结果显示,与对照组(IgG)相比,含有Ago2的复合物可显著富集OIP5-AS1和miR-942-5p(P<0.01),见图5C。
2.8 miR-942-5p直接靶向癌基因CHEK1通过StarBase v2.0在线软件预测miR-942-5p的潜在靶基因,发现miR-942-5p与CHEK1的3'-UTR存在结合位点,见图6A。双荧光素酶实验结果显示,与miRNC组相比,miR-942-5p过表达可显著降低含CHEK1-wt报告载体细胞的荧光素酶活性(P<0.01),对含CHEK1-mut报告载体细胞的荧光素酶活性无明显影响(P>0.05),见图6B。qPCR和Western blot检测miR-942-5p过表达和敲低对CHEK1表达的影响,结果显示miR-942-5p过表达降低了CHEK1的mRNA和蛋白表达,而miR-942-5p敲低具有相反的效果(P<0.01),见图6C~E。
3 讨论
3.1 OIP5-AS1、miR-942-5p和CHEK1在胶质瘤中的表达近年来,lncRNA正在成为肿瘤等疾病发生发展过程中的重要调节因子。越来越多的证据表明,lncRNA在脑胶质瘤中存在异常表达,会影响肿瘤细胞的生物学过程,如NEAT1[14]、SNHG7[15]和PVT1[16]等lncRNA的功能已被揭示。OIP5-AS1作为众多基因的转录调节因子而受到关注。据报道,OIP5-AS1在多种肿瘤中过表达,与包括脑胶质瘤[5-6]在内的多种肿瘤患者的不良生存率相关;可调节和控制肿瘤生长并参与肿瘤进展,可能是多种肿瘤的有效生物标志物和潜在治疗靶点[17]。本研究中,OIP5-AS1在人脑胶质瘤组织和细胞系中高表达,而miR-942-5p下调,CHEK1上调,与以往的研究结果一致[5,10-11]。此外,OIP5-AS1、miR-942-5p和CHEK1 mRNA的表达与胶质瘤的病理分级有关。胶质瘤患者病理分级越高,OIP5-AS1、CHEK1 mRNA表达水平越高,miR-942-5p表达水平越低,提示上述3个因子可能与脑胶质瘤的发生和发展密切相关。

Fig.4 Migration and invasion of U87 cells in each group(×200)图4各组U87细胞迁移和侵袭情况(×200)

Fig.5 Interaction of OIP5-AS1 with miR-942-5p in glioma cells图5 OIP5-AS1与脑胶质瘤细胞中miR-942-5p的相互作用

Fig.6 miR-942-5p directly targets the oncogene CHEK1图6 miR-942-5p直接靶向癌基因CHEK1
3.2 OIP5-AS1通过靶向miR-942-5p在胶质瘤中发挥致癌作用lncRNA可充当miRNA的分子海绵,在细胞的多个过程中发挥重要作用。有研究显示,miR-942-5p在脑胶质瘤中呈低表达,其低表达可诱导脑胶质瘤的恶性表型[10]。本研究结果显示,脑胶质瘤组织中OIP5-AS1的表达水平与miR-942-5p的水平呈负相关。StarBase数据库预测发现OIP5-AS1序列含有与miR-942-5p序列互补的结合位点,提示OIP5-AS1和miR-942-5p之间可能存在靶向关系。双荧光素酶报告基因分析证实miR-942-5p是OIP5-AS1的靶标。为进一步确定OIP5-AS1和miR-942-5p的结合关系,使用Ago2抗体在U87细胞中进行RIP测定以验证OIP5-AS1和miR-942-5p是否可以与Ago2相互作用。结果显示,OIP5-AS1和miR-942-5p均 可被Ago2富 集,表 明OIP5-AS1和miR-942-5p存在相互作用。为研究OIP5-AS1和miR-942-5p对脑胶质瘤生长的调节作用,本研究选择了U87细胞进行体外转染。结果显示,在U87细胞中使用siRNA沉默OIP5-AS1可上调miR-942-5p表达,有效抑制细胞增殖、侵袭和迁移能力,并促进细胞凋亡;而下调miR-942-5p表达促进了肿瘤细胞的恶性生物学功能,且减弱了OIP5-AS1沉默对细胞生物学行为的影响,提示OIP5-AS1可能通过调节miR-942-5p在脑胶质瘤的发病和进展中发挥作用。
3.3 CHEK1是miR-942-5p的潜在靶基因本研究发现,脑胶质瘤组织中miR-942-5p与CHEK1 mRNA相对表达量呈负相关。为进一步研究OIP5-AS1/miR-942-5p轴在调节胶质瘤发生中的潜在分子机制,通过生物信息学分析预测癌基因CHEK1可能是miR-942-5p的下游靶基因;双荧光素酶报告基因分析证实miR-942-5p可直接靶向CHEK1 mRNA的3'-UTR。然后,qPCR和Western blot分析显示,miR-942-5p过表达后,U87细胞中CHEK1的mRNA和蛋白水平显著降低,而下调miR-942-5p可增加U87细胞中CHEK1的表达水平,证实了CHEK1是miR-942-5p的直接靶标。以上这些结果表明,miR-942-5p可能通过直接结合CHEK1的3'-UTR来抑制CHEK1的表达。此外,沉默OIP5-AS1能够降低CHEK1的表达,同时上调miR-942-5p,抑制肿瘤细胞的恶性表型;而下调miR-942-5p可通过上调CHEK1表达,阻断OIP5-AS1沉默对肿瘤细胞恶性表型的抑制作用,提示OIP5-AS1可通过调节miR-942-5p/CHEK1轴来促进肿瘤的发生。
综上所述,沉默OIP5-AS1可能通过上调miR-942-5p抑制CHEK1表达,抑制脑胶质瘤细胞的增殖、侵袭和迁移,并促进细胞凋亡。OIP5-AS1可通过充当miR-942-5p的海绵来调节CHEK1表达,从而促进脑胶质瘤的发生和进展。本研究再次证实了OIP5-AS1可能是脑胶质瘤治疗的潜在靶点,加深了对其分子机制的认识,但OIP5-AS1/miR-942-5p/CHEK1网络在脑胶质瘤细胞其他生物学功能中的调控机制仍有待深入研究。此外,OIP5-AS1的功能机制仍需通过体内研究进一步验证。
