犀角地黄汤合方对DC激活ITP患者T细胞增殖分化的影响
2022-12-21杨武霞刘宝山吴玉红李润杰王梦晓王爱迪
杨武霞,刘宝山,吴玉红,李润杰,王梦晓,王爱迪△
免疫性血小板减少症(primary immune thrombocytopenia,ITP)是以无明确诱因的孤立性外周血血小板减少为主要特点的一种常见的自身免疫性疾病,临床表现为不同程度的出血,轻者可见皮肤黏膜出血,严重者可见内脏及颅内出血[1]。体液免疫失调和细胞免疫失调为ITP的主要发病机制。细胞免疫失调主要指T细胞功能异常,包括调节性T细胞(regulatory T cells,Treg)数量减少和效应性T细胞(effector T cells,Teff)数量增多等。树突状细胞(dendritic cell,DC)作为功能强大的抗原提呈细胞,在受到抗原刺激后可逐渐成熟,进而激活T细胞,使初始T细胞增殖活化并分化为Treg和Teff,引起免疫功能紊乱,导致ITP的发生[2]。本研究旨在通过DC荷载血小板抗原与CD4+T细胞共培养,体外模拟ITP发病过程中T细胞被DC激活的情况,探讨犀角地黄汤合方对DC激活的T细胞增殖分化的影响。
1 材料与方法
1.1 动物SPF级SD雄性大鼠10只,8周龄,体质量(200±20)g,购自北京华阜康生物科技股份有限公司,动物许可证号:SCXK(京)2021-0011。饲养于易生源基因科技(天津)有限公司动物中心清洁级动物房,温度20~26℃。适应性喂养7 d,自由进食和饮水。
1.2 研究对象选取2021年9月—2022年1月于天津医科大学总医院血液科住院的初诊ITP患者8例,年龄18~50岁,诊断符合《成人原发免疫性血小板减少症诊断与治疗专家共识》(2016年版),且不伴有妊娠、糖尿病、高血压、结核病和其他(如系统性红斑狼疮和强直性脊柱炎等)自身免疫性疾病;同期选取天津医科大学总医院健康志愿者15例,年龄18~50岁,排除妊娠、高血压、糖尿病、结核病和其他自身免疫性疾病,且肝肾功能及血常规均正常。本研究符合医学伦理要求并通过天津医科大学总医院伦理委员会审核批准(IRB2020-KY-189),所有入选者均对研究知情同意。
1.3 主要试剂与仪器犀角地黄汤合方颗粒剂购自天津红日康仁堂药业,人全血单个核细胞分离液购自天津瀚洋生物制品有限责任公司,CD14免疫磁珠购自德国美天旎生物技术有限公司,重组人粒细胞-巨噬细胞集落刺激因子(GMCSF)、重组人白细胞介素(IL)-4及羧基荧光素二醋酸盐琥珀酰亚胺酯(CFSE)均购自北京索莱宝生物工程有限公司,脂多糖(LPS)购自德国默克公司,PD-1抗体、CD4抗体、CD25抗体、叉头框蛋白P3(FoxP3)抗体购自BD Bioscience公司;白细胞介素(IL)-2、干扰素-γ(IFN-γ)、IL-17、IL-10、转化因子-β(TGF-β)酶联免疫吸附试验(ELISA)试剂盒均购自北京索莱宝生物工程有限公司。Transwell小室购自美国康宁公司、CO2细胞培养箱Micro CL21R、常温低速离心机、Presco 21Muitifuge XIR离心机均购自美国Thermo Fisher Scientific公司,超净工作台购自苏州苏净仪器自控设备有限公司,Cytation 3型多功能酶标仪购自美国Bio-Tek公司,流式细胞仪(FCM)购自安捷伦科技有限公司。
1.4 研究方法
1.4.1 犀角地黄汤合方含药血清制备采用随机数字表法将10只SD大鼠分为含药血清组和空白血清组,每组5只。犀角地黄汤合方成人临床常用量为水牛角30 g(先煎)、生地24 g、白芍12 g、丹皮9 g、当归6 g、黄芪30 g、旱莲草15 g及女贞子15 g,根据《中药药理研究方法学》[3]按人与动物体表面积换算公式等效计量法确定大鼠用量为2 g/(kg·d),浓缩药物含量至2 g/mL,4℃冰箱保存。给药方法:含药血清组给予犀角地黄汤合方灌胃,空白血清组给予等量蒸馏水灌胃,每日2次,连续灌胃3 d。末次给药1 h后腹主动脉取血,静置2 h后700×g离心10 min取上层血清,除菌灭活后放置于-20℃冰箱,备用。
1.4.2 CD14+T细胞和CD4+T细胞获取收取ITP患者和健康志愿者外周血50 mL,将血液等浓度稀释后缓慢加入到人单个核细胞分离液上层,700×g离心20 min,液体分为4层,吸取第2层环状乳白色层,磷酸缓冲盐溶液(PBS)洗涤后得到外周血单个核细胞,计数,每1×107个细胞加入20 μL CD14+免疫磁珠,4℃孵育15 min后将细胞悬液通过磁力架上的细胞分选柱,得到CD14+T细胞。同样的方法收集得到CD4+T细胞。
1.4.3 荷载血小板抗原的DC细胞培养将ITP患者自体血小板与CD14+T细胞以数量100∶1的比例加入到含10%胎牛血清及1%双抗的1640培养基中重悬,并加入终浓度为5×104ng/L的IL-4及1×105ng/L的GM-CSF,置于37℃、5%CO2的培养箱中培养5 d,再加入1×103μg/L的LPS继续培养2 d,诱导成为荷载血小板抗原的成熟DC细胞。
1.4.4 CFSE标记CD4+T细胞在进行共培养检测T细胞增殖能力前,将CD4+T先进行CFSE染色,用PBS调整细胞浓度为1×106个/mL,并加入2×CFSE工作液,轻轻混匀。37℃避光孵育10 min,加入10 mL 37℃预热的完全培养基,室温颠倒混匀,终止标记反应。1 000 r/min离心5 min后弃上清液,再加入5 mL全培养基洗涤1次后与荷载血小板抗原的DC细胞构建共培养体系。
1.4.5 建立DC与CD4+T细胞共培养体系并分组干预将荷载血小板抗原的DC与CD4+T细胞按照数量1∶10的比例培养于Transwell小室,DC接种于下室(1×105个/孔),CD4+T细胞接种于上室(1×106个/孔)。将共培养细胞分为对照组、模型组和犀角地黄汤合方低、中、高剂量组,对照组为荷载血小板抗原的DC与健康志愿者CD4+T细胞,模型组和犀角地黄汤合方低、中、高剂量组为荷载血小板抗原的DC与ITP患者的CD4+T细胞,其中对照组和模型组加入大鼠空白血清,犀角地黄汤合方低、中、高剂量组分别加入体积分数5%、10%、20%大鼠含药血清,干预72 h。
1.4.6 FCM检测经CFSE标记的CD4+T细胞的增殖情况干预结束后,收集各组上室中的CD4+T细胞,并调整为6×105个/mL,PBS洗涤2次,流式细胞仪FL1通道检测CD4+T细胞增殖情况。
1.4.7 FCM检测CD4+T细胞中Treg和Teff的比例干预结束后,收集各组上室中的CD4+T细胞,并调整为6×105个/mL,PBS洗 涤2次,以CD4+CD25+FoxP3+标 记Treg细 胞,CD4+CD25-标记Teff,常温避光反应20 min后PBS洗涤2次,流式细胞术检测CD4+T细胞中CD4+CD25+FoxP3+及CD4+CD25-表达率。
1.4.8 FCM检测CD4+T表面PD-1表达量干预结束后,收集各组上室中的CD4+T细胞,并调整细胞浓度为6×105个/mL,PBS洗涤2次,加入PD-1抗体,常温避光反应20 min后PBS洗涤2次,流式细胞术检测PD-1的表达量。
1.4.9 ELISA检测共培养上清液中细胞因子的含量 干预完成后,收集共培养细胞上清液,按照ELISA检测试剂盒说明书操作,检测细胞因子IL-2、IFN-γ、IL-17、IL-10、TGF-β的含量。
1.5 统计学方法 采用SPSS 26.0软件进行数据分析。符合正态分布的计量资料采用±s表示,多组间用单因素方差分析,方差齐者用单因素方差分析,组间多重比较用LSD-t法,方差不齐用Welch法,多重比较用Dunnett T3法。P<0.05为差异有统计学意义。
2 结果
2.1 倒置显微镜下DC和CD4+T细胞形态人外周血单个核细胞诱导的DC细胞培养到第7天时细胞成熟,大部分细胞悬浮生长,倒置显微镜下可见细胞边缘有明显的树突样突起;从外周血中分离出的CD4+T细胞亦悬浮生长,镜下可见细胞呈圆形,体积较小,见图1。
2.2 各组CD4+T细胞增殖情况比较对照组、模型组及犀角地黄汤合方低、中、高剂量组CD4+T细胞增殖比例分别为(单位:%)84.34±0.63、94.34±0.24、88.24±0.34、87.27±0.60、86.05±0.58(n=3,F=172.709,P<0.05);与对照组比较,其他各组CD4+T淋巴细胞增殖比例升高(P<0.05);与模型组比较,犀角地黄汤合方低、中、高剂量组CD4+T淋巴细胞增殖比例依次降低(P<0.05),见图2。
2.3 各组CD4+T细胞中Treg和Teff比例比较与对照组比较,各组Treg比例降低,Teff比例升高(P<0.05);与模型组比较,犀角地黄汤合方低、中、高剂量组Treg细胞比例升高,Teff比例依次降低(P<0.05),见图3、表1。
2.4 各组CD4+T细胞表面PD-1表达量比较对照组、模型组及犀角地黄汤合方低、中、高剂量组CD4+T细胞PD-1的表达量分别为(单位:%):9.03±0.45、4.83±0.60、5.35±0.94、5.94±0.48、8.37±0.18(n=3,F=1 616.023,P<0.05),与对照组比较,各组CD4+T细胞上PD-1的表达量减少(P<0.05);与模型组比较,犀角地黄汤合方低、中、高剂量组CD4+T细胞上PD-1表达量依次升高(P<0.05),见图4。

Fig.1 DC and CD4+T cells and co-culture morphology of DC and CD4+T cells under inverted microscope图1倒置显微镜下DC、CD4+T细胞及DC与CD4+T细胞共培养形态

Fig.2 Effects of XJDHHF on DC-induced CD4+T cell proliferation图2 DC诱导后各组CD4+T细胞增殖的水平
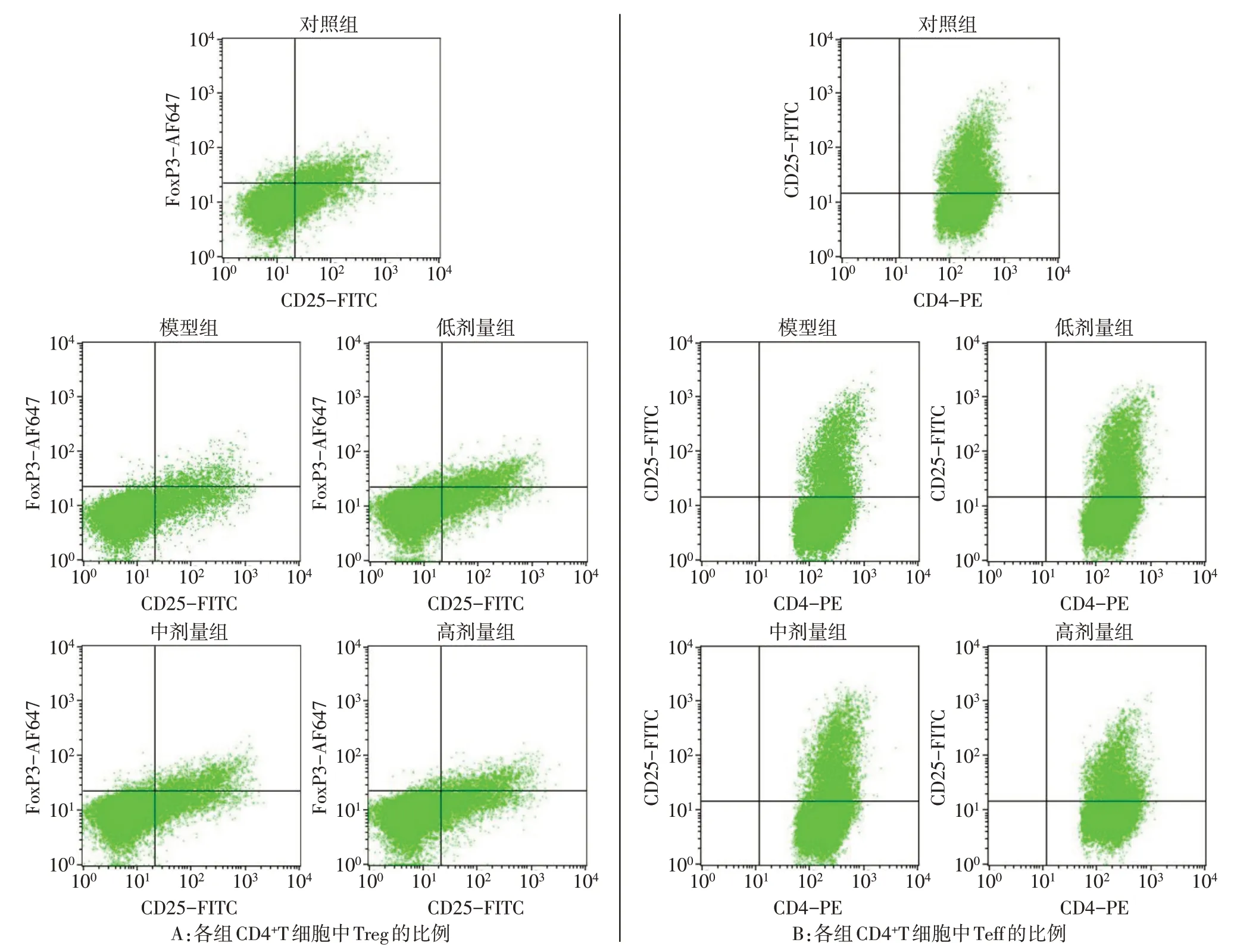
Fig.3 The proportion of Treg and Teff in CD4+T cells in each group图3各组CD4+T细胞中Treg、Teff的比例
Tab.1 The proportion of Treg and Teff cells in CD4+T cells in each group表1各组细胞中Treg和Teff细胞所占CD4+T细胞的比例(n=3,%,±s)

Tab.1 The proportion of Treg and Teff cells in CD4+T cells in each group表1各组细胞中Treg和Teff细胞所占CD4+T细胞的比例(n=3,%,±s)
*P<0.05,**P<0.01;a与对照组比较,b与模型组比较,c与低剂量比较,d与中剂量比较,P<0.05。
组别对照组模型组犀角地黄汤合方低剂量组犀角地黄汤合方中剂量组犀角地黄汤合方高剂量组F Treg 8.82±0.11 3.46±1.11a 4.09±0.13ab 5.23±0.95abc 6.47±0.45abc 747.550**Teff 67.75±1.20 82.54±0.66a 79.50±0.69ab 76.57±0.97abc 72.02±1.70abcd 83.971**
2.5 各组CD4+T细胞下游效应因子分泌水平比较与对照组比较,各组的促炎因子IL-2、IFN-γ、IL-17水平升高,抑炎因子IL-10、TGF-β水平降低,但高剂量组IFN-γ和IL-10与对照组比较差异无统计学意义;与模型组比较,犀角地黄汤合方低、中、高剂量组促炎因子IL-2水平降低,抑炎因子IL-10、TGF-β水平升高(P<0.05);低、中、高剂量组IFN-γ、IL-17依次降低,但低剂量组IFN-γ、IL-17与模型组比较差异无统计学意义;TGF-β水平依次升高(P<0.05),见表2。
3 讨论
目前,ITP的一线治疗方案包括输注糖皮质激素、免疫球蛋白、血小板生成素(TPO)受体激动剂、脾切除术及免疫抑制剂等[4]。尽管这些治疗方案在短期内对ITP具有一定效果,但其不良反应较大,长期缓解率较低。ITP在传统医学中被称为“紫癜病”[5]。根据其“热”、“虚”、“瘀”的病因病机,刘宝山教授采用“益气养阴、凉血化瘀”的治疗法则,拟定以犀角地黄汤(水牛角代、生地黄、白芍、丹皮)为主方,加用当归补血汤(当归、黄芪)和二至丸(女贞子、旱莲草)治疗本病,临床效果显著[6]。

Fig.4 Expression levels of PD-1 on CD4+T cells in each group图4各组CD4+T细胞表面PD-1表达量
Tab.2 The amount of downstream effectors secreted by CD4+T cells in each group表2各组CD4+T细胞下游效应因子分泌的量 (n=3,ng/L,±s)

Tab.2 The amount of downstream effectors secreted by CD4+T cells in each group表2各组CD4+T细胞下游效应因子分泌的量 (n=3,ng/L,±s)
*P<0.05,**P<0.01;a与对照组比较,b与模型组比较,c与犀角地黄汤合方低剂量比较,d与犀角地黄汤合方中剂量比较,P<0.05。
组别对照组模型组犀角地黄汤合方低剂量组犀角地黄汤合方中剂量组犀角地黄汤合方高剂量组F IL-2 15.77±3.46 137.56±7.19a 51.71±3.30ab 27.98±0.51abc 27.52±1.53abc 476.357**150.24±10.71 809.56±41.18a 685.93±7.45a 467.41±21.54abc 381.29±56.48bcd 915.451**IFN-γ IL-17 118.80±3.27 520.29±9.96a 515.86±3.51a 456.48±5.25abc 327.08±6.59abcd 2 226.488**IL-10 47.22±2.54 16.45±3.70a 27.76±3.05ab 31.81±2.43ab 41.54±4.39bc 39.683**TGF-β 609.51±9.39 200.84±3.69a 213.98±1.91ab 311.57±3.60abc 481.23±7.04abcd 2 810.404**
既往观点认为,ITP的发病机制主要是体液免疫失调导致的血小板过度破坏和血小板生成受抑。近年来,越来越多的研究聚焦于细胞免疫失调,其中CD4+T细胞稳态失调在ITP的病理生理过程中发挥重要作用[7]。CD4+T细胞稳态失调表现为Treg数量和功能下降,以及Teff过度活化、增殖能力增强[8]。T细胞的激活需要DC参与并提供3种信号:第一信号是外源性抗原肽与DC表面主要组织相容性复合体(MHC)分子结合形成的MHC分子-抗原肽复合物,与T细胞表面受体(TCR)相互作用;第二信号是DC表面表达的协同共刺激分子CD80、CD86和人类白细胞DR抗原(HLA-DR)等与T细胞表面分子如CD28相互作用后产生共刺激信号;第三信号是DC分泌产生的细胞因子如IL-12、TNF-α、IL-6等,直接影响T细胞的分化方向。CD4+T细胞被DC激活后可以增殖分化为Treg细胞和Teff细胞[9-10]。Treg和Teff是初始T细胞被激活后增殖分化的两种功能不同的T细胞亚群,其中Treg细胞是限制免疫和确保免疫耐受的重要检查点,可通过分泌IL-10、TGF-β等细胞因子促进CD4+T细胞不断分化,或通过细胞间接触抑制效应性免疫细胞的活化和增殖,发挥免疫负调控作用,从而维持机体的免疫平衡[11]。Teff细胞是执行免疫功能的主要细胞,当Teff细胞分泌的炎性因子IL-2、IFN-γ、IL-17等过多时,可导致自身免疫或过敏性疾病的发生[12]。
本课题前期研究证实,犀角地黄汤合方可以修复Teff/Treg失衡,这可能与抑制磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(Akt)/哺乳动物雷帕霉素靶蛋白(mTOR)信号通路活化有关[6]。本研究结果显示,与对照组比较,模型组CD4+T增殖比例明显增加,Treg比例明显降低,Teff比例明显升高,且促炎因子IL-2、IL-17、IFN-γ水平较高,抑炎因子TGF-β、IL-10水平较低,表明血小板预载活化的DC细胞可以激活ITP患者CD4+T细胞过度增殖,导致ITP细胞模型发生过度免疫反应。经犀角地黄汤合方含药血清干预后,与模型组比较,犀角地黄汤合方低中高剂量组CD4+T增殖比例下降,且Treg比例上升,Teff比例下降,IL-2、IL-17、IFN-γ等促炎因子水平下降,抑炎因子TGF-β和IL-10水平上升,提示犀角地黄汤合方含药血清尤其是高剂量组可在体外抑制CD4+T的过度增殖,纠正ITP患者Teff和Treg的比例失衡,调节细胞因子的分泌,维持机体免疫稳态。
PD-1是一种共抑制性表面受体,可影响T细胞的分化,抑制炎症介质的释放,促进Treg细胞生成,在免疫应答调控、免疫耐受的建立中发挥重要作用。PD-1主要通过与其配体PD-L1结合,促使TCR复合物中的信号分子去磷酸化,抑制TCR信号传导,进一步抑制T细胞增殖活化、并抑制炎性细胞因子分泌[13]。本研究显示,与对照组比较,模型组PD-1的表达量明显减少,提示ITP患者细胞模型存在免疫功能失调,经犀角地黄汤合方含药血清干预后,犀角地黄汤合方低、中、高剂量组PD-1表达量依次升高,提示犀角地黄汤合方尤其是高剂量组可以提高T细胞表面PD-1的表达,抑制TCR信号的传导,进而影响T细胞的增殖分化。
综述所述,犀角地黄汤合方含药血清可以在体外提高CD4+T细胞表面PD-1的表达,抑制T细胞的过度增殖活化,进而影响T细胞的分化,促进Treg细胞的生成,抑制Teff细胞的生成,使促炎因子IL-2、IL-17、IFN-γ分泌减少,抑炎因子TGF-β、IL-10分泌增多。有利于机体恢复免疫平衡稳态,对ITP产生积极作用。
