大口黑鲈β-防御素在杆状病毒系统中的表达及抑菌活性
2022-12-21管翠翠李洁琼蒋长军姚伦广
管翠翠 邱 礽,3 李洁琼 蒋长军 姚伦广,3
(1.南阳师范学院生命科学与农业工程学院, 南阳 473061; 2.河南省畜禽保健品工程技术研究中心, 南阳 473061; 3.河南省伏牛山昆虫生物重点实验室和河南省昆虫生物反应器工程实验室, 南阳 473061)
抗菌肽(AMPs)是所有生物先天免疫系统的重要组成部分[1], 在免疫应答中通过直接杀伤或刺激免疫效应细胞, 从而发挥抗细菌、抗真菌、抗寄生虫和抗癌等多种防御特性[2]。目前发现了鱼类特有的抗菌肽: piscidin家族及防御素、cathelicidin、hepcidin家族[3]。防御素通常含有18—45个氨基酸和3—4个二硫键[4]。在哺乳动物中, 根据防御素的结构可以分为3个不同的亚家族(α-、β-和θ-防御素)[5]。鱼类的防御素只有β-防御素样蛋白[6], 含有6个保守的半胱氨酸, 可以形成Cys1-Cys5、Cys2-Cys4和Cys3-Cys6三对二硫键[7]。鱼类防御素被证明具有多种功能, 包括抗菌、抗病毒和免疫调节活性等[8]。很多研究也表明, 重组或合成防御素能够直接抑制革兰氏阳性和革兰氏阴性细菌及一些病毒的生长[9,10]。
大口黑鲈(Micropterus salmoides)属于鲈形目、太阳鱼科, 黑鲈属, 原产于美国加利福尼亚州,于1983年引入中国, 因其易养殖、生长迅速、肉质肥美、抗病能力强等优点被广泛养殖。但近些年来人们发现, 在养殖大口黑鲈时, 其可能患上气泡病、水霉病、烂鳃病、脂肪肝病及肠炎病等十几种病, 急需采取措施改善这一现状。由于防御素对细菌有很强的抑制作用而不易在细菌中高效表达,且其在原核系统中的表达具有不能正确折叠, 缺少翻译后的修饰等缺点, 所以具有比较完备的基因表达调控机制和对真核基因表达产物的加工修饰能力的杆状病毒表达系统成为一个较为理想的防御素基因表达系统, 并且由于p10和polh启动子是晚期基因表达的强活性启动子, 所以可以高效表达防御素基因。在本研究中, 我们通过分析大口黑鲈β-防御素基因(MSBdefe), 并通过杆状病毒表达系统, 进行了MSBdefe重组蛋白表达及其抑菌功能的鉴定。本研究将为开发水产养殖药物提供依据。
1 材料与方法
1.1 材料
菌种与表达载体大肠杆菌E.coliTOP10菌株; 质粒pYBDM-IM是由本实验室改造pFBDM所得, 缺失掉SpeⅠ酶切位点, 在SphⅠ位点和KpnⅠ位点之间插入核糖体结合位点的IRES 基因(简写为Ⅰ)和起报告基因作用的红色荧光蛋白基因Mecherry(简写为M), 而其中的IRES有助于其红色荧光蛋白的表达显示; 菌株Ac MμLtiBac/rSW106/asd–/inv+,Sf9细胞、嗜水气单胞菌(Aeromonas hydrophila)由本实验室保存, 大口黑鲈购买自附近养殖场。
主要试剂KOD-Plus-Neo高保真酶购自TOYOBO公司, 限制性核酸内切酶购自NEB公司;提质粒和胶回收试剂盒购自OMEGA公司; ExTaq酶购自宝生物; 镍亲和层析介质、增强型DAB显色试剂盒、抗生素购自Solarbio公司; pEASY-Blunt Zero Cloning Kit, Trans2K Plus DNA Marker, TOP10感受态细胞购自全式金; Biospin Virus DNA/RNA Extraction Kit 试剂盒购自BioFlux公司; T4 DNA Ligase、蛋白预染Marker、昆虫细胞培养基Sf-900 ⅢSFM购自赛默飞; 6×His, His-Tag Mouse Monoclonal antibody、HRP-conjugated Affinipure Goat Anti-Mouse IgG(H+L)购自Proteintech Group公司。
1.2 方法
MSBdefe的序列分析通过本实验室构建的大口黑鲈基因组文库, 发现一个核酸序列同之前报道的大口黑鲈β-防御素基因(GenBank: XP0385 64716)完全一致。通过DNAMAN对大口黑鲈β-防御素(MSBdefe)与GenBank中的部分硬骨鱼类: 欧洲鲈(QZN83614)、条石鲷(AJA33388)、鳜(ACO88907)、大西洋白姑鱼(ASW20415)、长棘银鲈(QNV47918)、马拉巴若鲹(QJW82620)、点带石斑鱼(AFA41485)、鲻(QOS14209)、卵形鲳鲹(AWY04221)、泰国鳢(QJW82621)、小鼠(AAT67592)及人类(NP001035792)的β-防御素进行同源性比对。
MSBdefe的克隆与载体构建根据昆虫密码子偏爱性, 对MSBdefe基因进行密码子优化后, 由苏州鸿讯生物科技有限公司合成, 序列克隆5′端引入SmaI酶切位点(CCCGGG)和Flag标签(DYKDDDDK), 3′端引入XhoⅠ酶切位点, 酶切位点前添加8个His标签和终止密码子(TAA), 以保证目的基因的检测和纯化。添加标签后, 表达基因序列长度达到345 bp。目的基因插入pUC57载体中, 得到pUC-MSBdefe质粒。MSBdefe区域检测引物用Primer Premier5.0软件分析设计, 只针对目的片段其中305 bp进行扩增, 设计的引物送上海生物工程技术服务有限公司合成, 上游引物MSBdefeJCF:ATGGATTACAAGGATGACGAC, 下游引物MSBdefeJCR: CAGCAGAATGCCCAGAGTC。
构建重组转移载体用SmaⅠ/XhoⅠ限制性内切酶双酶切pUC-MSBdefe上的目的基因, 将其与经SmaⅠ/XhoⅠ限制性内切酶双酶切的供体载体pYBDM-IM按1﹕7(摩尔比)混合, 在T4 DNA连接酶作用下4℃孵育过夜后, 转入大肠杆菌TOP10感受态细胞。经菌落PCR和SmaⅠ/XhoⅠ双酶切鉴定,将鉴定正确的阳性质粒命名为MSBdefe-pYBDM-IM。
重组Bacmid菌株的获得将5 μL重组转移质粒MSBdefe-pYBDM-IM加到100 μL大肠杆菌感受态Ac MultiBac/rSW106/asd–/inv+中, 冰浴30min,待冰浴时间到后迅速在42℃水浴锅中热激90s, 待热激结束, 将感受态转移至冰上, 孵育3min后加入1 mL含有DAP的LB培养基, 32℃, 200 r/min, 振荡培养5—6h。离心后将适量菌液涂布于含有DAP/Kan/Tet/Spe/IPTG/X-Gal/Gm的LB筛选平板, 32℃培养48h,直至出现蓝白斑, 挑取白斑菌落用特异性引物MSBdefeJCF, MSBdefeJCR进行菌落PCR鉴定, 将鉴定正确的阳性Bacmid菌落命名为MSBdefe-pYBDMIM-Am。
重组杆状病毒的构建将构建好的Bacmid菌液感染Sf9细胞, 具体过程为: 取1 mLMSBdefepYBDM-IM-Am菌液于1.5 mL灭菌管中, 5000 r/min离心3min收集菌体并弃上清。用1 mL无菌水重悬菌体, 5000 r/min离心3min收集菌体并弃上清, 重复洗4—5次。加入1 mL Sf-900 Ⅲ SFM培养基重悬, 此时菌液浓度记为100。按1﹕10倍梯度稀释, 将菌液浓度稀释成10–1、10–2和10–3。将稀释后的菌液依次加入培养有Sf9细胞的24孔板中, 每孔500 μL。28℃孵育4h后弃去上清, 用培养基清洗3次后每孔加入500 μL培养基, 28℃孵育3—5d, 在倒置荧光显微镜下观察是否有红色荧光出现, 判断杆状病毒是否重组成功。收集200 μL感染重组病毒的Sf9细胞培养基上清, 使用BioFlux公司Biospin Virus DNA/RNA Extraction Kit试剂盒提取重组杆状病毒DNA。以重组杆状病毒DNA为模板, 用MSBdefe基因的检测引物MSBdefeJCF, MSBdefeJCR进行PCR鉴定, 重组病毒命名为AV-MSBdefe。
重组蛋白表达及鉴定收集200 mLAV-MSBdefe感染的Sf9细胞, 3000 r/min离心去掉细胞培养基后用PBS清洗1—2次, 加适量PBS重悬, 在冰上进行超声破碎直至溶液透亮。3000 r/min离心10min获得上清, 将上清经0.45 μm滤膜过滤后, 用带有His标签的Ni柱进行纯化, 纯化蛋白冻于–80℃保存,以备检测。蛋白进行SDS-PAGE电泳后, 转移到PVDF膜上, 脱脂奶粉封闭1h后, 分别用抗His的鼠单克隆抗体为一抗, HRP标记的山羊抗小鼠IgG为二抗各孵育1h, 用最新配置的DAB显色试剂进行显色。
重组蛋白体外抑菌活性检测采用平板涂布法检测MSBdefe重组蛋白抑菌活性。具体过程为: 将嗜水气单胞菌接种于LB液体培养基中,28℃、200 r/min培养12h, 至A600为1.0, 菌液梯度稀释至1×104CFU/mL。分别添加终浓度为30、15 和7.5 μg/mL的MSBdefe重组蛋白, 每个浓度做3个重复, 28℃培养2h后, 取100 μL涂于无抗固体LB平板上, 阴性对照为PBS处理组, 同样做3个重复, 28℃过夜培养后观察菌落生长情况并进行菌落计数, 并使用GraphPad Prism 9软件进行分析。

式中,A1为实验组的菌落数,A2为阴性对照组的菌落数。
2 结果
2.1 同源序列分析
MSBdefe基因编码63个氨基酸残疾, BLAST分析表明,MSBdefe与一些硬骨鱼的β-防御素的序列同源性可以达到92.06%—98.41%。和欧洲鲈(Dicentrarchus labrax)、条石鲷(Oplegnathus fasciatus)、鳜(Siniperca chuatsi)、大西洋白姑鱼(Argyrosomus regius)、长棘银鲈(Gerres filamentosus)、马拉巴若鲹(Carangoides malabaricus)、点带石斑鱼(Epinephelus coioides)、鲻(Mugil cephalus)、卵形鲳鲹(Trachinotus ovatus)和泰国鳢(Channa striata)的同源性分别达到98.41%、96.83%、96.83%、95.31%、95.24%、93.65%、93.65%、92.54%、92.06%和92.06%。同人(Homo sapiens)和小鼠(Mus musculus)的同源性分别达到30.67%和26.03%。序列比对同时显示MSBdefe的6个半胱氨酸同其他高等和低等脊椎动物中都是保守的。
2.2 克隆载体MSBdefe-bluntzero的合成
针对MSBdefe基因进行昆虫杆状病毒系统表达, 采用同义置换进行昆虫氨基酸密码子优化, 对MSBdefe进行基因合成, 并在该氨基酸的N端加Flag标签序列DYKDDDDK, C端加8个His标签, 合成的质粒pUC-MSBdefe包含345个核苷酸, 理论分子量为12.2 kD。序列如下: CCCGGGATGGATT ACAAGGATGACGACGATAAGAGGACCCTCGC CATCCTTGCTGCCATTCTCCTGGTGGCCCT GCAGGCCCAGGCTGAGCCACTCCAGGCAA GAGCTGATGAGGTTGCTGCAGCCCCGGAG CAGATTGCAGCGGACATCCCAGAAGTGGT TGTTTCCCTTGCATGGGACGAAAGCTTGGC TCCAAAGCATCCAGGCTCAAGGAAAAACAT GGCCTGCTATTGCAGAATACCAGCGTGCAT TGCAGGAGAACGTCGCTATGGAACCTGCATC TACCAGGGAAGACTCTGGGCATTCTGCTGC CACCACCACCACCACCACCACCACTAACTC GAG。
2.3 转移载体及重组菌株的构建
对合成的质粒pUC-MSBdefe进行SmaⅠ/XhoⅠ酶切, 同转移质粒pYBDM-IM进行连接, 获得重组质粒MSBdefe-pYBDM-IM, 进行SmaⅠ/XhoⅠ酶切鉴定, 切出345 bp的目的条带, 和预计分子量一致,这些结果表明转移质粒MSBdefe-pYBDM-IM构建成功。转移质粒MSBdefe-pYBDM-IM转化Ac MultiBac/rSW106/asd–/inv+感受态细胞后, 进行菌落PCR鉴定, 电泳结果显示扩增得到305 bp左右的片段, 得到重组菌株MSBdefe-pYBDM-IM-Am。
2.4 杆状病毒的重组及检测结果
将重组菌株MSBdefe-pYBDM-IM-Am直接感染Sf9细胞, 3d后倒置荧光显微镜下观察到有明显红色荧光的细胞, 细胞低速离心后, 收集上清, 获得病毒, 进行多代感染, 3d后细胞出现红色荧光, 表明获得了重组杆状病毒(图1)。提取重组杆状病毒基因组, 以MSBdefeJCF和MSBdefeJCR为引物, 进行PCR鉴定, 可扩增出305 bp左右的目的条带, 与理论值一致, 说明获得了含有MSBdefe基因的重组杆状病毒AV-MSBdefe。

图1 荧光显微镜观察重组杆状病毒感染Sf9细胞Fig.1 Microscopy observation of infected Sf9 cells by recombinant virus
2.5 重组蛋白纯化及Western鉴定结果
收集感染AV-MSBdefe的Sf9细胞, 在超声波破碎后, 进行SDS-PAGE电泳, 考马斯亮蓝染色, 可观察到约在相对分子质量12.2 kD处有明显可见的条带, 用带有His标签的Ni柱进行亲和层析, 获得12.2 kD的纯化蛋白, 进一步通过Western Blot验证, 表达蛋白可以同抗His的小鼠抗体进行结合(图2), 说明重组蛋白得到了特异性表达。
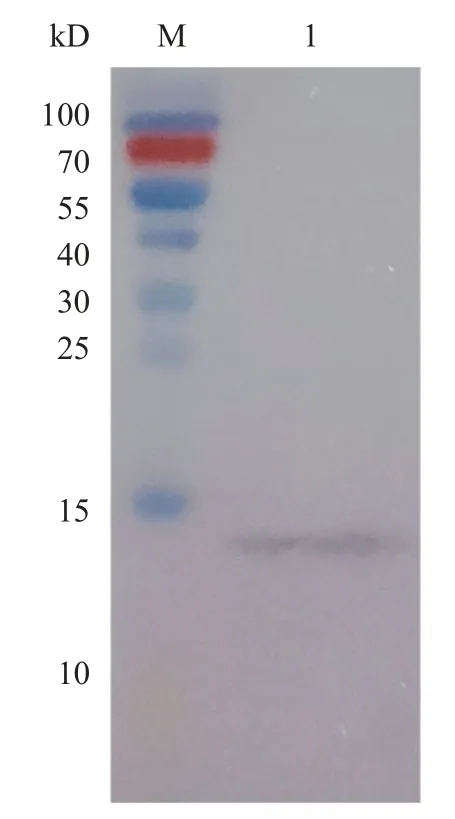
图2 MSBdefe蛋白Western Blot鉴定结果Fig.2 Western Blot of MSBdefe protein
2.6 MSBdefe重组蛋白抑菌活性检测
如图3所示, 与阴性对照PBS相比, 嗜水气单胞菌与重组蛋白作用后, 平板上的菌落数明显减少(图3a)。通过GraphPad Prism 9软件分析显示终浓度为30 μg/mL的MSBdefe重组蛋白对嗜水气单胞菌具有显著的抑菌作用, 细菌存活率为17.00%, 抑菌效率为83.00%。并随着梯度稀释2倍和4倍后, 即终浓度为15 和7.5 μg/mL时, 抑菌效果逐渐减弱, 抑菌效率分别为54.33%和33.67%(图3b)。这证明MSBdefe重组蛋白具有较好的抑菌活性。

图3 不同浓度重组蛋白体外抑菌分析结果Fig.3 In vitro antibacterial analysis results of MSBdefe protein at different concentrations
3 讨论
近年来, 随着病原体耐药性的增加, 人们对后抗生素时代的担忧迫使人们需要找到现有抗生素的替代品。β-防御素是一类富含半胱氨酸的阳离子抗菌肽, 具有广谱活性、反应时间快、耐药水平低和对宿主毒性最小等优点, 通过对入侵病原体的抗菌活性在天然免疫系统中发挥重要作用, 具有广阔的应用前景。如何通过基因工程手段进行防御素的大批量生产至关重要。大肠杆菌原核表达系统的外源蛋白质表达有其局限性, 例如对新生肽链无翻译后加工能力、以致表达产物缺乏应有的生物学活性, 故不适合作为真核基因表达的宿主[11]。真核酵母表达系统经过多年发展已经具备了成熟的发酵工艺, 来提高产量, 但酵母表达系统依然存在短板, 大多数重组蛋白表达量低, 而且可能会出现切割目的蛋白的情况出现, 并且存在过度糖基化的问题。而杆状病毒表达系统的宿主主要是以昆虫细胞为主, 因为昆虫细胞具有类似哺乳动物的翻译后加工修饰的能力, 能够正确折叠并表达蛋白,具有糖基化、磷酸化和酰胺化等翻译后修饰功能,并能够对信号肽进行识别, 使其形成正确的高级结构, 保留其生物活性, 与哺乳动物细胞内的差别很小。这些修饰对于所表达产物在生物活性、抗原性和免疫都接近于天然产物。并且由于多角体强启动子polh和p10的存在, 能够获得高水平的重组蛋白表达, 目标蛋白表达量可达到总蛋白的50%[12,13]。
在鱼类中, β-防御素首先在红鳍东方鲀 (Takifugu rubripes)、斑点绿色河鲀(Tetraodon nigroviridis)和斑马鱼(Danio rerio)中发现[14]。作为AMPs的典型成员, β-防御素具有直接的抗菌活性。在本研究中, 我们对MSBdede进行了序列分析比对工作,发现MSBdede和其他物种的β-防御素有着相似的结构, 都含有6个保守的半胱氨酸残基, 这些半胱氨酸残基参与了成熟肽区域内的三个分子二硫键, 这是防御素的主要特征。这些二硫键在维持防御素结果和抗菌功能方面起着重要作用[15]。本研究将MSBdefe克隆到转移载体pYBDM-IM上, 通过Tn7位点转座到Bacmid基因组中, 由多角体启动子p10启动,从而在Sf9细胞中大量表达MSBdefe重组蛋白。Tn7位点的转座为零背景转座, 大大提高了转化效率, 该系统利用缺失asd型的rSw106inv菌株可以通过直接感染Sf9细胞的方式进行重组病毒的构建,省去了大质粒提取和用转染试剂转染质粒的麻烦,具有更高效率和经济价值。最终利用获得的重组Bacmid菌株MSBdefe-pYBDM-IM-Am, 通过多轮感染, 在培养基中获得高滴度的重组昆虫杆状病毒AV-MSBdefe。Western Blot结果显示感染了AVMSBdefe重组病毒的Sf9细胞内表达了带有His标签的MSBdede蛋白。这说明利用昆虫杆状病毒表达系统成功表达了MSBdede蛋白。
之前在鱼类中已经有一些β-防御素抗菌功能研究成果, 且不同鱼类β-防御素的抑菌谱存在差异。例如: 利用真核哺乳细胞表达的金头鲷β-防御素重组蛋白对鳗弧菌(Vibrio anguillarum)和枯草芽孢杆菌(Bacillus subtilis)表现出较强的抑菌活性, 而对美人鱼发光杆菌(Photobacterium damselae)和哈维氏弧菌(Vibrio harvey)等其他鱼类病原体表现出较弱的抑菌活性[16]; 化学方法合成的香鱼β-防御素蛋白对嗜水气单胞菌具有较强的直接抑菌活性, 而对鳗弧菌等其他6种细菌的抑菌活性较弱[17]。对鳜β-防御素进行多拷贝基因的酵母重组表达, 重组蛋白对革兰氏阴性菌的副溶血性弧菌抑菌作用显著[18]。构建斑点叉尾鮰β-防御素的重组表达酵母菌株, 其重组菌株具有明显抑制革兰氏阳性菌金黄色葡萄球菌、单增李斯特菌及革兰氏阴性菌铜绿假单胞菌的活性[19]。在之前的研究中, 还发现不同鱼类β-防御素抑菌浓度存在差异。例如: 从文昌鱼(Branchiostoma japonicum)中克隆大防御素基因(Bjbd), 并利用原核表达对其抗菌活性进行研究, 研究表明在62.5 μg/mL浓度下, 对金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichia coli)和嗜水气单胞菌(Aeromonas hydrophila)生长均有显著抑制作用[20]; 通过同源克隆技术从草鱼的脑、肝及部分黏液组织中克隆β-防御素基因, 在原核表达系统中表达蛋白并研究其抑菌活性。抑菌结果表明重组蛋白在1 μg/μL浓度下对嗜水气单胞菌(Aeromonas hydrophila)的抑菌效率在90%以上[21];原核重组斑马贻贝(Dreissena polymorpha)的防御素蛋白对部分革兰氏阴性菌如摩根菌(Morganellasp.)、类志贺邻单胞菌(Plesiomonas shigelloides)、迟钝爱德华氏菌(Edwardsiella tarda)、大肠杆菌(Escherichia coli)和金黄色葡萄球菌(Staphylococcus aureus)的抑菌活性较强, 其MIC分别为0.35、0.43、1.16、6.46和30.39 μmol/L, 但对其他一些革兰氏阴性菌和革兰氏阳性菌的抑菌作用较弱[22]。原核重组石斑鱼(Epinephelus coioides)的β-defensin蛋白对8株细菌进行了抗菌分析, 其中包括5株革兰氏阴性菌: 大肠杆菌(Escherichia coli)、河弧菌(Vibrio fluvialis)、铜绿假单胞菌(Pseudomonas aeruginosa)、鳗弧菌(Vibrio anguillarum)、温和气单胞菌(Aeromonas sobria)和3株革兰氏阳性菌株: 蜡样芽孢杆菌(Bacillus cereus)、金黄色葡萄球菌(Staphylococcus aureus)和藤黄微球菌(Micrococcus luteus)。结果显示, 重组石斑鱼β-defensin蛋白浓度达512 μg/mL时, 8株菌的存活率均低于10%[9]。 我们选择淡水鱼类最常见的病原菌嗜水气单胞菌为指示菌, 研究了大口黑鲈β-defensin真核重组蛋白的抑菌活性, 结果表明, 当MSBdefe重组蛋白的终浓度为30 μg/mL时, 抑菌效率达到83.00%, 证明大口黑鲈β-defensin真核重组蛋白有明显的抑菌活性。这说明不同来源的鱼类抗菌肽有着不同的抑菌功能, 且抑菌活力也有较大差异。
总之, 在本研究中, 构建了基于杆状病毒表达系统的MSBdede表达菌株, 并通过零背景转座, 高效获得含有MSBdede的重组杆状病毒, 感染Sf9细胞进而表达了MSBdede重组蛋白, 体外抑菌活性实验检测出MSBdefe重组蛋白对嗜水气单胞菌活性有较强的抑制作用。为利用昆虫生物反应器规模化生产鱼类β-防御素奠定了基础。
