草鱼IL-10单克隆抗体的制备与鉴定
2022-12-21陈康勇朱晓真王梓璇王俊亚李耀国肖调义
刘 琴 贾 钊 陈康勇 朱晓真 王梓璇 陈 静 王俊亚李耀国 肖调义 邹 钧
(1.上海海洋大学水产与生命学院, 上海 201306; 2.湖南农业大学湖南省特色水产资源利用工程技术研究中心, 长沙 410128)
白细胞介素(Interleukin, IL)10是IL-10家族成员之一, 最初被称为细胞因子合成抑制因子(Cytokine synthesis inhibitory factor, CSIF)[1], 主要由2型先天淋巴细胞(Type 2 innate lymphoid cell, ILC2)和辅助性2型T细胞(T helper 2 cell, Th2)分泌, 具有广泛的免疫调控作用[2], 能够抑制1型辅助性T细胞(T helper 1 cell, Th1)分泌干扰素γ(Interferon gamma,IFN-γ)。此外, IL-10也可由B细胞、嗜酸性粒细胞、单核/巨噬细胞、树突状细胞、上皮细胞和肿瘤细胞等多种细胞产生[3,4], IL-10的细胞来源很大程度取决于刺激物引发的免疫反应强度和作用的部位[5]。
2003年, Zou等[6]首次在红鳍东方鲀(Fugu rubripes)基因组中发现il-10基因。此后,il-10在虹鳟(Oncorhynchus mykiss)、斑马鱼(Danio rerio)、大西洋鲑(Salmo salar)、黄颡鱼(Pelteobagrus fulvidraco)、海鲈(Dicentrarchus labrax)、鲤(Cyprinus carpio)和金鱼(Carassius auratus)等多种硬骨鱼类中被克隆[7—16], 鱼类il-10基因结构与哺乳动物相似,具有5个外显子, 4个内含子, 鱼类跟哺乳类IL-10氨基酸序列同源性可高达80%—90%, 均含有由4个保守半胱氨酸形成的两对二硫键, 另外, 鱼类IL-10还额外存在两个保守的半胱氨酸。生物信息学分析显示, 鱼类IL-10可能以非共价键连接形成同源二聚体与受体结合, 激活JAK/STAT信号通路, 调控靶基因表达[6,8,11—15]。与哺乳类相比, 鱼类IL-10功能的研究较为有限。Pinto等[11]发现海鲈在腹腔注射紫外灭活的发光细菌(Photobacterium damselaessp.piscicida)后头肾及脾脏il-10表达量显著升高。Grayfer等[16]对IL-10的功能进行了较深入的分析, 发现金鱼IL-10能够抑制嗜水气单胞菌(Aeromonas salmonicida)诱导的tnf-α、il-1β、il-10等细胞因子表达, 此外, 金鱼IL-10还能抑制IFN-γ诱导的超氧阴离子产生, 这与哺乳动物中IL-10抑制炎症的功能类似, 表明鱼类IL-10功能具有保守性。
迄今, 鱼类IL-10的细胞来源尚不清楚。鱼类具有tcr、cd3、cd4等T细胞标志基因[17—19]。与哺乳类不同, 鱼类cd4基因有两个拷贝, 即cd4-1和cd4-2。与CD4-2相比, CD4-1与哺乳动物CD4的亲缘关系更近, CD4-1胞外区有4个Ig结构域, 而CD4-2具有2个或3个Ig结构域[20,21]。Toda等[19]证明硬骨鱼类存在CD4+和CD8α+T细胞亚群, 其形态特征和组织分布与哺乳动物CD4+和CD8+T淋巴细胞相似,他们发现CD4+/CD8+双阳性T细胞仅存在于胸腺中。Xing等[22,23]用牙鲆弹状病毒(Hirme novirhabdovirus, HIRRV)和鳗弧菌(Vibrio anguillarum)外膜蛋白K对牙鲆(Paralichthys olivaceus)进行腹腔注射, 发现CD3+、CD4-1+、CD4-2+、CD8β+T淋巴细胞和IgM+B淋巴细胞数量在注射组中均显著升高。Piazzon等[24]发现鲤IL-10能够促进T细胞增殖,可激活CD8+记忆T细胞, 抑制Th1和Th2免疫反应。此外, IL-10还能促进IgM+B细胞的增殖、分化及抗体分泌, 抑制吞噬细胞的炎症反应。
目前, 虽然人们对鱼类Th细胞有了初步了解,但是依然缺乏对鱼类Th细胞亚群的深刻认知, 其主要原因是缺乏能够用于检测鱼类Th细胞亚群细胞因子的单克隆抗体。草鱼是我国大宗淡水鱼类中产量最高的养殖品种, 其产量超过全国淡水养殖总量的五分之一, 是优质养殖品种。本研究以草鱼为研究对象, 成功制备了高纯度的草鱼IL-10重组蛋白, 并获得了高特异性的单克隆抗体, 为草鱼ILC2和Th2细胞的增殖、分化和功能研究奠定了基础,并为发展鱼类疾病防控新措施提供了理论支撑。
1 材料与方法
1.1 质粒构建
从NCBI数据库中获取草鱼IL-10序列(登录号:JQ768312.1), 用于质粒构建。克隆质粒pUC57-CiIL-10和真核表达质粒pcDNA3.4-CiIL-10由苏州金唯智生物科技有限公司构建; pUC57-CiIL-10含草鱼il-10成熟肽编码区段(Lys23-His179); pcDNA3.4-CiIL-10包含编码区全长, 且其C端附加5个组氨基酸编码序列; 表达载体pET-21d、pcDNA3.4购于苏州金唯智生物科技有限公司。根据大肠杆菌密码子偏好表设计表达载体的正向引物(CiIL-10-F):CATGCCATGGCTAAGAAGGTTGATTGCAAG AGC, 反向引物(CiIL-10-F): CGGGATCCTTAGTG TTTTTCGCGTTTGCTCGCCAGATACTGCTCGA TGTACTTGAACAGCATGTCCAGCTCGCCCATT GC。正向引物下划线为NcoI酶切位点, 反向引物下划线为BamHΙ酶切位点。
以pUC57-CiIL-10为模板, 用高保真酶(Prime STAR Max, TaKaRa)进行PCR扩增。PCR反应体积为50 μL: 1 μL pUC57-CiIL-10, 1 μLCiIL-10-F, 1 μLCiIL-10-R, 25 μL Prime STAR Max, 22 μL ddH2O。PCR扩增程序为: 98℃ 3min; 98℃ 10s、62℃ 15s、72℃10s, 38个循环。PCR产物经1%琼脂糖凝胶电泳分析。利用Gel Extraction Kit(Omega)试剂盒纯化回收扩增片段, 下同。用NcoI和BamH Ι限制性内切酶将扩增片段及pET-21d载体在37℃下分别酶切过夜, 琼脂糖凝胶电泳后进行回收; 将回收产物和载体在16℃连接4h后转化至E.coliDH5α感受态细胞, 于37℃、200 r/min条件下培养2h, 取100 μL菌液均匀涂布于含100 μg/mL氨苄青霉素的LB固体平板上, 37℃培养过夜后挑单克隆菌落作PCR筛选,将阳性克隆菌液送至苏州金唯智生物科技有限公司测序验证。
1.2 CiIL-10原核蛋白表达与纯化
将pET-21d-CiIL-10重组质粒转化至E.coliRosetta(DE3)感受态细胞, 取阳性单克隆菌落, 转移至含100 μg/mL氨苄青霉素的LB液体培养基, 37℃培养2h, 取100 μL接种于含氨苄青霉素的6 mL LB液体培养基中; 当菌液OD600达到0.4—0.6时, 加入6 μL 1 mmol/L IPTG(异丙基硫代-β-D-半乳糖苷, VWR),37℃、170 r/min培养8h。取1 mL菌液12000 r/min离心2min, 弃上清, 用40 μL PBS重悬菌体, 再加入10 μL蛋白上样缓冲液(5×), 100℃加热10min, 随后12000 r/min离心2min, 取上清进行聚丙烯酰胺凝胶电泳(SDS-PAGE)分析。
将单克隆菌落接种至50 mL LB培养基, 37℃培养8h, 然后将菌液转移至1 L LB培养基中培养, 在37℃、200 r/min条件下培养至OD600达到0.4—0.6,用1 mmol/L IPTG诱导8h, 收集细菌并提取包涵体。用6 mol/L盐酸胍(VWR)对包涵体进行变性, 采用稀释复性法复性蛋白, 用Superdex 200层析柱(GE Healthcare)纯化蛋白, 具体方法参照Xue等[25]。SDSPAGE分析蛋白纯度, 用Pierce®BCA Protein Assay Kit(Thermo)试剂盒测定蛋白浓度, 蛋白分装后于–80℃冰箱保存。
1.3 单克隆抗体制备
用CiIL-10重组蛋白免疫4只BALB/c雌性小鼠(SPF级), 每只注射60 μg, 经4次加强免疫(30 μg/只)后测定血清抗体效价。选用抗体效价高的小鼠, 用PEG法将其脾细胞与SP2/0细胞进行融合。通过ELISA法筛选杂交瘤阳性细胞株, 并鉴定其产生的抗体亚型, 单克隆抗体制备由北京华大蛋白质研发中心有限公司完成。
1.4 单克隆抗体的Western Blot验证分析
在37℃、5% CO2的培养箱中, 用25 cm2细胞培养瓶培养HEK293细胞, 当细胞汇合度达90%以上时, 用胰酶消化细胞, 加入12 mL DMEM培养基(含10% FBS和1%青霉素/链霉素), 将细胞转移至六孔细胞培养板(2 mL/孔), 培养12h。用jetOPTIMUS®DNA Transfection Reagent试剂转染表达质粒, 具体操作如下: 在EP管中加入 200 μL jetOPTIMUS®buffer、2 μg pcDNA3.4-CiIL-10或pcDNA3.4、2 μL jetOPTIMUS®Transfection Reagent, 混合均匀后室温静置10min, 加入至六孔板中, 轻轻混匀。转染36h后, 加入5 μg蛋白转运抑制剂(碧云天), 12h后加入200 μL RIPA裂解液(碧云天)(含1 mmol/mL PMSF, 蛋白酶抑制剂), 冰上裂解细胞10min, 然后进行Western Blotting分析, 步骤如下: SDS-PAGE电泳后, 将蛋白转印至PVDF膜上, 用5%脱脂奶粉封闭1h, 用一抗在4℃下孵育4h, 弃一抗, 用含0.1% 吐温20的TBS洗涤3×5min, 加入二抗, 4℃孵育1h。一抗为杂交瘤细胞上清(V﹕V=1﹕4, 抗体稀释液为含5%脱脂奶粉的TBS, 下同), 二抗为IRDye 800CW®羊抗鼠IgG抗体(V﹕V=1﹕10000, LI-COR)。Western Blot具体方法参照Qin等[26]。
1.5 草鱼IL-10单克隆抗体纯化及标记
利用HiTrap rProtein A FF柱对草鱼IL-10单克隆抗体进行亲和层析提纯, SDS-PAGE检测抗体纯度, 然后用E L I S A 测定抗体亲和力(亲和常数=150000 × A/抗体浓度, A代表最大OD值的1/2所对应的抗体稀释倍数, 在450和630 nm双波长下测定OD值), 并用FITC(异硫氰酸荧光素)标记单克隆抗体, 抗体纯化与标记均由北京华大蛋白质研发中心有限公司完成。
1.6 激光共聚焦分析
将经无菌处理的盖玻片置于六孔板中, 加入2 mL HEK293细胞(1 × 107细胞/mL), 参照章节1.4进行转染实验; 48h后, 弃培养基, 用1 mL无菌PBS洗涤细胞3次, 加入700 μL 4%多聚甲醛固定细胞15min,PBS洗涤3次; 加入700 μL含5% BSA和0.5% Triton X-100的PBS(封闭液)封闭30min, 弃封闭液; 加入700 μL稀释的FITC标记的单克隆抗体(V抗体﹕V封闭液=1﹕200), 4℃孵育2h, 弃一抗稀释液; DAPI染色30min后用含0.25% Triton X-100的PBS洗涤3次, 经抗荧光淬灭剂封片后在激光共聚焦显微镜(Leica TCS SP8)下观察、拍照。
1.7 流式细胞术分析
细胞培养及转染实验参照1.4, 弃培养基, 用胰酶消化细胞, 加入1 mL DMEM培养基重悬细胞, 将细胞转移至1.5 mL EP管, 250 ×g离心10min(下同),PBS洗涤细胞2次, 取2 × 106个细胞, 用Cytofix/Cytoperm Soln Kit试剂盒对细胞进行固定、破膜等处理, 步骤如下: 用Stain Buffer重悬细胞, 经Fixation/Permeabilization Solution 4℃固定通透20min后, 离心,BD Perm/Wash Buffer重悬细胞2次, 加入经500 μL BD Perm/Wash Buffer稀释的FITC标记CiIL-10单克隆抗体(V﹕V=1﹕200), 对照为FITC标记的羊抗鼠IgG2b(V﹕V=1﹕200), 4℃避光孵育2h; 用BD Perm/Wash Buffer重悬细胞两次, 离心, 加入200 μL Stain Buffer重悬细胞, 最后用BD AccuriTMC6 Plus流式细胞仪进行分析。
1.8 激光共聚焦分析LPS和IL-1β刺激草鱼性腺细胞(GCO)
将GCO细胞接种于25 cm2细胞培养瓶中, 置于28℃、5% CO2培养箱培养, 当细胞汇合度达90%以上时, 用胰酶消化, 加入4 mL培养基将细胞吹打混匀, 取1 mL细胞悬液加入12 mL培养基, 稀释混匀,将无菌盖玻片置于6孔细胞培养板中, 每孔加入2 mL稀释的细胞悬液, 置于28℃、5% CO2的培养箱培养6h。细胞贴壁后加入LPS(终浓度为75 μg/mL)或IL-1β(终浓度为250 ng/mL)[27], 对照组加入同体积的PBS, 32h后分别加入10 μg蛋白转运抑制剂, 继续培养4h, 然后对细胞进行激光共聚焦分析, 细胞固定、破膜和染色等处理参照1.6进行。
2 结果
2.1 pET-21d-CiIL-10质粒构建、重组蛋白表达与纯化
该研究以克隆载体为模板, 通过PCR扩增获得了il-10成熟肽片段(474 bp, Lys23-His179), 将扩增il-10片段连接到pET-21d载体上, 获得了草鱼IL-10原核蛋白表达质粒pET-21d-CiIL-10, 转化pET-21d-CiIL-10质粒的E.coliRosetta(DE3)菌经IPTG诱导后高量表达IL-10蛋白, 随后进行大规模细菌培养诱导表达CiIL-10蛋白, 细菌经高压破碎和离心后获得上清和沉淀, SDS-PAGE分析表明, 重组蛋白以包涵体形式表达, 且表达量较高。包涵体经变性、复性和凝胶过滤层析纯化后获得蛋白, SDS-PAGE显示单一条带, 表明蛋白纯度高(图1), 蛋白条带位于15—25 kD, 大小与理论值(18.8 kD)一致。
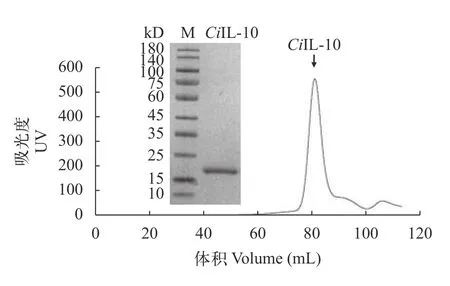
图1 CiIL-10重组蛋白的纯化Fig.1 Purification of recombinant CiIL-10 protein
2.2 单克隆抗体制备和效价测定
采用ELISA方法测定小鼠血清的抗体效价(效价为大于最大OD值/2中的最小OD值所对应的抗体稀释度), 如图2所示, 3号小鼠血清中的抗体在稀释倍数6400时, 呈现较好的亲和力, 且效价最高; 1号小鼠血清中的抗体效价稀释倍数为3200, 效价最低,故选用3号小鼠进行细胞融合实验。经融合、筛选后, 得到4株分泌CiIL-10抗体的阳性杂交瘤细胞株,并将其进行Ig亚类鉴定, 结果显示, GC4-IL10、GC10-IL10单抗为IgG1亚型, GC5-IL10、GC6-IL10单抗为IgG2b亚型(表1)。

表1 单克隆抗体亚型鉴定Tab.1 Characterization of subtypes of monoclonal antibodies

图2 免疫小鼠血清中抗体效价的测定Fig.2 Determination of serum antibody titers in immunized mice
2.3 Western Blot分析
将pcDNA3.4-CiIL-10转染至HEK293细胞中,收取细胞裂解液, 进行Western Blot分析, 阳性对照为纯化的原核重组蛋白。如图3所示, 四株抗体均可与原核蛋白特异性结合。GC4-IL10和GC6-IL10单抗能够特异性结合两条真核表达的蛋白条带, 其中位于20 kD位置的条带与IL-10真核蛋白理论分子量(19.3 kD)吻合, 大小约为40 kD条带与CiIL-10二聚体分子量大小一致, 表明CiIL-10能形成同源二聚体; GC5-IL10和GC10-IL10单抗则检测不到HEK293中表达的IL-10蛋白; 转染空载质粒的蛋白样品均未出现目的条带, 表明GC4-IL10和GC6-IL10单抗能够特异性识别HEK293细胞中表达的CiIL-10重组蛋白。

图3 单克隆抗体的Western Blot验证Fig.3 Western Blot validation of monoclonal antibodies
2.4 CiIL-10单克隆抗体纯化
根据Western Blot结果选择GC6-IL10单抗进行纯化, SDS-PAGE结果显示, 抗体纯度高于90%, 重链(55 kD)和轻链(25 kD)清晰可见(图4A), 其大小符合小鼠免疫球蛋白重链和轻链的理论值。ELISA法测定抗体的浓度和亲和常数, 分析结果显示, 抗体浓度为3 mg/mL, GC6-IL10单抗与抗原结合的亲和常数为6.40 × 108, 表明GC6-IL10单抗亲和力较强(图4B)。

图4 抗体SDS-PAGE分析及抗体亲和常数测定Fig.4 SDS-PAGE analysis of monoclonal antibody and determination of antibody affinity
2.5 激光共聚焦分析
将pcDNA3.4-CiIL-10真核表达质粒及pcDNA3.4载体转染至HEK293细胞中, 用FITC标记的GC6-IL10单抗检测IL-10的蛋白表达; 如图5所示, GC6-IL10单抗能检测到转染pcDNA3.4-CiIL-10质粒的HEK293细胞质中的IL-10蛋白, 而对照组细胞中未观察到荧光信号, 表明制备的GC6-IL10单抗可以特异性结合CiIL-10蛋白, 可用于激光共聚焦检测CiIL-10产生细胞。

图5 激光共聚焦分析Fig.5 Confocal analysis
2.6 流式细胞术分析
用FITC标记的GC6-IL10单抗及羊抗鼠IgG2b抗体(同型抗体阴性对照)孵育转染pcDNA3.4-CiIL-10和pcDNA3.4载体的HEK293细胞, 通过流式细胞术分析阳性细胞数量。如图6所示, 通过同型抗体阴性对照进行屏蔽非特异性信号, GC6-IL10单抗能够特异性识别表达IL-10的HEK293阳性细胞, 并具有良好的分群效果, 阳性率为20.6%。

图6 GC6-IL10抗体的流式细胞术分析Fig.6 Flow cytometry analysis of GC6-IL10
2.7 激光共聚焦分析LPS和IL-1β刺激草鱼GCO细胞的IL-10表达情况
LPS(75 μg/mL)和IL-1β(250 ng/mL)刺激GCO细胞36h后, 用FITC标记的单克隆抗体进行激光共聚焦分析。结果显示, GC6-IL10单抗能够特异性识别产生IL-10的草鱼GCO细胞(图7); 在PBS组、LPS及IL-1β刺激组中均发现IL-10阳性细胞,但IL-10阳性细胞的数量在对照组和处理组中无显著差异。

图7 LPS和IL-1β对GCO细胞产生IL-10的影响Fig.7 Effects of LPS and IL-1β on the production of IL-10 in GCO cells
3 讨论
单克隆抗体制备对抗原纯度要求高, 大肠杆菌原核表达系统因其表达量高、操作简单、低成本、时效短成为制备重组蛋白最广泛的表达系统之一。但表达的重组蛋白容易形成包涵体, 经变性和复性获得的蛋白会产生错误折叠, 不能形成正确的构象[28], 而且大肠杆菌缺乏翻译后修饰机制, 无法进行糖基化、磷酸化等修饰[29]。使用原核蛋白作为抗原制备的抗体有可能不识别具有翻译后修饰的真核蛋白, 本实验中获得的四株抗体中有两株能与原核重组IL-10结合, 但不识别HEK293表达的重组IL-10, 可能是由上述原因所致。
本研究制备了特异性较好的CiIL-10单克隆抗体, Western Blot分析显示,CiIL-10单克隆抗体能够识别两条大小为20和40 kD的蛋白条带, 其中40 kD大小的蛋白与同源二聚体大小吻合, 表明草鱼IL-10以同源二聚体形式存在。哺乳类研究表明, IL-10以同源二聚体形式行驶功能, 与受体结合, 激活下游信号通路[30], 我们的研究提示草鱼IL-10结合受体的方式可能跟哺乳类相似。
哺乳动物中IL-10可由B细胞、巨噬细胞、T细胞和上皮细胞等多种细胞产生[3,4,31]。Boonstra等[32]用TLR9(Toll样受体9, Toll-like receptor 9)的配体CpG刺激小鼠巨噬细胞、髓样树突状细胞、浆细胞样树突状细胞, 发现巨噬细胞及髓样树突状细胞皆能产生IL-10, 而浆细胞样树突状细胞则不能; 同样,poly(I:C)和LPS能诱导单核细胞、巨噬细胞和髓系树突状细胞产生IL-10[33,34]。CD4+效应T细胞和1型调节性T细胞(T regulatory cell, Treg)亦可合成IL-10, 以维持免疫稳态和免疫耐受[35,36]。迄今, 有关鱼类IL-10的表达分析均局限于mRNA水平, 对IL-10细胞来源的研究几乎为空白。本研究初步分析了草鱼IL-10产生细胞, 发现LPS和IL-1β不影响GCO细胞IL-10产生细胞的数量。但是, 有研究表明LPS上调草鱼头肾原代细胞中IL-10的mRNA水平[37], 提示LPS和IL-1β诱导后单个细胞中合成的IL-10可能有所增多。此外, 本实验结果表明我们制备的单克隆抗体可与草鱼内源IL-10结合, 可应用于对IL-10产生细胞的分析及T细胞的相关研究。
细胞因子是鉴定T细胞亚群重要标志分子, T细胞亚群的研究在鱼类中进展缓慢, 其主要原因是缺少相关细胞因子抗体。T细胞亚群可通过细胞特异受体, 结合细胞内转录因子、细胞因子进行鉴定,如CD3、CD4、IL-10和FOXP3是调节性T(Treg)细胞的标志分子; Th2细胞表达CD3和CD4受体, 分泌IL-4、IL-5和IL-10[38]。因此, IL-10对于Treg细胞和Th2细胞的鉴定和功能分析至关重要。研究表明,鱼类存在Treg细胞和Th2细胞, 斑马鱼中研究发现表达il-4/13b的Th2样细胞存在于鳃特化组织中[39,40];Maisey等[41]利用虹鳟CD3ε和CD4-1单克隆抗体证明了CD3ε+CD4-1+T细胞的存在, 而且表达il-10和tgf-β1。最近, Qin等[26]制备了草鱼CD3γ/δ的抗体,分析了头肾、脾脏和外周血中的CD3γ/δ+细胞数量。这些研究表明硬骨鱼类具有与哺乳类动物相似的Th细胞亚群分布, 但是, 对鱼类T细胞亚群的鉴定大多局限于基于表面标志受体抗体, 如CD3、CD4等, 因此, 结合CD4 T细胞表面特异受体抗体的应用, 本研究制备的草鱼IL-10单克隆抗体将有利于促进鱼类T细胞亚群的鉴定和功能探究。
综上, 本实验制备了高纯度的草鱼IL-10重组蛋白, 获得了特异性强的单克隆抗体, 可用于Western Blot、ELISA、激光共聚焦和流式细胞术等分析方法, 为研究草鱼ILC2和Th2细胞的分化、增殖和功能奠定基础。此外, 我们发现LPS和IL-1β对GCO细胞中产生IL-10的细胞数量没有显著影响。
