UPLC-MS/MS 检测氟吡菌酰胺在菜豆中的残留及消解动态
2022-12-20李凯龙姚燕霞姜锦林罗路云陈武瑛
李凯龙,姚燕霞,姜锦林,罗路云,陈武瑛,黄 洪,熊 浩,陈 昂
(1. 湖南省农业科学院植物保护研究所,湖南 长沙 410125;2. 生态环境部南京环境科学研究所,江苏 南京 210042;3. 长江师范学院,重庆 408100)
菜豆(Phaseolus vulgarisLinn.)是一种特色小宗蔬菜,原产于美洲,现广泛种植于热带至温带各地区,中国也有栽培。菜豆用途广泛,营养丰富,既是中国食品加工工业的原料,也是出口创汇的优质农产品。菜豆生长季节易发生病虫危害,常见病害有炭疽病、锈病和灰霉病,而目前中国农药信息网(http://www.icama.org.cn/fwb/index.jhtml)上农药登记数据中,作物菜豆一栏上仅登记了苯甲·氟酰胺、苯醚甲环唑和氟硅唑3 种杀菌剂,在实际生产中,由于病虫害防治需要,可能会使用其他杀菌剂。
氟吡菌酰胺(fluopyram)是一种新型的苯甲酰胺类杀菌剂,具有广谱的杀菌活性,可用于70 多种作物病害的防治,主要用于防治由白粉病菌、灰葡萄孢菌、丛梗孢属病菌和核盘菌等引起的病害[1]。中国食品中农药最大残留限量标准[2]和JMPR 报告(http://www.fao.org/agriculture/crops/thematic-sitemap/theme/pests/lpe/en/)中,关于氟吡菌酰胺的残留定义描述为氟吡菌酰胺母体,而氟吡菌酰胺在土壤和植物中以母体及代谢物2-(三氟甲基)苯甲酰胺(BZM)的残留形式广泛存在。国际食品法典委员会(CAC)规定氟吡菌酰胺在豆类蔬菜(荚可食)中的最大残留限量(MRLs)为1.0 mg/kg(https://www.fao.org/fao-who-codexalimentarius/home/zh/),欧盟限量规定3.0 mg/kg(https://food.ec.europa.eu/plants/pesti cides/eu-pesticides-database_en),而中国的临时限量规定为1.0 mg/kg[2]。目前,氟吡菌酰胺及其代谢物的检测方法主要有气相色谱法(GC)[3]、气相色谱-串联质谱法[4]和液相色谱-串联质谱法[5]。国内外关于氟吡菌酰胺在番茄[6]、石榴[7]、草莓[5]等作物上的残留规律已有少量报道,但在菜豆中的残留及消解动态研究尚未见报道。因此,笔者拟通过改良的QuEChERS方法提取和分散固相萃取净化,建立菜豆中氟吡菌酰胺及其代谢物BZM 残留的高效液相色谱-串联质谱检测方法,并通过田间试验分析其消解动态,为氟吡菌酰胺在菜豆上的安全使用提供依据。
1 材料与方法
1.1 试验材料
所用仪器包括:Aglien LC1290-MS/MS 超高效液相色谱-质谱联用系统(ABSCIEX 4500Q,美国Aglien 公司和SCIEX 公司),CPA225D 型电子天平(德国赛多利斯股份公司),Centrifuge 5424 型高速离心机(Eppendorf 艾本德公司),TDL-40B 型低速台式离心机(上海安亭科学仪器厂),微量移液器(Eppendorf艾本德公司),T25 型高速匀浆机(德国IKA)。
试验样品包括:41.7%氟吡菌酰胺悬浮剂(拜耳股份公司),99.4%氟吡菌酰胺标准品(德国Dr.Ehrensorfer 公司),98.0% 2-(三氟甲基)苯甲酰胺(BZM,西格玛奥德里奇公司),色谱级乙腈和甲醇[默克化工技术(上海)有限公司],色谱级甲酸(美国ROE),分析级乙腈、乙酸和无水硫酸镁(国药集团化学试剂有限公司),C18 净化剂(天津博纳艾杰尔科技有限公司)。
1.2 田间试验方法
在长沙县春华镇(露地)按照NY/T 788—2018农药残留试验准则[8]的要求进行氟吡菌酰胺及其代谢物BZM 的消解动态试验,小区面积50 m2,另设相同面积的空白对照。参照该药剂在黄瓜上的施用量(中国农药信息网 http://www.icama.org.cn/fwb/index.jhtml),设定氟吡菌酰胺在菜豆上的使用制剂量为70.6 g/hm2(以有效成分含量计算),于菜豆长至成熟个体一半大小时喷雾施药1 次,分别于施药后2 h 以及1、3、5、7、14、21、28 d 采样,每个采样点设置3 次重复。在试验小区内随机采摘生长正常、无病害的菜豆(不少于1 kg)混匀后切碎用四分法取200 g 以上的样品,并于-20℃冰箱中冷冻保存至分析检测用。
1.3 分析方法
1.3.1 样品前处理称取10 g 菜豆样品于100 mL 离心管中,加入50 mL 乙腈,涡旋2 min(2 500 r/min),加入5 g NaCl,摇匀并涡旋1 min(2 500 r/min)后离心5 min(4 000 r/min)。取1.5 mL 上清液到装有40 mg C18 的2 mL 微量离心管中,离心4 min(12 000 r/min),过0.2 μm 滤膜,待LC-MS/MS 检测。
1.3.2 仪器条件(1)液相条件:色谱柱ZORBAX Eclipse Plus C18(3 mm×100 mm,1.8 µm); 柱 温25℃;流速0.4 mL/min;进样量1.0 μL;流动相为乙腈/0.1%甲酸水(V/V)溶液,梯度洗脱如表1 所示。(2)质谱条件:离子源类型ESI+;离子源温度500℃;离子喷雾电压5 500 V;气帘气压力40 psi;喷雾气压力45 psi;辅助加热气压力45 psi;多重反应监测(MRM)质谱参数见表2。

表1 流动相梯度洗脱程序

表2 氟吡菌酰胺和BZM 的质谱测定参数
1.3.3 标准溶液的配制准确称取氟吡菌酰胺标准品0.010 1 g、BZM 标准品0.010 1 g 分别置于10.0 mL容量瓶中,用乙腈溶解并定容,分别配制成1 000.0 mg/L 浓度的标样储备液,密封贮存在0~4℃的环境中,根据试验要求稀释使用。准确量取氟吡菌酰胺和BZM 母液用乙腈逐级稀释成0.2、0.1、0.05、0.01、0.005、0.001 和0.000 5 mg/L 的混合标准溶液。菜豆空白样品经过前处理得出基质空白溶液,分别配制氟吡菌酰胺和BZM 菜豆基质系列0.2、0.1、0.05、0.01、0.005、0.001和0.0005 mg/L 浓度的空白基质标准溶液。
1.3.4 添加回收试验称取空白菜豆样本,添加氟吡菌酰胺及代谢物BZM 标准溶液,配置成0.005、0.1和1.0 mg/kg 这3 个添加水平,每一水平设5 次重复,同时设不加药的空白对照。采用实际添加可达到定量检测的最小浓度水平为定量限(LOQ),基质校正标准曲线定量,计算添加平均回收率及相对标准偏差。
1.3.5 数据处理氟吡菌酰胺在菜豆中的残留量变化,采用一级动力学方程表示:

式中,CT为施药后T时刻菜豆中氟吡菌酰胺的残留量(mg/kg),C0为施药后氟吡菌酰胺在菜豆中的动力学方程拟合原始沉积量(mg/kg),k为菜豆中氟吡菌酰胺的消解系数,t为施药后时间(d)。通过公式(1)计算得到消解系数k,通过公式(2)计算得到氟吡菌酰胺在菜豆中的消解半衰期T1/2(d)。
根据公式(3)计算基质效应(ME):当-20%<ME <20%时为弱基质效应;当-50%<ME ≤-20%或20%≤ME <50%为中等基质效应,当ME ≤-50%或≥50% 为强基质效应[9]。
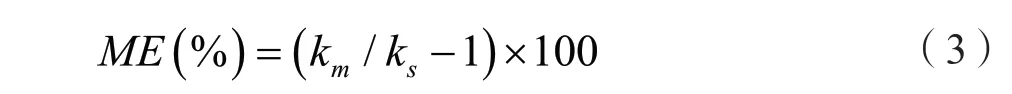
式中,km和ks分别为基质标准曲线和溶剂标准曲线的斜率。
2 结果与分析
2.1 分析方法的线性关系、准确度和精密度
以标样溶液浓度为横坐标、响应值为纵坐标绘制标准曲线,氟吡菌酰胺和BZM 在溶剂和基质中的标准曲线和相关系数如表3 所示。在试验设计的浓度范围(0.000 5~0.2 mg/L)内,氟吡菌酰胺和BZM 在基质中呈良好的线性关系,相关系数为0.992 0~0.999 9。这表明研究建立的残留分析方法能满足农药残留分析所要求的准确性和重现性。
液相色谱-串联质谱技术已被广泛用于农药残留检测中,但作物中的一些提取物可能会产生基质效应而干扰分析结果的准确性与精密度,因此在残留分析中应考虑不同作物所带来的基质效应[10-11]。由表3 可知,氟吡菌酰胺和BZM 的基质效应分别为6.6%和-6.0%,属于弱基质效应。

表3 氟吡菌酰胺和BZM 的线性方程
检测方法的准确度和精密度分别以方法的添加回收率和相对标准偏差表示。由表4 可知,氟吡菌酰胺在菜豆上的添加回收率为91.5%~98.7%,RSD 为2.3%~4.2%;BZM 在菜豆上的添加回收率为90.5%~96.7%,RSD 为3.3%~10.1%。氟吡菌酰胺和BZM 的方法检出限(LOD)均为0.000 5 mg/L,而最低检测浓度(LOQ)均为0.005 mg/kg。在试验设置的色谱条件下,氟吡菌酰胺和BZM 的色谱峰能较好地与基线分离,且峰形完整,可以满足农残分析的要求。
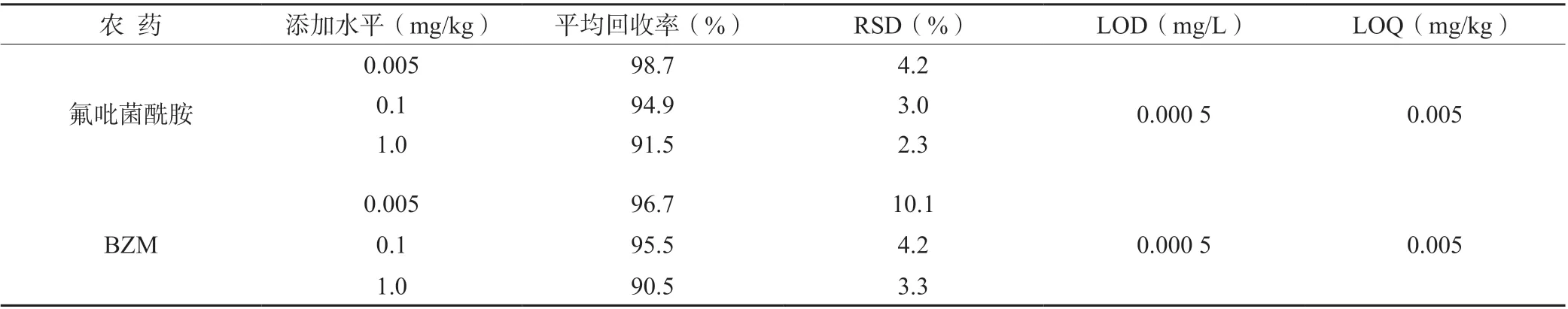
表4 氟吡菌酰胺和BZM 在菜豆样品中的回收率和检出限(n=5)
2.2 氟吡菌酰胺在菜豆中的消解动态
由图1A 可知,使用41.7%氟吡菌酰胺悬浮剂对菜豆喷雾施药,菜豆中氟吡菌酰胺的残留量随着时间的推移而逐渐降低,氟吡菌酰胺在菜豆上的原始沉积量为0.248 mg/kg;其消解动态符合一级动力学方程:CT= 0.258 1e-0.236t,R2=0.965 3,半 衰 期 为2.9 d,施药后28 d 消解率分别达99.8%。由图1B 可知,氟吡菌酰胺代谢物BZM 在菜豆上的残留量不到母体氟吡菌酰胺的10%且均小于0.005 mg/kg,因此未计算BZM 在菜豆中的半衰期;从其消解动态来看,代谢物BZM 在菜豆上的残留表现为积累和消解2 个阶段,即其含量随施药后时间的延长表现出先上升后下降的变化规律,在施药后第10 天达到最大残留水平,而后逐渐消解,到施药后28 d 菜豆上已检测不出BZM。

图1 氟吡菌酰胺(A)和BZM(B)在菜豆中的残留消解动态
3 讨论与结论
该研究通过改良的QuEChERS 方法提取和分散固相萃取净化,建立了菜豆中氟吡菌酰胺及其代谢物BZM 残留的高效液相色谱-串联质谱检测方法,该方法简单快速、对环境友好,准确度和精密度均符合农药残留试验准则的相关要求。氟吡菌酰胺在菜豆中的半衰期结果(2.9 d)与芒果(4.3~5.4 d)[12]中的半衰期相近,快于西瓜(6.5~6.6 d)[12]、番茄(6.9~7.9 d)[6]、甜椒(7.3 d)[13]、草莓(7.2~8.2 d)[5]和石榴果实(7.3~9.1 d)[7]中的半衰期。这表明氟吡菌酰胺在菜豆中降解速度快、残留低,属于容易降解的农药,为氟吡菌酰胺在菜豆上的安全使用提供了参考数据。目前,我国尚未对氟吡菌酰胺在菜豆上进行登记,氟吡菌酰胺在菜豆上的最大残留限量也仅是临时最大残留限量,建议加强菜豆农药登记和MRL 的制定工作,保障群众食品质量安全。
