南沙美济礁海域隆背笛鲷繁殖和食性的初步研究
2022-12-20李纯然李纯厚唐广隆肖雅元
王 腾 ,刘 永 ,李纯然,李纯厚 ,唐广隆,肖雅元,林 琳,吴 鹏
1. 中国水产科学研究院南海水产研究所/农业农村部南海渔业资源开发利用重点实验室/广东珠江口生态系统野外科学观测研究站/广东省渔业生态环境重点实验室,广东 广州 510300
2. 南方海洋科学与工程广东省实验室 (广州),广东 广州 511458
隆背笛鲷 (Lutjanus gibbus) 隶属笛鲷科、笛鲷属,广泛分布于热带和亚热带海域[1],具有性成熟早、生长快、寿命长 (可高达38龄) 等特点,是存在雪卡毒素风险的鱼类[2-3],也是印度-太平洋海域商业渔业、手工渔业、休闲渔业和土著渔业的重要目标物种[2]。隆背笛鲷占西太平洋岛国图瓦卢手钓渔获捕捞的36%[3]和波纳佩渔业生物量的26%[4],也是我国南沙群岛美济礁海域手钓和刺网的优势物种[5]。隆背笛鲷肉质鲜美、经济价值高,促使渔民对其进行高强度捕捞而忽视了种群的可持续性[6];此外,产卵聚集是其生活史中的必须生态过程[7],也导致其被过度捕捞[3]。
隆背笛鲷是一种典型的珊瑚礁鱼类。我国南海珊瑚礁生态系统出现了严重退化[8],而鱼类是珊瑚礁生态系统的顶级消费者,是其关键组成部分[9]。对鱼类资源的保护尤其对优势关键物种的保护是珊瑚礁生态系统保护的重要环节[10]。为更好地制定保护和管理措施,需要了解鱼类的基础生物学信息[11]。然而,国内鲜见有关隆背笛鲷的生物学研究。本研究对2020年于南沙美济礁采集的隆背笛鲷样本的雌雄比、性成熟体长、繁殖力、食性组成、营养级和营养生态位等生物学特征进行了分析,以期为其渔业资源、珊瑚礁生态系统的保护和管理提供理论依据,同时也为其养殖提供有益参考。
1 材料与方法
1.1 调查方法与生物学测量
隆背笛鲷样本是雇佣渔民于2020年7月在南沙美济礁瀉湖海域潜水捕捞获得。美济礁 (115°32'E、9°54'N) 位于南沙群岛中东部海域,属于典型半封闭环礁,东西长约9 km,南北宽约6 km,瀉湖环礁内水深20~30 m,礁坪面积14.69 km2,潟湖面积 30.62 km2,环礁总面积约56.6 km2。样本经速冻后,由科考船“南锋”号带回,进行生物学测量 (测量体长、体质量、性腺质量等数据)。体长精确至1 mm,体质量和性腺质量精确至0.01 g。性腺发育期采用I—VI期性腺成熟度划分标准,规定性腺发育期达III期及以上个体为性成熟个体;摄食等级采用0~4级划分标准[12]。两性的体长分布差异采用Kolmogorov-Smirnov test (K-S test) 检验。
1.2 繁殖
卡方检验用于检验雌雄比是否偏离1∶1[13],显著性水平为P<0.05。
性腺发育期III—VI期的鱼类均记为成熟个体。将鱼的体长划分为10 mm的区间来计算50%性成熟体长 (L50),以Logistic方程拟合各体长区间性成熟百分比,计算公式为:
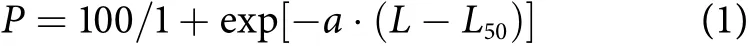
式中:P为成熟百分比;a为参数;L为体长。
卵径测量。先在解剖镜下对随机选取的性腺发育期为IV期的卵母细胞进行拍照,然后用FishBC 3.0软件对所拍照的卵母细胞进行测量。
繁殖力 (F) 的计算采用质量法,对准确称质量后性腺发育期为IV期的卵巢,随机称取0.2 g,并计数所有有卵黄的卵母细胞,计算其繁殖力。体长(L) 和体质量 (W) 的相对繁殖力分别用F/L和F/W计算。
1.3 食性
鱼类在实验室解剖后,现场识别其胃含物,鉴定区分到大类。
解剖时从鱼类背部选取一块白色肌肉,用清水冲洗干净,然后在60 ℃下烘烤48 h,再将其研磨成均匀粉末用于同位素测量。所有样品的碳、氮稳定同位素 (δ13C、δ15N) 分析均在中国科学院水生生物研究所进行,所用仪器为美国Thermo公司的元素分析仪和 Delta Plus Finnigan MAT 253同位素质谱仪,测定样品中的δ13C和δ15N,计算公式如下:

式中:δ表示稳定同位素丰度;X为13C或15N;R为13C/12C或15N/14N;Rsample为样品所测得的同位素比值;Rstandard为标准物质的同位素比值;δ13C和δ15N测定的标准物质分别为PDB (美洲拟箭石)和大气氮。每测定10个样品插入1个标准样品。Rsample营养级的计算公式为:
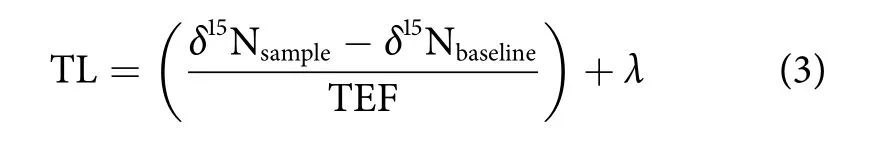
式中:TL为计算生物的营养级;δ15Nsample和δ15Nbaseline分别为鱼类样品和选取的基准生物的氮稳定同位素比值;λ为基准生物营养级,本研究选取植食性鱼类灰额刺尾鱼 (Acanthurus glaucopareius) 作为基准生物,发现本海域灰额刺尾鱼(δ15N=3.93) 是植食性鱼类 δ15N 最低的鱼类 (λ=2);TEF为相邻营养级的富集度,取值为3.4‰[14]。
利用R软件的SIAR和SIBER[15]软件包计算隆背笛鲷的营养生态位。本研究选取δ13C范围(CRb)、δ15N范围 (NRb)、凸多边形面积 (Total area of convex hull, TA)[16]和校正标准椭圆 (Corrected standard ellipse area, SEAc)[15]4种营养生态位定量指标进行分析。CRb和NRb分别为隆背笛鲷的δ13C和δ15N的最大值与最小值之差,描述鱼类利用食物资源碳、氮的范围。TA为所有隆背笛鲷个体δ13C-δ15N二维空间包围构成的凸多边形面积,表示鱼类占据的生态位总大小。SEAc为隆背笛鲷个体δ13C-δ15N二维空间包围大概40%数据点的椭圆面积,表示鱼类占据的核心生态位的大小。
2 结果
2.1 体长-体质量特征
共采集隆背笛鲷样本67尾,体长介于115~270 mm (平均198.08 mm);体质量介于51.41~665.43 g (平均256.7 g) (表1)。独立样本t检验表明,雌、雄隆背笛鲷体长和体质量的差异均不显著(P>0.05),但雌性的平均体长和体质量均大于雄性(表1)。隆背笛鲷两性的体长分布差异显著 (P<0.05),雌性以大个体分布为主,而雄性的中大型个体较多且分布较均匀 (图1)。
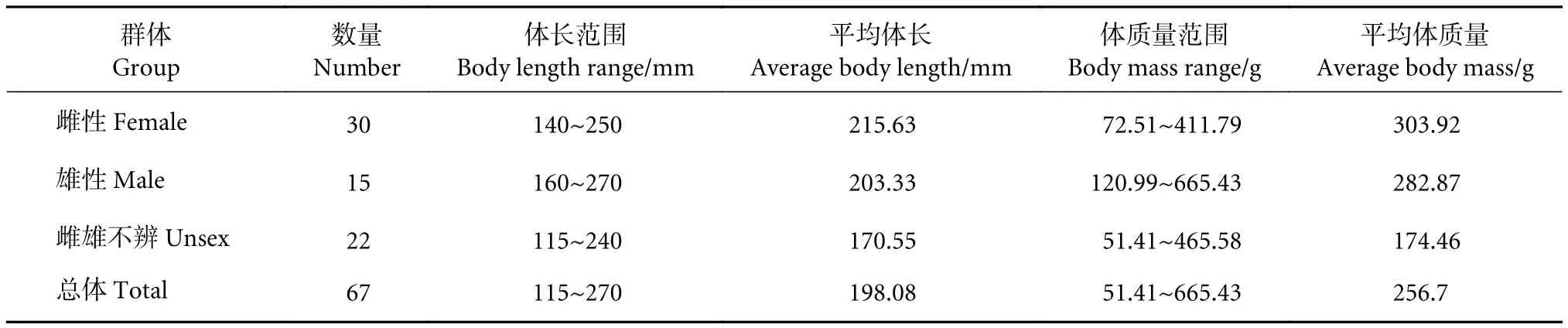
表1 美济礁海域隆背笛鲷体长、体质量特征Table 1 Body length and body mass of L. gibbus from Meiji Reef

图1 美济礁隆背笛鲷体长分布Fig. 1 Distribution of body length of L. gibbus from Meiji Reef
2.2 性比与性成熟体长
美济礁海域共鉴别雌、雄隆背笛鲷分别为30和15尾,无法鉴别雌、雄性样本22尾 (表1),雌雄比为2∶1,不符合1∶1的理论值 (P<0.05)。
美济礁隆背笛鲷雌、雄性的L50分别为204.757和201.623 mm,雌性略大于雄性 (图2)。
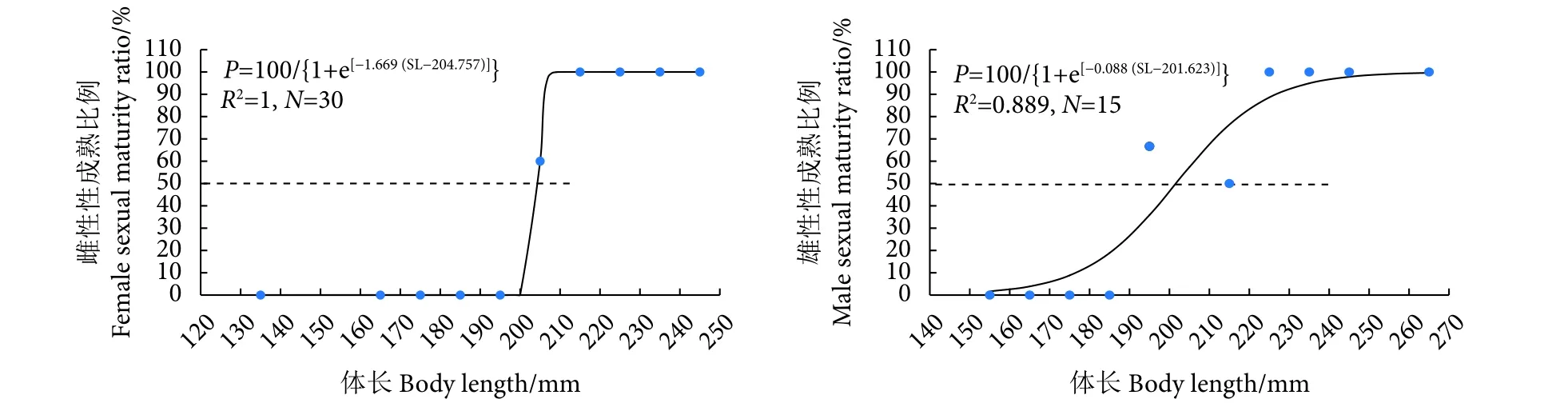
图2 美济礁隆背笛鲷个体性成熟比例的逻辑斯蒂曲线Fig. 2 Logistic curve of sexual maturity percentage of L. gibbus from Meiji Reef
2.3 卵径特征
本研究随机挑选了2尾性腺发育期为IV期的个体性腺进行卵径测量 (共测量306粒),卵径介于0.176~0.419 mm (平均0.296 mm)。卵径频率分布显示,美济礁隆背笛鲷的卵径频率分布为典型单峰型分布 (图3)。
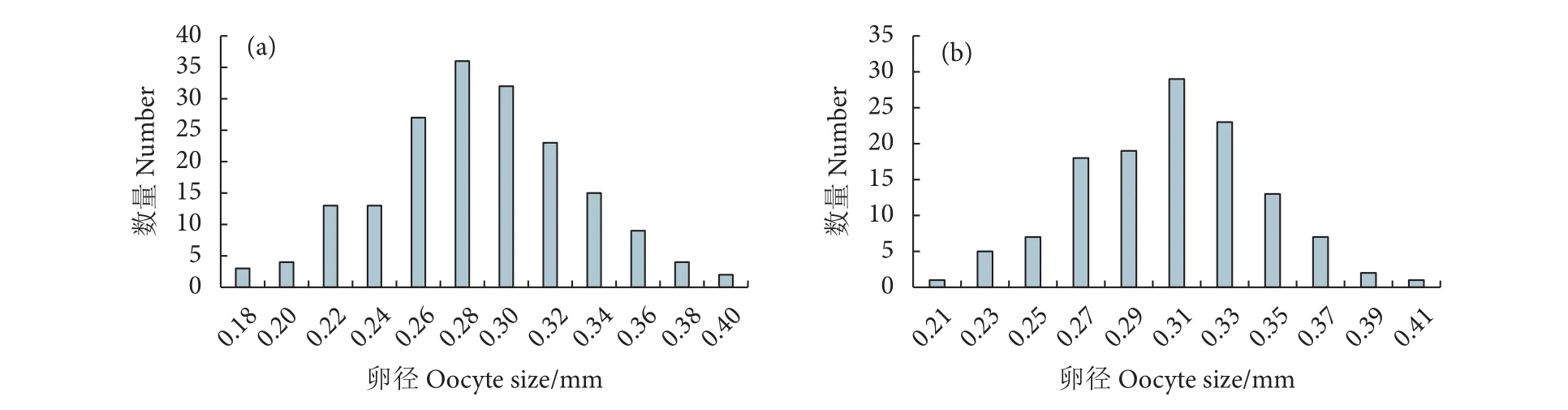
图3 美济礁隆背笛鲷的卵径分布频率分布注:a. 体长为 230 mm,体质量为 366.91 g;b. 体长为 220 mm,体质量为 314.50 g。Fig. 3 Oocyte size-frequency distribution of L. gibbus from Meiji ReefNote: a. Body length: 230 mm, and body mass: 366.91 g; b. Body length: 220 mm, and body mass: 314.50 g.
2.4 繁殖力
本研究共获取了21尾性腺发育期达到IV期的隆背笛鲷性腺,计算了所有个体的繁殖力。繁殖力为 51 858 粒 (体长215 mm)~276 205粒 (体长230 mm),平均139 145 粒。体长的相对繁殖力为241.20 粒∙cm−1(体长 215 mm)~1 200.89 粒∙cm−1(体长230 mm),平均611.61粒∙cm−1。体质量的相对繁殖力为 164.48 粒∙g−1(体长 215 mm)~763.53 粒∙g−1(体长 230 mm),平均 407.72 粒∙g−1。
美济礁隆背笛鲷的繁殖力与体长、体质量成显著的幂函数关系 (图4)。
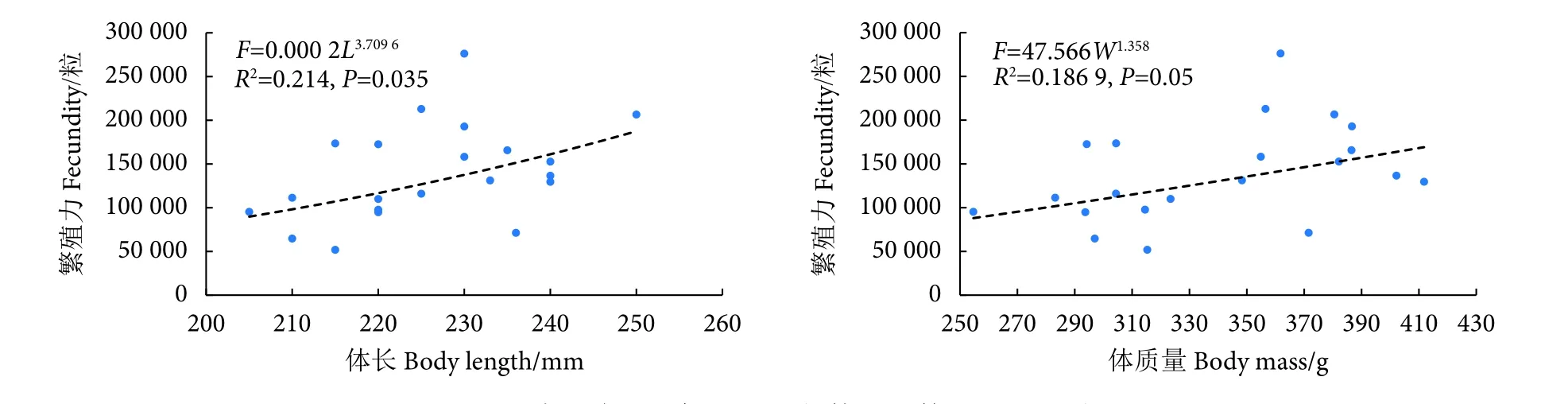
图4 美济礁隆背笛鲷繁殖力与体长和体质量的相关性Fig. 4 Relationships of fecundity-body length and fecundity-body mass of L. gibbus from Meiji Reef
2.5 食性
本研究67尾鱼中仅有7尾存在胃含物,空胃率高达89.56%。胃含物分析表明,螃蟹出现率最高 (4次),是美济礁隆背笛鲷最主要的食物,其他胃含物均仅出现1次,分别是鱼、螺、贝、虾和珊瑚沙。
随机选取了15尾隆背笛鲷 (体长140~236 mm)进行稳定同位素分析,δ15N介于7.13‰~9.27‰,平均8.44‰;δ13C介于−15.75‰~−14.11‰,平均−14.11‰ (表2)。独立样本t检验表明,美济礁隆背笛鲷性成熟 (7尾) 与未性成熟 (8尾) 个体δ15N和δ13C均无显著性差异 (P>0.05)。δ15N与体长呈现显著正相关性 (P<0.05),即随体长的增加而增加;δ13C与体长无相关性 (P>0.05,图5),说明隆背笛鲷食性随个体的发育发生了转变。通过营养级计算公式,使用δ15N计算得到隆背笛鲷营养级介于2.94~3.57 (平均3.33),性成熟个体营养级均值为3.40,未性成熟个体营养级均值为3.27,较性成熟个体小了0.13个营养级。

图5 美济礁隆背笛鲷的体长与δ13 C、δ15 N的相关性Fig. 5 Relationships of body length-δ13 C and body length-δ15 N of L. gibbus from Meiji Reef
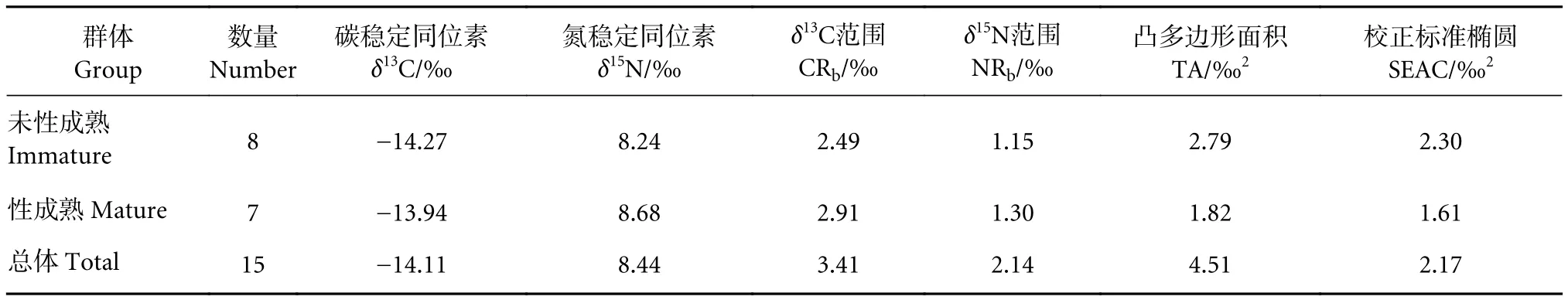
表2 美济礁隆背笛鲷的δ13C、δ15N和营养生态位指标Table 2 δ13C, δ15N values and trophic niche metrics for L. gibbus from Meiji Reef
从TA来看,美济礁隆背笛鲷占据的营养生态宽幅为4.51‰2,性成熟个体为1.82‰2,未性成熟个体为2.79‰2;从SEAC的面积来看,整体营养生态宽幅为2.17‰2;性成熟个体为1.61‰2,未性成熟个体为2.30‰2(表2)。这说明性成熟个体的营养生态宽幅较未性成熟个体明显变窄,食性变得更加专一。
3 讨论
L50是渔业管理的重要参数,也是制定鱼类最小可捕规格的重要参考依据。本研究中隆背笛鲷雌、雄性L50均约为200 mm,与其他水域的研究结果较相似,如密克罗尼西亚水域雌、雄分别为188.77和182.62 mm[17];新喀里多尼亚水域分别为235.30和226.52 mm[3];美属萨摩亚水域未区分雌雄,为218.62 mm[18]。此外,所有研究结果均显示雌性性成熟体长大于雄性,雌性更大个体参与繁殖有利于后代的成活。
卵径频率分布一般可以说明鱼类的产卵类型。本研究发现美济礁隆背笛鲷的卵径频率分布为单峰型,说明其为同步发育卵巢[19]。West[20]指出卵径频率分布只能是繁殖方式的一个佐证,最终需要通过性腺组织切片来验证。Nanami等[21]通过对隆背笛鲷性成熟性腺进行组织切片分析,发现大量未被吸收的产后卵泡,这一结果充分证实隆背笛鲷为分批繁殖鱼类。而其性腺为同步发育,因此可以认为隆背笛鲷是同步分批产卵鱼类。
卵径大小是鱼类繁殖策略的重要组成部分,是鱼类对单个后代的繁殖投入。本研究发现隆背笛鲷的卵径特别小,平均卵径不到0.3 mm,这一结果与同属鱼类金焰笛鲷 (L. fulviflamma) 类似,其IV期卵母细胞的最大卵径为0.42 mm[22],与本研究的0.419 mm基本一致。
卵径小一般意味着繁殖力大。本研究的最大繁殖力为276 205粒。繁殖力是鱼类种群评估的重要参数和评估鱼类补充量的重要计算依据。有关隆背笛鲷繁殖力的研究较少,仅Longenecker和Langston[17]对2尾隆背笛鲷性腺进行了繁殖力评估。本研究对21尾隆背笛鲷进行了繁殖力分析,发现其体长和体质量均与繁殖力呈显著幂函数关系,这一规律与其他笛鲷属鱼类一致,如金焰笛鲷[22]、西大西洋笛鲷 (L. campechanus)[23]、画眉笛鲷 (L. vitta)[24]等。笛鲷为繁殖力很强的鱼类,其最大与最小的繁殖力可相差2个数量级[25]。本研究的最大繁殖力和最小繁殖力相差1个数量级,但最大个体远小于Fishbase记录的最大全长 (500 mm),因此也符合这一规律。这也证实了大个体鱼类在繁殖中起主导和决定性的作用。Barneche等[26]通过分析342种海洋鱼类发现,79.1%的鱼类繁殖能量输出随个体大小呈超比例的增加,成幂函数关系。体长61 cm的美国红鱼 (L. campechanus) 怀卵量为9.3×106粒,相当于212尾体长为42 cm小个体的总怀卵量[27]。此外,像隆背笛鲷这一类具有季节性集群产卵的鱼类,大个体在繁殖过程中占据主导地位,可通过抑制小个体同类繁殖来维护种群结构的稳定[27]。
食性研究可以了解鱼类在生态系统中的能量流动,确定鱼类在生态系统中的位置[28]。美济礁隆背笛鲷主要摄食蟹类,这一结果与Nanami和Shimose[29]的研究吻合,其分析了4种笛鲷属鱼类食性,并从形态学方面证实了隆背笛鲷以蟹类为食的原因。隆背笛鲷拥有较高的体高、短的圆锥状牙齿和较小的颌结构,这决定其不具备较大的咬合力,也导致其更容易捕获底栖生物如螃蟹和虾类等[28]。
食性转变是鱼类生活史中的普遍现象[30]。本研究通过稳定同位素分析发现,隆背笛鲷食性随个体大小发生了转变,这一结果不仅与其他隆背笛鲷的研究[31]相似,也与墨西哥笛鲷 (L. guttatus)[32]、L. peru[33]、巴哈马笛鲷 (L. synagris)[17]、双色笛鲷(L. analis)[34]、西大西洋笛鲷[35]等研究结果一致。无论是隆背笛鲷还是其他笛鲷属鱼类,其摄食鱼类比例均随着个体发育逐渐增加。本研究也证实了这一观点,美济礁隆背笛鲷性成熟的个体营养生态位宽度较未性成熟个体窄,说明其食性来源更窄,更多摄食鱼类。另外,摄食高营养级的鱼类也导致了性成熟个体的营养级比未性成熟个体高。这一结果与墨西哥笛鲷[32]研究相似,小个体的营养级为3.8,大个体为4.0,同时生态位宽度也明显较小个体窄。食性的转变与个体的形态、行为、栖息地等的改变息息相关[30]。Valle-Lopez等[32]研究表明,笛鲷食性的转变是因为不同大小的鱼类形态学存在差异。笛鲷捕食选择性与嘴的直径相关,小个体鱼类只有较小口裂,导致其只能捕食小的食物如甲壳类,而大个体鱼类口裂较大,能够捕食鱼类等大个体食物;此外,大个体鱼类的游泳和捕食猎物的能力也会明显增加。食性的转变是鱼类为了减少竞争、增加共存的一种潜在捕食生存策略[33]。
本文对隆背笛鲷繁殖和食性进行了初步研究,为其生物学研究提供了基础资料,并为其资源的保护、管理和可持续发展提供理论依据,也为今后这一优质种质物种的养殖提供基础的理论参考。
