有氧运动对睡眠剥夺大鼠学习记忆及海马神经元突触可塑性的效果
2022-12-20李童方志鹏邵玉萍王平
李童,方志鹏,邵玉萍,王平
1.湖北中医药大学基础医学院,湖北武汉市 430065;2.湖北中医药大学体育健康学院,湖北武汉市 430065;3.湖北中医药大学老年医学研究所,湖北武汉市430065
0 引言
睡眠剥夺指人为干预睡眠-觉醒周期,通过减少睡眠时长或改变睡眠时相,使机体处于亚健康或病理状态,引起身心和行为异常。42.92%大学生每晚睡眠总时长<6 h[1]。长期处于睡眠剥夺不仅影响工作效率和生活质量,还会导致学习记忆等认知功能损伤[2]。
学习记忆的形成与巩固离不开神经元及神经元间的突触连接。睡眠期间,机体能够选择性增强正在编码记忆的突触活动,使记忆表征逐渐加强并巩固存储,形成长期记忆[3]。睡眠剥夺减弱突触活动,影响海马区神经元激活,导致记忆损伤[4]。
突触活动受突触结构和突触调节相关蛋白调控。环磷酸腺苷反应元件结合蛋白(cyclic adenosine phos‐phate reactive element binding protein,CREB)/脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)信号通路是调节突触活动的重要通路[5]。磷酸化CREB(p-CREB)进入神经元细胞核,促进BDNF 表达,上调突触后致密蛋白95 (postsynaptic density protein 95,PSD95)、生长相关蛋白43 (growth-associated protein 43,GAP43)、突触素1 (synapsin I,SYN1)和小GTP 酶Rac1 等蛋白表达,促进树突棘发育,增强突触活动,减缓学习记忆损伤[6-11]。有氧运动在调节突触活动、缓解学习记忆等认知功能损伤方面有良好效果,能激活CREB/BDNF 信号通路,上调PSD95、GAP43、SYN1 和Rac1 等相关蛋白表达,增强突触活动,缓解学习记忆受损。
睡眠剥夺损伤树突棘发育,抑制突触活动,与有氧运动的作用机制相似。本研究观察有氧运动对睡眠剥夺大鼠学习记忆表现的效果,并从CREB/BDNF 信号通路角度来探讨可能性的机制。
1 材料与方法
1.1 实验动物及分组
雄性Sprague-Dawley大鼠48只,SPF 级,8周龄,体质量200~220 g,购买于辽宁长生生物技术股份有限公司,许可证号SCXK(辽)2020-0001,饲养于湖北中医药大学SPF 级动物房,恒温恒湿,12 h 光照/12 h黑暗周期交替,自由进食与饮水。适应性饲养1周后,电脑生成随机数,分为对照组、模型组、模型运动组和运动组,每组12只。
本实验通过湖北中医药大学实验动物伦理委员会伦理审查,实验过程中严格遵循《关于善待实验动物的指导性意见》。
1.2 主要仪器及试剂
ZH-PT 型动物实验跑台、ZH0065 Morris 水迷宫:安徽正华生物仪器设备有限公司。自制睡眠剥夺箱。RM2016 切片机:德国LEICA 公司。ECLIPSE E100正置光学显微镜:日本尼康公司。T8-1 磁力搅拌器:江苏省金坛市中大仪器厂。WB D-9413C 凝胶成像分析系统:北京六一仪器厂。H8070 苏木素-G1100 伊红(HE)染色液:索莱宝公司。G1069 高尔基染色套装:武汉赛维尔生物科技有限公司。20665-1-AP 兔多抗PSD95、20258-1-AP 兔多抗SYN1:武汉三鹰生物技术有限公司。DF7766 兔多抗GAP43、AF4200 兔多抗Rac1、DF6387 兔多抗BDNF、AF6188 兔多抗CREB:AFFINITY BIOSCIENCES公司。AB-P-R001兔多抗GAPDH:杭州贤至生物科技有限公司。9198S兔单抗p-CREB:CST 公司。BA1054 HRP 标记羊抗兔二抗:武汉博士德生物工程有限公司。
1.3 方法
模型运动组和运动组采用六道动物跑台进行有氧运动训练。跑台坡度0°,速度15 m/min,15 min 一个小节,小节结束后休息5 min,共4 周[12]。第1、2 周每天训练2 小节,第3 周每天训练3 小节,第4 周每天训练4小节。正式训练开始前,适应性训练3 d,每天10 min。对照组和模型组置于运动跑台中相同时间,但不进行训练。
有氧运动结束后,采用多平台水环境法对模型组和模型运动组连续睡眠剥夺72 h[13]。设备为本实验室自制。每箱5 只大鼠,置于70×50×40 cm 水箱中,水箱内置直径6.5 cm、高9 cm、间隔16 cm 的连体金属圆形平台。箱内注水,使水面低于平台1 cm,大鼠可在平台上活动;当其进入快动眼睡眠时相时,会因肌张力下降而落水惊醒。对照组和运动组在平台上放置金属网板,让其在箱内自由活动,不进行睡眠剥夺。实验开始前对其进行适应性睡眠剥夺3 d,每天1 h。
1.4 Morris水迷宫
有氧运动结束后第1 天开始,进行Morris 水迷宫训练7 d。Morris 水迷宫为直径120 cm 的圆形水池,以及直径10 cm、高18 cm 的站台,设备正上方的摄像头记录并分析大鼠行为。分析系统自动将圆形水池划分为4个象限,站台放在第四象限。
定位巡航实验中,将大鼠分别从4 个象限背对站台放入水中,每次入水的位置固定;若大鼠90 s 内找到平台,让其自行在站台上停留10 s,记录潜伏期;若未找到平台,则引导其在站台停留10 s,潜伏期记为90 s。记录最后一天的潜伏期和游泳总距离。
定位巡航实验结束后2 h,撤去平台,进行空间探索实验,记录大鼠在90 s 内穿越平台次数及大鼠在平台所在象限停留时间和距离。
1.5 样本采集
空间探索实验结束后,大鼠以10%水合氯醛3 mg/kg 腹腔注射麻醉,冰上剥离全脑。取3 只于4%多聚甲醛中固定;3只于高尔基染液中固定,常温保存;6只分离海马各区,无菌冻存管中冻存。
1.5.1 HE染色
4%多聚甲醛固定脑组织梯度酒精脱水,浸蜡、包埋、修整。切片机切片,厚4 μm;二甲苯和酒精脱蜡,苏木素染色,伊红复染。酒精、二甲苯脱水,中性树脂封片,经典海马处切片光学显微镜观察。
1.5.2 高尔基染色
高尔基固定液固定的脑组织采用蒸馏水、80%冰醋酸、30%蔗糖处理。切片机切片,厚4 μm,过夜,避光,晾干。浓氨水、蒸馏水、酸性坚膜定影液处理,甘油明胶封片。正置荧光显微镜200 倍视野下观察,选取海马区2 个结构清晰的神经元,以其从胞体伸出的树突第一次分支进行标记,1 000 倍下观察树突棘形态和密度[14]。
1.5.3 Western blotting
冻存组织剪碎,加入去污剂和裂解液,匀浆,冰上裂解30 min,离心取上清液。BCA 法检测目标蛋白浓度,上清液中加入4 倍体积5×蛋白还原缓试液,沸水10 min 变性。制备5%浓缩胶和12%分离胶,依序上样、分离、转移,封闭液摇床封闭。加入PSD95(1∶2000)、SYN1(1∶4000)、GAP43(1∶1500)、Rac1(1∶600)、BDNF(1∶1000)、p-CREB(1∶1000)、CREB(1∶1000)和GAPDH(1∶1000)一抗,4 ℃孵育过夜,洗去多余一抗,封闭液稀释二抗(1∶10000),封闭摇床孵育。加入增强液与稳定液,待荧光条带明显后,去掉多余底液,加入显影液,凝胶成像仪拍摄条带并分析,计算与GAPDH的相对灰度。
1.6 统计学分析
采用SPSS 23.0 统计软件处理数据。计量资料符合正态分布,以()表示,采用单因素方差分析。显著性水平α=0.05。
2 结果
2.1 Morris水迷宫
与对照组比较,模型组潜伏期和游泳总距离延长(P<0.05),运动组潜伏期和游泳总距离有所降低(P>0.05);与模型组比较,模型运动组潜伏期和游泳总距离降低(P<0.05)。
与对照组比较,模型组穿越平台次数、停留目标象限的时间和距离减少(P<0.05),运动组穿越平台次数、停留目标象限的时间与距离都有上升趋势(P>0.05);与模型组比较,模型运动组穿越平台次数、停留目标象限的时间和距离增加(P<0.05)。见表1。

表1 各组Morris水迷宫测试结果
2.2 HE染色
与对照组比较,模型组海马CA1区神经元形态不完整,数量减少,排列疏散,分布紊乱,胞质深染,胞核固缩;运动组海马CA1区神经元形态完整,排列紧密,胞质和胞核正常;与模型组比较,模型运动组海马CA1区神经元形态相对完整,数量较多,排列相对紧密,分布相对均匀,胞核固缩现象有所减轻。见图1。

图1 各组海马区神经元形态
2.3 高尔基染色
与对照组比较,模型组海马CA1区神经元树突一级分支上树突棘总密度,以及成熟型、不成熟型、丝状伪足型树突棘密度都下降(P<0.05),运动组有所上升(P>0.05);与模型组比较,模型运动组树突棘总密度,以及成熟型、不成熟型、丝状伪足型树突棘密度增加(P<0.05)。见图2、表2。

图2 各组海马神经元棘比较
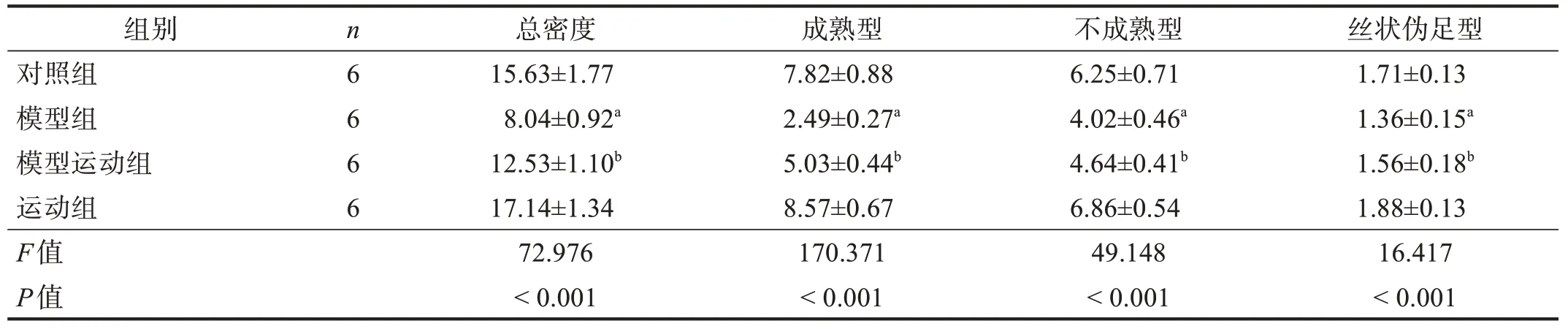
表2 各组海马神经元棘密度 单位:(10 μm)-1
2.4 突触相关蛋白
与对照组相比,模型组海马区PSD95、SYN1、GAP43、Rac1蛋白均下降(P<0.05),运动组所有蛋白有所增加(P>0.05);与模型组相比,模型运动组大鼠海马区所有蛋白增加(P<0.05)。见图3、表3。

表3 各组海马突触相关蛋白表达 单位:%
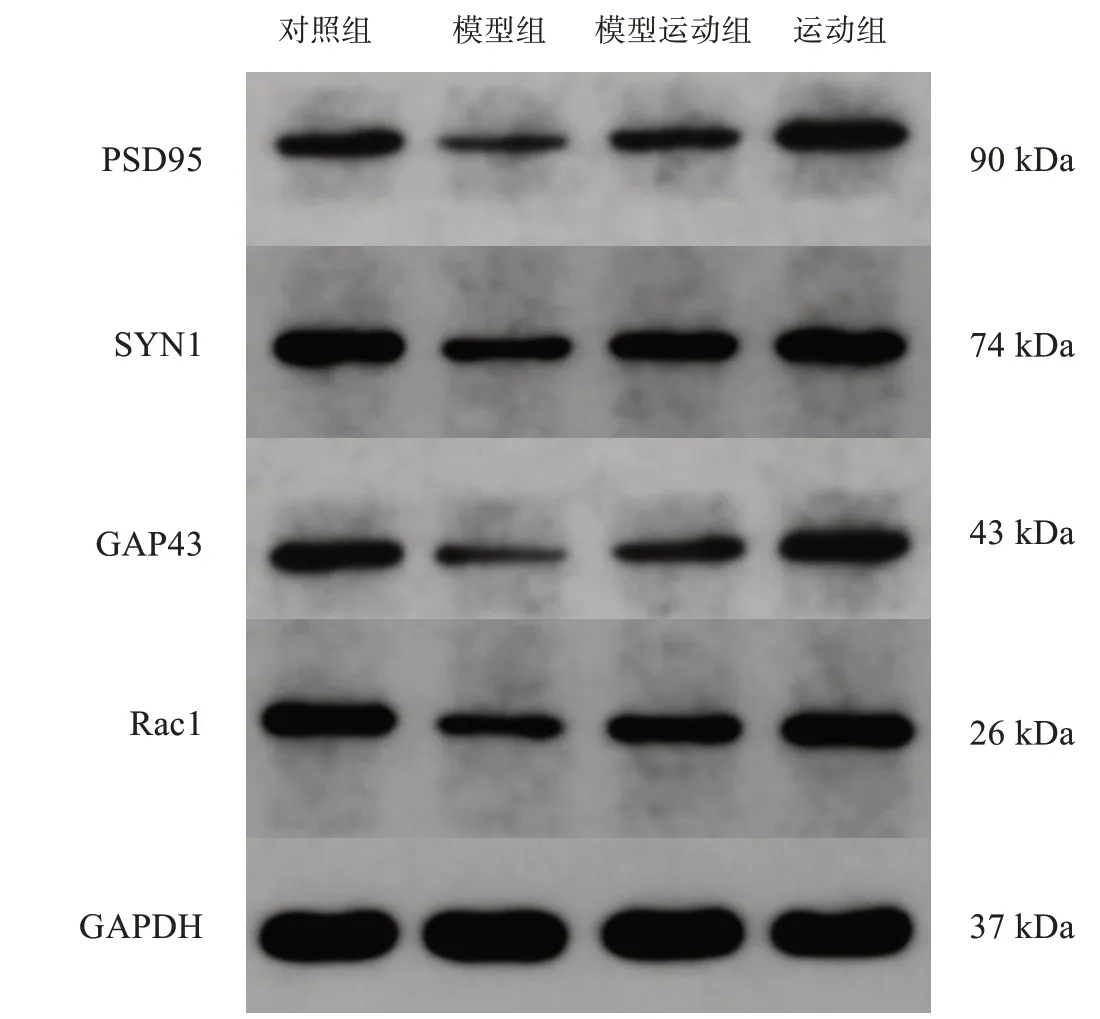
图3 各组海马突触相关蛋白表达
2.5 CREB/BDNF信号通路
与对照组相比,模型组海马区BDNF、p-CREB和CREB 蛋白表达下降(P<0.05),而运动组各蛋白均有所增加(P>0.05);与模型组相比,模型运动组海马区各蛋白增加(P<0.05)。见图4、表4。

表4 各组海马CREB/BDNF信号通路相关蛋白表达 单位:%

图4 各组海马CREB/BDNF信号通路相关蛋白表达
3 讨论
记忆是指将直接或间接获得的信息或经验在大脑中进行编码、巩固和读取的过程[15]。睡眠由快动眼睡眠和非快动眼睡眠两种睡眠时相组成,在快动眼睡眠时相,海马体以θ 节律方式促进记忆形成和巩固[16]。多平台水环境能特异性剥夺大鼠快动眼睡眠时相,干扰海马体神经网络活动,影响学习记忆的形成和巩固[17]。规律的有氧运动对学习记忆形成和巩固有良好的促进作用。Gomes da Silva 等[18]的研究显示,有氧运动能影响大脑发育,促进空间学习记忆形成,并增强后期机体唤起空间记忆的能力。本研究显示,睡眠剥夺明显损伤大鼠学习记忆,而有氧运动能有效改善睡眠剥夺大鼠和正常大鼠的学习记忆。与以前的结果一致[19]。Kojima 等[20]借助近红外光谱测量发现,有氧运动可以缓解成年人睡眠剥夺导致的认知损伤。
脑神经元是学习记忆形成和巩固的物质基础。本研究显示,睡眠剥夺大鼠海马CA1区神经元损伤,而有氧运动可以减轻损伤程度。
脑神经网络由神经元间的突触连接,突触结构由神经元树突或轴突分支形成杯状或球状能与多个神经元胞体或树突接触的末端膨大树突棘组成[21]。树突棘从形态上分为成熟型、不成熟型和丝状伪足型3 种,其形态和密度是动态变化的,这是突触可塑性的前提[22]。树突棘密度增加,突触可塑性随之增强[23]。Guo 等[24]发现,长期皮下注射辛伐他汀会导致小鼠海马区树突棘发育异常,成熟型树突棘减少,学习记忆损伤。Miletínová 等[25]梳理发现,睡眠能够通过突触结构促使学习记忆形成。Zhou等[26]发现,剥夺小鼠快动眼睡眠时相,海马区树突状钙尖峰下降,成熟型树突棘减少,学习记忆损伤。Feng 等[27]发现,8 周有氧运动能缓解卵巢切除小鼠海马区树突棘发育,增加成熟型树突棘数量,缓解学习记忆损伤。本研究显示,睡眠剥夺大鼠学习记忆损伤以及有氧运动逆转其学习记忆受损的机制,与突触可塑性改变有关。
树突棘的发育及密度变化受PSD95、GAP43、Rac1 等蛋白调控。PSD95 是突触后膜的脚手架蛋白,能促进神经元发育,影响树突棘形成;降低大鼠脑内PSD95 蛋白表达,大鼠海马区树突棘形态异常,单位长度棘密度下降,并伴有学习记忆水平下降[28-29]。SYN1 是与神经元发育密切相关的磷蛋白,能调控树突棘生长与形成,并与神经元细胞骨架蛋白相互作用,维持树突棘形态[30]。12 周有氧运动可以上调学习记忆损伤小鼠海马和前额叶SYN1 表达,增加树突棘密度,逆转学习记忆受损[31]。GAP43 广泛分布于神经元中,在树突棘生长发育阶段增加,与树突棘形态和密度线性相关[32]。GAP43 在树突棘局部积累后,通过钙调蛋白信号转导,导致神经元细胞质膜结构和肌动蛋白细胞骨架组织改变,调节树突棘生长,并维持其形态和密度,促进学习记忆形成和巩固[33]。Rac1 为神经元关键的结构蛋白,可作用于肌动蛋白核相关蛋白2/3 (actin-related proteins,Arp2/3),驱 动Arp2/3 活性,使神经元肌动蛋白骨架重排,导致树突棘形成。当Rac1缺失或抑制时,阻碍海马区树突棘形成,损伤长时程促进,降低突触传递活性[34-35]。本研究显示,有氧运动调节树突棘形态及密度的机制可能与其调节PSD95、SYN1、GAP43和Rac1等蛋白表达有关。
CREB/BDNF 信号通路是调节突触可塑性的常见通路[36-37]。CREB 作为一种核内转录因子,在脑内神经元细胞核中广泛分布,常需要多种蛋白激酶在丝氨酸129、133 或142 位点上使其磷酸化,才能进行核内转 录[38]。Wu 等[39]发现,8 周有氧运动能促使CREB 磷酸化,调节BDNF 表达,增强大鼠学习记忆。BDNF作为神经营养素的一种,由内质网中合成前体BDNF,经呋喃或其他前转化酶在跨高尔基网络或分泌颗粒中转化为成熟的BDNF,在维护和完善涉及学习和记忆的神经元回路方面发挥关键作用[40]。BDNF是PSD95、SYN1、GAP43 和Rac1 等树突棘调节蛋白的上游调节蛋白[6-7]。Zagrebelsky 等[8]发现,BDNF 可通过扩大微管,增加PSD95 表达,使肌动蛋白在树突棘处募集,从而促进树突棘成熟,并维持其形态。Lu 等[10]发现,BDNF能通过去乙酰化酶3调节SYN1表达,影响树突棘形态。Gong 等[9]发现,给予BDNF 后,能增加GAP43 表达,促进树突棘生长。Hedrick 等[11]发现,BDNF能调节Rac1表达,影响树突棘结构。本研究显示,有氧运动调节PSD95、SYN1、GAP43 和Rac1 等蛋白表达的机制可能与其调节CREB/BDNF 信号通路有关。
综上所述,有氧运动能缓解睡眠剥夺大鼠学习记忆损伤,可能与调控睡眠剥夺大鼠海马CREB/BDNF信号通路,改善其突触可塑性有关。
利益冲突声明:所有作者声明不存在利益冲突。
