PU-H71对结直肠癌HCT-15细胞凋亡和周期的影响
2022-12-20田朵朵赵学荣王建平郑华川肖丽君赵恩宏
田朵朵,邓 程,赵学荣,王建平,郑华川,肖丽君*,赵恩宏
(1.承德医学院基础医学院,河北承德 067000;2.承德医学院附属医院)
结直肠癌(colorectal cancer,CRC)是全球第三大常见癌症和第四大致命癌症,每年都有超过80多万人因其死亡[1]。随着癌症筛查的措施逐渐增多,如今结直肠癌的诊出率和死亡率都有所降低,但结直肠癌的分子机制不是十分明确,所以探求高效的分子靶点仍是关键。热休克蛋白90(heat shock protein 90,HSP90)是一种进化比较保守的伴侣蛋白,可以参与200多种蛋白质的折叠装配过程,在体内参与细胞增殖和凋亡等生物学行为。有报道称HSP90在肿瘤细胞中表达升高,而在正常细胞中表达较低[2]。HSP90抑制剂可以影响ATP酶活性导致客户蛋白降解,从而使信号传导通路停止[3]。PU-H71是近几年发现的一种新型的HSP90抑制剂,有研究介绍了PU-H71在转移性乳腺癌中的作用,通过实验证明PU-H71可以抑制肿瘤的生长,并发现PU-H71在TNF-α存在的情况下可以诱导乳腺癌细胞的死亡[4]。目前,PU-H71在结直肠癌中的作用未见相关报道,本研究将介绍PU-H71对结直肠癌HCT-15细胞周期和凋亡的影响,并且进一步探讨该药物的分子作用机制,为PU-H71的进一步开发提供依据。
1 材料与方法
1.1 细胞、主要试剂和仪器
细胞:HCT-15细胞,实验室留存。主要试剂:PU-H71(Selleck);RPMI-1640 培养基和DMEM培养基(Gibco);胎牛血清(Fetal BovineSerum(Prime));PBS(hyclone);胰酶(Tbd);青链霉素(Tbd);DMSO(Sig-ma);细胞凋亡试剂盒(KeyGEN);细胞周期试剂盒(凯基);BCA试剂盒(Solarbio);抗体(Abcam)。仪器:酶标仪(BioTek);细胞培养箱(Thermo);显微镜;超净工作台;水浴箱;流式细胞仪(BD);全自动化学发光仪(BD)。
1.2 主要方法
1.2.1 细胞培养 结直肠癌HCT-15细胞株用1640培养基,加入10%~15%胎牛血清和1%的双抗。放在37℃、5%CO2的恒温培养箱中,根据细胞生长状态每1~2d换液并且及时传代,待细胞达到对数生长期时可用于各项实验。
1.2.2 MTT检测PU-H71对HCT-15细胞的增殖情况 取生长至对数期的细胞,弃培养液后,用PBS清洗,加入0.25%的EDTA胰酶。细胞变圆后加入含血清的培养液缓慢吹打,将细胞收集于10ml离心管中,1000rpm离心5min,弃去上清,再加入4ml含血清的培养基,制成单细胞悬液,随后计数。将细胞密度调为1.5×104个/mL,每孔200μl,加到96孔板里,继续培养24h后取出。观察细胞状况,如果较良好,则弃去96孔板的上清液,再加入新鲜配置的培养基,每孔190μl,另外每孔再加入10μl的PU-H71,来配制成实验设计所需要的药物终浓度,每个浓度需设5个复孔,并且要设置对照组(不加药组)和空白对照组(只加含血清的培养基)。放置24h和48h后,每孔加入10μl的MTT,再放置4h,小心弃上清液,每孔加150μl的DMSO,用酶标仪检测490nm处的波长,震荡8min后,检测OD值。计算生长抑制率和IC50。实验重复3次。
1.2.3 流式细胞术检测细胞周期 细胞生长到对数期后,接种于六孔板中,每孔1×106个细胞,在培养箱中放置24h。加入相应浓度的PU-H71,本实验设置的终浓度为50μg/L和75μg/L,并且设置对照组,继续培养24h。弃上清液,PBS清洗一次,然后用无EDTA的胰酶消化细胞小心吹打,将细胞收集到离心管中,1400rpm、5min离心,弃去上清,加适量PBS吹打混匀,计数,将细胞浓度调整为1×106/mL。取1ml单细胞悬液,1000rpm、4min离心,弃去上清液,加入70%的冷乙醇500μl,在4℃冰箱放置2h或者过夜。后续操作前每管加入3ml PBS清洗细胞3遍,去除残留的冰乙醇(在清洗过程中用200目筛网过滤一次),弃去上清液,加入提前配制的PI/RNase A染色工作液500μl,室温避光放置45min,1h内上机进行检测,上机之前用枪头吹打混匀并且再过一次筛网。重复实验3次。
1.2.4 流式细胞仪检测细胞凋亡 取对数生长期的细胞,每孔细胞数量为5×105个,接种在6孔板中。培养24h后,加入新鲜配置的PU-H71,使六孔板中浓度为50μg/L和75μg/L,再设置一组不加药组。继续培养24h,取出6孔板,每孔加入0.5ml无EDTA胰酶,轻轻吹打细胞并收集到离心管中,2000rpm、6min离心,小心弃去上清液。每管加入3ml预冷的PBS,清洗2次。制成单细胞悬液计数,取出1×105个细胞移入到流式管中,并且用200目筛网过滤一次,离心后小心弃去上清液。每管加入500μl的Binding Buffer悬浮细胞,再加入5μl Annexin V-FITC,混匀后继续加入5μl Propidium Iodide,室温避光染色5~15min,1h内上机检测。重复实验3次。
1.2.5 蛋白质印记法 取对数生长期的细胞用胰酶消化后在培养箱中放置24h。加入新配置的PU-H71,终浓度分别为0(对照组)、50和75μg/L。24h后拿出细胞终止培养,用PBS清洗细胞3次。将细胞收集于1ml离心管中,离心弃去上清,每管加入300μl RIPA和3μl蛋白酶抑制剂,混匀,在-80℃冰箱或者液氮中反复冻融4次,12000rpm、20min收集上清,即蛋白。BCA定量完成后进行电泳、转膜、封闭、一抗孵育和二抗孵育,最后用化学发光仪显影。以β-actin作内参对照。用Image J检测图像条带,得到各条带灰度值,进行统计分析。重复实验3次。
1.3 统计学处理
采用SPSS 13.0软件进行相关统计学分析,用均数±标准差()表示,以P<0.01为差异有统计学意义。采用Graphpad Prism5对周期、凋亡及相关蛋白进行柱状图统计分析。
2 结果
2.1 MTT检测PU-H71对HCT-15细胞增殖能力的影响
PU-H71对体外培养的HCT-15细胞株作用浓度为25~150μg/L时有显著的抑制作用,且有浓度依赖性(图1)。P<0.01表示差异具有统计学意义。
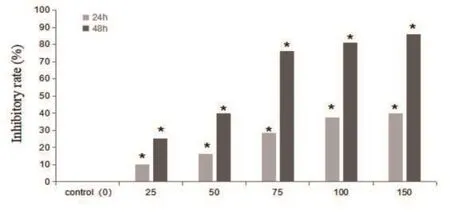
图1 不同浓度PU-H71对HCT-15细胞增殖的影响
2.2 流式细胞术检测PU-H71对HCT-15细胞周期的影响
结果显示,PU-H71作用于HCT-15细胞24h后,处于G2期细胞的比例增高,且与药物浓度呈正相关(附表、图2)。P<0.01表示差异具有统计学意义。

附表 PU-H71对结直肠癌HCT-15细胞生长周期和凋亡率的影响
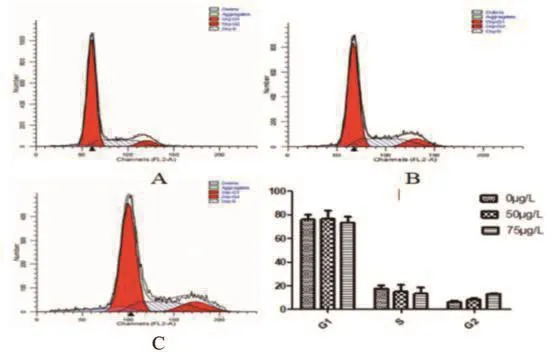
图2 不同浓度PU-H71对HCT-15细胞周期的影响
2.3 流式细胞术检测PU-H71对HCT-15细胞凋亡的影响
流式细胞术检测凋亡结果展示PU-H71作用于HCT-15细胞24h后能够有效促进肿瘤细胞凋亡,且和浓度正相关(附表、图3)。P<0.01表示差异具有统计学意义。
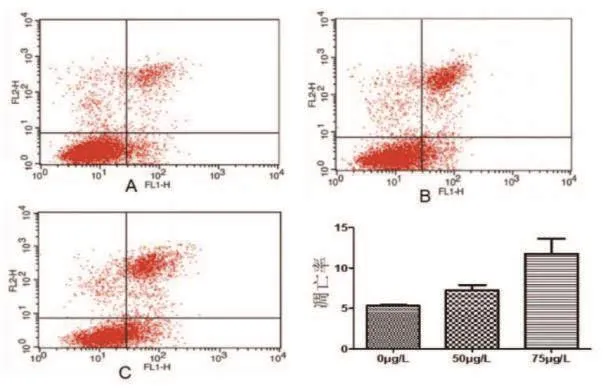
图3 不同浓度PU-H71对HCT-15细胞凋亡的影响
2.4 Western-blot检测凋亡和周期相关因子蛋白水平的变化
采用Western-blot法检测PU-H71作用于HCT-15细胞后,STAT3以及凋亡和周期相关因子CyclinD1、JAK2和Bcl-2蛋白表达水平下调,Cytc、Caspase9、Caspase3、及Bax蛋白表达水平上调,且所有因子表达水平均与PU-H71的浓度呈现相关性(图4)。P<0.05表示实验结果具有统计学意义。
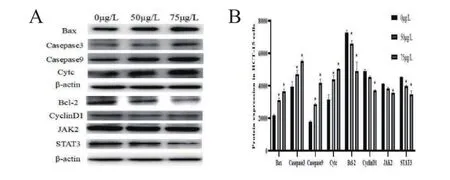
图4 PU-H71对HCT-15细胞凋亡和周期相关因子的影响
3 讨论
CRC因其复发率和转移率高、早期诊断率低、治疗效果差成为人们关注的一类疾病。手术及放化疗都是目前较常见治疗结直肠癌的措施,然而,这些方法对正常细胞会产生很大的副作用。因此,新的研究正在朝着更有效和不入侵正常细胞的方向发展,来寻求最佳的治疗方式。结直肠癌的分子靶向治疗是提升疗效和降低毒性的新方法和新方向,根据目前对CRC的了解,及时检测和有效的精准治疗对于患者治疗和生存至关重要[5]。在抗肿瘤的过程中,HSP90可以调节参与肿瘤发生有关的信号通路蛋白、受体和转录因子等在内的癌蛋白和客户蛋白。HSP90有极其重要潜在的临床应用,它可以作为确诊和预后的生物标志物,来评判癌症的进展。HSP90介入了多种促癌蛋白的构象稳定和功能成熟等过程,Akhil等的研究揭示了HSP90在促进细胞周期进程中的核功能等的作用[6]。近年来,透过HSP90开发新的抗癌治疗药物,如一系列HSP90抑制剂,成为克服结直肠癌新的方向。PU-H71是一种新发现的HSP90抑制剂的衍生物,是一种嘌呤-支架型抑制剂,相较其他HSP90抑制剂展示出了独特的选择性结合优势,它可以优先与致癌客户蛋白相关,并富集于肿瘤细胞。有研究表明,PU-H71可引起内质网应激反应,进而激活不同人类癌细胞的线粒体凋亡途径,且PUH71能够诱导过表达Bcl-2的细胞凋亡,这种抵抗力在化疗中具备重要意义[7]。PU-H71具有高水溶性和低肝毒性,这些优势赋予了它更具潜力的应用前景。
我们选用HCT-15细胞,通过MTT法检测到PU-H71对HCT-15细胞增殖有鲜明的抑制作用,且呈剂量依赖性。本实验设置两个浓度以及不加药组共3组,流式实验结果显示,药物浓度加大后,凋亡率增加且细胞阻滞在G2期。线粒体作为负责能量代谢的场所,其通路在诱导细胞凋亡通路中发挥重要作用。细胞发生凋亡时,线粒体中的Cytc进入到细胞质,经过ATP的作用,和Apaf-1结合形成凋亡小体,经过活化等过程形成Caspase9前体,然后激活Caspase3,使DNA分子片段化,细胞最终凋亡。Bcl-2蛋白家族可在线粒体通路中发挥作用,引起Caspase的激活,从而导致细胞凋亡。Bax基因是Bcl-2基因家族中起促凋亡作用的成员,它编码的一种与Bcl-2有关的Bax-alpha蛋白,在调节细胞凋亡层面起着关键作用。本研究采用Westernblot法进行检测,显示Cytc、Bax、Casepase3和Casepase9表达增高,Bcl-2表达降低。CyclinDl属于周期相关因子,它在正常组织细胞中不表达或低表达,但是在肿瘤组织细胞中表达增高。本实验检测到CyclinD1蛋白表达较不加药组降低,但两个浓度之间区别不明显,需后续实验继续探讨。信号转导和转录激活因子3(STAT3)属于STAT家族成员,在细胞生长和分化中发挥重要作用,它几乎在所有体细胞中普遍表达,通过调控其下游靶基因Bcl-2、BclxL、cyclin等,在促进细胞增殖、分化、细胞周期进程、转移、血管生成和免疫抑制以及化疗耐药中发挥重要作用[8]。STAT3在大多数研究中被称为原癌基因,它的组成性激活与多种癌症的发展有关,例如白血病和淋巴瘤等恶性肿瘤[9]。JAK-STAT3信号通路是受细胞因子刺激而产生的信号转导通路,与细胞增殖、分化和凋亡等重要生物学过程都密切相关。在肿瘤发展过程中JAK-STAT3通路有着重要的作用,Su等的研究证明了brevilin A在体外和体内通过JAK2/STAT3通路的抑制发挥抗黑色素瘤作用[10]。本实验中JAK2和STAT3蛋白表达都降低,提醒我们PU-H71有可能通过该通路发挥作用。
综上所述,本研究证明了PU-H71对HCT-15细胞的增殖有抑制作用,并且可以促进细胞凋亡和阻滞细胞周期,并进一步探讨了该药对结直肠癌细胞凋亡和周期的分子作用机制。其中,线粒体凋亡通路中Cytc、Caspase3、Bax和Caspase9表达水平均上升,提示PU-H71通过线粒体途径诱导HCT-15细胞凋亡,而STAT3表达水平降低,所以我们猜测PU-H71可能通过STAT3途径启动线粒体凋亡通路,诱导HCT-15凋亡。本实验中STAT3和JAK2表达均下降,我们预测PU-H71可能通过JAK-STAT3信号通路使HCT-15细胞周期发生阻滞,并且使STAT3的表达下调来达到负向调控JAK-STAT3信号传导通路的作用。我们接下来将进一步探讨PU-H71的抗肿瘤作用及其涉及的通路和机制等,为PU-H71应用于临床提供数据依据和寻找更有效的分子靶点。
