xanK单位点突变对野油菜黄单胞菌菌黄素合成及黄原胶产物性质的影响
2022-12-20梁佳园刘洋韩鸿宇张艳敏张永刚伏广好董学前
梁佳园,刘洋,韩鸿宇,张艳敏,张永刚,伏广好,董学前*
(1.齐鲁工业大学(山东省科学院),食品科学与工程学部,山东 济南 250353;2.山东省食品发酵工业研究设计院,山东 济南 250013;3.内蒙古阜丰生物科技有限公司,内蒙古 呼和浩特 010070)
黄单胞菌细胞呈直杆状,具有单端极生鞭毛,属于革兰氏阴性菌、好氧[1-4]。在自然界中,黄单胞菌通常对植物具有致病性,因而导致了多种重要经济作物出现黑腐病[5-6]。然而,在工业上应用黄单胞菌菌株生产微生物多糖,例如野油菜黄单胞菌(Xanthomonas campestris pv.campestris,Xcc)。该菌株可以生产一种水溶性胞外多糖,称为黄原胶,因其具有较好的触变性和增稠性,可以作为增稠剂、乳化剂和稳定剂,广泛应用于石油工业、食品、饮料、医药以及化妆品等领域。
菌黄素是黄单胞菌产生的一种不溶于水的黄色色素,最初被认为是一种类胡萝卜素[7],后经鉴定发现菌黄素的化学成分是溴化芳基多烯脂的衍生物,牢固地附着在细胞外膜上[8]。来自不同黄单胞菌的菌黄素在溴化和甲基化上有所不同[9]。菌黄素在黄单胞菌中是一种致病因子,并对菌株胞外多糖的合成、繁殖能力、抗氧化能力以及呼吸链中辅酶Q8的合成有一定影响[10-12]。因此,透彻理解菌黄素的合成机制对研究黄单胞菌有重要意义。
由于菌黄素的存在,在提取野油菜黄单胞菌的产物黄原胶的过程中需要使用大量溶剂脱色。该过程耗能大,成本较高,工艺复杂,甚至会影响黄原胶的产量。目前的研究结果表明,通过连续传代、诱变剂和基因工程等方法能够获得低色素的黄原胶。Poplawsky等[13-14]在Xcc中克隆了菌黄素生物合成的基因簇,鉴定其含7个转录单元。Xcc分离株ATCC33913基因组序列发表后,菌黄素生物合成基因簇(Xcc3998-Xcc4015)也随之被鉴定[15]。菌黄素生物合成受到了扩散因子(diffusible factor,DF) 的调控,Xcc4014(命名为XanB2)参与DF的生物合成[16]。He等[17]发现DF是菌黄素的合成前体3-羟基苯甲酸(3-hydroxybenzoic acid,3-HBA);Zhou 等[18]鉴定了 XanB2 为一种独特的分支酸裂解酶,以分支酸为底物同时合成3-HBA和4-羟基苯甲酸(4-hydroxybenzoic acid,4-HBA);Cao等[19]敲除了菌黄素合成基因簇中所有基因,分析了所有突变体的菌黄素生物合成,鉴定了XanA2为酰基-酰基载体蛋白合成酶(Aas S),与酰基载体蛋白(acyl carrier protein,ACP)Xan C一起激活 3-HBA合成 3-HBA-S-ACP,进入II型聚酮合酶生物合成途径,合成芳香多烯链。Cao等[19]也发现Fab G家族蛋白Xan H和新型糖基转移酶Xan K也参与菌黄素的生物合成。Yu等[20]通过基因敲除发现Xan H(Xcc4003)不仅参与菌黄素生物合成,还参与了扩散信号因子(diffusible signal factor,DSF)的生物合成。野油菜黄单胞菌中的pig基因簇和菌黄素有密切的关系,该基因簇的Xcc4000(xanK)被鉴定为糖基转移酶。糖基转移酶对菌黄素的生物合成具有必不可少的作用。大多数研究集中于菌黄素的生物合成途径[21],但菌黄素的具体合成机制还有待进一步深入研究。
在研究过程中得到一株自然突变的无黄色素黄原胶的XW菌株,经过测序发现在pig基因簇中xanK基因一处碱基由天冬氨酸突变为甘氨酸,为了验证该突变位点的作用,构建带xanK的回补质粒,将其导入XW菌株中,观察导入回补质粒后XW菌株的颜色变化,分析突变菌株和野生型菌株产物黄原胶之间的差异。本研究中针对碱基位点进行的相关研究不仅可以定位影响酶活性的关键碱基,还可以进一步的阐述xanK基因对菌黄素合成的影响。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株及质粒
野油菜黄单胞菌XCl菌株、野油菜黄单胞菌突变菌株XW、大肠杆菌DH5α菌株、广宿主穿梭质粒pBBR1MCS-2:山东省食品发酵工业研究设计院保存。
1.1.2 酶与试剂
酵母粉、胰蛋白胨(分析纯):英国Oxoid公司;蛋白胨(分析纯):南通东海龙生生物制品有限公司;酵母膏(分析纯):安琪酵母股份有限公司;牛肉膏(分析纯):北京奥博星生物科技有限公司;NaCl(分析纯):天津化学试剂有限公司;无水乙醇(分析纯):国药集团化学试剂有限公司。细菌基因组DNA提取试剂盒、琼脂糖凝胶回收试剂盒、质粒小提试剂盒(生化试剂):天根生化科技(北京)有限公司;Fastpfu DNA Polymerase(生化试剂):北京全式金生物技术股份有限公司。
1.1.3 主要培养基
LB(Luria-Bertani,LB)培养基:5 g/L 酵母粉、10 g/L胰蛋白胨、5 g/L NaCl。
HYG培养基:10 g/L葡萄糖、5 g/L蛋白胨、3 g/L牛肉膏、0.5 g/L酵母膏、2 g/L NaCl,pH7.0,可加入15 g/L琼脂粉配制为固体HYG培养基。
HYS培养基:20 g/L蔗糖、5 g/L蛋白胨、3 g/L牛肉膏、0.5 g/L 酵母膏、2 g/L NaCl,pH7.0,可加入 15 g/L 琼脂粉配制为固体HYS培养基[10]。
以上培养基灭菌条件均为121℃下高压灭菌20min。
卡那霉素(Kanamycin,Kana)(50 mg/mL):卡那霉素0.500 g,超纯水10 mL,0.22 μm滤膜过滤除菌,分装,-20℃储存。
1.2 仪器与设备
T960 PCR扩增仪:耶拿分析仪器股份公司;TU-1900双光束紫外可见分光光度计:杭州奥盛仪器有限公司;5804R冷冻离心机:美国艾本德公司;DW-86L416G超低温冰箱:青岛海尔公司;ZWY-2102C恒温培养箱:上海博迅实业有限公司医疗设备厂;DYY-7C电泳仪:北京六一生物科技有限公司;Gel Doc凝胶成像仪、MicroPulser电穿孔仪:美国伯乐公司;ZQZYCF9.9恒温摇床:上海智城分析仪器制造有限公司;HCB-900V智净洁净工作台:上海甄明科学仪器有限公司;DV-2T旋转黏度计:美国博勒飞公司;1260 Infinity II GPC/SEC:安捷伦科技公司;DLAB OS20-S搅拌器:大龙兴创实验仪器(北京)有限公司。
1.3 方法
1.3.1 菌株的构建
1.3.1.1 引物设计
引物设计见表1。

表1 引物Table 1 Primers
1.3.1.2 重组质粒的构建
将保藏菌株XCl接入HYG培养基中,放置于摇床30℃,200 r/min转接培养24 h,然后按相同步骤再转接培养1次。参照细菌基因组DNA提取试剂盒说明书,获得XCl的基因组DNA,置于-20℃冰箱保藏。
使用FastPfu DNA Polymerase对xanK基因进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,总体系100 μL,反应体系与PCR程序见表2。

表2 PCR扩增体系Table 2 PCR amplification system
PCR扩增程序:95℃预变性5 min,循环程序(95 ℃ 变性 30 s,60 ℃ 退火 25 s,72 ℃ 延伸 20 s),运行35次,后延伸72℃,5 min。琼脂糖凝胶电泳验证PCR扩增产物,验证正确的条带使用胶回收试剂盒回收,具体参照试剂盒说明书步骤进行。回收得到的产物测定浓度后,置于-20℃冰箱保存。
以野生型菌株XCl的基因组为模板,使用引物对xanK-F和xanK-R,用高保真酶FastPfu进行PCR扩增xanK基因回补片段。扩增的产物通过琼脂糖凝胶电泳回收得到xanK片段,用限制性内切酶EcoRI和NheI双酶切PCR产物和质粒pBBR1MCS2[22]。将得到的xanK片段使用T5连接酶与线性载体pBBR1MCS2连接,转化至DH5α菌株中。挑选出在加了卡那霉素抗性的LB培养基上长出来的大肠杆菌,做PCR验证。将条带大小符合的片段回收,做双酶切验证和测序验证。筛选出双酶切结果中碱基数匹配的质粒做进一步测序验证。将测序结果在美国国家生物技术信息中心NCBI数据库上进行序列比对,挑选出构建成功的pBBR1MCS2-xanK质粒。
1.3.1.3 xanK基因测序
在倒置培养14 h~16 h的含有卡那霉素的LB平板中挑取单菌落,验证转化子,具体步骤如下:1)在超净工作台中取若干高温灭菌后的PCR管,每管中加入10 μL无菌生理盐水;2)移液枪枪头挑取LB平板中的转化子菌落,然后枪头插入含有生理盐水的PCR管中,吹吸3次~5次,将单菌落收集到PCR管中;3)按照表2中PCR方法对已挑取的转化子单菌落进行PCR鉴定,模板的加入需要在洁净工作台中进行,PCR总体系为25 μL,程序相同;4)琼脂糖凝胶电泳验证PCR产物,验证正确的转化子从PCR管中接入含有卡那霉素的LB液体培养基中,37℃下,200 r/min培养16 h;5)使用质粒提取试剂盒提取培养完成的菌液中的质粒,方法按照说明书要求进行,随后送至相关公司测序。
1.3.1.4 xanK基因回补菌株[XW(xanK)]的构建
制作XW菌株电转化感受态细胞,用电击转化法将回补质粒pBBR1MCS2-xanK导入到XW菌株中,涂布在含有卡那霉素的抗性平板上,挑选长出的单菌落,进行下一步的验证试验。
1.3.1.5 xanK基因回补菌株的验证
XW、XW(xanK)和XCl菌株在HYG培养基中30℃培养48 h,菌液5 000 r/min离心3 min,观察沉淀的颜色。
1.3.2 菌黄素提取、纯化和定性定量分析
XW和XCl菌株于HYS培养基中30℃培养72 h,分别收集10 mL菌液,8 000 r/min离心5 min去除上清液,加入1 mL无水乙醇,涡旋使菌体充分悬浮。将含有悬浮液的离心管置于95℃水浴锅中水浴5 min,10 000 r/min离心10 min,取600 μL上清液,利用分光光度计测定上清液441 nm处吸光值,对菌黄素定量分析。将XW、XW(xanK)和XCl菌株在HYG培养基中30℃培养48 h,取菌液5 000 r/min离心3 min,对比XW、XW(xanK)和XCl菌液离心后菌体的颜色,对菌黄素定性分析。
1.3.3 黄原胶提取与定量分析
XW和XCl菌株于HYG培养基中30℃发酵72 h,发酵结束后取1 mL发酵液稀释10倍,90℃水浴1 h,使用硅藻土趁热过滤去除菌体,收集滤液。提前准备干净的50 mL离心管,收集上清液,向滤液中缓慢加入95%的乙醇,边加边搅拌,直至有絮状沉淀产生,收集沉淀,再次使用95%的乙醇清洗。-20℃中放置30 min,4℃、10 000 r/min离心10 min后倒去上清液,在60℃下干燥6 h,称量干燥后的黄原胶质量计算黄原胶产量。

1.3.4 乙酰基和丙酮酸含量测定
参照Cheetham等[23]的方法测定不同黄原胶样品的乙酰基和丙酮基含量:超纯水配制5 g/L的黄原胶溶液,取1 mL此溶液与1 mL的0.1 mol/L磷酸混合,密封于90℃下反应90 min,取反应液定容至5 mL,0.22 μm滤膜过滤,得到丙酮酸测定液。取1 mL的5 g/L黄原胶溶液与1 mL的0.2 mol/L KOH混合,冲入氮气后密封,45℃下反应6 h,反应结束后使用磷酸溶液(0.1 mol/L,1 mL)中和,使用超纯水精确定容至 5 mL,0.22 μm 滤膜过滤得到乙酰基测定液。
采用不同浓度的丙酮酸溶液(0.005、0.010、0.020、0.040、0.080 mg/mL)和乙酸溶液(0.05、0.10、0.20、0.40、0.80 mg/mL),绘制标准曲线。高效液相色谱(high performance liquid chromatography,HPLC) 测定乙酰基与丙酮酸含量,具体参数:AminexHPX87H有机酸分析柱,柱温60℃,紫外检测器,检测波长210 nm,流动相为5 mmol/L的H2SO4,流速0.6 mL/min。计算公式如下。
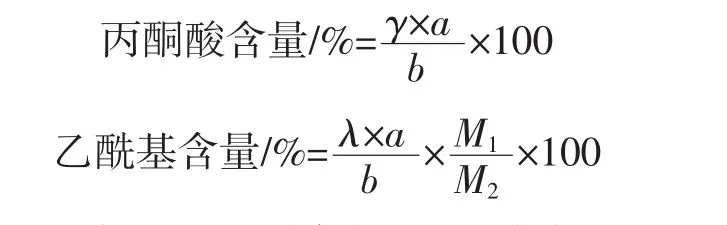
式中:γ为HPLC测定的丙酮酸含量,g/L;λ为HPLC测定的乙酸含量,g/L;a为稀释倍数;b为测定液浓度,g/L;M1为乙酰基摩尔质量,g/mol;M2为乙酸摩尔质量,g/mol。
1.3.5 黄原胶分子量测定
使用凝胶渗透色谱法测定各黄原胶的分子量[24],蒸馏水配制浓度为1 g/L的黄原胶溶液,10 000 r/min离心30 min,使用0.22 μm膜过滤以制备样品。使用Agilent 1260 Infinity II GPC/SEC系统测定分子量,配有示差折射检测器和多角度激光散射检测器。流速1 mL/min,柱温30℃,流动相为1 g/L的NaNO3溶液,流速1 mL/min。
1.4 数据处理
每组试验进行3个平行,采用Excel2016对试验数据进行差异显著性检验分析;利用Origin 2021和Adobe Illustrator CS6绘图软件处理试验数据并绘制图表。
2 结果与分析
2.1 xanK基因回补菌株的构建
xanK片段胶回收验证见图1。
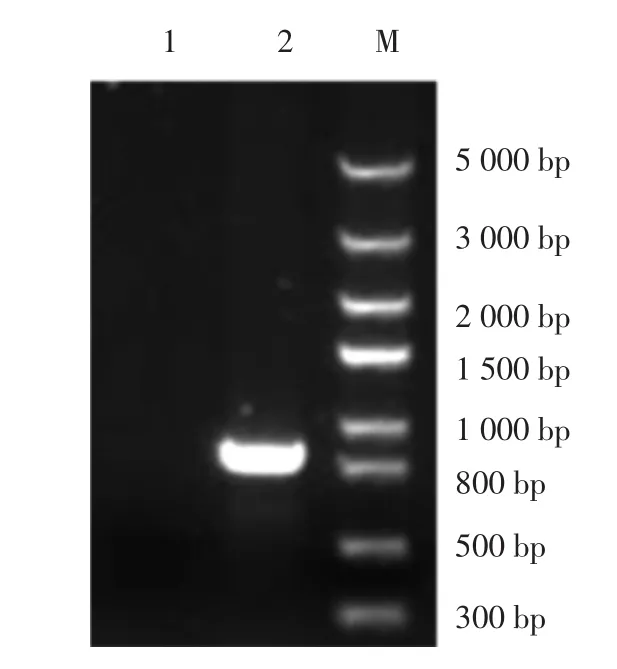
图1 xanK片段胶回收验证Fig.1 xanK fragment glue recovery verification
xanK片段大小为822 bp,图1中电泳结果显示得到一条位于800 bp与1 000 bp之间的条带即xanK。根据这一结果扩大PCR体系对xanK胶回收。
重组质粒的双酶切验证结果见图2。

图2 重组质粒的双酶切验证Fig.2 Verification of double digestion of the recombinant plasmid
2.2 xanK基因回补菌株的鉴定
对比XW、XW(xanK)和XCl菌株培养基离心后菌体的颜色,发现菌株XW(xanK)的颜色由白色变成了黄色,证明xanK基因突变导致无黄色素黄原胶的产生。改造菌株、突变菌株和野生型菌株颜色对照见图3。

图3 改造菌株、突变菌株和野生型菌株颜色对照Fig.3 Color comparison of modified strain,mutant strain and wild-type strain
2.3 菌黄素含量
为了研究菌株XW和XCl菌黄素的合成情况,选择发酵72 h的菌液分别提取测定菌黄素含量,结果见图4。

图4 菌黄素含量Fig.4 Lutein content
由图4可知,72 h时,菌株XCl和菌株XW的OD441水平分别为0.37和0.05,菌株XW和菌株XCl的OD441值相比较,发现菌株XW的OD441水平比菌株XCl降低了86.5%。由上述结果可知,xanK基因的存在,导致菌黄素的合成受阻,进而影响菌黄素的合成。
2.4 黄原胶性质
为了验证xanK突变菌株对黄原胶产量及性质的影响,进行了摇瓶发酵验证,两种黄原胶的基本性质见表3。
由表3可知,发酵72 h后,菌株XW发酵液黏度为8 930 mPa·s,比菌株 XCl提升了17.8%,菌株XW黄原胶的产量和黏度分别为3.28 g/100 g和1 326 mPa·s,分别比菌株XCl提升了10.4%、5.3%,分子量为3.67×106Da,比菌株XCl降低了80.2%。

表3 两种黄原胶的基本性质Table 3 Basic properties of the two xanthan gums
2.5 黄原胶的丙酮酸和乙酰基含量
研究表明,黄原胶分子结构侧链上的乙酰基与丙酮酸含量会影响黄原胶溶液性能[25]。乙酰基和丙酮酸在黄原胶分子链上的分布并无规律,但对黄原胶的构象及物化性质却有很大的影响[26-27]。丙酮酸化可增加黄原胶黏度,乙酰化可降低黄原胶黏度[28]。乙酰基团的存在加强了分子内的相互作用力,因为脱去乙酰基后使黄原胶分子变得更加柔顺[29]。高效液相色谱法测定黄原胶中乙酰基和丙酮酸含量的结果见图5。

图5 乙酰基和丙酮酸含量变化Fig.5 Change of acetyl group and pyruvate content
由图5可知,在xanK基因突变后,其黄原胶产物中丙酮酸含量为1.45%,比菌株XCl增加了74.70%,在xanK基因突变后,其黄原胶产物中乙酰基含量为6.52%,比菌株XCl降低了8.94%,无黄色素黄原胶分子侧链上乙酰基含量略低于黄原胶。
3 结论
为研究xanK突变对菌黄素合成的影响,通过构建回补菌株XW(xanK)来验证这一突变位点的影响,将构建成功的质粒导入白色菌株XW中,发现菌株由白色变为黄色,证实了xanK基因突变导致了黄原胶变为无黄色素黄原胶。摇瓶发酵对比白色菌株和野生型黄色菌株的黄原胶产生水平,菌株XW发酵液黏度为8 930 mPa·s,比菌株XCl提升了17.8%,菌株XW黄原胶的产量和黏度分别为3.28 g/100 g和1 326 mPa·s,分别比菌株XCl提升了10.4%、5.3%,分子量为3.67×106Da,比菌株XCl降低了80.2%,菌株XW菌黄素水平相比于XCl下降了86.5%。本研究中的突变菌株有利于提高黄原胶产量,且产生的菌黄素更少,方便后续的提取工作,降低了黄原胶的生产成本。