归元剔络养血方对NAION模型大鼠VEGF调控作用的研究
2022-12-20李欣李雪菲侯文博冯俊
李欣,李雪菲,侯文博,冯俊
非动脉炎性前部缺血性视神经病变(nonanteritic anterior ischemic optic neuropathy,NAION)是由于睫状后短动脉循环障碍,造成视盘的筛板前区及筛板区供血不足引起的视神经疾病。其主要症状特点是视力突然减退、视乳头水肿、与生理盲点相连的象限性视野缺损。NAION 的发病人群以45 岁以上者为主,其发病突然,对视功能造成不同程度的损害,是危害中老年人视功能的重要原因之一[1]。目前仍缺乏有效改善NAION 的视功能的治疗方法[2]。本课题组前期临床观察发现归元剔络养血方能有效改善NAION 患者视力、视野,以及患者视神经血液供应[3-4],但其具体机制不明确。血管内皮生长因子(vasculaur endothelial growth factor,VEGF)在缺血缺氧情况下表达显著,广泛参与缺血性脑卒中、心肌缺血及年龄相关性黄斑变性、糖尿性视网膜病变等多种疾病,在减轻氧化应激损伤、促进血管新生、抑制细胞凋亡、保护神经等方面发挥重要作用[5-7]。VEGF 在NAION 中的作用尚不明确。本研究拟探讨NAION 大鼠VEGF 表达情况,及归元剔络养血方对VEGF 的调控作用,探讨其治疗NAION的作用机制。
1 材料与方法
1.1 实验动物
选择健康的Spargue-Dawley (SD) 雄性大鼠72 只,体重160~180 g,SPF 级别[购于北京维通利华实验动物技术有限公司,合格证号:SCXK(京)2016-0006]。由中国中医科学院眼科医院实验动物中心饲养,饲养条件:12 h/12 h 交替光暗,温度25℃,湿度55%左右,自由饮食、饮水,动物房环境保持安静、通风良好。所有实验操作遵循《北京市实验动物管理条例》,并按实验动物3R 原则给予人道关怀。实验前在散瞳条件下检查SD 大鼠双眼前节和眼底,排除屈光间质和眼底异常的大鼠。
1.2 药品、试剂与仪器
归元剔络养血方水煎剂(组成:当归、土鳖虫、黄芪、川芎、桃仁、红花、茯苓、甘草,由中国中医科学院眼科医院药剂科煎制),煎制浓缩到2 g/mL;4%水合氯醛溶液(国药集团,H37022673);复方托吡卡胺滴眼液(日本参天制药有限公司,MP2234);盐酸奥布卡因滴眼液(日本参天制药有限公司,B2121);氧氟沙星眼膏(日本参天制药有限公司,TRN3138);孟加拉玫瑰红(美国Sigma 公司,632-69-9);荧光素钠注射液(广州白云山明兴制药有限公司,10V13);苏木素-伊红(hematoxylin-eosin staining,HE)染色试剂盒(北京博奥森生物技术有限公司,C-101);VEGF免疫组化试剂盒(中国迈新,KIT-9710);大鼠VEGF酶联免疫吸附测定试剂盒(杭州联科生物技术股份有限公司,138361135)。
氪激光机(美国Lumenis 公司,532nm 激光器);眼底血管造影机(日本Topcon 公司,TRC.50DX);石蜡切片机(德国Leica 公司,RM2235);石蜡切片摊片机(德国Leica 公司,HI1210);石蜡切片烘片机(德国Leica公司,HI1220);全自动脱水机(德国Leica公司,ASO300S);光学显微镜(德国Leica 公司,DM2500);90 D 前置镜(美国Ocular 公司);全自动多功能酶标仪[赛默飞世尔科技(中国)有限公司,THERMO Multiskan MK3];电热恒温培养箱(天津泰斯特公司,DH4000A);微型震荡器(江苏其林贝尔公司)。
1.3 动物模型的建立、分组及给药
SD 雄性大鼠24 只,右眼为实验眼,采用光动力方法[8]制备NAION 大鼠模型:复方托吡卡胺滴眼液点眼散瞳;4%水合氯醛(1 mL/100 g)腹腔注射麻醉;大鼠尾静脉注入孟加拉红后,立即将大鼠置于激光机前,瞄准光对准视盘进行照射(激光参数:波长532 nm,能量75 mW,光斑直径500 μm,照射时间18 s)。注入孟加拉红与激光照射结束的时间控制在1 min 以内。随机分为模型组和中药组,每组各12只。造模第2 d 每组随机抽取4 只大鼠行右眼眼底彩色照相及眼底荧光造影检查,存在视盘水肿,视盘早期低荧光、晚期荧光素渗漏者标志造模成功,未成模者剔除。中药组每日予30 g/kg 归元剔络养血方3 mL灌胃;模型组大鼠每日给予同体积蒸馏水灌胃1次。取正常未干预SD 雄性大鼠12 只为正常组,常规饲养作为对照。给药第10 d 处死大鼠,进行实验指标测定。
1.4 视网膜、视神经组织病理学改变
给药后第10 d每组颈椎脱臼法随机处死4只大鼠,快速摘取眼球,保留约2 mm 长视神经;去除眼前节和玻璃体,视网膜视神经组织固定24 h,梯度酒精脱水、二甲苯透明后浸蜡包埋;作过视神经的矢状面连续切片,厚度4 μm切片;切片常规脱蜡、水化后行HE 染色,光学显微镜观察视神经、视网膜各层病理改变,并照相记录。
1.5 免疫组织化学法测定大鼠视网膜VEGF表达
随机选取给药第10 d 各组大鼠石蜡切片3 张,常规脱蜡,水化,抗原修复,血清封闭;一抗4℃孵育过夜,二抗室温孵育,二氨基联苯胺(3,3'-diaminobenzidine,DAB)显色5~10 min,苏木精复染后脱水、透明、封片,光镜下观察组织VEGF 的表达。应用Image-Pro Plus 6.0软件测量平均光密度值。
1.6 ELISA 法检测大鼠玻璃体和外周血VEGF 的表达
给药第10 d,各组随机选取8 只大鼠,腹腔注射4%水合氯醛(1 mL/100 g),待全身肌肉松弛,呼吸平稳;迅速摘出右侧眼球。打开腹腔,于腹主动脉抽取全血约1 mL。0.9%氯化钠注射液漂洗眼球表面血液成分;去除大鼠角膜、晶状体,取出玻璃体,置于无菌EP 管中;加0.9%氯化钠注射液,手工匀浆,制备10%匀浆液;低温低速离心,2,500转/min,时间10~15 min,取上清液制备成玻璃体组织匀浆,酶联免疫双抗体夹心法测定玻璃体内VEGF 含量。将外周血静置,离心,2,500 转/min,时间10 min;吸取上清液300 μL 至EP管。应用酶联免疫双抗体夹心法测定血清VEGF含量。
1.7 统计学方法
采用SPSS20.0 统计学软件进行处理,计量资料以均数±标准差()表示,采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 眼底形态学改变
造模第2 d,眼底彩色照相(图1)显示NAION 大鼠视盘边界模糊;视网膜荧光血管造影显示视盘脉络膜充盈不良,视盘血管异常荧光素渗漏(图2),与NAION临床表现一致。
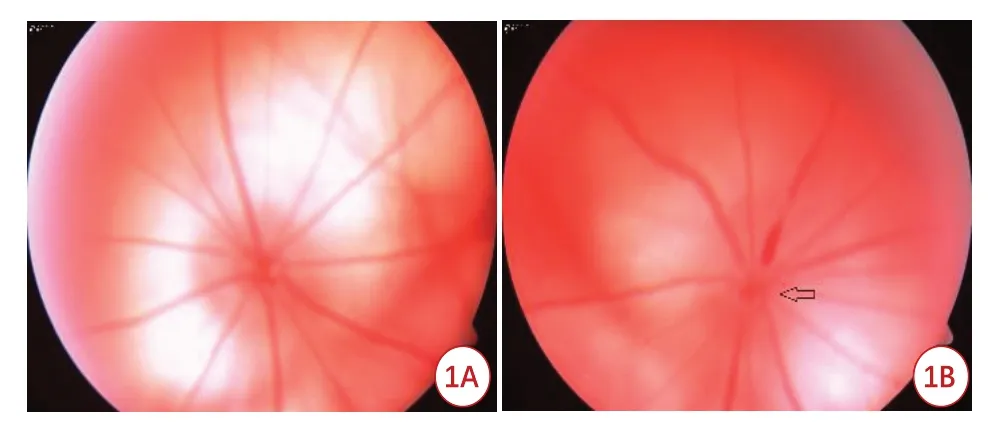
图1 NAION模型大鼠眼底形态学改变。
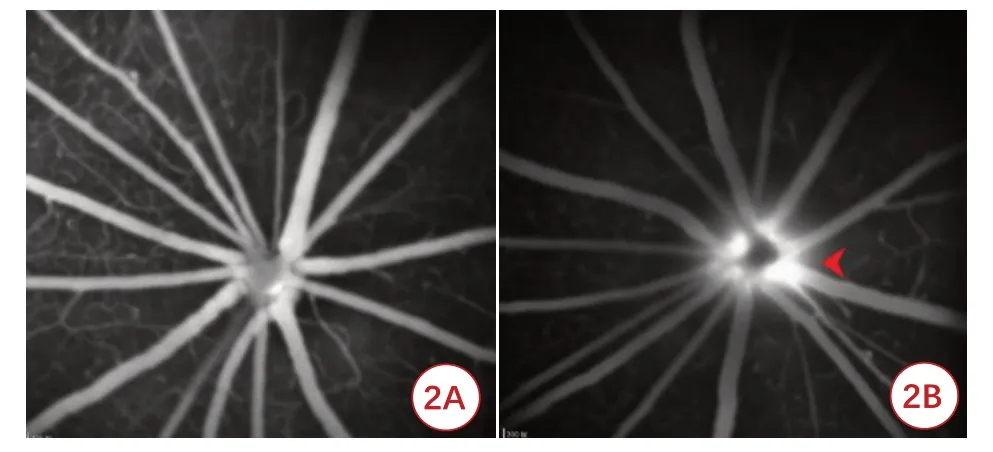
图2 大鼠视网膜荧光血管造影
2.2 大鼠视网膜组织病理学改变
HE 染色显示正常大鼠视网膜外核层(outer nuclear layer,ONL)、内核层(inner nuclear layer,INL)、视网膜神经节细胞(retinal ganglion cells,RGCs)、视神经纤维层(retinal nerve fiber layer,RNFL)各层组织结构完整,层次清晰,RGCs 排列有序、致密,RNFL 平铺于RGCs 表面;10 d 时,模型组RNFL 水肿、RGCs 丢失 明显;中药 组RNFL 水肿,RGCs少量丢失(图3)。
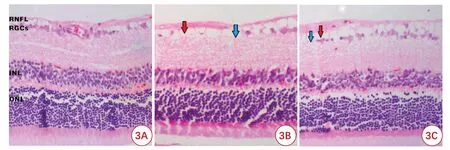
图3 3组大鼠视网膜组织病理学改变(HE染色,×200)
2.3 大鼠视网膜VEGF表达
正常组大鼠浅层视网膜血管有少量VEGF 表达。模型组、中药组浅层视网膜血管、视网膜色素上皮(retinal pigment epithelium,RPE)层可见VEGF表达(图4)。

图4 3组大鼠视网膜VEGF表达(免疫组织化学染色,×200)
组间视网膜VEGF 平均光密度差异存在统计学意义(F=19.851,P=0.004);模型组视网膜VEGF 平均光密度(0.17±0.02)较正常组(0.07±0.02)升高(t=6.299,P=0.001);中药组视网膜VEGF 平均光密度(0.13±0.01)高于正常组(t=3.646,P=0.015),低于模型组(t=-2.966,P=0.031),均有统计学意义。
2.4 ELISA 法检测大鼠玻璃体和外周血VEGF 的表达
组间血清VEGF 浓度存在统计学差异(F=5.440,P=0.018);模型组血清VEGF浓度较正常组升高(t=2.803,P=0.014);中药组血清VEGF 浓度较模型组降低(t=-2.787,P=0.015),差异均有统计学意义。中药组与正常组差异无统计学意义(P>0.05)。而3 组间玻璃体VEGF 浓度比较无统计学意义(P>0.05)(表1)。
表1 各组大鼠玻璃体、外周血VEGF浓度比较(,pg/mL,n=8)
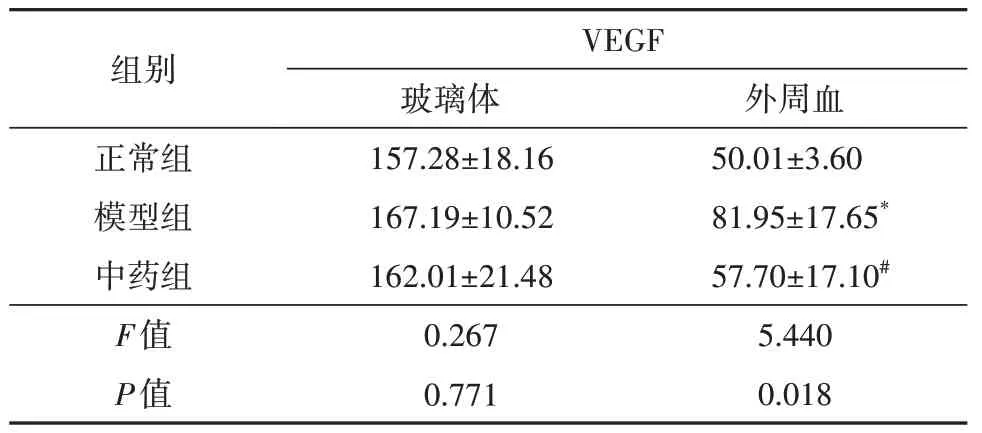
表1 各组大鼠玻璃体、外周血VEGF浓度比较(,pg/mL,n=8)
注:*与正常组比较,P<0.05;#与模型组比较,P<0.05;VEGF血管内皮生长因子
3 讨论
VEGF 作为内皮细胞的特异因子广泛作用于肿瘤、缺血性疾病及炎性病变等。VEGF 家族包括VEGF A-F、胎盘生长因子(placenta growth factor,PlGF)和内分泌源性血管内皮生长因子(endocrine gland-derived vascular endothelial growth factor,EGVEGF)[9]。VEGF受体包括VEGFR-1、VEGFR-2、VEGFR-3。VEGF 的作用主要有:(1)促血管生成。VEGF 不仅参与胚胎时期的血管发育。在肿瘤、炎症、缺血、缺氧状态下,内皮细胞、肿瘤细胞、巨噬细胞、RPE 细胞、视网膜Müller 细胞、胶质细胞等分泌VEGF-A。VEGF-A 是最强的促血管生成因子。VEGF-A 与VEGFR-1相互作用,通过激活蛋白激酶B(protein kinase B,PKB/Akt)、磷脂酰肌醇3-激酶/蛋白激酶B(phosphoinositide 3-kinase/ protein kinase B,PI3K/Akt)、丝裂原活化蛋白激酶/细胞外调节蛋白激酶 (mitogen-activated protein kinase/extracellular signal-regulated kinase,MAPK/ERK)等途径,促进血管内皮细胞、单核细胞、巨噬细胞、造血干细胞等趋化和迁移。VEGF-A 与VEGFR-2 结合,通过多种通路,参与内皮细胞的增殖;通过激活PI3K/Akt 信号转导通路,抑制内皮细胞凋亡。通过以上一系列步骤,VEGF 促进了血管形成相关细胞的增殖和迁移,诱导了病理性血管的形成。在疾病中,病理性血管生成可以增加血流灌注,改善血氧供应[10]。但同时由于其结构不完善,存在引发出血、水肿,或促进肿瘤生长等问题。(2)增加血管通透性。VEGF-A、VEGF-E 与VEGFR-2 结合,作用于某些整合素,破坏细胞之间的连接,诱导内皮细胞形成窗孔,增加血管通透性;或通过激活Akt 激酶,促进内皮细胞生成一氧化氮(nitric oxide,NO),进而扩张血管,增加血管通透性。血管通透性的增加为细胞迁移、血管生成创造条件,但同时导致血浆大分子外渗[11],加重组织水肿、炎症反应加重。VEGF增加毛细血管通透性的作用是组胺的5 万倍。(3)保护神经元,①抑制神经元凋亡,VEGF-A、VEGF-B 可以拮抗RGCs 凋亡[12]。VEGFR-2R/PI3K/Akt是抑制神经元凋亡的重要信号转导通路[13];②促进神经元再生,VEGF 可以直接促进神经干细胞的增生,或者促进胶质细胞转分化为新生神经元[14-16]。(4)促进淋巴管的生长。VEGF-C、VEGF-D 有促进淋巴管生长的功能。
综上分析,VEGF 具有促血管生成、增加血管通透性、保护神经、促进淋巴管生长的重要作用。眼部视网膜血管内皮细胞、RPE 细胞、Müller 细胞、星形胶质细胞、RGCs 都可以分泌VEGF[17]。在年龄相关性黄斑变性、糖尿病性视网膜病变及视网膜静脉阻塞等眼病中VEGF 均扮演重要角色,通过诱导血管新生和增加血-视网膜屏障通透性[18-19],导致视网膜出血、水肿的发生,使病变加重或反复。
目前关于NAION 中VEGF 的研究尚未深入。有文献[20]报道VEGF 为影响NAION 患者的独立危险因素,与病变呈正相关。对于NAION 的抗VEGF治疗目前存在分歧[21],有研究[22]表明玻璃体腔注射康柏西普可有效降低玻璃体内VEGF-A 水平,显著提高NAION 患者的视力和视野,有效改善临床疗效。亦有实验[23]表明玻璃体腔注射抗VEGF 药物对于NAION 没有明显的治疗作用。多次抗VEGF 治疗甚至成为患缺血性视神经病变的危险因素[24]。
本次研究观察了NAION 大鼠视网膜、玻璃体、外周血中VEGF 表达的变化,及中药复方归元剔络养血方对其调节作用。根据文献[25-27]报道,在NAION、视网膜静脉阻塞、脑缺血等病变的大鼠模型中,造模后约2 周组织VEGF 表达有差异性变化。本次研究考虑中药的起效时间,以10 d 为观察点进行取样检测。研究发现模型组大鼠视网膜VEGF 表达及外周血VEGF 浓度明显高于正常组,证明在NAION 早期存在VEGF 的高表达,这与SUN 等[25]、RANGELA 等[28]的研究一致。中药组视网膜VEGF表达及外周血VEGF 浓度均较模型组降低,说明归元剔络养血方有抑制VEGF 过度表达的作用。结合视网膜组织病理表现,中药组RNFL水肿及RGCs丢失较模型组减轻,说明归元剔络养血方可能通过抑制VEGF 过度表达,减轻其增加血管通透性的作用,进而减轻水肿和炎症反应,对视神经、视网膜组织起到保护作用,抑制了RGCs 的凋亡。本次实验中,模型组玻璃体VEGF 浓度较正常组有增高的趋势,但无统计学意义;中药组玻璃体VEGF 浓度较模型组有降低的趋势,亦无统计学意义,可能与观察时间短,或者归元剔络养血方主要在血液中发挥作用有关。后续将在此基础上,研究早期NAION 中,归元剔络养血方抑制VEGF 过度表达的机制;观察VEGF 在NAION 病变过程中的动态表达,以及归元剔络养血方对它的调控作用,系统分析归元剔络养血方对VEGF的调控作用,及治疗NAION的机制。
