胜红蓟总黄酮抗氧化及其抑癌活性
2022-12-19林泽燕林燕燕刘慧丽林艺华王淑贞林姿羽
林泽燕 ,林燕燕 ,章 倩 ,刘慧丽 ,林艺华 ,王淑贞 ,林姿羽
(1.漳州卫生职业学院药学系,福建漳州 363000;2.漳州卫生职业学院海洋天然产物与活性研究实验室,福建漳州 363000;3.漳州卫生职业学院转化医学检测应用技术协同创新中心,福建漳州 363000)
胜红蓟(Ageratum conyzoidesL.)是菊科藿香蓟属,系一年生草本植物,原为入侵植物并成为农田杂草[1].胜红蓟含有丰富的黄酮类物质,目前已报道的已经有21种之多[2].在已有的文献报道中发现胜红蓟含有的黄酮类物质对多株肿瘤细胞在体外具有良好的抗肿瘤活性[3-6].而血液肿瘤当中的急性髓性白血病是目前世界上排名前十的恶性肿瘤[7],利用胜红蓟总黄酮的抗癌活性,抑制血液肿瘤细胞的增殖并促进凋亡,将为下一步寻找高效且准确的靶位药物提供坚实的实验室理论基础,为解决恶性肿瘤疾病提供新思路,并为胜红蓟的有效防控即资源利用开辟新途径.
1 材料与方法
1.1 供试材料与主要仪器
1.1.1 供试材料
胜红蓟总黄酮溶液(胜红蓟采于福建漳州芗城区芝山公园,烘干后粉碎后,用60%乙醇提取后,用石油醚除油脂和叶绿素,浓缩后用无水乙醇沉淀多糖和蛋白,离心取上清并旋蒸,再过大孔树脂D101洗脱,复旋至无醇味转至冷冻干燥机冷冻干燥成胜红蓟总黄酮粉末,用双蒸水配制成40 mg/mL母液)
总抗氧化能力(T-AOC)试剂盒、羟自由基清除能力检测试剂盒超氧阴离子清除能力检测试剂盒均购自上海优选生物科技有限公司;DPPH购自北京索莱宝科技有限公司;磷酸盐酸缓冲液和胎牛血清购自美国Sigma,CCK8试剂盒均购自大连美仑生物技术有限公司,0.22 μm滤膜购自无锡耐思生命科技股份有限公司;其他普通化学试剂均购自西陇化工股份有限公司.试验用细胞株为漳州卫生职业学院转化协同创新中心自行传代.
1.1.2 主要仪器
酶标仪以及恒温孵育箱均购自美国赛默飞世尔科技公司;恒温震荡培养箱购自上海知楚仪器有限公司;超净工作台购自苏净安泰空气技术有限公司;紫外分光光度计购自北京普析通用仪器有限责任公司;高速台式冷冻离心机购自湖南湘仪离心机仪器有限公司.
1.2 试验方法
1.2.1 胜红蓟总黄酮抗氧化能力测定
1.2.1.1 总抗氧化能力(T-AOC)测定
1)绘制标准曲线按试剂盒要求,将20 μmol/mL FeSO4标准溶液稀释至0.2、0.1、0.05、0.025、0.012 5、0.006 25、0.003 125 μmol/mL,分别取500 μL标准溶液加入试剂二,充分混匀,反应10 min,双蒸水调零,蒸馏水为空白,与593 nm 处测吸光值A,计算ΔA=A标准-A空白,此时Fe2+终浓度为0.1、0.05、0.025、0.0125、0.006 25、0.003 125、0.000 78 μmol/mL,以Fe2+终浓度为横坐标,ΔA为纵坐标绘制标准曲线,绘制标准曲线y=kx+b.
2)样品总抗氧化能力计算预热酶标仪30 min至稳定状态的期间,按说明书要求按照7:1:1将试剂一、试剂二和试剂三混合,并预热至37 ℃.
将胜红蓟总黄酮溶液稀释100倍,得到0.4 mg/mL的总黄酮溶液.按试剂盒说明书加样要求,在180 μL混合液中加入样品5 μL,混匀后反应10 min,双蒸水调零,以0.25 mg/mL 的VC 溶液为阳性对照,吸取200 μL 于96 孔板中593 nm 处测吸光值A,计算总抗氧化能力(U/mL)=(ΔA’-b)/k×V反总/V样,其中:V反总为反应总体积223 μL;V样为反应中样品体积5 μL.
1.2.1.2 超氧阴离子清除能力测定
预热酶标仪30 min,将胜红蓟总黄酮溶液稀释20倍,得到2 mg/mL的总黄酮溶液,采用黄嘌呤氧化酶法,按照试剂盒说明书操作,以双蒸水调零在530 nm 处测定吸光值,计算公式:超氧阴离子清除率I/%=(A对照管-A测定管)/A对照管×100%.
1.2.1.3 羟自由基清除能力测定
酶标仪预热30 min,将胜红蓟总黄酮溶液稀释成1.8 mg/mL,采用Fenton 反应氧化法,测定536 nm 的吸光值下降情况,按试剂盒操作说明,吸取样品50 μL进行显色反应,计算胜红蓟总黄酮羟自由基清除率:羟自由基清除率D/%=(A测-A对)/(A空--A对)×100%.
1.2.1.4 DPPH清除能力测定
精密称取0.002 g DPPH 溶于50 mL乙醇,避光保存待用.精密称取10 mg VC标准品双蒸水定容至10 mL配制成1 mg/mL的母液,精密吸取250 μL加入750 μL蒸馏水中将其稀释成0.25 mg/mL的VC对照液.分别配制0.2、0.1、0.08、0.06、0.04、0.02 mg/mL 的胜红蓟总黄酮溶液.酶标仪预热30 min,调节波长至515 nm,无水乙醇调零,在90 min测定不同浓度胜红蓟总黄酮处理组吸光值,计算DPPH清除能力:

1.2.2 胜红蓟总黄酮对白血病癌细胞增殖抑制作用
收集对数生长期的细胞,以5×103个/孔接种于96孔板,设4个重复孔,各组加入胜红蓟总黄酮溶液,使其分别成为终浓度400、200、100、50、25、12.5、6.25 μg/mL,设置不接种细胞的各药物浓度对照,以营养液为空白组,于细胞培养箱中孵育24、48、72 h.每次孵育结束后,在每孔加入10 μL CCK8 溶液,在细胞培养箱内继续孵育4 h,取出适当混匀,继续孵育2 h后在450 nm测定吸光度,计算细胞生长抑制率.
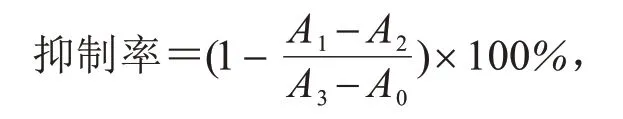
其中:A1为处理组吸光值;A2为处理组对照(即加药液未加细胞);A3为对照(即加细胞未加药液);A0为空白(即只加营养液).
2 实验结果与分析
2.1 胜红蓟总黄酮抗氧化能力测定
2.1.1 总抗氧化能力测定
按照试剂盒要求进行标准曲线绘制,得到图1(A)的吸光值y与总抗氧化能力浓度x的标准曲线为y=0.683 6x+0.000 3,R2=0.999.根据标准曲线计算不同胜红蓟总黄酮的总抗氧化能力得到图1(Β),胜红蓟总黄酮的总抗氧化能力随着胜红蓟总黄酮质量浓度(ρ)的升高而增强,其中0.1 mg/mL 胜红蓟总黄酮总抗氧化能力((5.37±1.33)U/mL)与0.05 mg/mL VC的((6.92±0.87)U/mL)无显著差异(F=0.643,t=0.970,p=0.387,df=4);当胜红蓟总黄酮浓度达到0.8 mg/mL时,其总抗氧化能力与0.25 mg/mL的VC无显著差异(F=6.565,t=1.615,p=0.169,df=4).
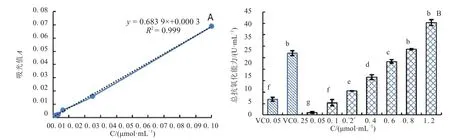
图1 胜红蓟总黄酮总抗氧化能力Fig.1 Total antioxidant capacity of total flavonoids from Ageratum conyzoides L.
2.1.2 超氧阴离子清除能力
胜红蓟总黄酮对超氧阴离子的清除能力试验结果如图2所示,胜红蓟总黄酮对超氧阴离子的清除能力随着浓度变化具双向性.在其浓度达到1 mg/mL时,超氧阴离子清除率最高为(72±1.68)%,与0.5 mg/mL时的清除率无显著性差异(F=10.521,t=0.717,df=4,P=0.513),与其它各处理组差异显著(P<0.05).其对超氧阴离子的清除率比0.25 mg/mL VC的清除率(86.67±4.91)%低,且差异显著(F=7.397,t=4.821,df=4,P=0.009).另外,胜红蓟总黄酮含量为0.2 与1.5 mg/mL 的两组处理,超氧阴离子清除能力差异不显著(F=0.427,t=0.486,df=4,P=0.652),0.2 与0.5 mg/mL处理组差异不显著,但与1 mg/mL处理组差异显著(P<0.05).
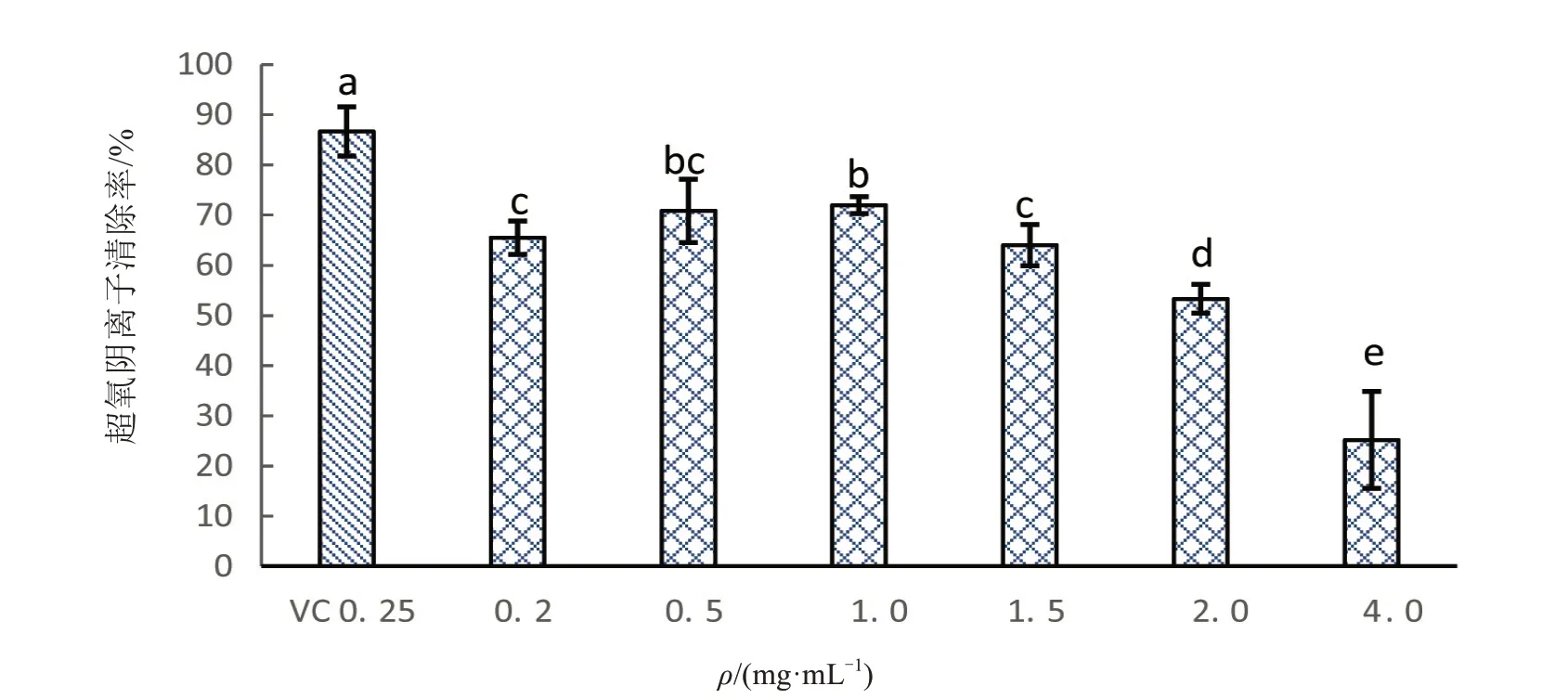
图2 胜红蓟总黄酮对超氧阴离子的清除能力Fig.2 Superoxide anion scavenging activity of total flavonoids from Ageratum conyzoides L.
2.1.3 羟自由基清除率
胜红蓟总黄酮对羟自由基的清除能力强,如图3所示.胜红蓟总黄酮浓度为1.8 mg/mL 时清除率最稳定,达到(99.48±0.40)%,与VC 0.25 mg/mL 的清除率(39.88±9.06)%比较,差异显著(F=10.94,t=6.97,df=10,P<0.001).

图3 胜红蓟总黄酮对羟自由基的清除能力Fig.3 Hydroxyl radical scavenging activity of total flavonoids from Ageratum conyzoides L.
2.1.4 DPPH自由基清除率
不同浓度胜红蓟总黄酮对DPPH 自由基的动态清除效果区别比较明显,其清除能力具有浓度依赖,6个浓度的动态清除曲线都在60 min 后到达平台期.当胜红蓟总黄酮浓度达到0.2 mg/mL 时其动态清除曲线在10~20 min区间基本与0.25 mg/mL 的VC的动态清除曲线重合,在30 min后清除率超过VC.
胜红蓟总黄酮在不同温度下对DPPH 自由基的清除能力不同,但是都随着时间的推移在增加,而VC的清除能力则比较恒定,如图4 中的Β.温度在40℃时,1.0 mg/mL 处理组的清除能力最强,25 ℃时,其清除能力最低,30和35 ℃的清除能力相当,在反应30 min后其清除率几乎相同.

图4 胜红蓟总黄酮对DPPH自由基的清除能力Fig.4 DPPH scavenging activity of total flavonoids from Ageratum conyzoides L.
2.2 胜红蓟总黄酮对血液肿瘤细胞增殖抑制作用
用不同浓度胜红蓟总黄酮对三株白血病细胞株分别进行24、48、72 h 处理,运用CCK8 法测定细胞的增殖抑制率得到如图5~7所示.三株细胞株的增殖抑制率对总黄酮均具有浓度依赖,在12.5 μg/mL处理组抑制率急剧上升,超过25 μg/mL 之后抑制率到达90%以上.胜红蓟总黄酮对KGIA 细胞系的抑制率对时间处理具有依赖性,在任一组浓度处理组中,经过24、48、72 h处理后其抑制率存在一定的梯度变化(图6).而THP-1和Kasumi-1两株细胞株的抑制率在低浓度时与时间处理有差异,高浓度无差异(P<0.05).
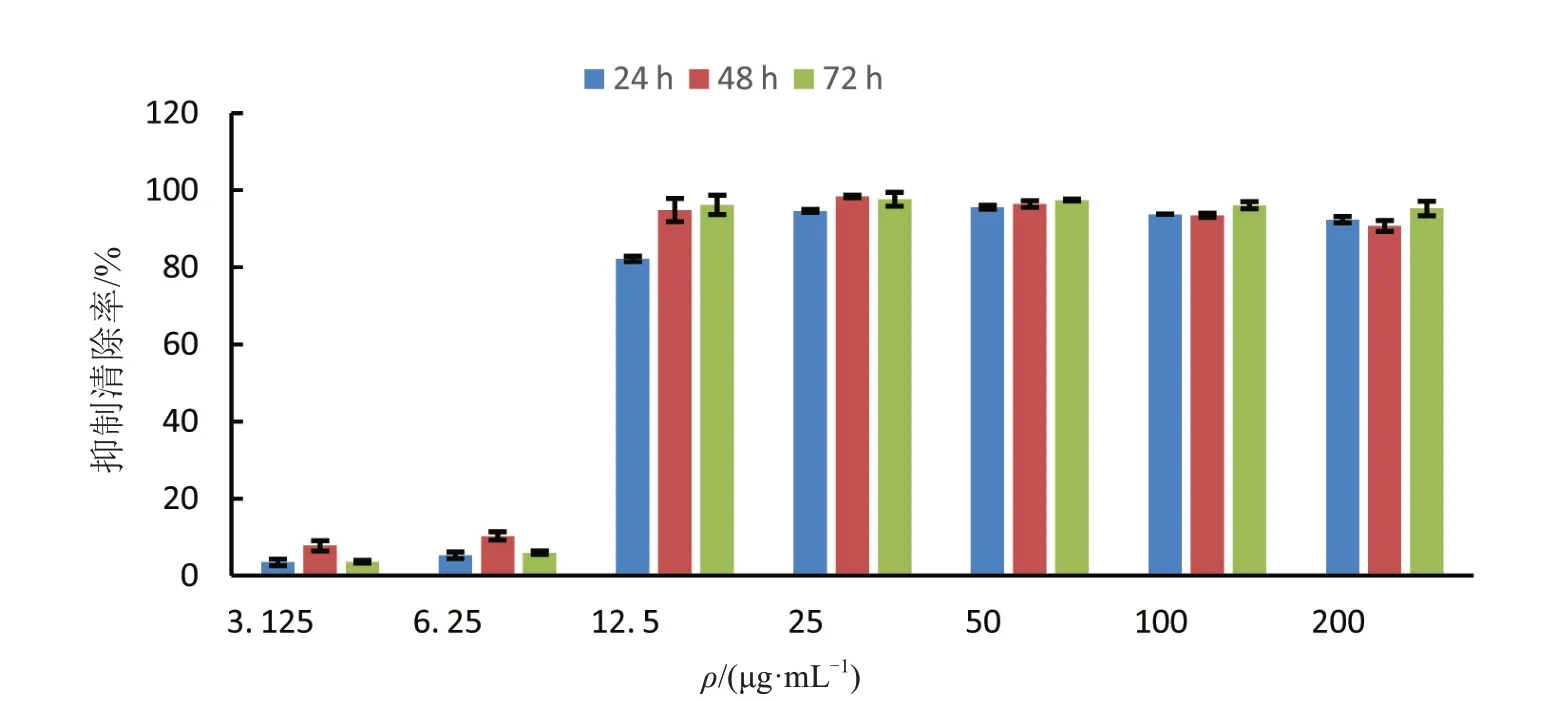
图5 胜红蓟总黄酮对人单核细胞型白血病细胞株THP-1的增殖抑制作用Fig.5 Inhibitory effect on THP-1 Cells of total flavonoids from Ageratum conyzoides L.
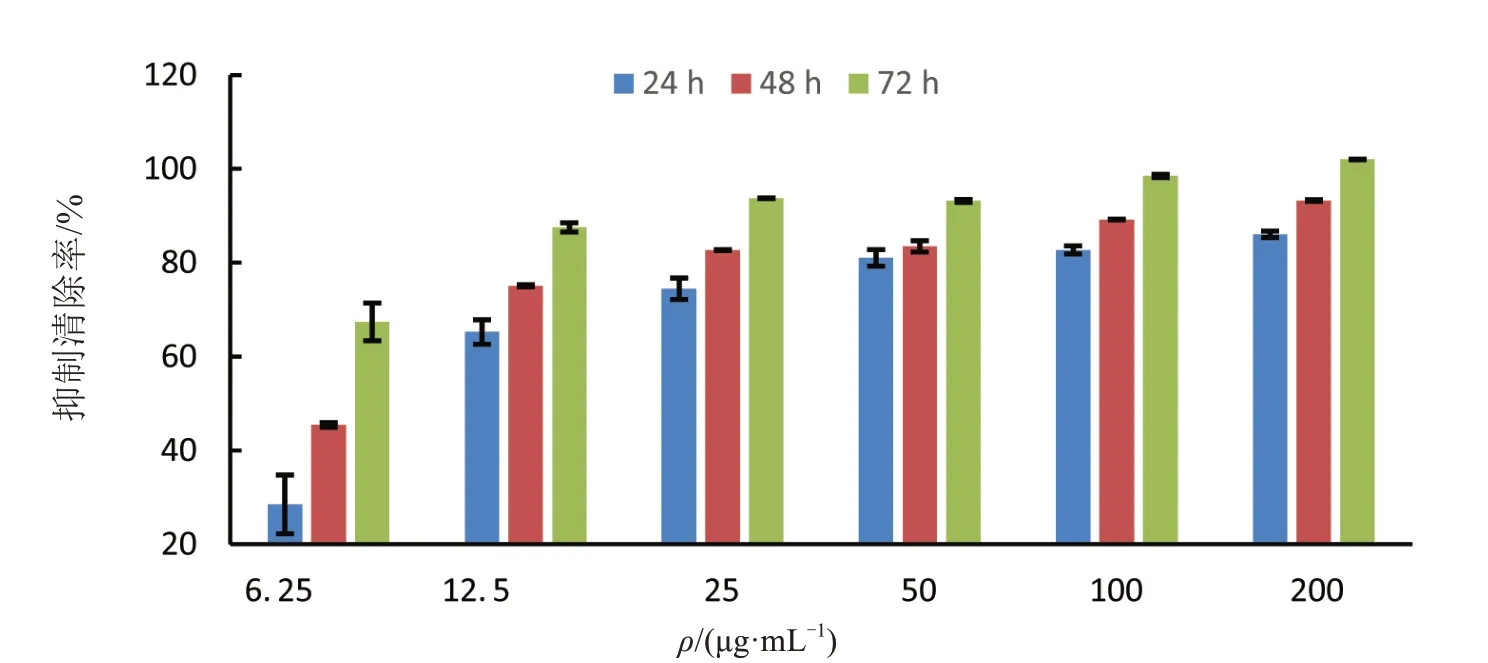
图6 胜红蓟总黄酮对人急性髓系白血病细胞株KGIA的增殖抑制作用Fig.6 Inhibitory effect on KGIA Cells of total flavonoids from Ageratum conyzoides L.
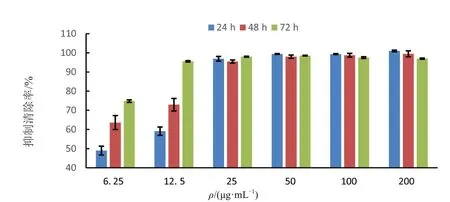
图7 胜红蓟总黄酮对人急性髓系白血病细胞株Kasumi-1的增殖抑制作用Fig.7 Inhibitory effect on Kasumi-1 Cells of total flavonoids from Ageratum conyzoides L.
通过对各细胞株不同时间组的抑制率进行曲线拟合得到曲线如表1,通过曲线求出各细胞株不同时间处理的IC50 如图8 所示.胜红蓟总黄酮对三株细胞的抑制作用明显,致死中浓度在11 μg/mL 以内.其对KGIA 和Kasumi-1 细胞株的影响随着时间的推移,浓度下降,处理72 h 的时候,致死中浓度低至3.86 μg/mL 和3.18μg/mL.对于THP-1 的影响符合逻辑斯蒂规律,48 h 和72 h 的致死中浓度相差不大,分别为9.01 μg/mL 和9.31 μg/mL.

表1 白血病细胞株不同时间处理后抑制率拟合曲线Tab.1 Fitted curves of inhibition rate of leukemia cell lines treated with different time
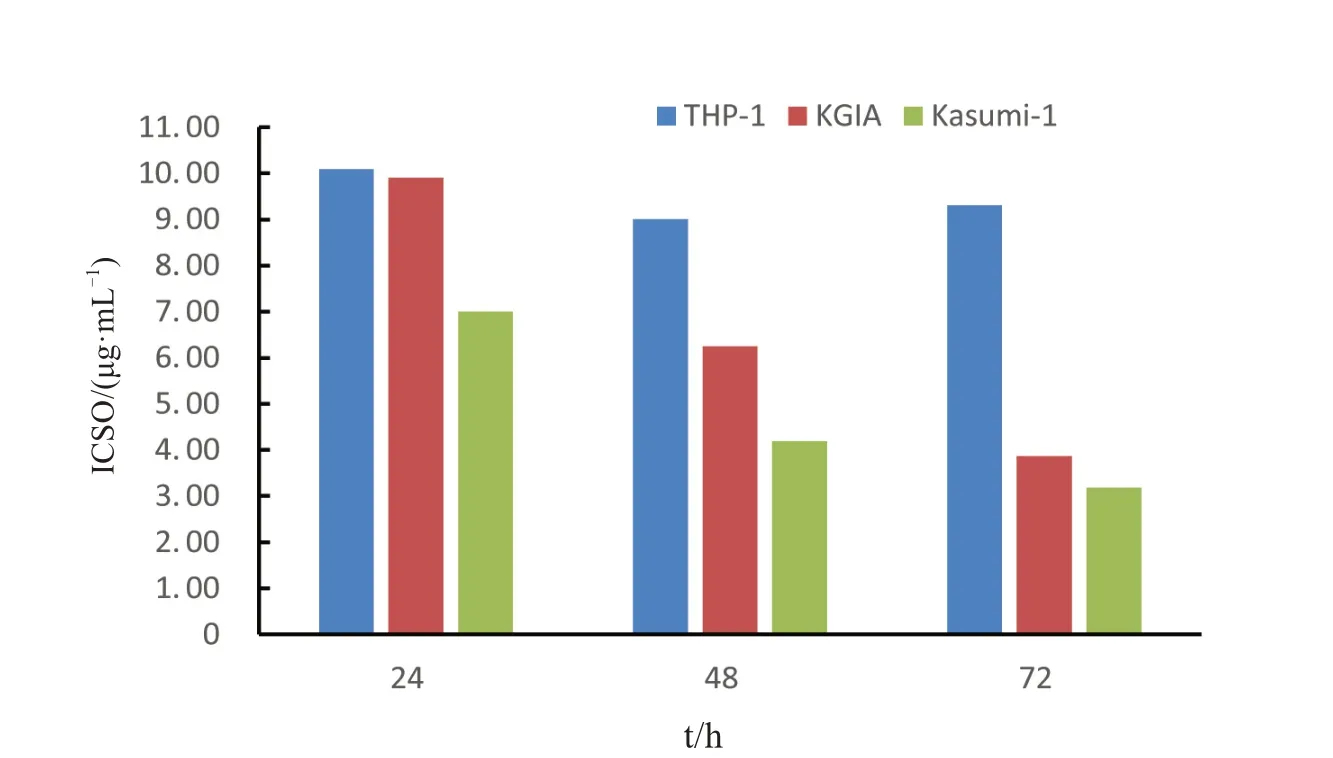
图8 胜红蓟总黄酮对三株白血病细胞株的IC50Fig.8 IC50 of total flavonoids from Ageratum conyzoides L.on the three leukemic cell lines
3 小结与讨论
目前根据文献检索,尚未见到报道胜红蓟总黄酮的抗氧化活性研究.植物黄酮具有良好的抗氧化活性[8-9],胜红蓟总黄酮的抗氧化活性测定结果也证实了这一观点.
胜红蓟总黄酮的DPPH 清除能力强,仅需含量为0.2 mg/mL 就能达到与0.25 mg/mL 维生素C 的清除能力,早在2013年黄宏妙等[10]就研究过胜红蓟的抗氧化活性,其挥发油具有良好的DPPH 清除能力,这与本次试验结果相吻合.胜红蓟总黄酮0.1mg/mL 溶液与0.05 mg/mL 的VC 溶液总抗氧化能力无差异(P<0.05)、1.8 mg/mL 的胜红蓟总黄酮溶液清除羟自由基的能力高达(99.48±0.40)%,1 mg/mL 的胜红蓟总黄酮对超氧阴离子的清除能力最强,往低浓度有浓度依赖的趋势,往高浓度则相反.
Β环上的酚羟基被认为是抗氧化的主要活性基团,而A环上的3,5位上的酚羟基以及4位上的羰基对于形成稳定的自由基中间体起到很重要的作用[11].胜红蓟多种黄酮的Β 环上含有酚羟基、A 环上的3,5 号位含有酚羟基以及大部分黄酮A 环4 号位上含有羰基[12],可能是这些酚羟基能够与自由基结合形成稳定的半醌结构,阻止其发生链式反应,表现出良好的抗氧化活性.这些结果都说明胜红蓟资源利用可通过利用其抗氧化活性来实现.
有学者认为黄酮的抗氧化活性能通过抑制脂质的过氧化所致的细胞破坏而达到抗癌抗肿瘤作用[13-14].研究结果表明胜红蓟总黄酮对三株白血病细胞株THP-1、KAIG 和Kasumi-1 细胞株的抑制效果好.Kasumi-1细胞株增殖抑制率对胜红蓟总黄酮具有浓度依赖,与其他植物黄酮对其增殖抑制率具有剂量依赖的结果相同.由此可见,胜红蓟总黄酮具有抗氧化作用所以能够抗癌.胜红蓟提取物曾被报道对几种肿瘤细胞具有抑制活性[6,15],但这几种细胞均为贴壁细胞,虽与本次研究的白血病细胞株属不同类型细胞,但也从侧面证实了胜红蓟总黄酮能够抗癌.因此抗癌活性也是可以作为胜红蓟资源利用的另一途径.
综上所述,胜红蓟总黄酮的抗氧化活性和抗肿瘤活性也可成为胜红蓟化废为宝[16]的另一依据.
