抗核抗体与主动脉壁间血肿发生的相关性分析
2022-12-19张静波史坚杨静云冉继鹏刘子腾张莎莎
张静波,史坚,杨静云,冉继鹏,刘子腾,张莎莎
(保定市第一中心医院心脏血管外科,河北 保定 071000)
主动脉壁间血肿(variants intramural hematoma, IMH)占急性主动脉综合征的5%~25%,其特征是主动脉壁内出血,无内膜瓣或假腔及内膜撕裂[1-2]。目前IMH的危险因素,包括高血压、主动脉中层异常等[1]。有研究显示,炎症反应参与了急性主动脉综合征的发生[3],而免疫反应在炎症过程中发挥关键的保护作用[4]。其次,约有1/3 IMH患者有动脉粥样硬化[5],因此,推断动脉粥样硬化可能参与了IMH的发生。研究表明,免疫调节的失调可导致动脉粥样硬化的产生[6],并且与动脉粥样硬化的不稳定有关[7]。抗核抗体(antinuclear antibodies, ANAs)作为“初始自身免疫”因子,可能与炎症反应及动脉粥样硬化有关[8]。既往研究显示,与正常冠心病患者相比,严重冠心病患者的ANAs阳性更为普遍,这种相关性可能是一个潜在的有价值的指标,ANAs阳性可能增加冠状动脉疾病的风险[7,9]。Solow等[6]报道,ANAs可能涉及不同于传统危险因素的途径,如内皮细胞和免疫系统的失调。目前尚无关于全身自身免疫反应与IMH发生的相关报道。现通过对IMH患者及同时期年龄匹配的健康患者血浆进行比较,明确ANAs与IMH发生的相关性。
1 对象和方法
1.1 研究对象
本研究纳入2018年11月至2020年7月就诊于保定市第一中心医院心脏血管外科诊断为IMH的患者88例为试验组,均行主动脉全程增强CT检查确诊[1]。排除标准:(1)已诊断的自身免疫性疾病;(2)应用免疫治疗药物;(3)甲状腺疾病;(4)慢性感染;(5)外伤;(6)肿瘤。对照组由经过年龄匹配成功的88名胸痛但经主动脉全程增强CT检查排除主动脉疾病患者组成。本文为回顾性研究,由于未涉及泄漏患者的姓名及个人情况,故无患者及家属知情同意书。本研究获保定市第一中心医院伦理委员会批准([2020]048)。本研究共收录96例IMH患者作为试验组,排除合并自身免疫疾病的患者2例,慢性感染患者1例,甲状腺疾病患者3例,外伤患者1例,肿瘤患者1例,试验组最终入选88例。对照组由同期经过年龄性别匹配成功的88名胸痛但经主动脉全程增强CT检查排除主动脉疾病患者组成,故年龄基线水平差异无统计学意义。对照组中胃食管反流病21例,胸膜炎16例,肋间神经痛20例,肋软骨炎15例,心脏神经症16例。
1.2 研究方法
收集有关人口统计学特征、合并症、生化检查和药物治疗的数据。所有患者入院后第1天空腹检测外周血ANAs水平,按Euroimmun AG免疫荧光法说明书要求检测ANAs,滴度>1∶100为阳性。比较2组间ANAs的差异。
1.3 统计学方法

2 结果
2.1 一般情况及实验室检查
试验组患者中吸烟、高血压、高脂血症、动脉粥样硬化及入院血压等发生率高于对照组,且白细胞、C-反应蛋白、高敏肌钙蛋白、D-二聚体高于对照组(表1和表2)。

表1 受试者的一般情况(n=88)
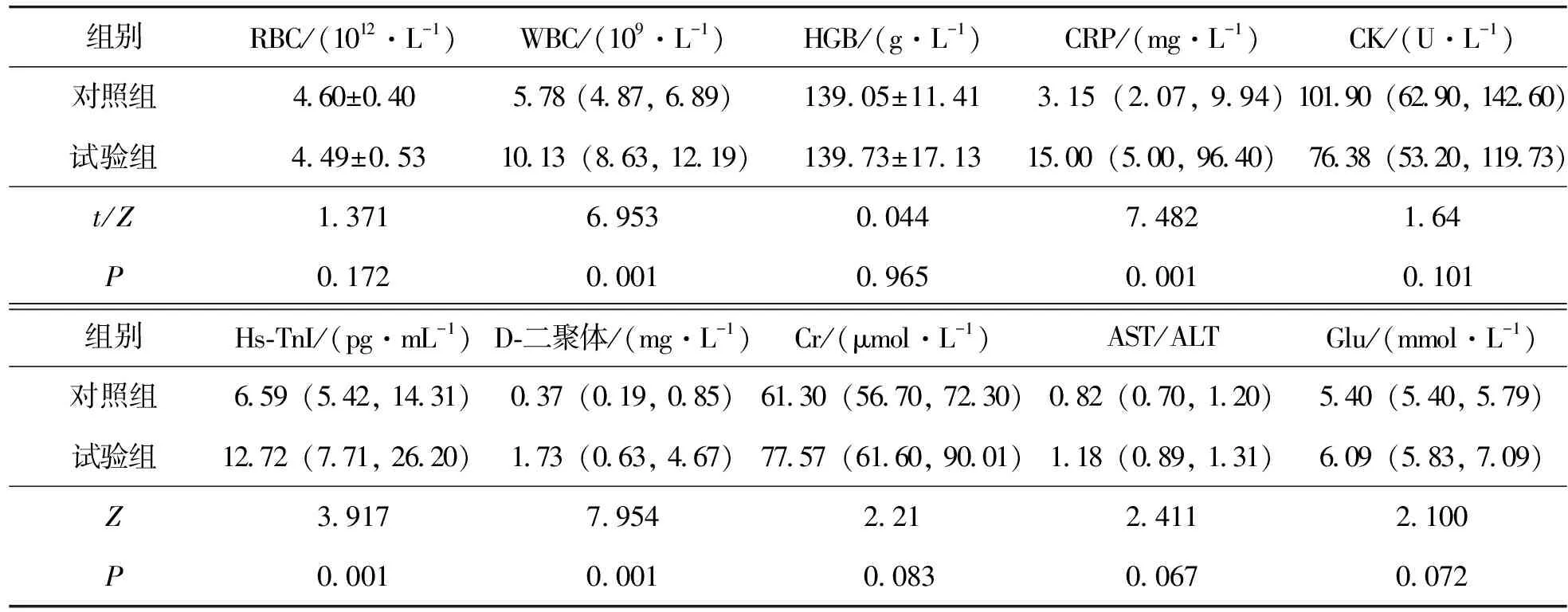
表2 受试者的实验室检查(n=88)
2.2 2组间免疫指标比较
88例对照组受试者中,16例(18.18%)ANAs阳性,3例(3.41%)抗中性粒细胞胞质抗体(antineutrophil cytoplasmic antibodies, ANCA)阳性,88例试验组中,48例(54.55%)ANAs阳性,12例(13.64%)ANCA 阳性,2组间差异有统计学意义(表3)。
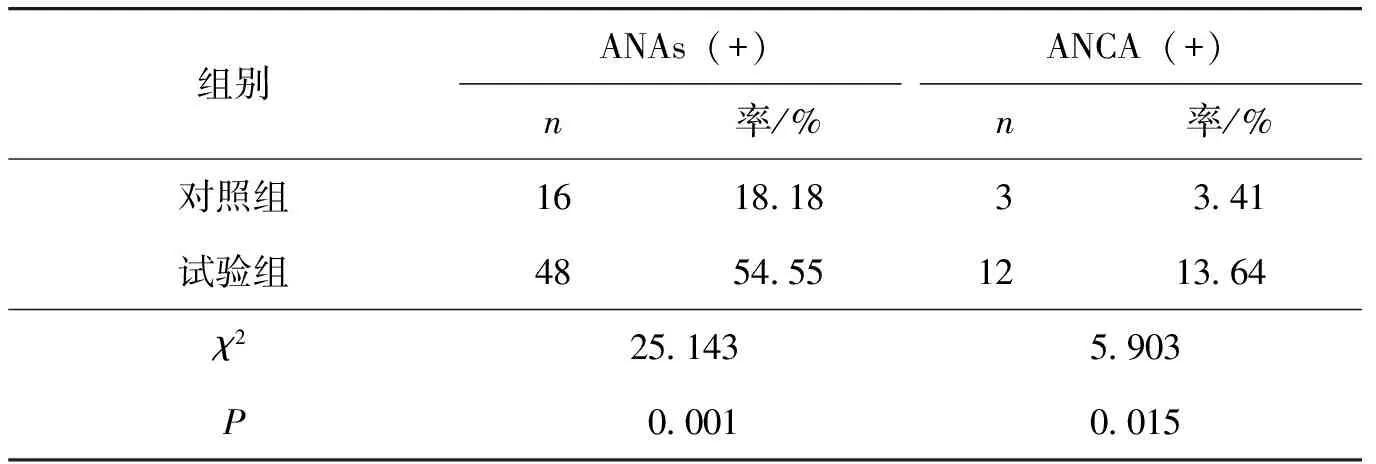
表3 2组间免疫指标(n=88)
2.3 IMH的独立危险因素
对自变量吸烟史、高血压、高脂血症、动脉粥样硬化、ANAs、ANCA进行赋值, 并将因变量存在IMH赋值为1,不存在IMH赋值为0(表4)。

表4 多元Logistic回归分析变量赋值

表5 IMH患者的危险因素
3 讨论
IMH属于急性主动脉综合征,在主动脉中膜层产生血肿,没有内膜破口及假腔形成[5]。与急性主动脉综合征一致,其发生率随年龄增长而增高,部分可进展为主动脉夹层,严重可致死亡[10]。既往研究表明,急性主动脉综合征生物标志物包括肌钙蛋白T、中性粒细胞/淋巴细胞比值、炎症因子(C-反应蛋白、白细胞介素6、肿瘤坏死因子α)、血清基质金属蛋白酶9(matrix metalloproteinase 9, MMP9)和MMP12等,但均需进一步研究,而针对IMH生物标志物的文献目前仍然缺乏[11]。
本研究中,IMH患者ANAs阳性率高达54.55%,高于对照组。考虑ANAs可能参与了主动脉内膜的损伤过程。ANAs作为自身免疫的起始因子,与人群中的全因病死率直接相关[12]。在一些重要报道中,ANAs参与了冠状动脉粥样硬化性心脏病[9]、静脉血栓性疾病[13]及周围动脉疾病[14]等血管疾病的发生发展。Pertovaara等[8]研究显示,ANAs阳性患者血管的顺应性及弹性下降,动脉壁发生了早期的结构变化。此外,有研究[6,15]表明,ANAs与血管内皮相关的可溶性血管细胞黏附因子(soluble cell surface adhesion molecules, sVCAM-1)及可溶性细胞间黏附因子(soluble intracellular adhesion molecules, sICAM-1)等密切相关,考虑ANAs可能与血管内皮相关因子共同参与了血管壁完整性的改变。
炎症反应是已知的主动脉综合征的危险因素,参与了IMH的发生发展[3]。本研究中,白细胞计数是IMH的独立危险因素。IMH发生过程中反复出现炎症反应,血管壁反复出现促炎因子,可能导致炎症调节障碍,从而进一步增加主动脉壁局部损伤,刺激循环中ANAs释放。同时,动脉粥样硬化为IMH的独立危险因素,考虑动脉粥样硬化可导致主动脉内膜完整性发生改变[16]。ANAs大量释放可能由于动脉粥样硬化急性改变所致[7]。
ANCA是一组针对中性粒细胞胞浆颗粒中主要表达的蛋白质的自身抗体。ANCA可引起中性粒细胞活化,导致小血管内皮损伤。因此认为ANCA是ANCA相关血管炎的生物标志物[17]。ANCA相关血管炎一般发生在系统性小血管炎中,大血管中发现较少。本研究中2组患者间ANCA水平差异虽有统计学意义,但水平较低,仅占13.64%,不除外假阳性结果。也有可能存在具有ANCA相关性血管炎患者,但尚未确诊。
本研究中,正常对照组ANAs阳性率为18.18%,较既往研究中保定市正常人群ANAs阳性率(14.01%)偏高[18],可能与对照组为胸痛人群,胸痛患者可能存在非主动脉综合征的其他疾病。
本研究存在一定的局限性,首先,ANAs是病因还是症状以及ANAs在预后方面的作用尚需进一步研究。其次,本研究为单中心回顾性研究,且样本量较少,故结果可能存在偏倚,尚需进一步更大规模的临床研究支持。
目前,IMH的发生与免疫因子方面的研究较少,本研究证实,免疫反应参与了IMH的发生,为未来进一步研究提供了一定的理论基础。
