实蝇高引诱性酵母菌的分离和筛选
2022-12-19张栩浩罗流河王珊珊李晓雪张宏宇
张栩浩,罗流河,王珊珊,胡 杰,李晓雪*,张宏宇*
(1.华中农业大学园艺与城市昆虫研究所,湖北洪山实验室,中澳园艺与城市有害生物联合研究中心,武汉 430070;2.湖北省十堰市丹江口市习家店镇农技中心,十堰 442706)
实蝇Tephritidae是一类重要的检疫性害虫,雌成虫通过产卵针在果实内产卵,幼虫孵化后潜伏在果皮下取食果肉,引起落果和果实腐烂,使果实失去商品价值。防治措施不当时,实蝇种群数量在几个月内迅速增长,严重影响果实的产量和品质,造成巨大的经济损失[1-4]。目前生产上防控措施主要依赖化学农药防治和性诱剂诱杀[5-6]。化学防治见效快,同时也易引发害虫抗药性(resistance)、再猖獗(resurgence)和残留(residue)的“3R问题”;性信息素引诱效果好,专一性强,但性诱剂只对雄虫有效,而未引诱到的雄虫可与多头雌虫交配,造成防治效果减弱。此外,有报道表明橘小实蝇性诱剂甲基丁香酚(methyl eugenol,ME)对生态平衡存在安全隐患,且对人类有致癌性,不适宜长期田间使用,而以ME为模板合成的衍生物不仅引诱效果差且工艺复杂[7-8]。因此,研究开发新型高效环保的实蝇绿色防治技术迫在眉睫。
微生物在昆虫协调生长、取食、免疫等方面有着非常重要的作用[9-13]。例如黑腹果蝇Drosophilamelanogaster幼虫在取食无菌食物的情况下,生长较为缓慢。补充少量酵母作为营养强化剂后,幼虫的生长发育显著加快[14]。酵母的代谢能产生多种氨基酸、甾醇、B族维生素和脂肪酸,也能进行一些解毒和简单的消化反应[15]。由于这些特性,许多昆虫在生长过程中会摄取酵母菌作为食物,例如切叶蚁会用叶子繁殖酵母菌,然后取食酵母菌和酵母菌的代谢产物[16]。酵母菌也可以帮助白蚁Termites消化半纤维素和木聚糖[17]。而多种酵母菌被报道具有引诱昆虫取食的作用。例如克鲁维毕赤酵母Pichiakluyeri代谢产物气味对昆士兰果实蝇Bactroceratryoni有一定的引诱活性[18];Kuraishiacapsulata和Lachanceathermotolerans对橄榄实蝇Bactroceraoleae具有较强的引诱活性[19]。雌雄实蝇会寻找及补充对自身有益的微生物。然而我国田间和果园环境中是否存在具有引诱活性的酵母菌有待研究。
橘小实蝇Bactroceradorsalis和南亚果实蝇Zeugodacustau在我国南方地区分布广泛且危害巨大[20]。如2008年橘小实蝇对广东省国民经济各部门造成的总损失达20.77亿元,其中直接经济损失为11.95亿元,占经济总损失的57.50%,占农业总产出的6.057‰[21]。本研究通过在实蝇为害的南方果园中采集虫果及寄主叶片上的环境酵母菌,经过分离培养纯化,单菌落鉴定以及活化菌株后,通过田间生物测定来筛选对两种实蝇具有高效引诱活性的菌株,以期为实蝇绿色防控高效引诱剂研制提供菌种资源。
1 材料与方法
1.1 虫果及环境酵母菌采集
从海南、广东、广西、江西、浙江、湖北等地实蝇发生为害的果园采集被害果实及其同株寄主叶片样品。采集样品时,优先采集果实内仍有幼虫的落果。采集果实样品后,再于同一株植物上采集叶片样品。采样地点见表1。
1.2 酵母菌的分离培养
将果实表面消毒后,用无菌手术刀将幼虫附近的果肉切出约0.50 g,置于2 mL无菌离心管中,加入500 μL无菌水和2粒无菌钢珠,于全自动快速研磨仪上70 Hz研磨20 s后,10 000 r/min短暂离心5 s,取100 μL上清液涂布在灭菌YPD (yeast extract peptone dextrose medium)培养基平板上,于黑暗条件下27℃恒温培养72 h至出现较多菌落后,挑取单菌落接种于1 000 μL YPD液体培养基中,于27℃恒温,120 r/min振荡培养48 h后得到供试菌株发酵液。

表1 受害虫果及叶片样品采样地点Table 1 Sampling locations for collecting damaged fruit and leaf samples
叶片样品用无菌手术剪剪成小段后,放入玻璃锥形瓶中,每10 g叶片加入100 mL无菌水,室温下以150 r/min振荡24 h,得到叶片样品原液。再以前述方法涂板,培养成供试菌株发酵液。
1.3 酵母菌鉴定
取5 μL菌株样品加入PCR裂解缓冲液中(Lysis Buffer for Microorganism),90℃裂解并变性15 min,离心后取上清液作为PCR模板,使用引物NL1(5′-GCATATCAATAAGCGGAGGAAAAG-3′)和 NL4(5′-GCATATCAATAAGCGGAGGAAAAG-3′)[22]对酵母的26S rDNA的D1/D2区进行扩增。将PCR产物送武汉昆泰锐生物公司进行一代测序,获得的序列在NCBI数据库中运用BLAST进行序列比对。
1.4 供试菌株对实蝇引诱活性的生物测定
供试虫源:本研究所用橘小实蝇、南亚果实蝇均为本实验室饲养种群,已连续室内传代几十代。饲养环境光周期L∥D=16 h∥8 h,温度(25±4)℃,相对湿度(70±10)%。
引诱效果测定:以灭菌YPD培养基为阴性对照,以商品圆酵母引诱剂(美国IDEALS CRAFTWORK CO,LTD公司)为阳性对照,不同菌株的发酵液作为处理,分别装在规格为直径100 mm,高215 mm的近圆筒引诱罐(漳州英格尔科技开发公司)中,每个菌株加入100 mL,设置3个重复,阳性对照以推荐剂量使用(100 mL/颗,约4.6 g/颗)。每天上午09:00在模拟田间环境约160 m2的半开放网室中,随机布置装有发酵液的诱捕罐,每次测试9个菌株并分别释放橘小实蝇、南亚果实蝇各400头,雌雄比1∶1。次日上午08:00收集诱捕罐。按照种类、性别分别统计引诱到的实蝇数量。
1.5 高引诱活性菌株的筛选
取初筛引诱效果较好的菌株进行高引诱活性菌株筛选,因半开放网室面积有限,为减少不同处理之间间距过近产生干扰,故分为两组进行试验。每天在模拟田间环境的半开放网室中测定一组菌株引诱效果。每组重复5次。每天上午09:00前随机布置诱饵并按照雌雄比1∶1的比例分别释放400头橘小实蝇、南亚果实蝇。次日上午08:00收集诱捕器,并于09:00前布置下一次试验。然后按照实蝇种类、性别分别统计引诱瓶内的实蝇数量。测定完成后,每组选出引诱活性较好的3株菌株,合计6株菌株。按上述方法再次测定引诱活性。
1.6 数据处理方法
酵母菌菌种数据处理参考苏宇乔等[23]的方法。
Simpson多样性指数(Simpson’s index of diversity,C)计算公式如下:
其中C表示Simpson多样性指数,i为样品内菌种数量,Ni为样品内该菌种的菌株数量,N为样品所含菌株数量。C越大,说明该样品的菌种丰富度和均匀度越大,多样性越好。
为了评价单个菌种在样品中的分布情况,采用了Berger—Park优势度指数(D),其计算公式如下:
其中D表示优势度指数,Nmax表示该物种所有优势种群数量,NT为该地区全部种群数量。D越大,说明该菌种在该地区分布越广,优势度越大。
实蝇引诱数据处理:按照实蝇种类、性别分别统计引诱瓶内的实蝇数量。按照下列公式计算相对引诱指数和雌虫引诱率。


数据通过Microsoft Office Excel软件整理与分类,通过R4.1.2以及其中的tidyverse、agricolae、RColorBrewer程序包进行方差分析及多重比较并绘图。
2 结果与分析
2.1 不同地区虫果及叶片样品中酵母菌群落组成
从浙江、江西、海南、湖北、广西、广东省中的7个地点共计采集并分离获得357株酵母菌菌株,分属于8个属,25个种。25个菌种具体如表2所示。
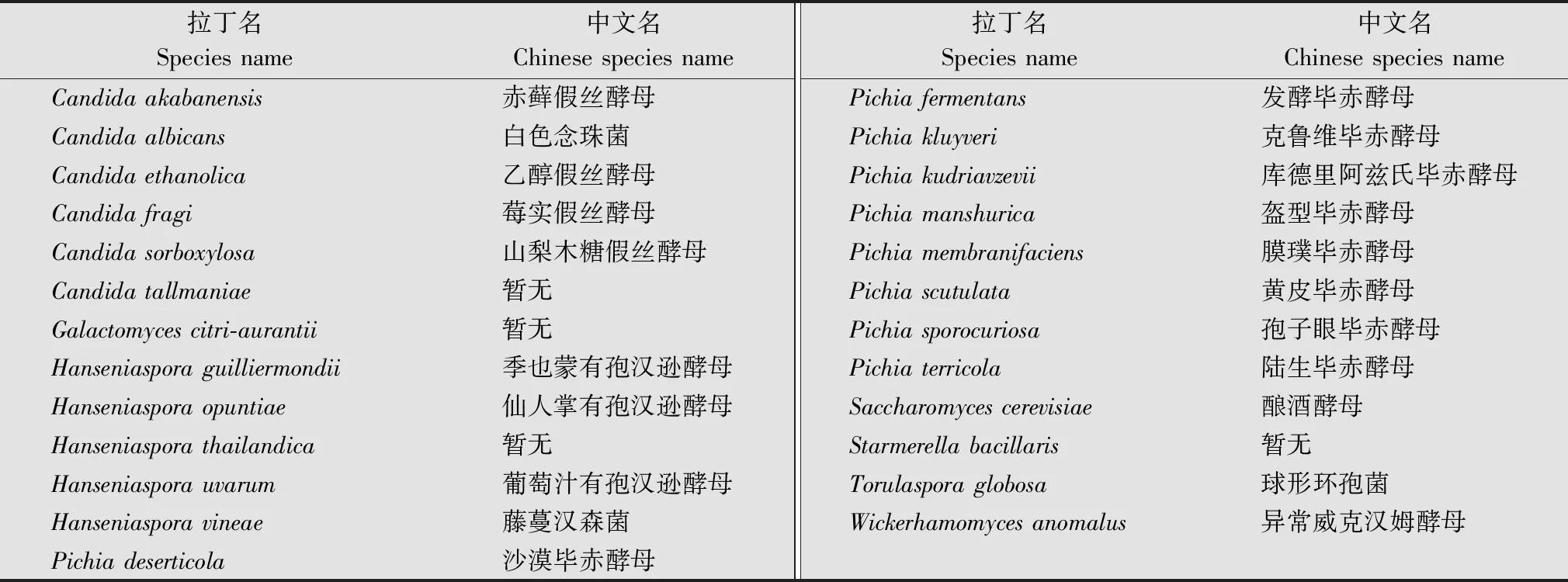
表2 所采集菌株以及种属鉴定结果Table 2 The collected strains and the results of the genus identification of the bacteria
在菌株属水平上而言,不同地区的菌株属的多样性区别较大(图1),其中湖北省武汉市样品和广西贵港市样品菌株分布最广,包含6个属。湖北武汉市样品中有假丝酵母属Candida、毕赤酵母属Pichia、有孢汉逊酵母属Hanseniaspora、有孢圆酵母属Torulaspora、子囊酵母属Galactomyces和威克汉姆酵母属Wickerhamomyces;广西贵港市样品中有Pichia、Hanseniaspora、酿酒酵母属Saccharomyces、Starmerella、Galactomyces、Wickerhamomyces;最少的广东中山市样品仅含Pichia。

图1 酵母菌属水平分布Fig.1 The distribution of yeast on genus level
采集到的所有酵母中,属水平上,Pichia酵母的分布最广,在所有7个采样地区中均能发现,在浙江台州、江西赣州、广东广州、广东中山4个采样地样品中Pichia优势度最高,分别占比61.7%、88.9%、68.3%和100%;Hanseniaspora在除广东中山市样品以外的6个样品中均有分布,该属酵母在海南三亚和广西贵港采样点样品中分别占比61.9%和53.2%。Saccharomyces仅在广西贵港样品中发现,占比2.1%;Torulaspora仅在湖北武汉样品中发现,占比49.4%,高于该地区样品中其他酵母,说明该属酵母可能是武汉市的优势酵母。
不同采样点中,海南三亚的样品Simpson多样性指数最高,为0.85,H.guilliermondii的优势度指数最高,为0.26;其次是广东广州,Simpson多样性指数为0.73,P.kluyveri的优势度指数最高,为0.45;广西贵港与浙江台州样品的Simpson多样性指数均为0.72,广西贵港样品中优势度最高的菌种为H.opuntiae,优势度指数为0.49,浙江台州样品中优势度最高的菌种为P.kudriavzevii,优势度指数为0.32;湖北武汉的样品Simpson多样性指数为0.70,T.globosa优势度指数最高,为0.49;广东中山样品的Simpson多样性指数为0.46,优势菌种为P.kudriavzevii,优势度指数为0.68;江西赣州样品的Simpson多样性指数为0.20,优势菌种为P.kudriavzevii,优势度指数为0.89(图2,表3)。

图2 酵母菌种水平分布Fig.2 The distribution of yeast on species level
在采集的所有酵母菌中,优势种是H.opuntiae,优势度指数为0.22;其次为P.kudriavzevii,优势度指数0.21。其中虫果分离的酵母菌优势种是P.kudriavzevii,优势度指数为0.29;其次为H.opuntiae,优势度指数0.17;叶片分离的酵母菌优势种是H.opuntiae,优势度指数为0.30;其次为P.kluyveri,优势度指数为0.18。
2.2 酵母菌各菌株发酵液对南亚果实蝇的引诱活性
357株酵母菌发酵液对南亚果实蝇的相对引诱指数及雌虫引诱率结果表明,对南亚果实蝇相对引诱指数大于等于1的酵母菌菌株有22株;相对引诱指数0.5~1之间的有33株;相对引诱指数低于0.5的有302株,其中有127株菌株相对引诱指数低于0.1。挑选出的12株引诱活性较高的酵母菌如表4所示。

表3 不同采样点的Simpson多样性指数Table 3 Simpson’s diversity index of different sampling site
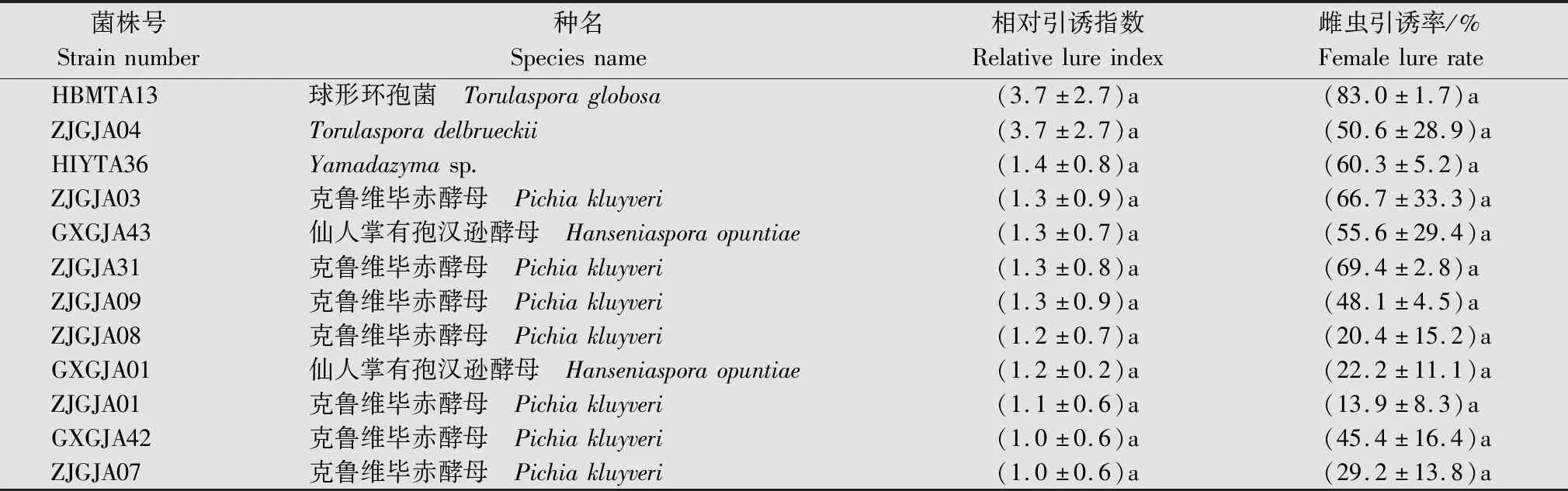
表4 对南亚果实蝇引诱活性较高的酵母菌相对引诱指数和雌虫引诱率1)Table 4 Relative lure index and female lure rate of yeast with high lure activity against Zeugodacus tau
2.3 酵母菌菌株发酵液对橘小实蝇的引诱活性
357株酵母菌发酵液对橘小实蝇的相对引诱指数方差分析可知,对橘小实蝇相对引诱指数大于等于1的菌株有142株;相对引诱指数在0.5~1之间的菌株有53株;相对引诱指数低于0.5,即引诱活性低于阳性对照的50%的菌株共有162株;还有52株菌株相对引诱指数低于0.1。挑选出的12株引诱活性较高的酵母菌如表5所示。
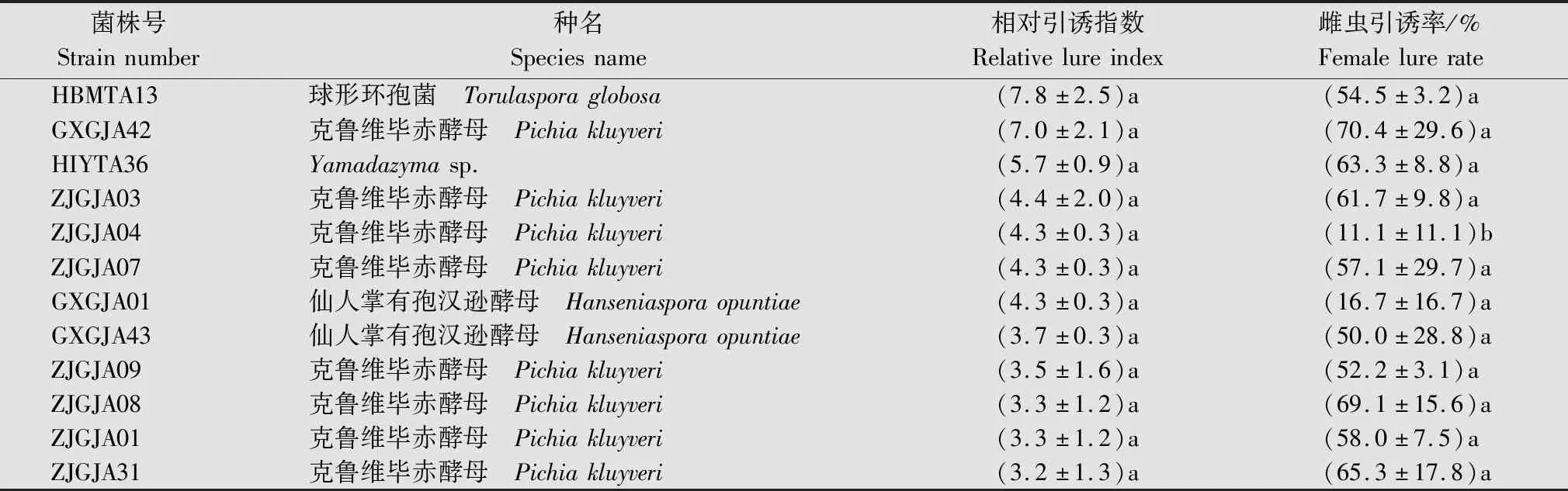
表5 对橘小实蝇引诱活性较高的酵母菌相对引诱指数和雌虫引诱率Table 5 Relative lure index and female lure rate of yeast with high lure activity against Bactrocera dorsalis
2.4 对南亚果实蝇高引诱活性的酵母菌菌株发酵液引诱活性复测结果
将筛选出的12株对南亚果实蝇具有较好引诱活性的菌株分两组进一步进行竞争性生物测定,结果表明,第一组较好引诱活性菌株中,ZJGJA31菌株的引诱活性最好,引诱数量为(10.6±1.7)头/诱捕器,其次为ZJGJA08菌株(8.1±0.9)头/诱捕器、GXGJA42菌株(7.1±0.9)头/诱捕器。第二组较好引诱活性菌株中,HBMTA13菌株引诱活性最好,引诱数量为(6.8±1.1)头/诱捕器,其次为HIYTA36菌株(4.7±1.2)头/诱捕器、ZJGJA01菌株(4.3±0.5)头/诱捕器(表6)。

表6 高引诱活性菌株对南亚果实蝇的引诱效果Table 6 Effect of the strains with high lure activity to Zeugodacus tau
2.5 对橘小实蝇高引诱活性的酵母菌菌株发酵液引诱活性复测结果
将筛选出的12株对橘小实蝇具有较好引诱活性的菌株分两组进行竞争性生物测定,进一步筛选结果表明,第一组中,ZJGJA31菌株对橘小实蝇的引诱活性最好,引诱数量为(9.1±1.1)头/诱捕器,其次为ZJGJA09菌株(8.3±0.7)头/诱捕器、GXGJA01菌株(7.6±0.8)头/诱捕器;第二组中,HBMTA13菌株显著好于其他菌株,引诱数量为(23.0±2.9)头/诱捕器。其次是GXGJA43菌株(10.6±2.0)头/诱捕器、HIYTA36菌株(10.4±2.8)头/诱捕器(表7)。

表7 高引诱活性菌株对橘小实蝇的引诱效果Table 7 Effect of the strains with high lure activity to Bactrocera dorsalis
3 结论与讨论
本研究通过分离实蝇为害的虫果、叶片样品中的酵母菌菌株,共分离出357株酵母菌,归属于25个种。相比于其他研究[24-26],我们获得了较丰富的菌株资源,且从海南、广东、广西、江西、浙江、湖北多个省市的柑橘、番石榴、杨桃等多个寄主植物取样具有较大的广泛性,单克隆菌落通过分子鉴定结果有较高的可靠性。
除江西赣州、广东中山样品外,其余样品的Simpson多样性指数较高,均大于0.70,表明实蝇生存的环境中具有较多的酵母菌。这种多样性可能与实蝇在野外取食过程中被动扩散了酵母菌有关,有些微生物通过散发气味、诱导植物发生畸变等措施引诱昆虫取食植物,昆虫取食植物的时候携带上自己的菌体或者孢子,从而达到扩散传播的目的[27]。可能正是这种关系使得一些微生物对昆虫具有一定的吸引能力,这与其他学者的报道相似[28]。从菌株属水平的分布来看,Pichia酵母和Hanseniaspora酵母在我国浙江、江西、海南、湖北、广西、广东均可发现。各属酵母菌基本上在两个地点以上的样品中出现,说明酵母菌在不同地区的扩散范围较广,实蝇的扩散与酵母菌的传播之间可能存在协同进化或其他关联,需要进一步验证。
大部分分离菌株对实蝇具有一定引诱能力,但引诱能力差异较大。通过田间初筛,我们从357株酵母菌中筛选获得12株较高引诱能力的菌株,进一步筛选获得对南亚果实蝇和橘小实蝇引诱效果均较好的2株酵母菌P.kluyveriZJGJA31和T.globosaHBMTA13,分别属于毕赤酵母属和有孢圆酵母属。酵母菌可能存在实蝇发育所必需的物质,这些物质可能是引诱实蝇前来取食的关键因素。例如酵母菌或酵母菌的挥发物能够促进雌性实蝇发育及产卵[18]。P.kluyveri,Yamadazymasp.,T.delbrueckii,H.opuntiae对橘小实蝇幼虫生长发育有促进作用,可能作为食物来源而吸引实蝇[29]。采集到的菌株对橘小实蝇的引诱能力比对南亚果实蝇的引诱能力更强一些。这可能是由于大多数菌株的来源都是橘小实蝇寄主有关,但同时也说明南亚果实蝇也会被来自于非寄主植物的酵母菌所吸引,为研制出对橘小实蝇和南亚果实蝇通用的酵母菌源引诱剂提供了可能。从雌虫引诱率来看,对实蝇引诱能力强的菌株,其引诱到实蝇中雌虫的占比不一定高。后期选择菌株开发为引诱剂时,在引诱能力相近的情况下,应当优先选择雌虫引诱率较高的菌株,提高防治效果。此外本试验未对实验室饲养种群环境酵母菌与野外采集的酵母菌进行对比,需进一步确认酵母菌来自寄主环境还是实蝇本身。
本研究筛选获得的实蝇高引诱性酵母菌株具有良好的广谱适用性和潜在的开发价值,为后续开发实蝇高效饵剂提供了必要的菌种资源,在后续研究中将进一步进行活化,进行大规模发酵培养,研制最佳剂型,最终投入实际生产中,为实蝇绿色高效防控奠定资源和技术基础。
