梨火疫病菌对噻唑锌及其他几种杀细菌剂的敏感性
2022-12-19白雪莹热孜亚麦麦提吕天宇
白雪莹,热孜亚·麦麦提,蔡 超,2,吕天宇,盛 强,罗 明,2*
(1.新疆农业大学农学院,乌鲁木齐 830052;2.新疆维吾尔自治区高校农林有害生物监测与安全防控重点实验室,乌鲁木齐 830052;3.新疆巴音郭楞蒙古自治州农业科学研究院,库尔勒 841003)
梨火疫病是严重危害梨、苹果、山楂、海棠等仁果类果树生产的毁灭性细菌病害[1],被我国列为一类农作物病害和进境植物检疫性有害生物[2-3]。该病害1780年首次发生于美国纽约州,现已扩散传播到60多个国家和地区[4]。我国于2016年首次在新疆伊犁发现梨火疫病,2017年该病在新疆巴州发生暴发流行并迅速蔓延,近几年已传至甘肃张掖和武威地区[5-6]。国外对梨火疫病已有超过200年的研究历史,但该病害的病原菌传播速度快,传播途径多样,用于病害防治的效果优良、环境安全和无系统性药害的专用登记注册药剂欠缺,至今仍然是果树病害防治中的难题[7]。目前化学防治是梨火疫病最主要的防治手段,其中抗生素和铜制剂发挥了重要作用[8]。农用链霉素曾经是梨火疫病防治的最佳药剂,在果树开花期喷施,对保护花器,显著降低病原菌菌源量、减少初侵染发生的效果显著[9]。但它的普遍使用导致了病原菌抗药性菌系的产生,使防效大大降低[10]。在我国农用链霉素2016年已经停止生产并退出了农药市场。铜制剂作为广谱杀菌剂对梨火疫病具有一定的防效,但存在易对叶片和果实产生药害的缺陷,已有多种植物病原细菌对铜离子产生了抗性[11]。筛选和研发出新型的高效杀菌剂,阻断梨火疫病的进一步传播扩散,是保障林果产业健康发展的当务之急。
噻唑锌是我国自主研发创制的新农药,是防治农作物细菌性病害的新一代高效、低毒、安全的噻唑类农用杀菌剂[13],对水稻细菌性条斑病(病原Xanthomonasoryzaepv.oryzicola)、水稻白叶枯病(病原Xanthomonasoryzaepv.oryzae)和柑橘溃疡病(病原Xanthomonasaxonopodispv.citri)等细菌性病害具有良好的防治效果并已在生产中推广应用[14]。针对梨火疫病菌Erwiniaamylovora,课题组通过室内毒力测定、温室盆栽苗生物测定和果园防效试验,明确了该药剂具有显著的抑菌作用和较好的防病效果。2021年噻唑锌获得了梨火疫病防治药剂的登记认证,同时获批登记的有春雷霉素和噻霉酮等药剂,但都未大面积使用。本研究采用2016年-2021年期间在新疆不同地区、不同寄主上获得的梨火疫病菌的分离菌株,建立梨火疫病菌对噻唑锌的敏感基线,比较不同菌株对噻唑锌的抗性差异,并分析梨火疫病菌对噻唑锌及其他药剂的敏感性差异,以期为梨火疫病防治药剂的选择和合理使用提供依据,并为田间病原菌抗药性的监测和治理提供基础。
1 材料与方法
1.1 材料
1.1.1供试药剂
96.9%噻唑锌(zinc thiazole)和84%噻霉酮(benziothiazolinone)原药,分别由浙江新农化工有限公司和陕西西大华特科技实业有限公司提供;98%硫酸农用链霉素(streptomycin)和70.2%春雷霉素(kasugamycin)原药分别购自J&K公司和陕西麦可罗生物科技有限公司。
1.1.2供试病原菌菌株
梨火疫病菌Erwiniaamylovora菌株:2016年-2020年连续5年,在新疆巴州(库尔勒市、轮台县)、伊犁州(霍尔果斯市、巩留县)、昌吉州(昌吉市、呼图壁县)、哈密地区、阿克苏地区、喀什地区、和田地区、塔城地区、阿勒泰地区和乌鲁木齐市(三坪农场、五一农场)等10个地州(区/市)的果树种植区采集具有梨火疫病典型症状的300余份病样,通过组织分离法分离菌株,经致病性测定、鉴定及保存的E.amylovora菌株145株[15]。选取其中来自不同地区、不同寄主和不同分离年份的具有代表性的50个菌株作为供试菌株,详见表1。
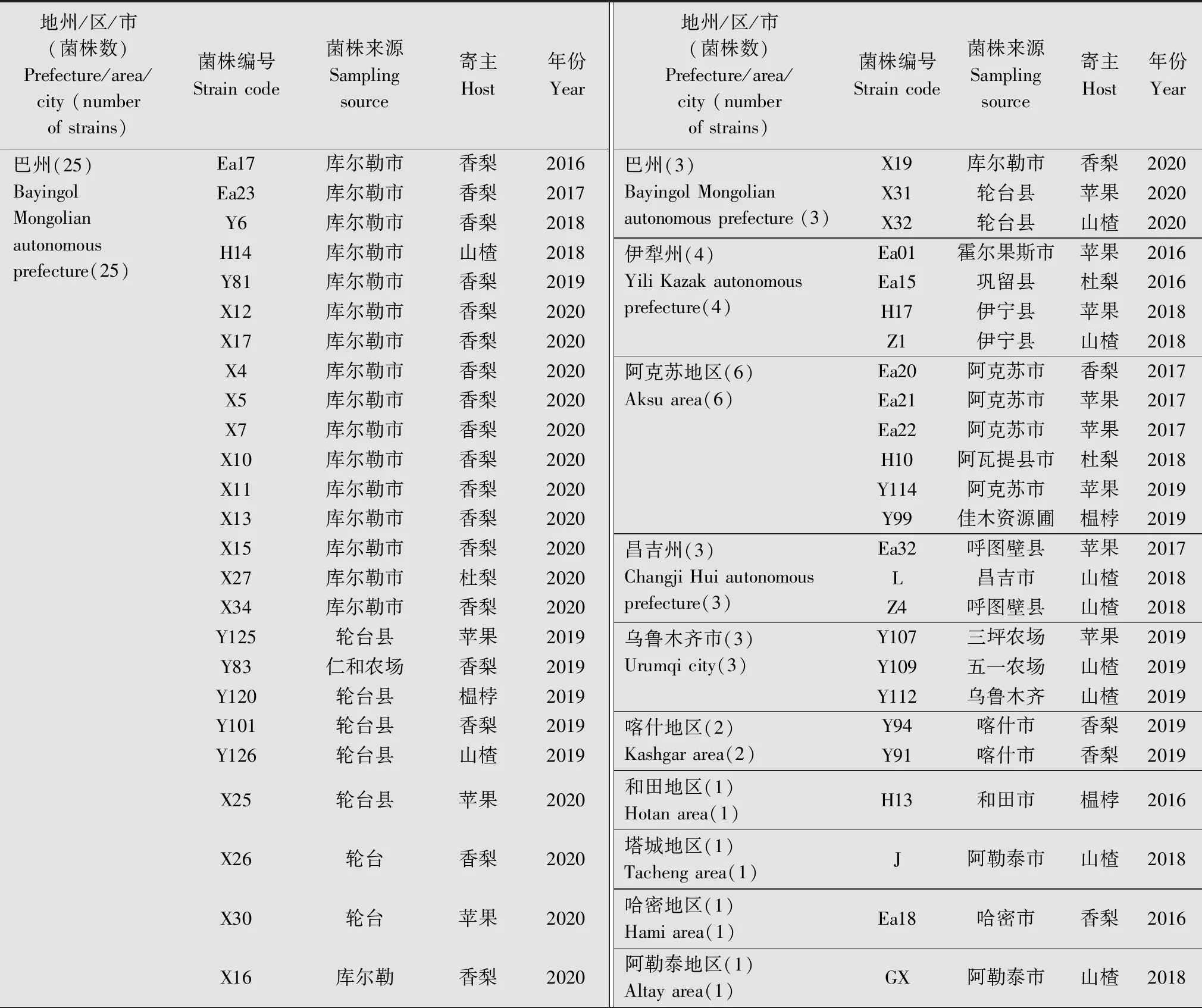
表1 供试梨火疫病菌菌株来源及分布Table 1 Source and distribution of the tested Erwinia amylovora strains isolated from Xinjiang
1.1.3培养基
营养琼脂(NA)培养基(g/L):牛肉浸膏3.0,蛋白胨10.0,氯化钠5.0,蔗糖5.0,琼脂粉18.0,pH 7.2。
营养肉汤(NB)培养基(g/L):牛肉浸膏3.0,蛋白胨10.0,氯化钠5.0,蔗糖5.0,pH 7.2。
1.2 梨火疫病菌对噻唑锌的敏感性测定
1.2.1药剂母液及稀释液配制
将噻唑锌原药加入二甲基亚砜(DMSO),在200 r/min,28℃振荡7 d溶解,获得20 mg/mL的母液,过滤除菌后室温贮存备用[16]。使用时用二甲基亚砜将母液稀释制成1 200、1 000、900、800、600 μg/mL和400 μg/mL的药液备用。
1.2.2梨火疫病菌菌悬液的制备
将供试的E.amylovora菌株接种在NA培养基平板上活化,挑取单菌落接入NB培养基中,28℃、160 r/min振荡培养12~18 h,再以1%(V/V)的接种量转接至NB培养基中,28℃,培养至OD600达到1.2左右,用无菌水将菌悬液稀释至浓度为108cfu/mL的接种液。
1.2.3敏感性测定
采用药剂-病原菌共培养+平板菌落法。在装有25 mL 灭菌NB培养液的三角瓶中,分别加入1.2.1配制的不同浓度的噻唑锌稀释液1 mL和25 μL梨火疫病菌菌悬液,在28℃、160 r/min振荡共培养24 h,以不加药剂的病原菌培养液(加入与处理等体积的二甲基亚砜)为对照。分别取药剂和病原菌共培养液以及对照1 mL,10倍梯度稀释后,取3个稀释度的100 μL稀释液均匀涂布于NA培养基平板,重复3次,28℃培养箱中培养24 h,计数菌落数,计算菌悬液中存留的活菌数(cfu/mL),统计抑制率。
抑菌率=(病原菌培养液中的菌落平均数-药剂和病原菌共培养液中的菌落平均数)/病原菌培养液中菌落平均数×100%。
1.2.4梨火疫病菌对噻唑锌的敏感基线的建立
使用DPS v 9.01和SPSS 22.0软件进行数据统计分析。以药剂有效成分浓度对数值(lg)为自变量(x),抑菌率的几率值为因变量(y),进行回归分析,计算抑制中浓度(EC50)、相关系数及95%置信限[17]。采用Kolmogorov-Smirnov检验方法,对供试菌株对噻唑锌的敏感性频率进行正态分布检验。依据野生型病原群体对药剂的敏感性为正态分布的原理,以EC50为横坐标,菌株分布频率为纵坐标,绘制敏感性频率分布柱状图,确定敏感基线[18]。
1.2.5梨火疫病菌对噻唑锌的抗性水平
依据杀菌剂抗药性行动委员会(FRAC)制定的植物病原菌对杀菌剂抗性标准的划分方法,根据供试菌株的EC50与1.2.4确定的敏感基线的比值,确定供试菌株的抗性水平[19]。
抗性水平(Rf)=供试菌株EC50/敏感性基线值。Rf<5为敏感菌株(S);5≤Rf<10为低抗菌株(LR);10≤Rf<40为中抗菌株(MR);Rf≥40为高抗菌株(HR)。
1.2.6梨火疫病菌对噻唑锌及农用链霉素、噻霉酮和春雷霉素的抗性相关性
参照成世杰等[20]的方法分析梨火疫病菌对噻唑锌及其他3种杀菌剂的抗性相关性。选取对噻唑锌敏感性较高(X16,X27,Ea15,H10)和敏感性较低的(Ea20,X13,X32,Y126) 8个E.amylovora菌株为供试菌株,分别测定其对农用链霉素、噻霉酮和春雷霉素的敏感性。98%硫酸农用链霉素原药和70.2%春雷霉素原药均用无菌水溶解制备母液,过滤灭菌后用无菌水稀释成不同浓度(1 600、800、400、200、100 μg/mL和50 μg/mL)的药液。84%噻霉酮原药用无水乙醇溶解配制成母液,过滤灭菌后用无菌水稀释成不同浓度(1 600、800、400、300、200 μg/mL和100 μg/mL)的药液。E.amylovora对噻霉酮和农用链霉素敏感性采用抑菌圈法测定[21],对春雷霉素的敏感性的测定方法同1.2.3。
将药剂的EC50转换为lgEC50,采用皮尔逊相关性系数分析梨火疫病菌对不同药剂的抗性相关性。
2 结果与分析
2.1 梨火疫病菌对噻唑锌的敏感性
供试的50个E.amylovora新疆分离菌株对噻唑锌的敏感性测定结果见表2。结果表明,不同E.amylovora菌株对噻唑锌的敏感性存在明显差异,EC50值范围为2.67~38.13 μg/mL,均值为(18.60±6.35)μg/mL。其中33个菌株的EC50在2~20 μg/mL之间,占供试菌株的66%;15个菌株的EC50在20~30 μg/mL之间,占供试菌株的30%;EC50>30 μg/mL的菌株只有2个。H10菌株(分离自阿瓦提县的杜梨)的敏感性最高,EC50为2.67 μg/mL,而Y126菌株(分离自巴州轮台县的山楂)的敏感性最低,EC50为38.13 μg/mL,二者相差13.28倍。
2.2 梨火疫病菌对噻唑锌的敏感基线
供试的E.amylovora新疆分离菌株对噻唑锌的EC50值呈现连续性变化,通过Kolmogorov-Smimov进行正态分布检验,D=0.092,渐进连续性P=0.15(>0.05),符合正态分布。所测定的E.amylovora菌株对噻唑锌敏感性分布频率呈连续的单峰曲线(图1),表明不同来源的E.amylovora分离菌株对噻唑锌敏感性较高,未发现敏感性分化的亚群体。因此,可将其EC50平均值(18.60±6.35) μg/mL作为新疆梨火疫病菌对噻唑锌的敏感基线值。

图1 新疆梨火疫病菌分离菌株对噻唑锌的敏感性频率分布Fig.1 Frequency distribution of sensitivity of Erwinia amylovora strains isolated from Xinjiang to zinc thiazole
2.3 梨火疫病菌不同分离菌株对噻唑锌的抗性水平
2.3.1不同地州(区/市)的E.amylovora分离菌株对噻唑锌的抗性水平
基于本研究建立的梨火疫病菌对噻唑锌的敏感基线,比较新疆不同地州(区/市)来源的E.amylovora分离菌株对噻唑锌的抗性水平。结果(表3)显示,巴州轮台县的E.amylovora菌株对噻唑锌的敏感性最低,EC50平均值为23.63 μg/mL,抗性水平均为1.29;其次是阿克苏、喀什、乌鲁木齐、库尔勒和阿勒泰地区的菌株,EC50平均值在17.08~20.06 μg/mL之间,抗性水平为0.92~1.09;再次是昌吉、伊犁、塔城及哈密的菌株,EC50平均值在12.34~16.07 μg/mL之间,抗性水平在0.64~0.86之间;和田的菌株对噻唑锌的敏感性最高,EC50均值最低,为12.05 μg/mL,抗性倍数为0.62。敏感性最低的轮台和敏感性最高的哈密两地菌株的EC50相差0.96倍,抗性水平相差2.08倍。同一地区的菌株的敏感性也存在差异,如阿克苏分离菌株的EC50最高值(28.57 μg/mL)和最低值(2.67 μg/mL)相差9.7倍,抗性水平相差10.86倍。
2.3.2不同寄主的E.amylovora分离菌株对噻唑锌的抗性水平
从不同寄主上分离的梨火疫病菌菌株对噻唑锌的抗性水平比较见表4。榅桲分离菌株的敏感性最低,EC50为20.66 μg/mL,抗性水平为1.14;其次是山楂和苹果上的分离菌株,EC50分别为20.58 μg/mL和20.28 μg/mL,抗性水平为1.03和1.09,二者抗性水平差异不大;香梨上分离的菌株EC50平均值为17.09 μg/mL,抗性水平1.01;杜梨上分离的菌株对噻唑锌最为敏感,其EC50平均值为6.90 μg/mL,抗性水平最低,为0.37。
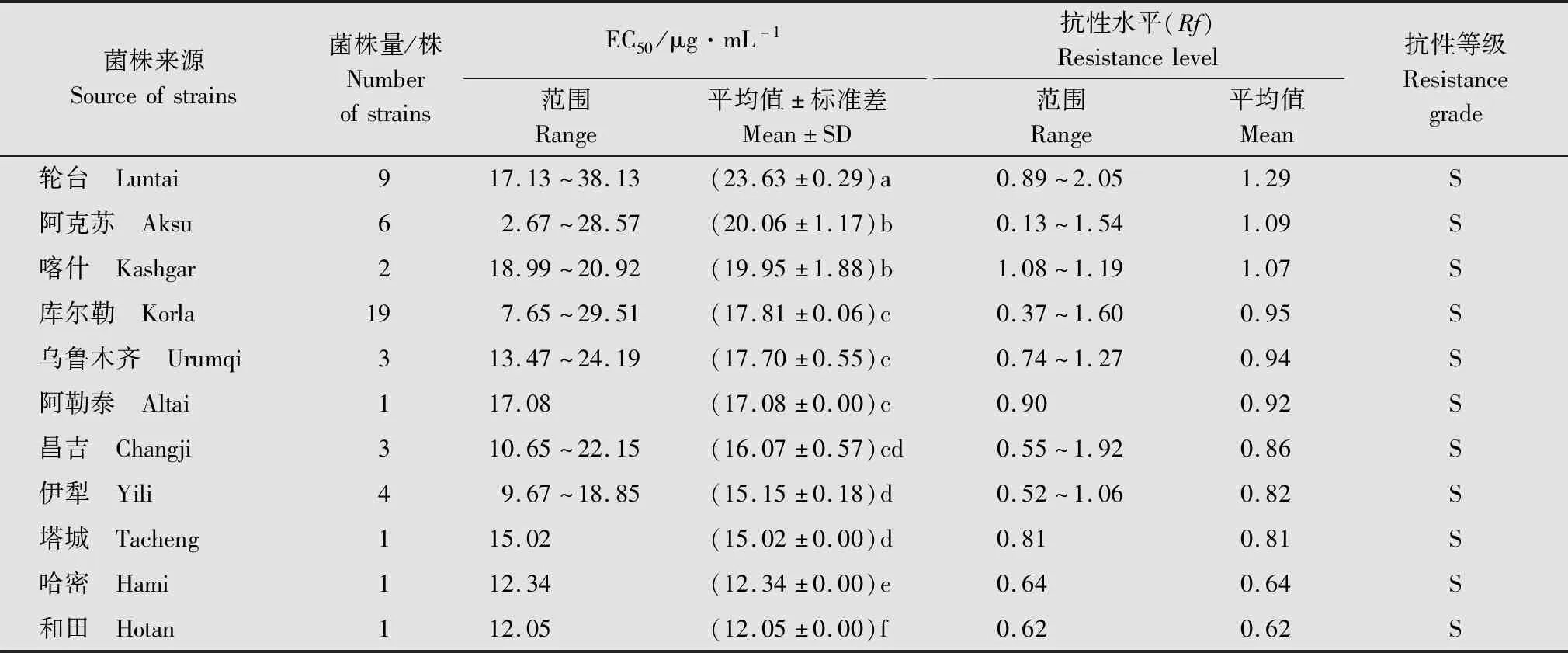
表3 不同地区分离的梨火疫病菌对噻唑锌的抗性水平1)Table 3 Sensitivity and resistance level of Erwinia amylovora strains from different regions to zinc thiazole
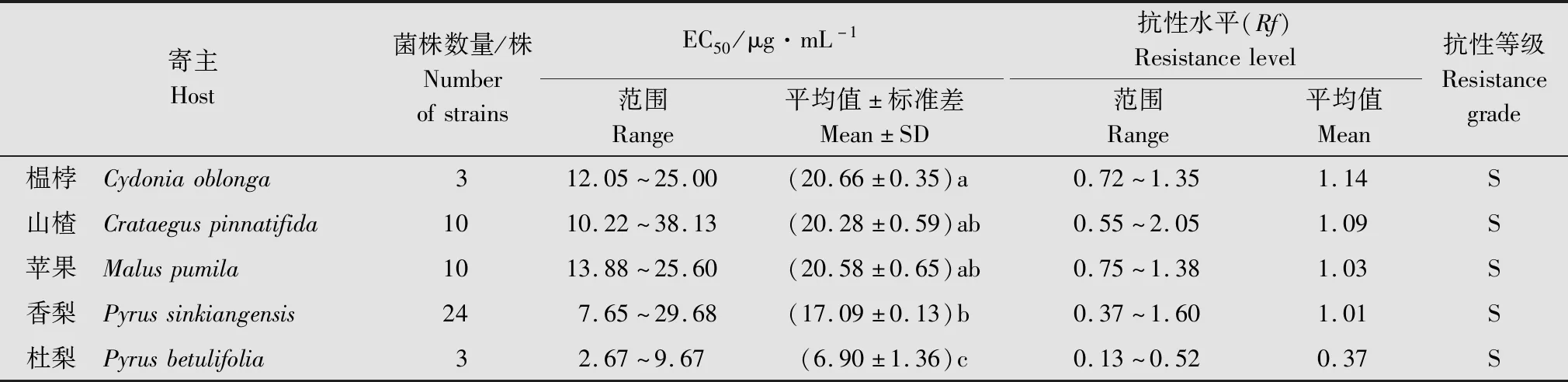
表4 不同寄主的梨火疫病菌分离菌株对噻唑锌的抗性水平Table 4 Sensitivity and resistance level of Erwinia amylovora strains from different host to zinc thiazole
2.3.3不同年份的E.amylovora分离菌株对噻唑锌的抗性水平
比较2016年-2020年分离的E.amylovora菌株对噻唑锌的抗性水平(表5)可见,噻唑锌对2016年的梨火疫病菌分离菌株的EC50均值为14.76 μg/mL,抗性水平均值为0.80;而噻唑锌对2019年和2020年分离菌株的EC50均值分别增加至21.45 μg/mL和18.33 μg/mL,抗性水平均值提高到1.16和0.99。梨火疫病菌对噻唑锌的敏感性总体呈现出随年份增加缓慢下降,抗性水平逐渐增大的趋势。
2.4 梨火疫病菌对噻唑锌及其他3种杀细菌剂的抗性相关性
供试的E.amylovora菌株对噻唑锌及农用链霉素、噻霉酮和春雷霉素的抗性相关性分析表明,噻唑锌对梨火疫病菌的EC50与农用链霉素、噻霉酮和春雷霉素药剂敏感性的皮尔逊相关性系数(r)分别为0.138、0.417、0.434,均小于0.6,F检验的显著水平(P)值分别为1.56、0.78、0.65,均大于0.05,表明噻唑锌与这3种杀细菌剂之间不存在相关性。

表5 梨火疫病菌不同年份分离菌株对噻唑锌的抗性水平Table 5 Sensitivity and resistance level of Erwinia amylovora strains isolated in different year to zinc thiazole
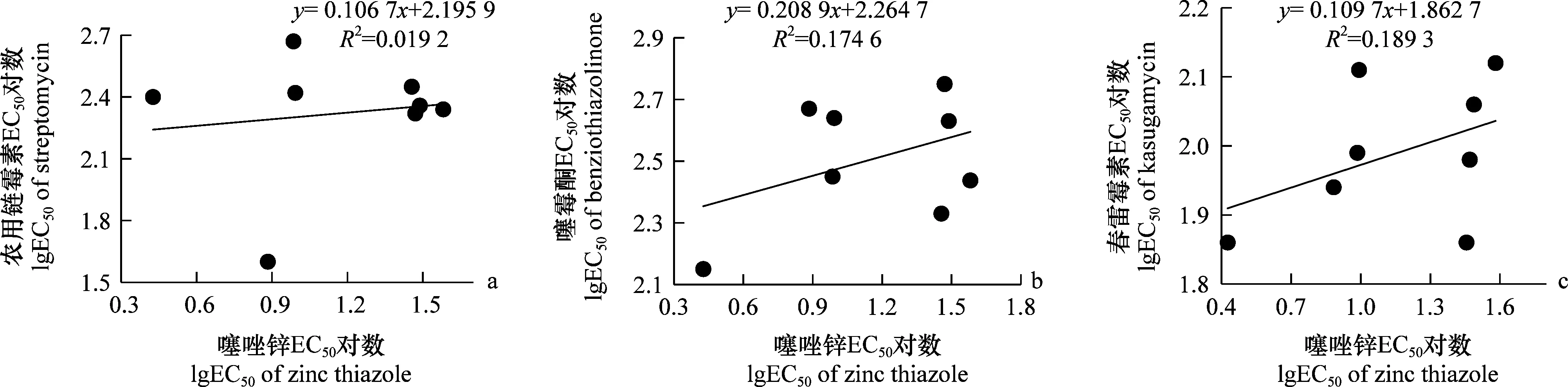
图2 梨火疫病菌对噻唑锌及农用链霉素、噻霉酮和春雷霉素的抗性相关性Fig.2 Cross-resistance of Erwinia amylovora to zinc thiazole with streptomycin,benziothiazolinone and kasugamycin by LgEC50 values
3 结论与讨论
目前用于防治细菌性病害的化学药剂的类型和品种都相对较少,新型、安全和高效的杀细菌剂较为缺乏[22]。噻唑锌是新一代噻二唑类有机锌杀菌剂,在我国于2009年正式登记,开始生产和应用,主要用于防治水稻、柑橘和黄瓜、番茄等作物的细菌性病害[23-25]。作为梨火疫病防治的新登记药剂,为了明确噻唑锌对梨火疫病菌的抑菌活性,梨火疫病菌田间种群对其敏感性和抗药性现状,本研究采用2016年-2020年期间从新疆不同地州(区/市)分离获得的50个E.amylovora菌株,通过药剂-病原菌共培养结合平板菌落法测定了梨火疫病菌对噻唑锌(96.9%原药)的敏感性。结果表明,不同来源的E.amylovora菌株对噻唑锌的EC50在2.67~38.13 μg/mL,供试菌株对噻唑锌的敏感性分布频率符合正态分布,未发现敏感性分化的亚群体,将EC50均值(18.60±6.35)μg/mL作为新疆梨火疫病菌对噻唑锌的敏感基线。周丽洪等[26]采用抑菌圈法检测了西南地区云贵川3省水稻细菌性条斑病菌X.oryzaepv.oryzicola菌株对20%噻唑锌悬浮剂的敏感性,将EC50平均值 1.641 μg/mL 作为西南地区水稻细菌性条斑病菌对噻唑锌的敏感基线。Zhang等[27]采用比浊法测定浙江、江苏、安徽、湖北4省的水稻白叶枯病菌X.oryzaepv.oryzae对20%噻唑锌悬浮剂的敏感基线值为(6.79±1.61)mg/L。研究结果显示,在离体条件下噻唑锌对不同植物病原细菌的抑菌活性有较大差异,对E.amylovora有较强的抑菌活性,但略低于对X.oryzaepv.oryzicola和X.oryzaepv.oryzae的抑菌活性。其原因一方面与病原菌自身的生理差异有关,另一方面药剂不同剂型的理化性质、毒力测定的不同方法都可能是影响因素。有研究发现,噻唑锌具有内吸向顶传导的特性,在水稻活体上对X.oryzaepv.oryzae的杀菌活性远高于其在离体条件下的毒力,还具有促进植物生长的特性[28]。本研究仅测定了离体条件下噻唑锌对梨火疫病菌的抑菌活性,以后还需进一步结合活体试验进行测定。
细菌杀菌剂毒力测定方法主要有滤纸片-抑菌圈法、比浊法和平板菌落法等,每种方法各有其优缺点,应依据不同的供试药剂的特点选择适宜的方法。游文莉等[29]用抑菌圈法和平板菌落计数法分别测定农用链霉素、氧氯化铜对柑橘溃疡病菌和白菜软腐病菌(病原Pectobacteriumcarotovorumsubsp.carotovorum)的毒力,发现与抑菌圈法相比平板菌落计数法具有快速、简便、重复性好等优点。本研究测定的噻唑锌原药溶解性差,在平板培养基中不易扩散的特性使其不适宜采用滤纸片-抑菌圈法测定其毒力。在前期预试验中将药液-病原菌共培养液分别采用比浊法和平板菌落法进行比较。比浊法通过测定药剂+病原菌共培养液混浊度的变化来反映药剂的抑菌效果,无法区分培养液中病原菌的死活细胞数,所得结果较为粗放;而平板菌落法通过测定药剂与病原菌的共培养液中存活的病原菌数体现药剂的抑菌效果,该法测定细菌杀菌剂毒力具有变异系数小,结果更加灵敏、精确,数据稳定、可重复性好的优点,因此采用该法测定的EC50建立了E.amylovora对噻唑锌的敏感基线。研究中也发现,在应用平板菌落计数法测定杀细菌剂毒力的过程中,应根据供试细菌的培养特性,使悬浮液中菌体充分分散、严格控制菌悬液的稀释倍数和加入量以及培养时间,才能保证测定结果的准确性。
本研究利用建立的E.amylovora菌株对噻唑锌的敏感基线,分析了来源于新疆不同地区、不同寄主和年份的梨火疫病菌田间分离菌株对噻唑锌的抗性水平。结果发现,供试的E.amylovora菌株对噻唑锌均敏感,未发现抗性菌株。有研究证明,不同地理来源的病原菌对同一种杀菌剂的敏感性会存在明显差异[30]。本研究也发现,不同地州(区/市)的梨火疫病菌分离菌株对噻唑锌的抗性水平存在一定差异。如巴州轮台县分离菌株的敏感性最低,抗性倍数最高,和田市分离菌株的敏感性最高,抗性倍数最低,两地差异显著(P<0.05),其他地州(区/市)分离的菌株之间也明显不同。从榅桲上分离的菌株对噻唑锌最不敏感,抗性倍数最高,而杜梨上的分离菌株最敏感,抗性倍数最低,两寄主之间差异显著(P<0.05),其他寄主上的分离菌株的抗性也有一定差异。2016年-2020年连续5年的分离菌株,总体体现出随年份增加,敏感性下降的趋势。田间植物病原菌对药剂抗药性水平的差异,除了与菌株的地理来源分布、寄主植物及种植年限、病原菌采集时间有一定关系外,与病害的发生程度、当地生产所施用的药剂种类,用药时间、浓度、施药方式和范围等都可能有关。此外,本研究中受分离菌株的局限性,有些地区(塔城、和田、哈密和阿勒泰地区分离菌株各1株)、寄主(榅桲和杜梨分离菌株各3株),年份(2016年分离菌株5株)供试菌株的样本量偏少,不能完全代表不同地区、寄主和年份分离菌株的敏感性差异及变异程度,还需更加广泛地收集菌株进一步比较验证。目前尚未见植物病原细菌对噻唑锌的抗性报道。有试验表明,在实验室紫外线下诱导获得的X.oryzaepv.oryzae的噻唑锌抗药突变体不具备稳定遗传性,但从药剂处理稻苗后接种病原所形成的病斑上,能够筛选到致病力不受影响的该病原菌抗药性突变体[27]。E.amylovora菌株在离体条件下尚未产生抗药性,但在活体植株上是否存在对噻唑锌的抗药性风险还需在后续工作中进一步监测。
农用链霉素曾是防治梨火疫病的传统最佳药剂。针对梨火疫病在新疆首次发生,在疫情严重、缺乏专用药剂的情况下,应急采用了花期喷施农用链霉素防治病害。虽然农用链霉素用于防治梨火疫病的时间不长,但它已在我国农业生产中使用50多年,不可避免地导致植物病原细菌多重抗药性的出现及传播[31]。噻唑锌、噻霉酮和春雷霉素都是近期在我国登记的梨火疫病的防治药剂。本研究通过分析梨火疫病菌对噻唑锌与农用链霉素、噻霉酮和春雷霉素敏感性的相关性表明噻唑锌与农用链霉素、噻霉酮和春雷霉素之间不存在明显相关性。其原因可能是这几种药剂的作用机制不同并且在生产中刚开始小规模应用,尚未对病原菌产生选择压力。影响菌株的敏感性和抗药性产生风险的因素是多方面的,与杀菌剂和病原菌双方,如杀菌剂的选择压力、抗性突变体的适合度以及与生产中使用的其他药剂之间的交互抗性,药剂的作用机制等密切相关[32]。目前,噻唑锌在梨火疫病发生的林果生产区应用仅仅几年时间,本研究通过测定梨火疫病菌对噻唑锌的敏感性,尚未发现在离体条件下的抗性菌株,说明目前该药剂防治梨火疫病的风险低。今后在推广应用中仍需继续监测病原菌对药剂抗性的发展情况,将噻唑锌与噻霉酮、春雷霉素等不同作用机制的杀细菌剂合理搭配与轮换使用,为制定合理的病害防治策略,防止或延缓病原菌抗药性的产生提供依据。
