梨品种‘玉露香’抗火疫病蛋白质组学分析
2022-12-19吴瑞瑞叶云锋陈松余徐幼平楼兵干蔡新忠
吴瑞瑞,叶云锋,陈松余,徐幼平,楼兵干,蔡新忠*
(1.浙江大学海南研究院,三亚 572025;2.浙江大学农业与生物技术学院生物技术研究所,浙江省作物病虫生物学重点实验室,杭州 310058;3.浙江大学分析测试中心,杭州 310058)
由革兰氏阴性菌——解淀粉欧文氏菌Erwiniaamylovora引起的梨火疫病是世界范围内的毁灭性病害,已被我国列为重要的检疫性有害生物[1-2]。梨火疫病菌寄主范围广,主要侵染蔷薇科仁果类果树和其他植物,如梨、苹果和山楂。其毁灭性还体现在可以侵染寄主植物地上部分所有组织,包括花、嫩枝、树干、主干、果实以及砧木[3]。该病害起源于北美,但是随着人类活动现已传播扩散至世界60多个国家和地区 (https:∥gd.eppo.int/taxon/ERWIAM/distribution)。我国果树资源丰富,苹果和梨的栽培面积和总产量均居世界首位。仅梨年出口创汇就达2亿美元以上,是中国农村和农业经济的支柱产业之一。如果火疫病在我国大面积发生将造成巨大的经济损失[3-4],因此必须进行有效预防和控制。
E.amylovora主要通过自然孔口和伤口侵入植物,进而通过薄壁组织的细胞间隙移至维管束系统,菌体在木质部大量积累阻碍寄主植物的水分传输,从而导致植物枯萎甚至死亡[5]。E.amylovora致病分子机制已有系统研究,鉴定明确的致病因子包括Ⅲ型分泌系统和胞外多糖[6]。Ⅲ型分泌系统分泌的效应蛋白包括DspA/E,HrpN,HrpW,Eop1,Eop3和AvrRpt2EA等[7]。分别与DspA/E和HrpN互作的DIPMs和HIPMs为苹果感病基因[8-10]。
植物抗火疫病分子机制近年来取得了重要进展。已经明确植物对火疫病的抗性是一种数量性状。目前已经有一些抗火疫病的数量性状位点 (quantitative trait loci,QTLs) 得到了鉴定,如FB_Mr5,FB_Mfu10以及FB_Mar12[7]。有些QTL编码典型抗病蛋白 (resistance protein,R protein),具有识别Avr等典型基因对基因互作系统中R蛋白的功能。如FB_Mr5编码一个CC-NBS-LRR类R蛋白,识别火疫病菌AvrRpt2EA对苹果RPM1互作蛋白4 (RPM1 interacting protein 4,RIN4) 的攻击,激发抗病性[11]。鉴定明确了一个苹果凝集因子 (agglutination factor) 为抗火疫病病程相关蛋白(pathogenesis related proteins,PRs)[12]。Hamdoun等[13]发现E.amylovora侵染引起寄主植物苹果和非寄主植物拟南芥的水杨酸含量增加和水杨酸调节基因表达上升,过表达水杨酸下游的抗病反应关键调控基因NPR1可提升苹果对E.amylovora的抗性;而沉默水杨酸调节基因EDS1则降低拟南芥对E.amylovora的抗性,但是拟南芥ICS1(编码水杨酸合成关键酶)基因突变体并没有减少病原菌引起的寄主细胞死亡。因此,水杨酸在植物抗E.amylovora侵染中发挥的作用仍待进一步验证。此外,下调茉莉酸通路也会降低苹果对E.amylovora的抗性,乙烯含量在苹果接种病原菌5 h后远远大于对照组,但这两个通路在植物抗性中的作用机制仍不明确[14-15]。
总体而言,目前抗火疫病作物品种缺乏,植物抗火疫病分子机制尚不够明确。本研究鉴定了梨品种‘玉露香’对火疫病的抗性,并利用该材料开展抗性相关蛋白质组学分析。研究明确了‘玉露香’对E.amylovora表现出明显早期抗性。通过高通量蛋白组学分析,鉴定获得一组抗病和防卫相关蛋白,为进一步揭示梨火疫病抗性分子机制及抗病育种提供了候选基因。
1 材料与方法
1.1 菌株和植物材料
本研究所用梨火疫病菌菌株为XJSZ0102,分离自新疆伊犁的山楂病样,配成含20%甘油的菌液于-80℃保存。菌株活化培养用NA和NB培养基。
NA培养基:蛋白胨10 g,牛肉膏3 g,NaCl 5 g,蔗糖5 g,琼脂粉15 g,加水定容至1 000 mL,用1 mol/L NaOH调节pH至7.0~7.2,121℃高压灭菌20 min。NB培养基配方同NA,但不加琼脂粉。
本研究所用植物材料为梨,品种为‘玉露香’和‘库尔勒香梨’。将一年生梨苗移栽于新疆库尔勒市农业局育苗中心3号大棚。
1.2 梨火疫病菌接种分析
每个品种挑选10株移栽45 d且生长状态一致的植株用于接种。菌株XJSZ0102在NA固体培养基上划线培养后挑取单菌落在NB培养液中培养至浓度为1×109cfu/mL(OD600=0.4),稀释10倍后用于接种。接种时使用灭菌的牙签,先在菌液中浸泡2~3 min,使牙签充分吸收菌液,而后用牙签在嫩枝离顶端15 cm处穿刺,穿刺深度为5 mm,穿刺后停留3 s。每株接种1个嫩枝,每枝1个接种点。接种后梨苗在大棚条件下正常管理。连续观察梨苗的发病情况,观测记录病斑长度。整个接种试验重复3次。
1.3 梨蛋白质组质谱分析
剪取移栽45 d、未接种的梨植株嫩枝离顶端 10 cm 处向下6 cm长枝段,迅速置于液氮中冷冻。每个品种每样取6株梨苗、每株1个嫩枝的相应枝段。取出冷冻的梨枝小段,用研钵研磨成细粉。采用TCA/丙酮沉淀法提取总蛋白。蛋白提取,还原,烷化,酶解,脱盐,纯化,LC-MS/MS质谱分析具体操作参考曹嘉懿[16]的方法。蛋白通过超高分辨率质谱仪 (Orbitrap elite) 进行肽段鉴定,Theromo Xcalibur Qual Browser进行数据收集,Proteome Discoverer 2.0软件的Sequence HT方法检索NCBI(https:∥www.ncbi.nlm.nih.gov/genome)中的白梨Pyrusbretschneideri基因组数据库进行蛋白质鉴定。
1.4 蛋白组学数据分析
采用非标记定量蛋白质组鉴定分析技术比较分析‘玉露香’和‘库尔勒香梨’嫩枝蛋白质组。以 |log2fold change|≥1且Pvalue<0.05为标准进行差异表达蛋白鉴定分析。采用公共数据库KEGG(Kyoto Encyclopedia of Genes and Genomes)进行Pathway分析。
1.5 Cu2+对梨火疫病菌的抑菌作用分析
在NB培养液中培养梨火疫病菌至OD600为 0.2,然后分别加入CuSO4、MgSO4和CuCl2至终浓度分别为1、1.5、2 mmol/L(CuSO4)和 3 mmol/L(MgSO4和CuCl2)。在48孔板中加入800 μL含有不同浓度金属离子的菌液,未加金属离子的菌液作为对照。用全自动细胞成像多功能微孔板检测仪(BioTek Cytation 1,德国)对细菌的生长动态进行连续监测。仪器设置温度为28℃,线性晃动,每隔0.5 h记录1次菌液的OD600。培养18 h后,取各处理孔板中的培养液先稀释2倍然后再进行10倍梯度稀释,吸取5 μL菌液点样于NA培养板,观察菌落生长情况。
2 结果与分析
2.1 ‘玉露香’对火疫病的抗性分析
‘玉露香’是以‘库尔勒香梨’为母本,‘雪花梨’为父本杂交育成的优质中熟梨新品种[17]。为了探究‘玉露香’对火疫病是否具有抗性,以感病品种‘库尔勒香梨’为对照,对其进行梨火疫病抗性鉴定。移栽45 d的梨植株嫩枝经针刺接种后32 h,不同品种出现了表型差异,48 h后差异达到峰值(图1),感病对照品种‘库尔勒香梨’病枝率为86%,而‘玉露香’仅为14%,表现出明显的抗性。但接种后4 d,‘库尔勒香梨’和‘玉露香’的病枝率均为100%,即全部接种枝条均发病(图1a)。从病斑长度看,接种后4 d内两个品种有显著差异。接种后2 d和4 d,‘库尔勒香梨’的平均病斑长度分别为16.7 mm和71.8 mm,而‘玉露香’的平均病斑长度依次分别只有3.3 mm和39.8 mm。但接种6 d以后,两品种间无显著差异。‘库尔勒香梨’的平均病斑长度为195.0 mm,‘玉露香’的平均病斑长度也达183.9 mm(图1b)。接种7 d后,‘库尔勒香梨’近半的枝条已经呈现牧羊鞭状,而‘玉露香’没有产生该症状的枝条。这些结果表明,‘玉露香’对火疫病表现较显著的早期抗性,可能具有抗侵入或早期抗扩展的特性。
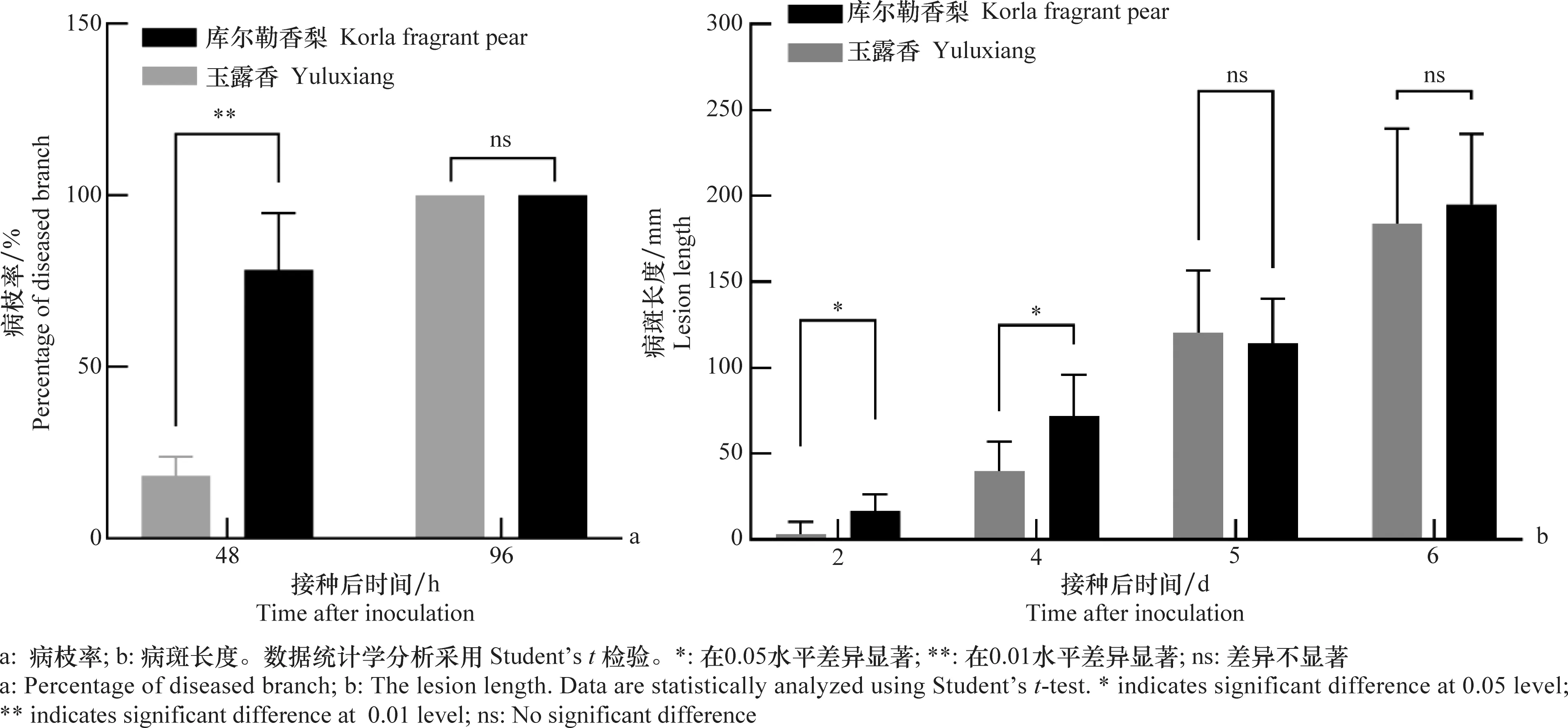
图1 ‘玉露香’对火疫病的抗性Fig.1 Resistance of ‘Yuluxiang’ to fire blight
2.2 ‘玉露香’与‘库尔勒香梨’的比较蛋白质组学分析
为明确‘玉露香’对火疫病的抗性机制,对‘玉露香’和感病品种‘库尔勒香梨’的差异表达蛋白进行了鉴定分析,共鉴定到2 589个蛋白。以|log2fold change|≥1且P<0.05为标准,鉴定出在‘玉露香’和‘库尔勒香梨’中显著差异表达的蛋白192个,其中133个蛋白在‘玉露香’中上调表达,59个下调表达。
2.3 ‘玉露香’抗火疫病相关蛋白的鉴定
基于KEGG数据库,对192个差异表达蛋白进行了富集分析。结果显示,差异表达蛋白涉及多个富集较明显的通路(图2)。其中,前8个通路为代谢途径(metabolic pathways)、次生代谢产物的生物合成(biosynthesis of secondary metabolites)、氨基酸的生物合成(biosynthesis of amino acids)、碳代谢(carbon metabolism)、内质网蛋白组加工(protein processing in endoplasmic reticulum)、乙醛酸和二羧酸代谢(glyoxylate and dicarboxylate metabolism)、MAPK信号通路(MAPK signaling pathway)和植物-病原互作(plant-pathogen interaction)通路。其中MAPK信号和植物-病原互作两个通路均富集到了2个钙调蛋白(calmodulin和calmodulin-7),表明基于钙调蛋白的钙信号传导途径可能在‘玉露香’早期抗火疫病中起重要作用。
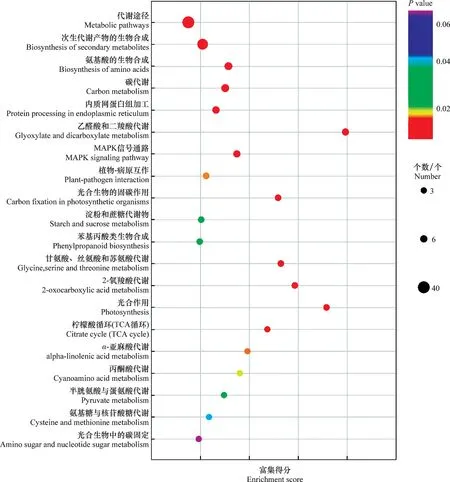
图2 ‘玉露香’与‘库尔勒香梨’差异表达蛋白的KEGG信号通路富集分析Fig.2 Enrichment analysis of KEGG signal pathway of proteins differentially expressed between ‘Yuluxiang’and ‘Korla fragrant pear’
进一步的序列功能注释和文献搜索分析显示,192个差异表达蛋白中,29个为抗病和防卫相关蛋白(表1),其中包括3个免疫受体FERONIA,LYK4 (lysM domain receptor-like kinase 4) 和LecRKⅧ.2 (L-type lectin-domain containing receptor kinase Ⅷ.2);一组防卫相关蛋白如碳酸酐酶 (carbonic anhydrase,CA),鞘脂激活蛋白原 (prosaposin,PASP)和SRG1-like;一组酚类合成调控酶;一组病程相关蛋白(PR1-like,germin-like protein,subtilisin-like protease,endochitinase)以及一个铜转运ATPase蛋白 (copper-transporting ATPase) HMA5。此外,差异表达蛋白还包括13个氧化还原相关蛋白 (SOD,PDI,phospholipid hydroperoxide glutathione peroxidase,laccase,thioredoxin等)。这些结果表明,基于FERONIA,LYK4 和LecRKⅧ.2等的免疫、碳酸酐酶,鞘脂激活蛋白原和SRG1-like介导的防卫反应、酚类合成以及氧化还原调控可能参与‘玉露香’对火疫病抗性的调控。
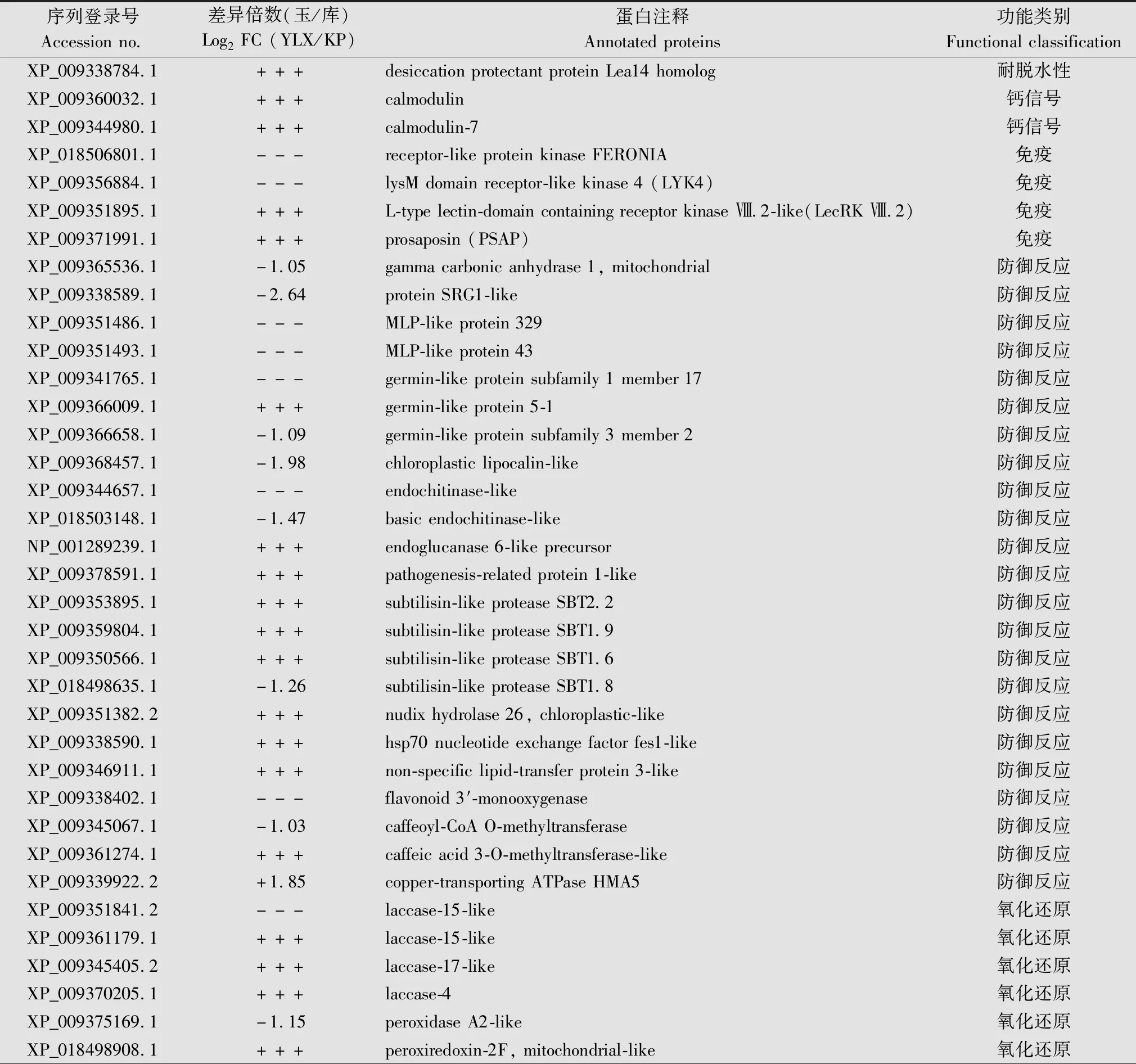
表1 ‘玉露香’与‘库尔勒香梨’差异表达的抗病相关蛋白1)Table 1 Resistance-related proteins differentially expressed between ‘Yuluxiang’ and ‘Korla fragrant pear’
2.4 Cu2+对E.amylovora 的抑菌作用
铜离子转运ATPase蛋白HMA5在‘玉露香’中的积累量显著高于‘库尔勒香梨’(表1)。为了明确抗病品种‘玉露香’是否通过在胞外积累高浓度铜离子,杀死火疫病菌,从而表现对火疫病的抗性,本研究分析了E.amylovora对铜离子的敏感性。Cu2+和E.amylovora共培养分析结果显示,Cu2+的抑菌作用随浓度升高而增强,2 mmol/L CuSO4对E.amylovora的抑制率达到了100%(图3)。CuCl2具有相同效果,然而浓度高达3 mmol/L的MgSO4不影响火疫病菌生长,表明在金属离子中Cu2+对火疫病菌有一定的抑制作用。

图3 Cu2+对梨火疫病菌的抑制作用Fig.3 Inhibitory effect of Cu2+ on the growth of Erwinia amylovora
3 结论与讨论
梨火疫病早在19世纪末就已经被发现,针对病害的研究前期主要集中在病原菌的致病机理上[18],植物对火疫病的抗性机制研究明显落后。此外,关于E.amylovora与植物的互作,主要集中在苹果和非寄主拟南芥上。梨和苹果虽同为寄主,但对病原菌的敏感性有很大差异。Santander等[19]发现,在E.amylovora从根系侵染杜梨苗时,能够很快扩展到植物的地上部分,这与苹果中缓慢而有限的向地上部分迁移相反[20-21],进一步表明梨抗性机制研究的重要性。
火疫病抗性品种的鉴定和获取是该病害绿色防控的重要途径。本研究通过枝条针刺接种,以病枝率和病斑长度为指标,初步明确了‘玉露香’对火疫病具有早期抗性,表现抗侵入特性。但该抗性强度及持久性等有待结合症状和菌量分析进行进一步验证。
本研究通过蛋白质组学分析鉴定了29个抗病和防卫相关蛋白,其中值得注意的包括钙调蛋白,FERONIA、LYK4 和LecRKⅧ.2等免疫受体,碳酸酐酶 (CA)、鞘脂激活蛋白原 (PASP) 和SRG1-like等防卫相关蛋白。FERONIA是RALF(rapid alkalinization factor)的受体,可以正向或负向调控植物对不同病原物的抗性[22-24]。另一免疫受体LYK4在拟南芥中参与几丁质信号转导,正向调控拟南芥对植物病原细菌丁香假单胞菌Pseudomonassyringaepv.tomato(Pst)DC3000和病原真菌芸薹生链格孢Alternariabrassicicola的抗性[25]。在本研究中,感病品种‘库尔勒香梨’中检测到这两个蛋白,而表现出早期抗性的‘玉露香’中并未检测到,表明它们有可能在梨抗火疫病中发挥负调控作用。flg22抑制拟南芥中β-CA1和β-CA4的表达,ca1和ca4双突变植株对Pst DC3000抗性明显增强[26]。本研究发现在‘玉露香’中有一个γ-CA1 (gamma carbonic anhydrase 1)表达量显著低于‘库尔勒香梨’,有可能在梨抗火疫病中发挥作用。PSAP是鞘脂活化蛋白的前体,存在于溶酶体和分泌蛋白中。已有研究报道它们具有抗微生物的活性,比目鱼中的PSALP1和PSALP2能抑制细菌的生长[27]。虽然PSAP家族成员是否参与植物抗病性尚无相关报道,但在本研究中发现,PSAP仅积累于‘玉露香’中,意味着PSAP可能抑制E.amylovora生长,使‘玉露香’产生抗性表型。拟南芥SRG2和SRG3是依赖水杨酸的植物免疫途径的正调控因子[28]。‘玉露香’中SRG1-like的显著下调,暗示其可能参与梨火疫病抗性的调控。
E.amylovora主要通过木质部而非韧皮部在植物组织内繁殖[19]。‘玉露香’钙信号传导相关蛋白钙调蛋白(calmodulin,calmodulin-7)较‘库尔勒香梨’显著上升,钙调蛋白作为一些病原菌的效应子的辅因子与拟南芥中MAP65(microtubule-associated protein 65)互作进而抑制植物基于细胞壁的细胞外免疫[29]。这些结果表明,‘玉露香’可能通过改变维管束的生理、生化性状或信号识别途径来抵御病原菌的侵染和定殖。该假设也一定程度上解释了‘玉露香’的抗性主要表现在侵染早期。
本研究发现一个与铜离子转运相关的蛋白HMA5,相较于‘库尔勒香梨’,在‘玉露香’中明显上调表达。进一步分析发现铜离子对于E.amylovora具有明显的抑制作用。Yuan等[30]在水稻中发现,COPT1和COPT5两个铜转运蛋白可以与抗病蛋白Xa13互作。维管束中铜离子浓度升高,COPT转基因植株对水稻白叶枯病菌PXO99 表现出明显的抗病表型。在梨中开展HMA5的功能分析,阐明其在铜离子转运以及不同细胞和组织部位中积累的作用及机制,分析其对E.amylovora的响应动态,有助于揭示‘玉露香’对E.amylovora是否与水稻抗白叶枯病菌相似具有依赖于HMA5的抗性调控机制。
本研究通过KEGG分析富集到了很多与次生代谢有关的蛋白。相关研究表明E.amylovora侵入植物后,一些次生代谢物水平发生显著变化,如类苯丙烷和类黄酮途径衍生化合物。该途径有大量的分支,可以通过结合还原酶、转移酶类、加氧酶类和结合酶等产生众多次生代谢物[31-33]。Jensen等[34]表明类苯基丙烷途径的整体表达可能在植物抗E.amylovora中发挥一定作用。此外,植物体内的次生代谢物也会因为品种、菌株的不同而有所差异,比如,抗性品种中的熊果苷含量较高,感病品种中绿原酸含量较高[35]。表1所列酚类合成调控酶在抗火疫病中的作用值得进一步分析。
本研究通过对抗病和感病梨品种的组成性差异蛋白组学分析,挖掘了一批潜在的参与火疫病抗性调控基因。它们已在其他植物抗病性机制中发挥重要作用。我们通过蛋白组学分析,发现这些差异蛋白也很有可能在梨对火疫病的抗性中扮演重要角色,为进一步采用遗传学、分子生物学等分析揭示抗火疫病分子机制提供了候选基因,并为梨火疫病抗性的遗传改良和更高效的防治措施提供参考。
