基于重组酶聚合酶扩增技术的玉米矮花叶病毒快速检测方法的建立
2022-12-19赵振兴范奇璇冯黎霞李献锋张永江
赵振兴,范奇璇,冯黎霞,李献锋,张永江
(1.中国检验检疫科学研究院,北京 100176;2.中国农业大学植物保护学院,北京 100193;3.广州海关技术中心,广州 510623)
玉米ZeamaysL.是世界三大粮食作物之一,也是重要的饲料和工业原料。自2007年起,玉米超过水稻,成为我国种植面积最大的作物,并于2013年起成为总产量最高的作物(http:∥www.fao.org)。玉米的产量和品质构成我国粮食安全的重要基础,对我国国民经济稳定发展有重要意义。
玉米病毒病是玉米上最严重的病害之一,超过40种病毒病威胁着全世界的玉米生产。在我国至少有12种病毒侵染玉米,其中水稻黑条矮缩病毒(rice black streaked dwarf virus,RBSDV)、南方水稻黑条矮缩病毒(southern rice black-streaked dwarf virus,SRBSDV)和甘蔗花叶病毒(sugarcane mosaic virus,SCMV)是我国玉米病毒病的主要病原[1]。随着国际贸易交流,大量的玉米种子及其产品的进口带来了外来有害生物入侵的风险,如玉米褪绿斑驳病毒(maize chlorotic mottle virus,MCMV)于2009年首次在我国云南元谋县田间玉米中检测到[2],随后逐渐扩散,成为我国玉米生产的潜在威胁[3]。
目前,《中华人民共和国进境植物检疫性有害生物名录》中侵染玉米的病毒有玉米褪绿矮缩病毒(maize chlorotic dwarf virus,MCDV)、玉米褪绿斑驳病毒(MCMV)和玉米矮花叶病毒(maize dwarf mosaic virus,MDMV),其中玉米矮花叶病毒MDMV于2021年4月9日新增补至该名录中,是我国关注的入侵物种。MDMV属于马铃薯Y病毒科Potyviridae,马铃薯Y病毒属Potyvirus,病毒粒体弯曲杆状,大小约为750 nm×14 nm,在寄主细胞可以形成风轮状及卷筒状内含体[4]。MDMV是一种世界性病害,其与SCMV、约翰逊草花叶病毒(Johnsongrass mosaic virus,JGMV)都可造成玉米矮花叶病,由于它们引起的症状相似,导致某一地区玉米矮花叶病的病原难以分辨[5-6]。我国玉米矮花叶病病原主要为SCMV[7],近年来,大量鉴定结果显示,引起我国玉米矮花叶病主要病原均为SCMV(原被认为是MDMV-B株系)[8]。我国厦门、上海等口岸从智利、阿根廷输华玉米种子中多次检出MDMV[9]。MDMV侵染玉米,造成植株矮化、叶片褪绿、不育、有时提早枯死,一般造成玉米产量减产20%以上,严重时绝收[4,10-11]。MDMV与MCMV可以复合侵染,引起玉米致死性坏死病(maize lethal necrosis disease,MLND),玉米发生MLND时叶片会严重黄化褐变,最终导致植株死亡,造成减产乃至绝收的严重后果[12]。目前我国关于MDMV的相关研究较少,对入境玉米种子中MDMV的检测对我国玉米生产安全具有重要意义。
核酸等温扩增技术中重组酶聚合酶扩增技术(recombinase polymerase amplification,RPA)具有快速、灵敏、引物设计简便的优势。RPA技术体系包含3种核心酶:重组酶、单链结合蛋白和DNA聚合酶。通过一对引物,在存在目标序列的情况下,于最适反应温度(37~42℃)启动DNA的指数级扩增,可广泛用于病毒基因组DNA或RNA的快速检测[13]。在植物病毒检测领域中,RPA技术至少已被用于35种植物病毒和4种类病毒的检测,相关报道逐年增加[14],RPA技术已被用于检测玉米中的MCMV[15-17]和RBSDV[18],由于玉米矮花叶病毒的定义发生了变化,以往国内认定的玉米矮花叶病毒均已证实为其他病毒[4,6-7,19-20],MDMV 的检测研究较少,也未见MDMV的RPA检测研究。本研究拟建立基于RPA技术的玉米矮花叶病毒的快速检测方法,以用于玉米种子和田间作物的快速检测。
1 材料与方法
1.1 供试材料
本研究中所用的带病毒玉米材料包括:SCMV、RBSDV、CMV侵染的‘郑58’玉米叶片和MCMV侵染的玉米‘B73’种子由中国检验检疫科学研究院保存;小麦条纹花叶病毒(wheat streak mosaic virus,WSMV)从乌克兰输华玉米种子中检出,由日照海关提供;MDMV带毒玉米种子由广州海关技术中心从智利输华玉米种子中检出并提供。
1.2 玉米材料总RNA提取
取10 g携带病毒或健康的玉米种子在干磨机中打碎至粉末状,按质量体积比1∶2比例加入PBS缓冲液(137 mmol/L NaCl,12.7 mmol/L KCl,10 mmol/L Na2HPO4·12H2O,2 mmol/L KH2PO4),充分混合放置15~30 min,取1 mL上清液备用;取携带病毒或健康的玉米叶片在液氮中充分研磨,取0.1 g备用。按照天根植物总RNA提取试剂盒(DP432)说明书进行种子粉末上清液或叶片干粉的RNA提取,提取后放置于-80℃保存。
1.3 RPA引物设计
根据NCBI中的MDMV外壳蛋白(coat protein,CP)基因序列,进行序列比对分析,使用引物设计软件Oligo Primer Analysis Software version 7.60 (Molecular Biology Insights,Inc.,Cascade,CO,USA)设计引物(表1)。使用NCBI中Primer-BLAST (https:∥www.ncbi.nlm.nih.gov/tools/primer-blast/)对设计的引物进行验证,确保其特异性。本研究所有引物均由北京诺赛基因组研究中心有限公司合成。
合成的RPA引物使用RNA恒温快速扩增试剂盒(基础型)-Ⅱ(安普未来生物科技有限公司)进行初步验证,扩增产物由北京诺赛基因组研究中心有限公司进行测序,并进行比对。
1.4 RPA反应体系优化
本研究采用的RPA扩增体系为50 μL,按照RNA恒温快速扩增试剂盒(基础型)-Ⅱ说明书进行配制,其中RNA模板为2 μL,buffer A 29.4 μL,buffer B 2.5 μL,ddH2O和引物总体积为16.1 μL。反应结束后,加入Tris饱和酚/氯仿/异戊醇(25∶24∶1)抽提液,1∶1混匀抽提反应液,12 000 r/min离心5 min,取5 μL上清进行琼脂糖凝胶电泳检测。

表1 用于扩增玉米矮花叶病毒的RPA和RT-PCR引物Table 1 Primers of RPA and RT-PCR for amplification of maize dwarf mosaic virus
首先进行了RPA引物浓度优化,设置了5个浓度,分别为0.1、0.2、0.3、0.4、0.5 μmol/L,反应温度为42℃,反应时间为30 min;然后对RPA体系的反应温度进行优化,设置了37、39.5、42、44.5、47℃ 5个反应温度,引物浓度为0.4 μmol/L,反应时间为30 min;最后对反应时间进行优化,分别设置5、10、15、20、25、30 min,反应温度为42℃,引物浓度为0.4 μmol/L。
1.5 RPA特异性验证和灵敏度测试
利用优化好的RPA体系,提取SCMV、MCMV、RBSDV、WSMV和CMV侵染的玉米材料总RNA为模板,对该体系的特异性进行检测。
使用MDMV CP全长特异性引物MDMV-CP-F/-R进行RT-PCR扩增,将扩增产物进行测序并比对,由北京擎科生物科技有限公司提供克隆服务,将该片段连入pUC57克隆载体中,获得阳性质粒。RT-PCR参照TransScript®Ⅱ One-Step RT-PCR SuperMix试剂盒(全式金)说明书进行。总反应体系为20 μL,包括模板RNA 4 μL、正向引物和反向引物(10 μmol/L)各0.4 μL、TransScript®Ⅱ One-Step Enzyme Mix 0.4 μL、2×TS Ⅱ One-Step Reaction Mix 10 μL、ddH2O 4.8 μL。反应条件:50℃ 15 min;94℃ 5 min;94℃ 30 s,56℃ 30 s,72℃ 30 s,35个循环;72℃,10 min。将阳性质粒稀释为108拷贝/μL(≈0.369 ng/μL),然后使用ddH2O将其梯度稀释到1拷贝/μL,使用这9个梯度浓度的阳性质粒进行灵敏度测试。
同时使用MDMV特异性检测引物3MDF和1MDR[19]对阳性质粒进行灵敏度测试,参照全式金2×EasyTaq®PCR SuperMix试剂盒配制50 μL反应体系,包括模板质粒1 μL,正向引物和反向引物(10 μmol/L)各1 μL、2×EasyTaq®PCR SuperMix 25 μL、ddH2O 22 μL。反应条件:94℃ 5 min;94℃ 30 s,55℃ 30 s,72℃ 30 s,35个循环;72℃,10 min。并与建立的RPA体系进行比较。
1.6 玉米样品检测
使用建立的RPA体系和普通RT-PCR体系对近3年收集的100份玉米样品进行MDMV检测并对结果进行比较,其中33份德国样品为玉米叶片,其他67份样品为玉米种子(表2)。
2 结果与分析
2.1 RPA体系的建立
为建立最适的RPA反应体系,设计了3对RPA引物(表1),提取携带MDMV的玉米种子样品CHI204-1、CHI204-2、CHI205-1、CHI205-2和健康玉米种子总RNA,以健康种子RNA为阴性对照,使用RPA试剂盒推荐的反应体系进行了测试(图1),结果显示,3对RPA引物均能成功扩增所有RNA样品的目的片段,其中MDMV-RPA-1F/-1R引物组合的扩增反应最为稳定且阴性对照杂带最少,挑选为待优化RPA体系的引物组合。

图1 玉米矮花叶病毒RPA引物筛选Fig.1 Screening of RPA primers for maize dwarf mosaic virus
2.2 RPA体系的优化
为获得最优的RPA反应条件,首先对引物浓度进行优化,结果显示,扩增条带亮度在0.1~0.4 μmol/L 间逐渐变亮,当浓度增加到0.4 μmol/L时,扩增产物亮度达到最亮,当引物浓度为0.5 μmol/L时,扩增产物亮度减弱,因此选择引物对终浓度为0.4 μmol/L 为最优引物终浓度(图2a)。
随后对反应温度进行优化,结果显示在37、39.5、42℃和44.5℃条件下,RPA体系均能获得较多的扩增产物,表明RPA体系能适应较广的反应温度,当温度升高到47℃时,扩增效率才受到一定的影响,5个反应温度中,42℃时RPA扩增体系条带背景最弱,选为最终反应温度(图2b)。
最后对反应时间进行优化,结果显示扩增产物亮度随反应时间的延长而增加,在反应20 min时达到最高值,随后变化差异不大,故20 min选为最佳反应时间(图2c)。最终的RPA反应体系中引物终浓度为0.4 μmol/L,反应温度为42℃,反应时间为20 min。
2.3 RPA体系的特异性
为了验证RPA反应的特异性,对分别带有MDMV、SCMV、MCMV、RBSDV、WSMV和CMV的玉米样品进行RPA检测。基于优化的RPA反应体系,带MDMV病毒的样品检测为阳性,带有其他5种玉米病毒的样品检测结果均为阴性,没有出现非特异性扩增的情况(图3)。
2.4 RPA体系的灵敏度
以获得的携带MDMV-CP片段的阳性质粒为模板,RPA反应能检测到浓度为105拷贝/μL(≈369 fg/μL),而RT-PCR的检测灵敏度为106拷贝/μL(≈3.69 pg/μL),在此条件下,RPA检测的灵敏度高于RT-PCR,是RT-PCR的10倍(图4)。
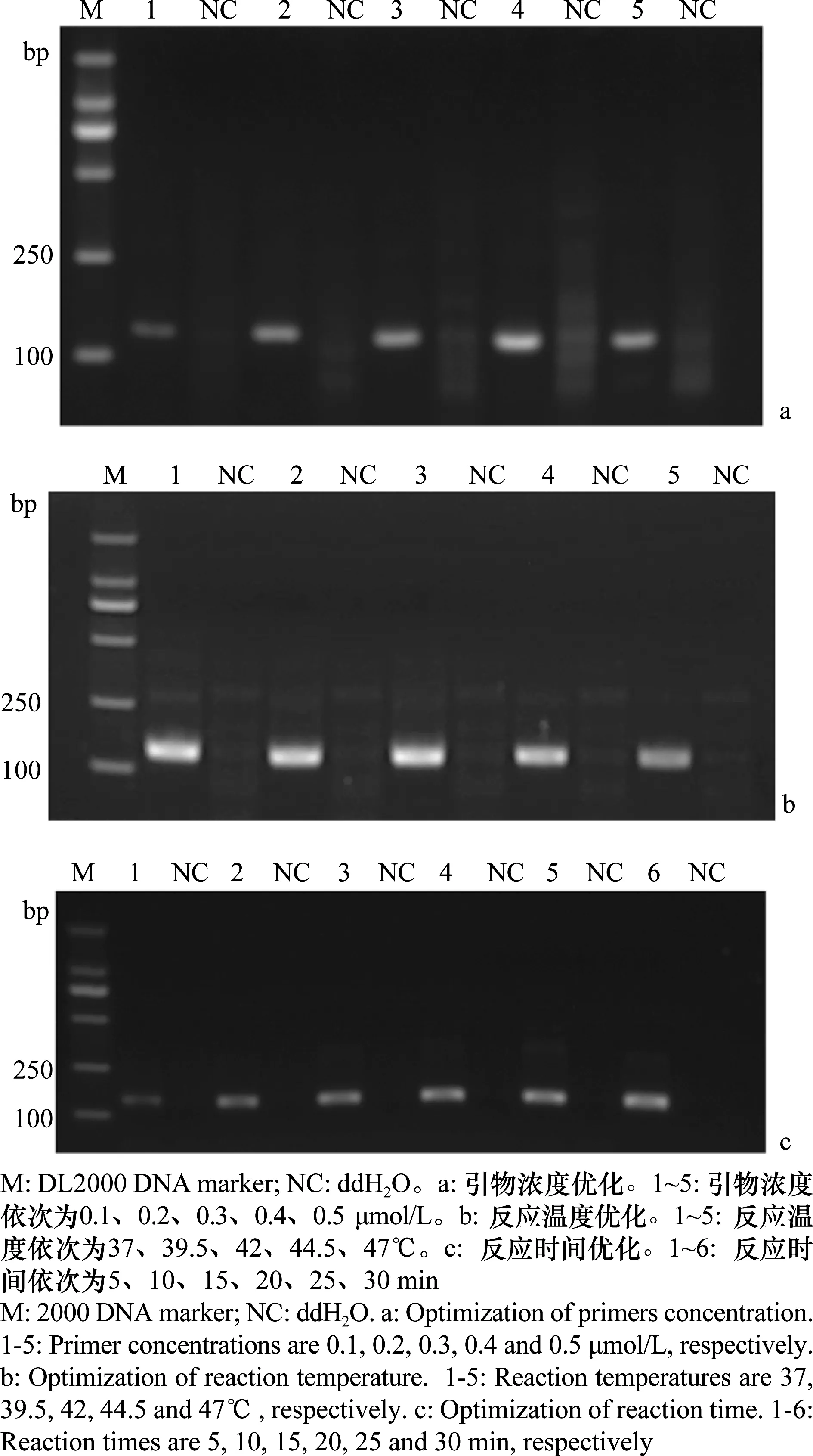
图2 RPA检测玉米矮花叶病毒反应体系优化Fig.2 Optimization of RPA reaction system for detecting maize dwarf mosaic virus
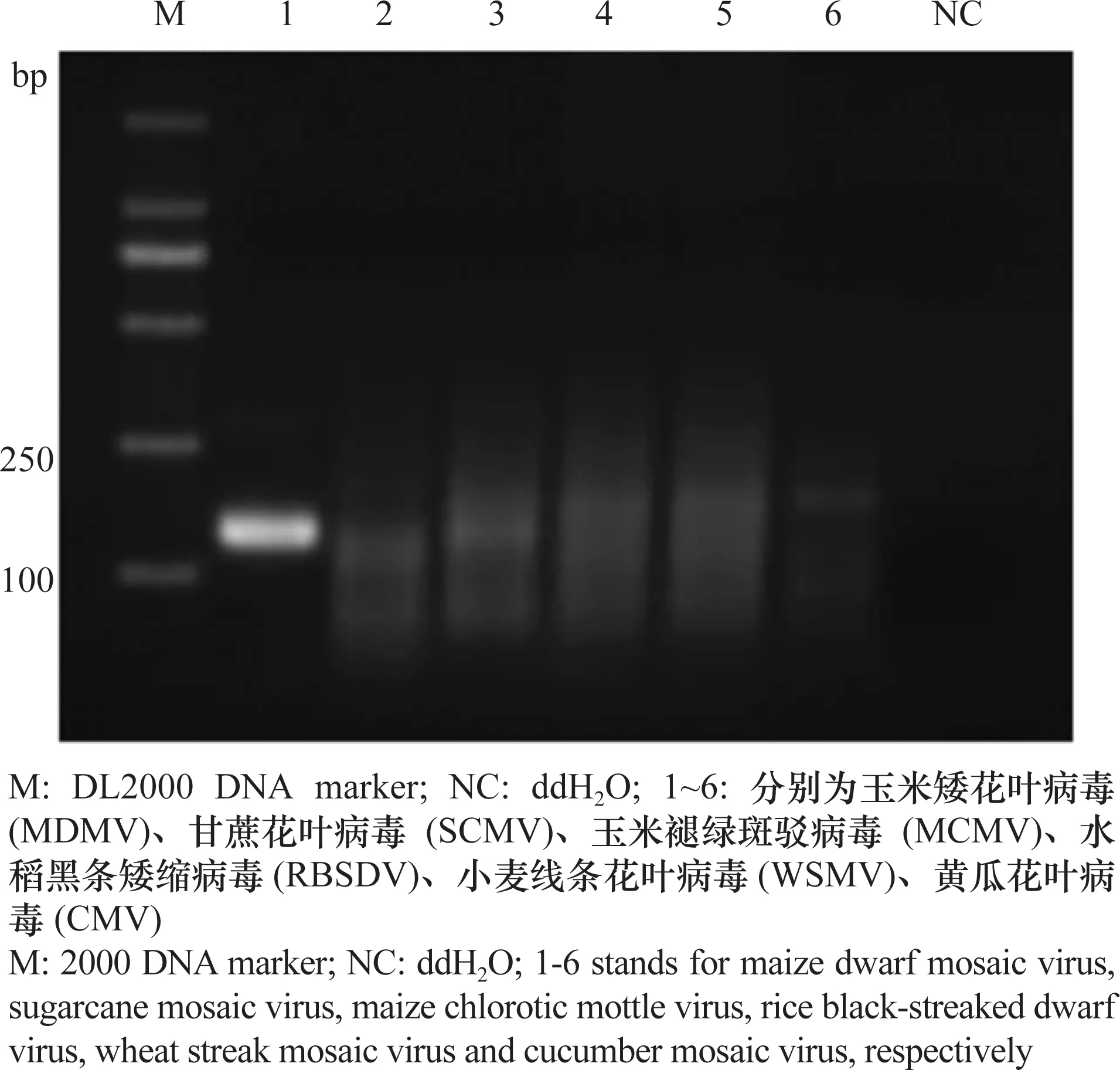
图3 玉米矮花叶病毒RPA体系特异性分析Fig.3 Specificity assay of RPA for maize dwarf mosaic virus
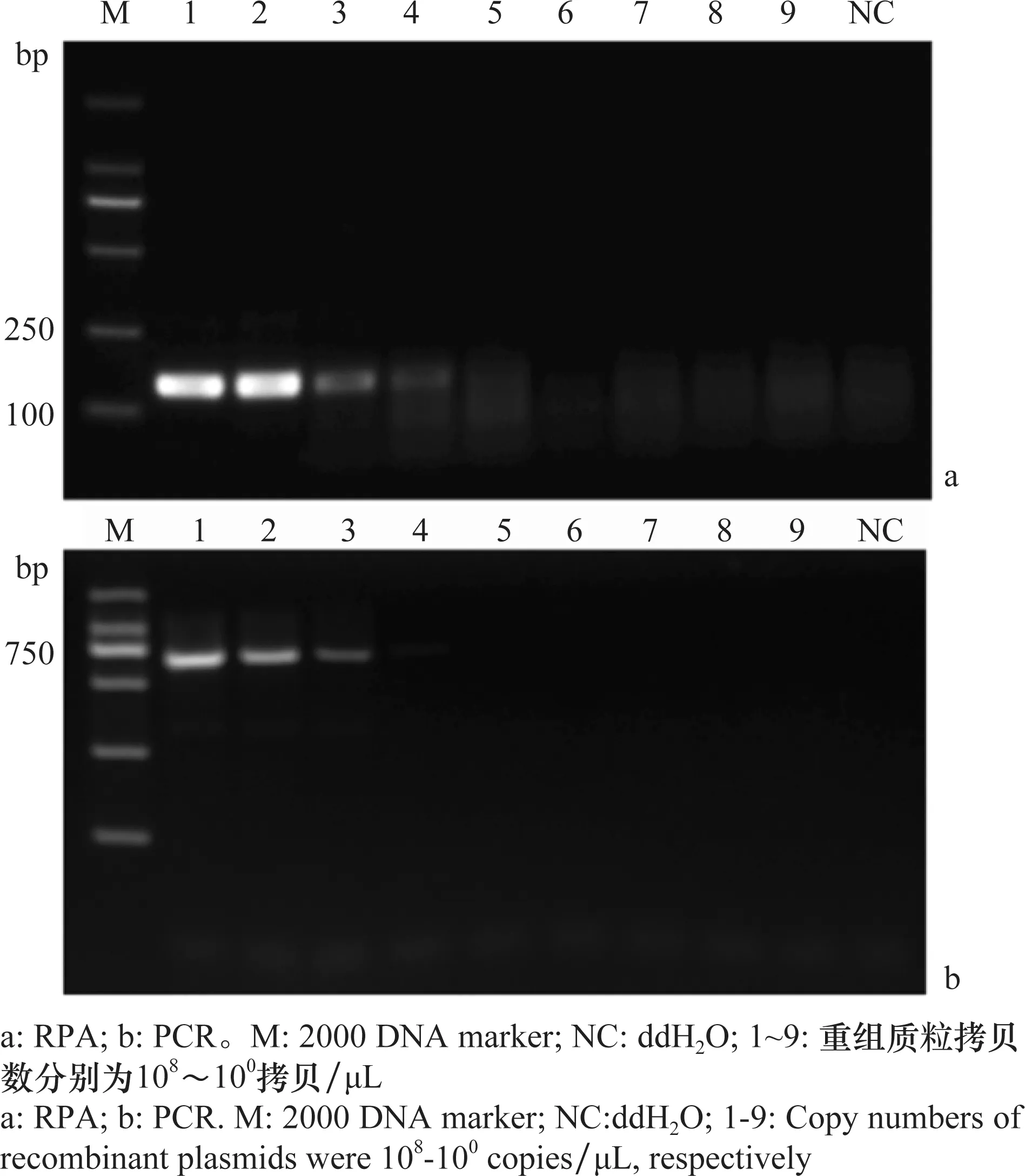
图4 玉米矮花叶病毒RPA和PCR体系灵敏度分析Fig.4 Sensitivity test of RPA and PCR for maize dwarf mosaic virus
2.5 玉米样品的检测
对近3年送检的国内外100份玉米种子或叶片提取总RNA,分别使用RPA和RT-PCR进行种子或叶片携带MDMV的检测,使用MDMV CP质粒为阳性对照。结果显示,总共8批次,共100个玉米样品均未检出MDMV(表2)。

表2 RPA和RT-PCR检测100份玉米样品携带玉米矮花叶病毒的情况Table 2 Detection results of maize dwarf mosaic virus from 100 maize samples by RPA and RT-PCR
3 结论与讨论
近年来,等温扩增技术被广泛应用于核酸检测,与传统的基于PCR的检测技术相比,其具有反应条件简便,高效特异的优点[13]。玉米矮花叶病毒威胁玉米生产,是我国进境植物检疫性有害生物名录中新列入的重要病毒。本研究建立了基于RPA技术的MDMV检测方法,具有特异性高、操作难度小、反应时间短、不依赖PCR仪等优点,为MDMV的快速精准检测提供了一种新方法。
等温扩增技术包括依赖核酸序列的扩增技术(nucleic acid sequence-based amplification,NASBA)[21]、滚环扩增技术(rolling circle amplification,RCA)[22]、环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)[23]、重组酶聚合酶扩增技术(recombinase polymerase amplification,RPA)[24]等,相对于基于PCR的检测技术,它们最大的优势在于能够在恒定温度下进行扩增反应,使扩增反应不依赖于PCR仪的限制。在等温扩增技术中,RPA技术仅需设计1对引物,反应温度为37~42℃,反应时间通常为30 min,灵敏度高,且易与其他技术相结合的特点,使其应用和发展更具优势。本研究根据MDMV CP的保守序列,设计了3对RPA引物,尽管效率和稳定性有差异,但都可以对MDMV进行特异性检测,表明RPA引物的设计难度并不大。进行了引物浓度、反应温度和反应时间的优化,结果显示在引物浓度0.4 μmol/L、反应温度42℃与反应时间20 min条件下扩增效果最好,其中反应温度在37~44.5℃之间均能高效扩增;而扩增时间达到5 min后,就可以通过凝胶电泳观察到阳性反应。以上结果显示出RPA体系的稳定性和高效性。
本研究挑选了玉米中重要的5种病毒作为对照,验证了建立的RPA体系的特异性。通过梯度稀释MDMV-CP参照质粒,检测构建的RPA体系的灵敏度为105拷贝/μL(≈369 fg/μL),灵敏度高于RT-PCR 的106拷贝/μL(≈3.69 pg/μL)。RPA体系易与除凝胶电泳外的其他核酸产物检测方法相结合,如与侧流层析试纸条法(lateral flow dipstick,LFD)相结合,其检测灵敏度是RT-PCR的100倍[25],还可减少总的检测耗时;与CRISPR/Cas报告系统相结合,可增加检测灵敏度[26-27]。本研究构建的RPA体系也有进一步改良的潜力。
以智利来源的MDMV带毒玉米种子为阳性对照,使用本研究建立的RPA技术和RT-PCR[19]方法对国内玉米样品中MDMV的检测结果与MDMV不是我国玉米矮花叶病的主要病原的报道一致[1,6,20]。对来自德国、俄罗斯、乌克兰和美国的部分玉米样品进行检测,均未检测到MDMV,但各口岸屡有截获从阿根廷、智利等南美洲国家进口的携带MDMV的玉米种子[8],因此要利用好高效快速精准的检测方法,重点做好南美洲等疫区进境玉米的检测工作。
