小肠结肠炎耶尔森菌非特异性核酸酶培养条件优化
2022-12-18郭森林李端华李进军
朱 瑜, 郭森林, 高 婷, 王 辂, 李端华, 李进军, 葛 燕, 赵 晨
(成都大学 药学院 四川抗菌素工业研究所, 成都 610106)
非特异性核酸酶(non-specific nuclease)是一类可非特异性降解单链、双链、线状、环状和超螺旋等几乎所有形式的核酸酶[1],被广泛应用于多个领域。在分子生物学研究中非特异性核酸酶可用于核酸结构测定和DNA修复,DNA、RNA的复制与重组,抗病毒试剂的应用等;医药方面,可用于疾病的诊断和治疗,如肿瘤、纤维性囊肿、红斑性狼疮、儿童急性气喘等;工业上主要应用于生物制品中外源核酸的去除[2],减少过敏反应,提高产品安全性。
来源于小肠结肠炎耶尔森菌的非特异性核酸酶(non-specific nuclease fromYersiniaenterocoliticasubsp.Palearctica,Nucyep)热稳定性好[3],80 ℃水浴2 h仍有60%左右的残余酶活,优异的热稳定性增加了其应用的广泛性。目前,重组Nucyep多使用大肠杆菌(Escherichiacoli,E.coli)表达系统进行表达。Boissinot[3]、Fang[4]等在大肠杆菌中成功表达重组Nucyep,但条件优化后仍产量较低;本实验室前期研究[5]对Nucyep基因进行密码子优化并克隆至E.coli,表达量有明显提高,但与绝大多数外源基因类似,Nucyep基因在E.coli系统中易形成包涵体[6],复性步骤复杂,且存在复性收率低、蛋白活性差等问题,为下游纯化及进一步应用带来限制。
枯草芽孢杆菌(Bacillussubtilis,B.subtilis)作为公认的安全菌株(generally recognized as safe,GRAS),具有蛋白分泌能力强、易于高密度发酵、遗传背景清晰等优势,是异源蛋白分泌表达的理想宿主[7]。信号肽(signal peptide,SP)作为一种重要的蛋白分泌调控元件,是一段存在于前体蛋白N-端的短肽链,其功能在于引导和调节前体蛋白的折叠,在蛋白转移和分泌过程中发挥极其重要的作用[8]。B.subtilis缺乏外膜结构,分泌蛋白会转运到胞外培养基中,保证分泌蛋白的正确定位和转移则由信号肽来完成[9]。鉴于Nucyep在E.coli表达系统中重组表达后提取复杂的问题,本研究拟采用B.subtilis表达系统进行Nucyep的分泌表达,以期达到简化下游处理的目的。通过无缝克隆方法将来源于B.subtilis基因组的信号肽DNA混合物随机构建至Nucyep基因的5′端得到重组表达载体,对信号肽进行筛选得到分泌水平最高的菌株。然后对该工程菌进行培养条件的优化,探究重组菌的表达条件对产酶的影响,确定最适培养条件,为该酶的基础研究及未来应用奠定基础。
1 材料与方法
1.1 材料
1.1.1 试剂及材料
硫酸卡那霉素、氨苄青霉素钠购自生工生物工程(上海)股份有限公司;限制性核酸内切酶NdeI和XhoI购自Thermo fisher公司;Plasmid Mini Kit、Gel Extraction Kit等试剂盒购自BioTek公司;限制性核酸内切酶MluI和Eco52 I、DNA Ligation Kit、B.subtilisSecretory Protein Expression System试剂盒购自Takara公司;DNA Marker Ⅳ购自天根生化科技有限公司;胰蛋白胨和酵母提取物购自OXOID公司;葡萄糖及其他无机盐等均购自成都科龙化工有限公司;Millipore超滤离心管(10 ku)购自Merck公司。
1.1.2 培养基
1×LB培养基(g/L):胰蛋白胨10、酵母提取物5、氯化钠10;3×LB培养基(g/L):胰蛋白胨30、酵母提取物15、氯化钠30;2×YT培养基(g/L):胰蛋白胨16、酵母提取物10、氯化钠5(pH 7.0);2×LM培养基(g/L):胰蛋白胨20、酵母提取物10、氯化钠10、一水合麦芽糖75、七水合硫酸镁2。
1.1.3 菌株及质粒
本研究所用菌株和质粒均为本实验室购买和保存,详见表1。

表1 本研究所用的菌株和质粒
1.2 方法
1.2.1 载体pBE-S-nucyep构建及验证
分别扩增提取实验室前期已成功构建的重组表达载体pET24a-nucyep[5]及pBE-S,使用NdeI和XhoI双酶切,1%琼脂糖验证正确后,按Gel Extraction Kit说明书操作,胶回收得到目的片段nucyep及线性载体pBE-S。按DNA Ligation Kit说明书操作,将二者于16 ℃连接过夜获得pBE-S-nucyep。连接产物转化E.coliTop10感受态细胞(转化及感受态制备方法见文献[10]),抗性筛选阳性克隆,扩增提取质粒双酶切验证并委托北京擎科新业生物技术有限公司(下称“北京擎科”)测序,将测序正确的质粒及菌种-20 ℃保存。
1.2.2 分泌表达载体pBE-S-nucyep-SPs的构建
以MluI和Eco52 I双酶切质粒pBE-S-nucyep得到线性化的pBE-S-nucyep,然后使用In-Fusion®HD Cloning Enzyme(无缝克隆酶)将线性化pBE-S-nucyep与带有15 bp重叠末端的B.subtilis信号肽DNA混合物(Takara公司B.subtilisSecretory Protein Expression System试剂盒提供)于50 ℃下温育15 min进行连接。将连接产物转化至E.coliStellar感受态细胞,涂布带抗性的LB琼脂平板培养过夜,得到阳性转化子。将E.coli转化子分别扩增提取质粒DNA,委托北京擎科进行测序,与试剂盒提供的信号肽DNA序列进行比对,将序列正确的质粒pBE-S-nucyep-SPs(SPs代表不同的信号肽DNA)及菌种分别于-20 ℃保存。
1.2.3 高分泌水平工程菌的构建及筛选
为防止含有相同信号肽的克隆被重复筛选,将上述含有不同信号肽DNA序列的载体pBE-S-nucyep-SPs分别转化B.subtilisRIK1285,得到带有不同信号肽DNA的重组工程菌B.subtilisRIK1285/pBE-S-nucyep-SPs。将上述各株重组工程菌分别接种LB培养基,37 ℃,220 r/min过夜培养。再将过夜种子液以体积分数5%接种量接种,37 ℃,220 r/min振荡培养。培养结束后,培养液于4 ℃,8 000 r/min离心10 min,收集培养上清液作为粗酶液直接用于活性检测,由此获得Nucyep分泌活性最高的重组工程菌。
1.2.4 重组Nucyep的分泌表达条件初步优化
将筛选得到的分泌表达水平最高的菌株作为出发菌株,过夜种子液以体积分数5%接种量接种于LB培养基,37 ℃,220 r/min培养表达至48 h并以此为对照进行条件优化。首先对不同培养基条件下Nucyep的分泌表达水平进行考察,选择1×LB、3×LB、2×LM、2×YT等4种不同培养基,取发酵上清液进行活性检测,选取最优分泌表达培养基。在此基础上,对重组工程菌的不同培养条件进行探讨,包括培养总时长(24、36、48、60 和72 h),培养温度(25 ℃、30 ℃、35 ℃、37 ℃),培养基初始pH值(6.1、6.9、7.5、8.0),转速(120、140、160、180、200、220 r/min)。以B.subtilisRIK1285作为阴性对照菌株。
运用Excel软件数据分析模块单因素方差分析[11]对优化结果进行统计学分析,同时对4种因素不同水平间对Nucyep分泌表达的影响结果进行t检验判断其差异程度,检验水准α=0.05。
1.2.5 粗酶液的浓缩及SDS-PAGE分析
培养结束后将培养液于4 ℃,8 000 r/min离心10 min,收集上清液即粗酶液,用Millipore超滤离心管50 mL/10 ku超滤浓缩并做脱盐处理。取40 μL上述浓缩上清液,加入5×上样缓冲液10 μL进行煮沸制样。以实验室前期纯化酶Nucyep为阳性对照品,进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE),电泳结束后用考马斯亮蓝R-250染色并脱色,对电泳结果进行分析。
1.2.6 重组Nucyep的活性测定
采用比光密度法对重组Nucyep进行活性检测。反应体系为36 μL 0.1 μg/μL鲑鱼精子DNA底物溶液(20 mmol/L Tris-HCl,2 mmol/L NaCl,2 mmol/L MgCl2,pH 7.23),加入2 μL发酵上清液混合均匀,即开启反应。反应温度37 ℃,反应时间4 min,加入反应终止液并立即冰浴以终止酶反应[12]。取10 μL反应混合物进行1%琼脂糖凝胶电泳,利用Biorad公司Quantity One(Ver.4.6.6)软件分析各条带,记录光密度值。在上述条件下,酶活单位定义为在37 ℃,pH 7.23的条件下,38 μL的体系中以浓度为0.1 μg/μL的核酸为底物,每分钟使核酸的比光密度值减少1%的酶量定义为1个活性单位(Unit)。
2 结果与分析
2.1 载体pBE-S-nucyep的构建及验证
如图1所示,目的基因nucyep长度为792 bp,对重组载体pBE-S-nucyep双酶切,经1%琼脂糖凝胶电泳分析可见800 bp左右出现目的条带,大小与预期一致,表明pBE-S-nucyep成功构建。

M:Marker IV;1:未酶切质粒pBE-S-nucyep;2:Nde I单酶切质粒pBE-S-nucyep;3:Nde I,Xho I双酶切质粒pBE-S-nucyep。图1 重组载体pBE-S-nucyep双酶切验证结果Figure 1 The double digestion results of plasmid pBE-S-nucyep
2.2 高分泌水平工程菌的构建及筛选
将线性化pBE-S-nucyep与信号肽DNA混合物进行无缝克隆,连接产物转化E.coliStellar感受态细胞并涂布于LB抗性平板,获得53个阳性转化子。扩增提取所有阳性转化子的质粒DNA并测序(包括基因5′端信号肽序列及nucyep基因序列),经比对后共得到43个正确质粒。将上述带不同信号肽的质粒DNA分别转化B.subtilisRIK1285,挑取阳性克隆并进行培养表达,对培养上清液进行Nucyep活性检测。含有不同信号肽重组菌的活性测定结果如图2所示,这表明大部分信号肽都能促进重组酶的分泌表达,且不同信号肽对Nucyep分泌表达的促进作用差异明显。其中,携带有信号肽YoaW的转化子活性最高,光密度下降值达到44.4%。分别对促进分泌表达作用最高的4种信号肽及最低的2种信号肽序列进行分析,结果如表2所示。其中,携带信号肽YoaW、AprE、XynA、Pbp的4个转化子重组Nucyep的分泌表达活性最高,光密度下降值均达到40%以上,而少数如携带信号肽citH、yjiA转化子的发酵上清液中几乎未检测到重组Nucyep的分泌表达活性(光密度下降值<1%),再次说明不同信号肽对Nucyep的分泌效率差异明显。

图2 43株阳性克隆的活性检测Figure 2 Activity assay of 43 positive clones
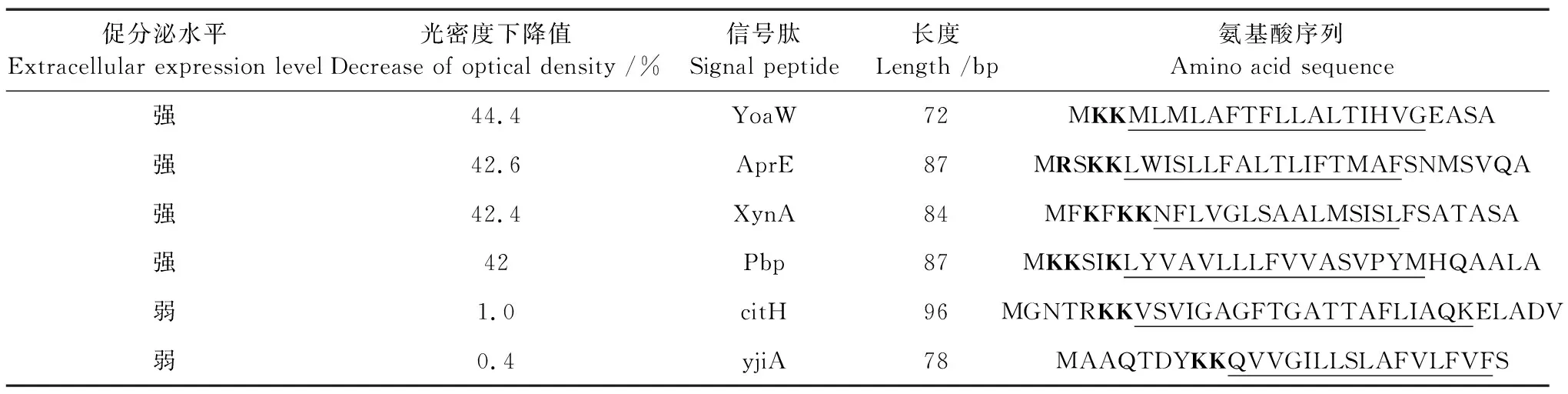
表2 高Nucyep活性克隆的信号肽序列
2.3 重组工程菌分泌表达条件初步优化
2.3.1 不同培养基对Nucyep分泌表达水平的影响
发酵培养基在微生物的生长过程中普遍发挥着重要作用,而其各成分添加量则对微生物合成蛋白质及产酶有重要影响。通过优化发酵培养基及发酵工艺可以充分利用菌株潜力,提高发酵的生产效率,降低生产成本。选取上述分泌水平最高的菌株B.subtilisRIK1285/pBE-S-nucyep-YoaW作为起始菌株进行培养条件的优化。将重组菌在1×LB、3×LB、2×LM、2×YT等4种不同培养基中进行培养,37 ℃,220 r/min培养48 h后离心取上清液进行Nucyep酶活测定,结果如图3所示。3×LB培养基对重组Nucyep的分泌表达效果最好,酶活达到(4.10±0.03) U/μL,约为1×LB培养基中的10倍,且显著高于2×LM、2×YT培养基,说明高含量的碳氮源对重组Nucyep的合成与释放具有显著的促进作用,故选取3×LB为最适培养基,并将其应用于后续培养条件研究。

数值为3个平行实验的平均值±标准差;不同字母表示差异显著(P<0.05)。图3 不同培养基对重组Nucyep酶活的影响Figure 3 Effects of culture media on recombinant Nucyep activity
2.3.2 培养时间对Nucyep酶活的影响
对不同培养时长下的Nucyep活性检测结果如图4所示,当培养时间从24 h至48 h时,B.subtilisRIK1285产酶呈现上升的趋势,酶活由(2.66±0.33) U/μL升高至(4.42±0.43) U/μL,达到最高,这与Irfan等[13]的研究中重组酶的最佳培养时长一致,最高点均出现在48 h。当持续发酵至58 h和72 h时,粗酶液中Nucyep酶活力分别下降至(1.84±0.22) U/μL和(2.95±0.55) U/μL。这可能是由于B.subtilisRIK1285存在分泌至胞外的多种蛋白酶对重组Nucyep具有一定降解作用,导致该阶段活性下降。对不同培养时间下Nucyep酶活测定结果进行单因素方差分析,得到P<0.01,表明不同培养时间对酶活的影响差异极显著。综上,选择48 h为最佳培养时间。
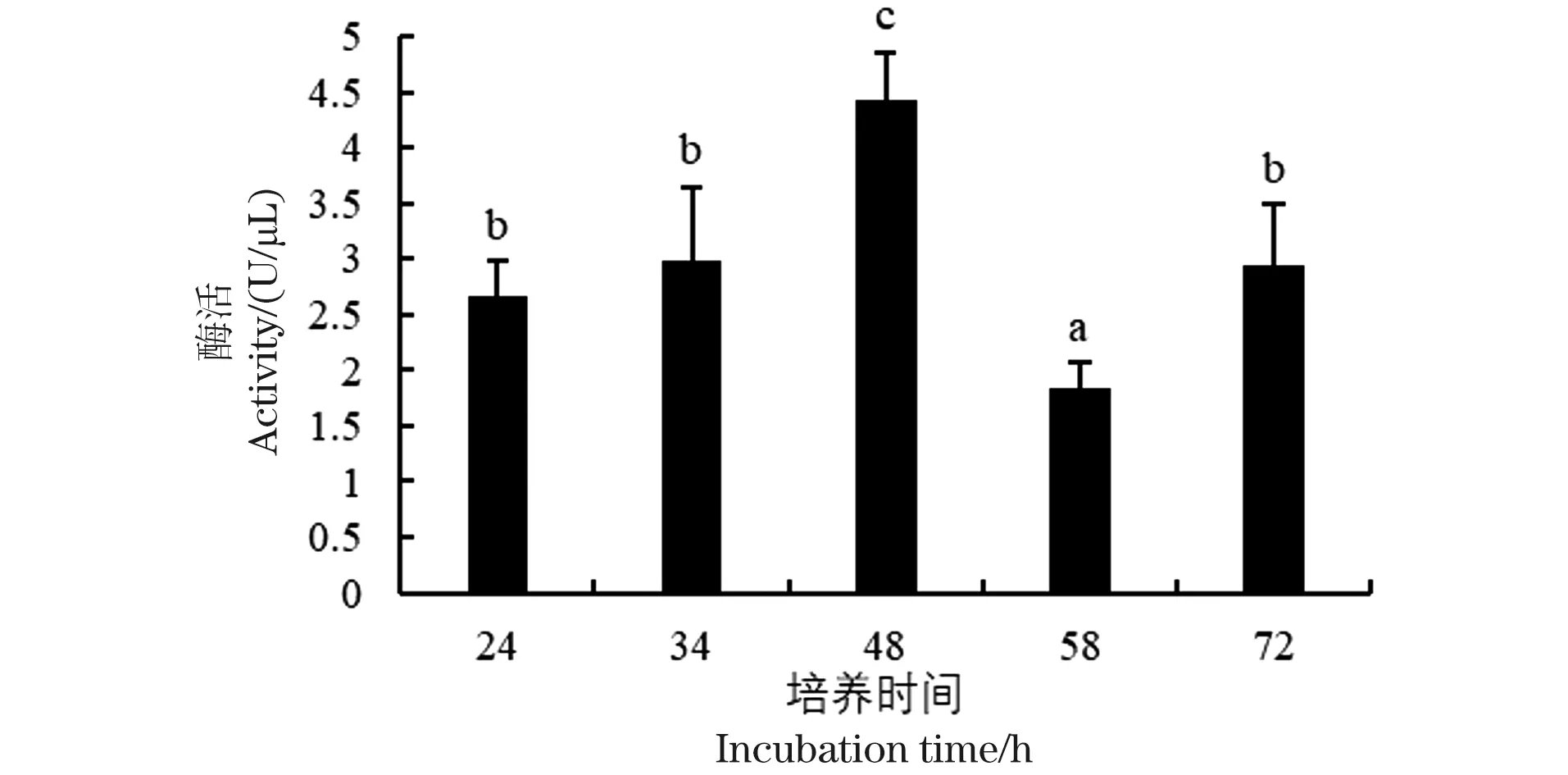
数值为3个平行实验的平均值±标准差;不同字母表示差异显著(P<0.05)。图4 不同培养时间下重组Nucyep酶活Figure 4 Effects of incubation time on recombinant Nucyep activity
2.3.3 培养温度对重组Nucyep酶活的影响
温度主要从发酵动力学特性、菌体代谢产物合成、微生物代谢调节机制、发酵液的理化性质等方面影响产物的合成,因此在发酵过程中必须保证稳定而合适的温度。B.subtilis最佳生长温度为25 ℃~37 ℃[14],且已有不少报道[15-17]对B.subtilis表达异源蛋白进行了研究,其中常用的培养温度范围为30 ℃~37 ℃。研究探讨培养温度分别为25 ℃、30 ℃、35 ℃和37 ℃时重组Nucyep的胞外活性。结果如图5所示,当温度由25 ℃升高至30 ℃时,酶活呈现上升趋势,且在30 ℃时重组Nucyep活性最高,达到(6.71±0.23) U/μL。当培养温度上升至35 ℃及37 ℃时,酶活水平分别出现不同程度的降低,为(2.57±0.70) U/μL和(4.42±0.43) U/μL。对不同温度下的酶活水平进行单因素方差分析,得到P<0.01,表明差异极显著,说明温度对Nucyep的分泌活性具有较大影响。因此,选择30 ℃为最佳培养温度。

数值为3个平行实验的平均值±标准差;不同字母表示差异显著(P<0.05)。图5 不同培养温度对重组Nucyep酶活的影响Figure 5 Effects of incubation temperature on recombinant Nucyep activity
2.3.4 转速、培养基初始pH值对重组Nucyep酶活的影响
研究还探讨了转速对重组Nucyep酶活的影响。结果如图6所示,在低转速120和140 r/min时,培养上清液中Nucyep酶活性偏低,而将转速继续提高,酶活出现较大幅度提升,最高值出现于160 r/min处,酶活达到(6.04±0.44) U/μL。通过对数据的单因素方差分析,得到P=0.001 548<0.05,差异显著。然而通过对160~220 r/min几组不同转速下的Nucyep酶活数据进行组间t检验结果表明,转速在160、180和200 r/min时,3组数据组间差异不显著,而180、200和220 r/min的各组间差异也不显著,这说明在160~220 r/min转速范围内,转速对Nucyep的分泌表达影响并不明显。故研究最终仍选择以不改变初始条件下的220 r/min为后续培养转速。
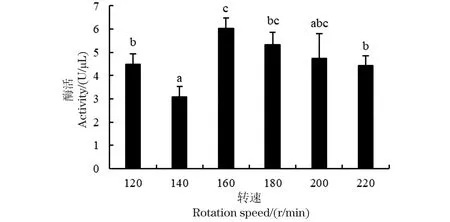
数值为3个平行实验的平均值±标准差;不同字母表示差异显著(P<0.05)。图6 不同转速对重组Nucyep酶活的影响Figure 6 Effects of rotation speed on recombinant Nucyep activity
微生物生长及生物合成都有其最适合的pH值范围,不同芽孢杆菌在生理模式上的差异也导致其产酶的培养条件差别很大。研究表明,枯草芽孢杆菌在pH值为6.5至7.5的条件下生长良好[18]。研究将分别调整培养基初始pH值至6.1~8.0,最终获得Nucyep的分泌活性结果如图7所示,对其进行单因素方差分析结果P=0.020 929<0.05,差异显著,说明培养基不同初始pH值对Nucyep的分泌表达具有一定影响。然而通过对培养基初始pH值下Nucyep酶活的数据进行组间t检验,结果表明培养基初始pH值6.1、6.9、7.5的组间差异均不显著,酶活均处于4~5 U/μL,这说明培养基初始pH值在6.1~7.5重组Nucyep的分泌活性并未受到很大影响,而当初始pH值调整为8.0时,酶活下降为(3.74±0.43) U/μL,说明重组Nucyep在偏碱性条件下分泌表达受到抑制。Wang等[19]的研究也表明有时在培养过程中不对pH值加以调控反而更利于芽孢杆菌的产酶,结合本研究所得结果,同时考虑到简化实验操作,故最终选择以培养基自然pH条件(约为6.8~6.9)为最适培养基初始pH值。

数值为3个平行实验的平均值±标准差;不同字母表示差异显著(P<0.05)。图7 不同初始pH值对重组Nucyep酶活的影响Figure 7 Effects of pH on recombinant Nucyep activity
综上,重组工程菌培养优化后的培养条件为3×LB培养基,体积分数5%接种量,30 ℃,220 r/min振荡培养48 h。
2.4 发酵优化结果验证
根据上述各个因素的优化结果,对该培养条件进行验证,培养结束后对粗酶液进行活性测定,结果如图8所示,优化后Nucyep酶活性具有显著提高,达到(8.27±0.41) U/μL,较优化前提高约20倍。用10 ku的超滤管对粗酶液进行浓缩约20倍并进行脱盐处理,然后进行酶活测定,反应混合物凝胶电泳结果如图9所示,核酸底物几乎被完全降解。超滤浓缩液SDS-PAGE分析见图10,在30 ku左右出现目的条带,与理论值相符[5]。结果均表明,优化后的培养条件下重组Nucyep的胞外分泌表达水平有明显提高,且活性良好。

数值为3个平行实验的平均值±标准差;不同字母表示差异显著(P<0.05)。图8 培养条件优化前后的酶活测定Figure 8 Nucyep activity assay before and after optimization
3 讨论
不同信号肽对目的蛋白的分泌效率差异明显,虽然目前还未发现目的蛋白与其自身最优信号肽之间存在一定特性与规律,但通过对宿主菌信号肽筛选仍是一种有效提高目的蛋白分泌表达的方法。Zhang等[20]建立了信号肽筛选系统,筛选木聚糖酶在B.subtilis中的最适信号肽,通过对Sec途径的114种信号肽和Tac途径的24种信号肽进行筛选,发现Sec途径比Tac途径信号肽更利于木聚糖酶的表达,其中信号肽PhoB为最佳信号肽。Yao等[21]通过高通量筛选系统对B.subtilis信号肽进行筛选,最终获得3种对α-淀粉酶分泌效率提高的信号肽,分泌能力YojL>RpmG>AspB,信号肽YojL使重组酶活提高了3.5倍。

1:NC为阴性对照;2~4:优化前;5~7:优化后;8~10:超滤外液。图9 活性测定反应产物的电泳结果Figure 9 Electrophoresis results of reaction mixture

M: Marker;C: 对照品;1: 浓缩液。图10 浓缩液SDS-PAGEFigure 10 The SDS-PAGE analysis of concentrated supernatant
研究通过无缝克隆法将B.subtilis信号肽DNA混合物构建入Nucyep表达载体,最终获得含有43种不同信号肽的阳性克隆。通过对43株重组工程菌的筛选得到具有高分泌活性的4株,分别含有信号肽YoaW、AprE、XynA、Pbp,对这4株高活性工程菌的信号肽序列及其他信号肽的序列比对分析,可发现信号肽的二级结构与其促分泌性能相关:信号肽N端带正电荷氨基酸数量为2或3,H端结构域的非极性氨基酸越多,对重组Nucyep的分泌表达有促进作用,这与B.subtilis信号肽相关研究[22-24]结论一致,但具体原因仍待进一步研究。因此应进一步加强对信号肽的基础研究及应用,充分了解每种途径中各信号肽的分泌机制及相互作用及其影响因素,为未来枯草芽孢杆菌的高效工业应用提供条件。
研究通过构建并筛选B.subtilis信号肽重组工程菌,实现了Nucyep的胞外分泌表达,并通过对培养条件的初步优化进一步提高了Nucyep的胞外分泌活性。优化后,重组Nucyep分泌活性虽然较初始条件有显著提高,但通过SDS-PAGE不难发现,其蛋白表达水平仍然偏低。这可能因为Nucyep几乎能降解一切形式的核酸,对机体来说属于毒性蛋白,且在B.subtilis中直接以具有活性的形式分泌表达,机体出于自我保护而限制了其表达水平,同时也可能是B.subtilis系统分泌蛋白酶较多而导致胞外分泌蛋白表达量低。蛋白酶基因缺陷菌株B.subtilisWB800、WB600等[25]的开发与应用可将胞外蛋白酶活性降至野生型活性的0.32%,从而提高外源基因的表达,因此后续可尝试敲除蛋白酶的B.subtilis菌株作为表达宿主。鉴于目前还未有利用枯草芽孢杆菌系统重组表达非特异性核酸酶的研究,无法对Nucyep在B.subtilis系统中的表达水平进行比较。但通过与实验室前期在E.coli中表达Nucyep的研究相比较[5],B.subtilisRIK1285培养上清液在浓缩约20倍的情况下,才能达到与E.coli胞内表达大致相当的水平(SDS-PAGE)。此外,由于Nucyep为毒性蛋白,在E.coli中以包涵体形式而非可溶形式表达,这也一定程度上有利其表达水平的提高,而研究旨在利用枯草芽孢杆菌系统良好的分泌性能及通过信号肽筛选以实现Nucyep的高活性分泌表达。通过培养条件优化,结果表明虽然单因素实验方法简单易行,结果表现直观,但存在一定弊端,如多因素考察时间长,实验次数多、成本高,且会割断因素之间的相互影响等。因此,将研究单因素实验优化结果作为基础条件,后期可选择统计学优化法,如Plackett-Burman设计法[26]、响应面方法[4]等对培养条件进行进一步优化,以获得更高的表达水平。
4 结论
研究首次将Nucyep的基因构建进B.subtilis表达系统,筛选信号肽得到工程菌B.subtilisRIK1285/pBE-S-nucyep-YoaW,实现Nucyep的高活性分泌表达。经表达条件优化,该工程菌在3×LB培养基中以体积分数5%接种量,30 ℃,摇床220 r/min振荡培养48 h,重组Nucyep酶活达到(8.27±0.41) U/μL,较优化前提高20倍,为其进一步应用奠定基础。
