土壤Cd胁迫条件下外源NO与EDDS复合处理对紫苜蓿生长、生理和Cd积累的影响
2022-12-16陈银萍赵镇贤丁浚刚王彤彤马骏杰张钰清
陈银萍, 赵镇贤, 丁浚刚, 王彤彤, 马骏杰, 张钰清
(兰州交通大学环境与市政工程学院, 甘肃 兰州 730070)
植物修复技术是利用超富集植物修复重金属污染土壤的一项新兴技术[1,2],但由于超富集植物通常生长缓慢、生物量小,因此修复效率较低,从而限制了该技术的实际应用。修复效率不仅取决于植物对重金属的吸收和积累效率,而且在很大程度上依赖于重金属在土壤中的生物有效性和植物根系吸收重金属的能力。研究表明:施加螯合剂,如乙二胺四乙酸(EDTA)、[s,s]-乙二胺二琥珀酸(EDDS)和氨基三乙酸(NTA)等[3,4],可以活化土壤中的重金属元素,促进重金属离子向植物地上部转移,从而提高东南景天(SedumalfrediiHance)对Cd污染土壤以及黑麦草(LoliumperenneLinn.)对Cu和Zn污染土壤的修复效率。在这些螯合剂中,易被生物降解的EDDS受到更为广泛的关注[5],例如:EDDS和NTA能诱导豨莶(SigesbeckiaorientalisLinn.)[6]和蕹菜(IpomoeaaquaticaForsk.)[7]有效修复Cd污染土壤;EDDS还能增加三叶鬼针草(BidenspilosaLinn.)对Cd的吸收和富集能力[8]。此外,微生物[9]和激素[10]等联合作用,能够强化EDDS和EDTA等对Cd和Pb污染土壤的修复效应,例如,植物生长调节剂(DA-6和6-BA)与EDDS联合施用可促进龙葵(SolanumnigrumLinn.)的生长和Cd吸收[11]。
一氧化氮(NO)是植物生长调节信号分子之一,并参与植物对各种重金属胁迫的信号应答[12]。在重金属胁迫条件下,适宜浓度的外源NO可以通过提高植物抗氧化酶系统的活性来缓解胁迫伤害[13];并通过促进纤维素的合成提高植物对重金属的吸收和累积能力,提升叶绿素含量或修复损伤的叶绿体,从而增强植物的光合能力[14,15]。但是,目前关于NO与螯合剂联用对植物生长和Cd吸收的影响效应尚缺乏明确的研究结论。
紫苜蓿(MedicagosativaLinn.)为多年生草本植物,具有生长快、适应能力强、根系发达、枝叶繁多、产量高等特点,并具有清除土壤中Cd、Cu、Zn等重金属的潜力,是一种很有应用前景的污染土壤修复植物[16]。为了探究NO与螯合剂联用对植物修复Cd污染土壤的作用效应,作者以紫苜蓿幼苗为研究材料,采用盆栽法研究了土壤Cd胁迫条件下不同浓度硝普钠(SNP)和EDDS单一处理及复合处理对紫苜蓿生长、生理和Cd积累的影响,并对紫苜蓿生长和Cd积累指标间及其与SNP和EDDS浓度的相关性进行分析,以期明确NO与EDDS协同处理对植物修复Cd污染土壤的作用机制,为Cd污染土壤植物修复强化技术的应用提供科学依据。
1 材料和方法
1.1 材料
紫苜蓿品种‘甘农3号’(‘Gannong No. 3’)种子购于甘肃省农业科学研究院。EDDS和SNP均购自Sigma-Aldrich上海贸易有限公司,0.15 mmol·L-1SNP大约可产生小于0.2 μmol·L-1的NO[17]。
供试土壤为甘肃省兰州市榆中县周边村庄农耕土的表层(0~20 cm)土壤,营养土购自兰州市西固区林产品开发公司。将土壤风干后粉碎,过孔径2 mm筛,与营养土等质量混匀,称取2 kg混合基质分装于配有托盘的花盆中(口径20 cm、高度15 cm),以CdCl2·2.5H2O模拟Cd污染土壤,以溶液的形式加入土壤中,直至土壤本底Cd质量浓度达到15 mg·kg-1;适量浇水,不定期翻动土壤,平衡21 d后开始实验。
1.2 方法
1.2.1 幼苗培育方法 选取饱满均匀的紫苜蓿种子,用体积分数1%NaClO溶液浸泡10 min,再用超纯水冲洗干净,晾干后播种至上述Cd污染土壤中,播种深度0.5 cm;置于温度20 ℃~25 ℃、色温6 500 K的条件下培养,光照时间为6:00—20:00;培养期间不定期更换花盆位置以消除边际效应。待种子发芽后间苗,每盆保留55株。在幼苗生长过程中,以自来水(未检测出Cd)浇灌,使土壤含水量保持在幼苗正常生长所需水平,不定期收集托盘中的渗漏液并倒回花盆中以防土壤中的Cd和养分流失,待紫苜蓿幼苗生长60 d后,用于SNP和EDDS处理。
1.2.2 实验设计和处理方法 参考项目组前期的研究结果[16]确定SNP和EDDS的处理浓度,并设计单一和复合2类处理。SNP单一处理设置4个处理组:0.05 mmol·L-1SNP(T1S)、0.10 mmol·L-1SNP(T2S)、0.20 mmol·L-1SNP(T3S)和0.30 mmol·L-1SNP(T4S)。EDDS单一处理设置2个处理组:0.50 mmol·L-1EDDS(T1E)和1.50 mmol·L-1EDDS(T2E)。SNP和EDDS复合处理设置8个处理组:0.05 mmol·L-1SNP-0.50 mmol·L-1EDDS(T1S-1E)、0.10 mmol·L-1SNP-0.50 mmol·L-1EDDS(T2S-1E)、0.20 mmol·L-1SNP-0.50 mmol·L-1EDDS(T3S-1E)、0.30 mmol·L-1SNP-0.50 mmol·L-1EDDS(T4S-1E)、0.05 mmol·L-1SNP-1.50 mmol·L-1EDDS(T1S-2E)、0.10 mmol·L-1SNP-1.50 mmol·L-1EDDS(T2S-2E)、0.20 mmol·L-1SNP-1.50 mmol·L-1EDDS(T3S-2E)和0.30 mmol·L-1SNP-1.50 mmol·L-1EDDS(T4S-2E)。以不施用SNP和EDDS的Cd处理为对照(TCK)。
根据上述实验设计配制不同浓度SNP和EDDS溶液,分别取100 mL SNP溶液喷施于紫苜蓿地上部分,取100 mL EDDS溶液施入土壤中,对照则施用同体积超纯水。每处理3盆,每盆视为1个重复,处理7 d后测定各指标。
1.2.3 生长指标及根系活力和叶片光合色素含量测定 在不同处理的每个盆中各取5株完整植株,抖落根系土壤,依次用自来水和超纯水分别冲洗3次,吸干表面水分,用直尺(精度1 mm)测量主根长和株高;将地上部与地下部分开,使用FA2204B型万分之一电子天平(上海越平科学仪器有限公司)称量地上部和地下部的鲜质量;随后于105 ℃杀青30 min,并于75 ℃烘干至恒质量,冷却后分别称量地上部和地下部的干质量[18]。称取紫苜蓿幼苗新鲜根系0.5 g,参照李合生[19]的方法测定根系活力;称取紫苜蓿幼苗鲜叶0.2 g,参照李玲[20]的方法测定叶绿素a、叶绿素b、总叶绿素和类胡萝卜素的含量。
1.2.4 植物和土壤中Cd含量测定 将烘干的地上部和地下部研磨成粉末,过孔径0.18 mm筛,分别称取0.5 g,参照文献[21]中的方法,采用HNO3-HClO4体系进行消解处理,并用超纯水定容至25 mL,用于Cd含量测定。
采用四分法采集盆中土壤,风干后研碎,过孔径0.25 mm筛;称取土壤样品0.5 g,参照文献[22]中的方法,采用HNO3-HCl-HF-HClO4体系进行消解处理,并用超纯水定容至50 mL,用于Cd含量测定。
用220型火焰原子吸收分光光度计(美国Nicolet公司)测定植物和土壤样品的Cd含量[23],并计算Cd富集系数、Cd转运系数和Cd修复效率,其中,Cd富集系数=植物Cd含量/处理后土壤Cd含量;Cd转运系数=植物地上部Cd含量/植物地下部Cd含量;Cd修复效率=〔(处理前土壤Cd含量-处理后土壤Cd含量)/处理前土壤Cd含量〕×100%。
1.2.5 不同亚细胞组分中Cd含量测定 参照徐君等[24]的方法测定不同亚细胞组分中Cd含量并略加改动:取不同处理的完整植株,先用自来水冲洗干净,再用20 mmol·L-1Na2-EDTA溶液交换15 min,以除去根表面吸附的Cd2+,用超纯水洗净并吸干植株表面水分,将地上部和地下部分开,分别称取2 g,加入5 mL预冷的提取液〔含250 mmol·L-1蔗糖、50 mmol·L-1Tris-HCl(pH 7.4)、1 mmol·L-1二硫赤藓糖醇(C4H10O2S2),4 ℃〕,冰浴研磨至匀浆,于4 ℃下600g离心10 min,沉淀为细胞壁组分;上清液于4 ℃下1 000g离心20 min,沉淀为细胞器组分;上清液于4 ℃下10 000g离心20 min,沉淀为线粒体组分;上清液为可溶部分(含细胞质、细胞液、核糖和各类蛋白质等),可直接用于Cd含量测定。细胞壁、细胞器和线粒体组分则参照文献[21]中的方法,采用HNO3-HClO4体系进行消解处理,并用超纯水定容至25 mL;用220型火焰原子分光光度计分别测定各亚细胞组分中的Cd含量。
1.3 数据统计与分析
采用EXCEL 2019软件进行数据处理;采用SPSS 23.0软件进行单因素方差分析(one-way ANOVA)、Duncan’s多重比较及Pearson相关性分析(双尾检验)。
2 结果和分析
2.1 土壤Cd胁迫条件下SNP和EDDS处理对紫苜蓿生长的影响
土壤Cd胁迫条件下经不同浓度SNP和EDDS处理后紫苜蓿株高、根长以及地上部和地下部的鲜质量和干质量的差异见表1。
结果显示:土壤Cd胁迫条件下,不同浓度SNP单一处理使紫苜蓿的株高、主根长、地上部的鲜质量和干质量、地下部的鲜质量和干质量均高于对照,其中,株高与对照差异显著(P<0.05),0.10和0.20 mmol·L-1SNP单一处理组地上部鲜质量与对照差异显著,0.20和0.30 mmol·L-1SNP单一处理组地下部的鲜质量和干质量以及0.10、0.20和0.30 mmol·L-1SNP单一处理组地上部干质量也与对照差异显著,但4个SNP单一处理组的主根长与对照无显著差异。随SNP浓度的升高,各项生长指标均呈先升高后降低的变化趋势,其中,0.20 mmol·L-1SNP单一处理组各项生长指标均最高,较对照分别增加了75.81%、106.23%、108.06%、79.78%和229.17%。
由表1可以看出:土壤Cd胁迫条件下,0.50 mmol·L-1EDDS单一处理使紫苜蓿株高、地上部的鲜质量和干质量、地下部的鲜质量和干质量均不同程度提高,较对照分别增加了35.48%、30.03%和66.13%、35.96%和95.83%,而主根长则较对照减小,但无显著差异。经不同浓度SNP与0.50 mmol·L-1EDDS复合处理后,紫苜蓿的各项生长指标总体上随SNP浓度升高呈先升高后降低的变化趋势。其中,SNP浓度为0.10 mmol·L-1时,紫苜蓿的株高、主根长、地上部鲜质量和地下部干质量最高,较0.50 mmol·L-1EDDS单一处理组分别增加了47.05%、29.82%、59.91%和72.34%;SNP浓度为0.20 mmol·L-1时,紫苜蓿的地上部干质量和地下部鲜质量最高,较0.50 mmol·L-1EDDS单一处理组分别增加了49.51%和51.24%。
由表1还可以看出:土壤Cd胁迫条件下,1.50 mmol·L-1EDDS单一处理使紫苜蓿株高、地上部的鲜质量和干质量、地下部的鲜质量和干质量均不同程度提高,较对照分别增加了31.94%、70.82和53.23%、25.84%和100.00%,而主根长则较对照减小,但无显著差异。经不同浓度SNP与1.50 mmol·L-1EDDS复合处理后,紫苜蓿的株高、主根长、地上部的鲜质量和干质量、地下部鲜质量均随SNP浓度升高呈先升高后降低的变化趋势,而地上部鲜质量随SNP浓度升高大体呈逐渐降低的变化趋势。其中,SNP浓度为0.10 mmol·L-1时,紫苜蓿的株高、地上部干质量和地下部鲜质量最高,较1.50 mmol·L-1EDDS单一处理组分别增加了33.25%、35.79%和25.00%;SNP浓度为0.05 mmol·L-1时,主根长和地下部干质量最高,较1.50 mmol·L-1EDDS单一处理组分别增加了20.25%和25.00%。
比较可见,经SNP与0.50 mmol·L-1EDDS复合处理,紫苜蓿的多项生长指标高于同浓度SNP与1.50 mmol·L-1EDDS复合处理组,部分指标也高于同浓度SNP单一处理组。0.10 mmol·L-1SNP与0.50 mmol·L-1EDDS复合处理组的株高、地上部鲜质量和地下部干质量在所有处理组中最高,而0.20 mmol·L-1SNP与0.50 mmol·L-1EDDS复合处理组的地上部干质量和地下部鲜质量在所有处理组中最高。
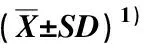
表1 土壤Cd胁迫条件下SNP和EDDS处理对紫苜蓿生长的影响
2.2 土壤Cd胁迫条件下SNP和EDDS处理对紫苜蓿根系活力和叶片光合色素含量的影响
土壤Cd胁迫条件下经不同浓度SNP和EDDS处理后紫苜蓿根系活力及叶片光合色素含量的差异见表2。
结果显示:土壤Cd胁迫条件下,不同浓度SNP单一处理使紫苜蓿根系活力和叶片光合色素含量高于对照,其中,经0.10~0.30 mmol·L-1SNP单一处理后根系活力和各项叶绿素含量指标均显著高于对照,但类胡萝卜素含量无显著差异。随SNP浓度的升高,紫苜蓿根系活力和类胡萝卜素含量逐渐增高,在SNP浓度为0.30 mmol·L-1时达到最大值,较对照分别增加了110.01%和24.81%;叶绿素a、叶绿素b和总叶绿素含量随SNP浓度升高呈先升高后降低的变化趋势,在SNP浓度为0.20 mmol·L-1时最高,较对照分别增加了37.67%、26.06%和34.06%。
由表2可以看出:土壤Cd胁迫条件下,0.50 mmol·L-1EDDS单一处理使紫苜蓿叶绿素b和总叶绿素含量显著减少,较对照分别减少了12.96%和5.76%;而根系活力、叶绿素a含量和类胡萝卜素含量则与对照无显著差异。经不同浓度SNP与0.50 mmol·L-1EDDS复合处理后,紫苜蓿根系活力和光合色素含量高于对照和0.50 mmol·L-1EDDS单一处理组,且总体上差异显著。随SNP浓度升高,SNP与0.50 mmol·L-1EDDS复合处理组的根系活力和光合色素含量均呈先升高后降低的变化趋势。其中,SNP浓度为0.10 mmol·L-1时,根系活力以及叶绿素a、叶绿素b、类胡萝卜素和总叶绿素的含量均最高,较0.50 mmol·L-1EDDS单一处理组分别增加了149.68%、44.82%、57.96%、38.09%和48.58%。
由表2还可以看出:土壤Cd胁迫条件下,1.50 mmol·L-1EDDS单一处理使紫苜蓿叶绿素a和类胡萝卜素含量较对照分别增加了8.02%和12.52%,且差异显著;而叶绿素b含量较对照降低了5.46%,且差异显著;根系活力和总叶绿素含量高于对照,但差异不显著。经0.05~0.20 mmol·L-1SNP与1.50 mmol·L-1EDDS复合处理后,紫苜蓿的根系活力及光合色素含量总体上均高于对照和1.50 mmol·L-1EDDS单一处理组,且差异显著。随SNP浓度升高,SNP与1.50 mmol·L-1EDDS复合处理组的根系活力和光合色素含量总体上呈先升高后降低的变化趋势。其中,SNP浓度为0.20 mmol·L-1时,根系活力最高,较1.50 mmol·L-1EDDS单一处理组增加了52.67%;在SNP浓度为0.05 mmol·L-1时,叶绿素a、叶绿素b、类胡萝卜素和总叶绿素的含量均最高,较1.50 mmol·L-1EDDS单一处理组分别增高了19.60%、29.21%、13.16%和22.32%。
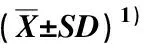
表2 土壤Cd胁迫条件下SNP和EDDS处理对紫苜蓿根系活力和叶片光合色素含量的影响
比较可见,0.10 mmol·L-1SNP与0.50 mmol·L-1EDDS复合处理组的根系活力和光合色素含量在所有处理组中均最高。
2.3 土壤Cd胁迫条件下SNP和EDDS处理对紫苜蓿Cd积累及Cd转运和修复效率的影响
土壤Cd胁迫条件下经不同浓度SNP和EDDS处理后紫苜蓿Cd含量、Cd转运系数和Cd富集系数以及土壤Cd含量和Cd修复效率见表3。
结果显示:土壤Cd胁迫条件下,不同浓度SNP单一处理使紫苜蓿地上部和地下部Cd含量、Cd转运系数、地上部和地下部的Cd富集系数以及Cd修复效率均高于对照,土壤Cd含量均低于对照,且差异显著。随SNP浓度升高,地上部的Cd含量和Cd富集系数均呈逐渐升高的变化趋势,而地下部的Cd含量和Cd富集系数以及Cd修复效率均呈先升高后降低的变化趋势,土壤Cd含量呈先降低后升高的变化趋势。其中,SNP浓度为0.30 mmol·L-1时,地上部的Cd含量和Cd富集系数以及Cd转运系数均最高,较对照分别增加了82.29%、29.03%和85.58%;地下部的Cd含量和Cd富集系数以及Cd修复效率也较高,较对照分别增加了42.57%、45.62%和66.89%;土壤Cd含量较对照减少了1.99%。

表3 土壤Cd胁迫条件下SNP和EDDS处理对紫苜蓿Cd含量、Cd转运系数和Cd富集系数以及土壤Cd含量和Cd修复效率的影响
由表3可以看出:土壤Cd胁迫条件下,0.50 mmol·L-1EDDS单一处理使紫苜蓿地上部和地下部的Cd含量、Cd转运系数、地上部和地下部的Cd富集系数以及Cd修复效率均高于对照,其中,地上部Cd含量、Cd转运系数、地上部Cd富集系数以及Cd修复效率均与对照差异显著。经不同浓度SNP与0.50 mmol·L-1EDDS复合处理后,紫苜蓿地上部和地下部Cd含量、地上部和地下部Cd富集系数及Cd修复效率均高于对照和0.50 mmol·L-1EDDS单一处理组;而Cd转运系数则高于对照但低于0.50 mmol·L-1EDDS单一处理组,且差异显著;土壤Cd含量低于对照和0.50 mmol·L-1EDDS单一处理组,且与对照差异显著。其中,SNP浓度为0.10 mmol·L-1时,地下部的Cd含量和Cd富集系数均最高,较0.50 mmol·L-1EDDS单一处理组分别增加了99.72%和81.03%;SNP浓度为0.20 mmol·L-1时,地上部的Cd含量和Cd富集系数以及Cd修复效率均最高,较0.50 mmol·L-1EDDS单一处理组分别增加了33.62%、36.05%和42.66%,土壤Cd含量最低,较0.50 mmol·L-1EDDS单一处理组降低了1.95%。
由表3还可以看出:土壤Cd胁迫条件下,1.50 mmol·L-1EDDS单一处理使紫苜蓿地上部和地下部的Cd含量、Cd转运系数、地上部和地下部的Cd富集系数以及Cd修复效率均高于对照,而土壤Cd含量低于对照,且差异显著。经不同浓度SNP与1.50 mmol·L-1EDDS复合处理后,紫苜蓿地上部和地下部的Cd含量、地上部和地下部的Cd富集系数和Cd修复效率均高于对照,且差异显著。与1.50 mmol·L-1EDDS单一处理组相比,0.05 mmol·L-1SNP与1.50 mmol·L-1EDDS复合处理组的各项指标均无显著差异,而其他复合处理组各项指标均较1.50 mmol·L-1EDDS单一处理组存在不同程度差异。其中,经0.10~0.30 mmol·L-1SNP与1.50 mmol·L-1EDDS复合处理后,紫苜蓿地下部的Cd含量和Cd富集系数及土壤Cd含量均高于1.50 mmol·L-1EDDS单一处理组,而Cd转运系数和Cd修复效率则均低于后者,且差异显著;仅0.30 mmol·L-1SNP与1.50 mmol·L-1EDDS复合处理组地上部的Cd含量和Cd富集系数显著低于1.50 mmol·L-1EDDS单一处理组。
比较可见,1.50 mmol·L-1EDDS单一处理组地上部和地下部的Cd含量和Cd富集系数以及Cd转运系数和Cd修复效率均高于0.50 mmol·L-1EDDS单一处理组,土壤Cd含量则低于0.50 mmol·L-1EDDS单一处理组。0.10 mmol·L-1SNP与0.50 mmol·L-1EDDS复合处理组的地下部Cd含量和Cd富集系数在所有处理组中均最高,0.20 mmol·L-1SNP与0.50 mmol·L-1EDDS复合处理组的地上部Cd含量和Cd富集系数以及Cd修复效率在所有处理组中均最高,而土壤Cd含量在所有处理组中最低。
总体上看,紫苜蓿地下部的Cd含量和Cd富集系数大幅度高于地上部,表明根系是紫苜蓿吸收和积累Cd的主要器官。
2.4 土壤Cd胁迫条件下SNP和EDDS处理对紫苜蓿不同亚细胞组分中Cd含量的影响
土壤Cd胁迫条件下经不同浓度SNP和EDDS处理后紫苜蓿地上部和地下部不同亚细胞组分中Cd含量的差异分别见表4和表5。
2.4.1 地上部亚细胞组分中Cd含量的差异 结果显示:在土壤Cd胁迫条件下,不同浓度SNP单一处理总体上使紫苜蓿地上部各亚细胞组分的Cd含量较对照显著增加。随SNP浓度升高,地上部各亚细胞组分的Cd含量总体上呈逐渐升高的变化趋势,SNP浓度为0.30 mmol·L-1时,地上部细胞壁、细胞器和可溶部分的Cd含量均最高,较对照分别增加了64.81%、52.41%和95.36%。
由表4可以看出:土壤Cd胁迫条件下,0.50 mmol·L-1EDDS单一处理以及不同浓度SNP与0.50 mmol·L-1EDDS复合处理均可使紫苜蓿地上部各亚细胞组分的Cd含量较对照显著增加。经不同浓度SNP与0.50 mmol·L-1EDDS复合处理后,紫苜蓿地上部细胞壁和可溶部分的Cd含量均较0.50 mmol·L-1EDDS单一处理组显著增加,且随SNP浓度升高均呈先升高后降低的变化趋势,在SNP浓度为0.20 mmol·L-1时最高,较0.50 mmol·L-1EDDS单一处理组分别增加了17.39%和49.24%;而细胞器和线粒体的Cd含量总体上与后者无显著差异。
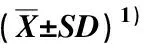
表4 土壤Cd胁迫条件下SNP和EDDS处理对紫苜蓿地上部的亚细胞组分中Cd含量的影响
由表4还可以看出:土壤Cd胁迫条件下,1.50 mmol·L-1EDDS单一处理以及不同浓度SNP与1.50 mmol·L-1EDDS复合处理均可使紫苜蓿地上部各亚细胞组分的Cd含量较对照显著增加。经不同浓度SNP与1.50 mmol·L-1EDDS复合处理后,紫苜蓿地上部细胞壁、细胞器和线粒体的Cd含量均低于1.50 mmol·L-1EDDS单一处理组,且总体上随SNP浓度升高呈逐渐降低的变化趋势,其中,与1.50 mmol·L-1EDDS单一处理组相比,细胞壁和细胞器的Cd含量无显著差异,0.10~0.30 mmol·L-1SNP与1.50 mmol·L-1EDDS复合处理组的线粒体Cd含量则差异显著;可溶部分Cd含量随SNP浓度升高呈先升高后降低的变化趋势,在SNP浓度为0.10 mmol·L-1时最高,较1.50 mmol·L-1EDDS单一处理组增加了8.98%。
总体上看,在所有处理组中,紫苜蓿地上部细胞壁、细胞器和线粒体的Cd含量均以1.50 mmol·L-1EDDS单一处理组最高,可溶部分Cd含量则以0.10 mmol·L-1SNP与1.50 mmol·L-1EDDS复合处理组最高。
2.4.2 地下部亚细胞组分中Cd含量的差异 由表5可见:在土壤Cd胁迫条件下,不同浓度SNP单一处理总体上可使紫苜蓿地下部细胞器和可溶部分的Cd含量较对照显著升高,但线粒体的Cd含量与对照无显著差异;而细胞壁的Cd含量则在SNP浓度为0.05和0.10 mmol·L-1时显著低于对照,在SNP浓度为0.20 mmol·L-1时显著高于对照。随SNP浓度升高,地下部各亚细胞组分的Cd含量总体上呈波动升高的变化趋势。其中,SNP浓度为0.20 mmol·L-1时,细胞壁和可溶部分的Cd含量最高,较对照分别增加了3.39%和141.86%。
由表5可以看出:在土壤Cd胁迫条件下,0.50 mmol·L-1EDDS单一处理使紫苜蓿地下部细胞器、线粒体和可溶部分的Cd含量显著高于对照,但细胞壁的Cd含量显著低于对照。经不同浓度SNP与0.50 mmol·L-1EDDS复合处理,地下部细胞壁和可溶部分的Cd含量显著高于对照和0.50 mmol·L-1EDDS单一处理组,且随SNP浓度升高均呈先高后低的变化趋势;线粒体的Cd含量显著高于对照,但与0.50 mmol·L-1EDDS单一处理组无显著差异;而细胞器的Cd含量显著低于0.50 mmol·L-1EDDS单一处理组,且仅0.10 mmol·L-1SNP与0.50 mmol·L-1EDDS复合处理组的Cd含量显著高于对照,其他复合处理组与对照无显著差异。SNP浓度为0.20 mmol·L-1时,地下部可溶部分Cd含量最高,较0.50 mmol·L-1EDDS单一处理组增加了149.56%;SNP浓度为0.10 mmol·L-1时,地下部细胞壁的Cd含量最高,较0.50 mmol·L-1EDDS单一处理组增加了65.19%。
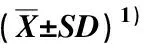
表5 土壤Cd胁迫条件下SNP和EDDS处理对紫苜蓿地下部的亚细胞组分中Cd含量的影响
由表5还可以看出:在土壤Cd胁迫条件下,经1.50 mmol·L-1EDDS单一处理后紫苜蓿地下部可溶部分的Cd含量显著高于对照,但细胞壁、细胞器和线粒体的Cd含量与对照无显著差异。经不同浓度SNP与1.50 mmol·L-1EDDS复合处理,地下部各亚细胞组分的Cd含量均随SNP浓度升高呈“降低—升高—降低”的变化趋势;0.10~0.30 mmol·L-1SNP与1.50 mmol·L-1EDDS复合处理组地下部细胞壁、线粒体和可溶部分的Cd含量显著高于对照和1.50 mmol·L-1EDDS单一处理组;与对照和1.50 mmol·L-1EDDS单一处理组相比,0.05 mmol·L-1SNP与1.50 mmol·L-1EDDS复合处理组地下部细胞壁和线粒体的Cd含量无显著差异,但细胞器的Cd含量显著降低,可溶部分的Cd含量较对照显著增加,但与1.50 mmol·L-1EDDS单一处理组无显著差异。SNP浓度为0.10 mmol·L-1时,地下部细胞器、线粒体和可溶部分的Cd含量均最高,较1.50 mmol·L-1EDDS单一处理组分别增加了32.91%、42.43%和46.41%;SNP浓度为0.20 mmol·L-1时地下部细胞壁的Cd含量最高,较1.50 mmol·L-1EDDS单一处理组增加了32.51%。
总体分析发现,不论是地上部还是地下部,细胞壁和可溶部分的Cd含量均大幅度高于细胞器和线粒体的Cd含量,Cd含量从高至低依次为细胞壁、可溶部分、细胞器、线粒体,表明Cd主要沉积于细胞壁和细胞质(液泡)中;且地下部各亚细胞组分的Cd含量明显高于地上部,表明根系是紫苜蓿Cd吸收和积累的主要器官。比较可见,SNP与0.50和1.50 mmol·L-1EDDS复合处理后,各亚细胞组分的Cd含量大多高于同浓度SNP单一处理组。
2.5 紫苜蓿生长和Cd积累指标间及其与SNP和EDDS浓度的相关性
在土壤Cd胁迫条件下,紫苜蓿地上部和地下部生长和Cd积累指标间及其与不同处理组SNP浓度和EDDS浓度的相关系数分别见表6、表7和表8。

表6 土壤Cd胁迫条件下SNP和EDDS处理后紫苜蓿地上部生长和Cd积累指标间的相关系数1)

表7 土壤Cd胁迫条件下SNP和EDDS处理后紫苜蓿地下部生长和Cd积累指标间的相关系数1)
2.5.1 地上部生长和Cd积累指标间的相关性 由表6可见:在SNP单一处理条件下,紫苜蓿地上部干质量与鲜质量呈极显著正相关,Cd含量与Cd富集系数也呈极显著正相关。经不同浓度SNP与0.50 mmol·L-1EDDS复合处理后,仅株高与地上部干质量、Cd含量和Cd富集系数的相关性未达显著水平,其他指标间均呈极显著或显著正相关。在EDDS单一处理和不同浓度SNP与1.50 mmol·L-1EDDS复合处理条件下,仅Cd含量与Cd富集系数呈极显著正相关,其他指标间的相关性均未达显著水平。
2.5.2 地下部生长和Cd积累指标间的相关性 由表7可见:在SNP单一处理条件下,紫苜蓿地下部仅主根长与其他指标间的相关性未达显著水平,其他4个指标间均呈极显著正相关。在EDDS单一处理条件下,仅主根长与干质量呈显著负相关,Cd含量与Cd富集系数呈显著正相关;经不同浓度SNP与0.50 mmol·L-1EDDS复合处理后,仅干质量与主根长和Cd含量呈显著正相关,Cd含量与Cd富集系数呈极显著正相关;经不同浓度SNP与1.50 mmol·L-1

表8 土壤Cd胁迫条件下SNP和EDDS处理浓度与紫苜蓿地上部和地下部生长和Cd积累指标的相关系数1)
EDDS复合处理后,仅鲜质量与干质量以及Cd含量与Cd富集系数呈极显著正相关。
2.5.3 生长和Cd积累指标与SNP和EDDS处理浓度的相关性 由表8可见:在SNP单一处理条件下,紫苜蓿地上部Cd含量和Cd 富集系数均与SNP浓度呈显著正相关,地下部的鲜质量、干质量、Cd含量和Cd富集系数也与SNP浓度呈显著正相关。经SNP与0.50 mmol·L-1EDDS复合处理后,SNP浓度与地上部和地下部的各项生长指标均呈正相关,但相关性未达显著水平;而经SNP与1.50 mmol·L-1EDDS复合处理后,SNP浓度与地上部和地下部的各项生长指标均呈不显著负相关,与地上部的Cd含量和Cd富集系数呈显著负相关,与地下部的Cd含量和Cd富集系数呈不显著正相关。在EDDS单一处理条件下,紫苜蓿地上部和地下部的各项生长和Cd积累指标均与EDDS浓度无显著相关性。
3 讨论和结论
3.1 外源NO和EDDS处理对土壤Cd胁迫条件下紫苜蓿生长的影响效应
修复植物的生物量是权衡修复效率及筛选修复植物的重要因子和指标。作者在前期研究中[25]发现,与对照相比,低浓度Cd处理能促进紫苜蓿幼苗根和茎的生长,提高叶片叶绿素含量,增强SOD和POD活性,并以此缓解Cd胁迫造成的膜脂过氧化损伤。本研究中,在土壤15 mg·kg-1Cd胁迫条件下,单施不同浓度SNP和EDDS也能够促进紫苜蓿地上部的生长及地上部和地下部的干物质积累,但随SNP和EDDS浓度的升高,这种促进作用减弱,这与周万海等[26]的研究结果一致。
研究结果表明:SNP与EDDS复合处理对紫苜蓿生长及部分生理指标的影响效应因SNP与EDDS浓度不同存在明显差异,其中,0.10 mmol·L-1SNP与0.50 mmol·L-1EDDS复合处理对紫苜蓿的株高、主根长、地上部和地下部的鲜质量和干质量,以及根系活力及光合色素含量均有不同程度的促进作用,但若SNP和EDDS浓度分别超过0.20和0.50 mmol·L-1,二者复合处理对紫苜蓿的生长指标、根系活力以及光合色素含量具有不同程度的抑制作用,说明适宜浓度的SNP与EDDS复合处理具有“协同作用”,能有效促进紫苜蓿幼苗的生长。杨波等[8]的研究结果也表明:Cd胁迫条件下,使用较低浓度的EDDS有利于三叶鬼针草幼苗的生长;蒋文博等[27]认为,在低盐胁迫下,SNP浓度超过一定量时对植物生物量有显著抑制作用。造成上述结果的原因可能是高浓度EDDS可增强重金属的溶解性,破坏植株体内的矿质元素平衡,从而导致生物膜结构破坏、细胞代谢紊乱,使光合色素的合成和积累减少,抑制光合作用,最终影响植株的生长发育[28];此外,过量的外源NO也可抑制光合色素合成,破坏光合电子传递链,造成DNA损伤,并抑制植株的生长发育[29]。
3.2 外源NO和EDDS处理对土壤Cd胁迫条件下紫苜蓿Cd吸收和积累的影响效应
将螯合剂应用于重金属污染土壤的植物修复,主要是因为螯合剂能够使土壤中的重金属解吸,或螯合剂与重金属离子螯合,增加金属流动性,或促进土壤中不易被生物吸收的重金属形态向生物有效态转化,从而增加植物对重金属的吸收[4,5]。本研究中,土壤Cd胁迫条件下,单施不同浓度SNP或EDDS后,紫苜蓿地上部和地下部Cd含量总体上升高,且SNP和EDDS浓度越高,Cd含量也越高;相关性分析结果也显示紫苜蓿地上部和地下部的Cd含量及富集系数均与SNP浓度呈显著正相关,与EDDS浓度呈正相关,说明单独施加外源NO或EDDS均能促进紫苜蓿对Cd的吸收富集。
研究结果表明:不同浓度SNP与EDDS复合处理能进一步提高紫苜蓿不同部位的Cd含量,但不同浓度EDDS的影响效应不同。其中,SNP与0.50 mmol·L-1EDDS复合处理时,随SNP浓度升高,紫苜蓿地上部和地下部Cd含量呈先升高后降低的变化趋势;SNP与1.50 mmol·L-1EDDS复合处理时,随SNP浓度升高地上部Cd含量总体下降,而地下部Cd含量则先升高后降低,说明采用适宜浓度的SNP与EDDS复合处理能对紫苜蓿吸收Cd产生“协同作用”。冉烈等[30]对东南景天(SedumalfrediiHance)和袁菊红等[31]对彩叶草(ColeushybridusHort. ex Cobeau)的相关研究也获得了类似的结论。因而,根据植物对重金属的解毒机制[32],在相同EDDS浓度条件下,添加适宜浓度的SNP有利于紫苜蓿不同部位对Cd的解毒作用。
高浓度SNP与EDDS复合处理使紫苜蓿对Cd的富集作用减弱,可能是因为SNP与EDDS作为外源化学制剂,施用浓度超过了植物的耐受限度,对植物造成了损伤,引起代谢失调、细胞膜系统受损,使植物生长受到抑制,进而对Cd的吸收减少[3,8]。而适宜浓度的SNP与EDDS联合施用则对提升紫苜蓿的Cd富集能力和转运能力具有“协同作用”,其中,0.20 mmol·L-1SNP与0.50 mmol·L-1EDDS复合处理时,紫苜蓿地上部和地下部的Cd富集系数在所有处理中均最高,对Cd的修复效率也达到最大(6.22%)。相关性分析结果表明:SNP与0.50 mmol·L-1EDDS复合处理时,地上部和地下部的Cd富集系数均与SNP浓度正相关,而SNP与1.50 mmol·L-1EDDS复合处理时,地上部Cd富集系数与SNP浓度显著负相关,说明SNP和EDDS浓度的变化对紫苜蓿不同部位对Cd的吸收和积累有较大影响,从而影响紫苜蓿不同部位的Cd含量,进而影响其修复效率。
3.3 外源NO和EDDS处理下紫苜蓿Cd吸收和积累的细胞学机制
细胞壁是重金属离子进入植物细胞的第一道屏障,其金属沉淀作用可能是一些植物耐重金属的原因之一;液泡含有的蛋白质、糖、有机酸、有机碱等物质都能与重金属离子结合,起到解毒作用,因而液泡常被认为是分隔重金属离子的重要细胞器[33]。本研究中,不同处理条件下,紫苜蓿富集的Cd主要集中在细胞壁和可溶部分,这与作者前期的研究结果一致[25]。经适宜浓度的SNP与EDDS复合处理,当细胞壁上Cd的结合位点达到饱和时,Cd离子透过细胞膜转运到原生质中,此时大量Cd离子累积在细胞质(含液泡),实现了对Cd的区隔化作用;而细胞器和线粒体中的Cd含量明显降低,避免了Cd对细胞器和线粒体的毒害,可见细胞壁的固持作用和液泡的区隔化作用是紫苜蓿应对Cd胁迫的重要防御机制之一。但是,当SNP和EDDS浓度超过一定范围时,这种防御作用受到抑制。
3.4 结论
对上述研究结果进行综合归纳和分析,结果表明:在土壤Cd胁迫条件下,单施SNP或EDDS均能促进紫苜蓿的生长,提高根系活力和叶绿素含量,促进地上部与地下部对Cd的吸收。适宜浓度的SNP与EDDS联合施用能进一步促进紫苜蓿的生长和Cd富集,其中,在0.10 mmol·L-1SNP与0.50 mmol·L-1EDDS复合处理条件下,紫苜蓿的地下部Cd含量和Cd富集系数在所有处理组中均最高,其株高、地上部鲜质量、地下部干质量、根系活力以及光合色素含量也均最高;在0.20 mmol·L-1SNP与0.50 mmol·L-1EDDS复合处理条件下,紫苜蓿地上部Cd含量和Cd富集系数以及Cd修复效率在所有处理组中均最高,其地下部鲜质量和地上部干质量也均最高。因此,综合考虑植株的生长状况以及Cd吸收积累效应和修复效率,初步建议选用0.10~0.20 mmol·L-1SNP与0.50 mmol·L-1EDDS联合施用,以强化紫苜蓿对Cd污染土壤的修复功能。
在亚细胞水平上,紫苜蓿细胞壁和可溶部分的Cd含量明显高于细胞器和线粒体,表明紫苜蓿通过细胞壁的屏障作用增强其对Cd的耐性,并通过液泡的解毒作用降低Cd毒害,而施加SNP和EDDS有助于细胞壁中的Cd向可溶部分转移及降低细胞器和线粒体中的Cd含量,说明SNP和EDDS的施用有利于紫苜蓿细胞对吸收的Cd进行解毒。
紫苜蓿对Cd的富集虽未达到Cd超富集植物的临界标准,但从植株生长量、耐Cd能力及对Cd的吸收和转化能力等方面综合考虑,紫苜蓿在Cd污染土壤的植物修复中具备潜在的应用价值。
由于本文的实验设计存在一定的不足,尤其是EDDS的浓度水平设置较为粗放,因而,在后续研究中将以本研究结果为基础,采用正交实验设计等更为科学的实验设计方法,筛选出较为精准且易于实际应用的SNP和EDDS复合处理浓度,并采用分子生物学以及代谢组学等方法进一步研究SNP和EDDS联合施用对紫苜蓿生长和Cd吸收积累的作用机制。
