3个不同木薯品种的代谢产物解析
2022-12-16吴金山王思琦耿梦婷宋记明黄家权贾迎雪张逸杰张肖飞陈银华
吴金山,王思琦,耿梦婷,宋记明,黄家权,贾迎雪,张逸杰,张肖飞,陈银华*
3个不同木薯品种的代谢产物解析
吴金山1,3,王思琦1,耿梦婷1,宋记明2,黄家权1,贾迎雪3,张逸杰1,张肖飞4,陈银华1*
1. 海南大学热带作物学院,海南海口 570228;2. 云南省农业科学院热带亚热带经济作物研究所,云南保山 678000;3. 海南大学林学院,海南海口 570228;4. 国际热带农业中心(CIAT),卡利A.A 6713
本研究以3种木薯品种(‘KU50’‘SC205’和‘SC9’)块根为实验材料,采用色谱-质谱联用非靶向代谢组学技术,对8月龄木薯块茎的代谢物进行差异性分析。通过鉴定共获得77个差异代谢物,主要涉及糖及其衍生物、氨基酸、有机酸等,‘KU50’和‘SC205’两个品种的优势代谢产物(相对含量>15%)均为蔗糖,且二者含量基本相当,‘SC9’的优势代谢产物为蔗糖与果糖;‘SC9’中蔗糖、柠檬酸相对含量显著低于‘KU50’和‘SC205’,但果糖、半乳糖、葡萄糖高于二者。利用主成分分析(PCA)发现,3个木薯品种块根代谢物组成结构差异性显著,获得差异显著的33种代谢物中主要涉及糖类及其衍生物、有机酸及其衍生物、生物碱、核苷酸及其衍生物、氨基酸及其衍生物等5个类别。通过GO、KEGG、通路富集分析共注释到14个差异显著性代谢途径,其中,共有16个代谢物富集于氨酰tRNA生物合成途径,9个富集于精氨酸和脯氨酸代谢途径,3个富集于氰基氨基酸代谢途径。本研究通过对3个木薯品种块根代谢物的种类、相对含量、主要代谢物和显著差异代谢物进行分析,阐明了不同木薯品种淀粉品质形成的物质基础。可为后期更好地进行木薯品种改良、品种选育及木薯食品加工提供参考。
木薯;代谢产物;代谢途径;差异分析
木薯(Crantz),又称南洋薯、木番薯、树薯,为大戟科灌木状多年生植物,是热带、亚热带地区主要的粮食作物[1-2]。主要用于生产以木薯淀粉为基础的食品及生物能源,其深加工产品多达3000种[3],是全球近10亿人的日常口粮[4],被称为“淀粉之王”“特用作物”“地下粮仓”[5],因此提高木薯淀粉含量一直是木薯栽培、育种研究中的核心问题。针对木薯淀粉合成机制,研究人员从基因水平、蛋白质水平均进行了不同的探讨[6-7],而木薯淀粉品质的不同也与各品种的蛋白质和淀粉代谢有关[8]。
代谢组学能够通过对某一生物或细胞在一特定生理时期内所有低分子量代谢产物同时进行定性和定量分析[9],考察生物体系在特定时期或受到刺激、扰动前后所有小分子代谢物的组成及其含量变化,从而表征生物体系的整体代谢特征,研究涉及微生物[10-11]、植物[12-13]及药物[14-15]等方面,在食品安全、食品质控、食品加工、食品溯源等领域有着广泛的应用[16-18]。
由于木薯在食品安全中的重要性,人们对木薯进行了大量的研究,以明确木薯中有益于人类的代谢物,从而开发更高营养价值的新品种。目前已经建立了木薯初级代谢产物和次级代谢产物的化学筛选方法,主要是通过色谱-质谱联用技术(GC-MS)[19],并结合主成分分析(principal component analysis,PCA)、偏最小二乘(partial least squares,PLS)等统计学方法[20],用于鉴定与木薯目的性状相关的代谢产物。但相关的研究报道多集中于特定木薯品种基因层面[21]及理化性质[22-23]层面,鲜有文献探讨不同木薯品种间特别是与淀粉品质相关代谢物的差异,以及在探究优势代谢物的生物学角色和代谢途径方面的研究较为欠缺。
本研究主要以3个优质的木薯品种为实验材料,3个木薯品种均具淀粉含量多、产量高等优质特性,尤其是‘SC9’的口感品质比其他2个品种好。造成3个木薯不同的淀粉品质特性是否与差异代谢物有密切联系,为解决这一问题,本研究采用GC-MS的非靶向代谢组学,结合PCA、正交偏最小二乘判别(orthogonal partial least squares discrimination analysis,OPLS-DA)等方法,差异分析3个不同木薯品种的代谢产物及各自优势代谢物,进一步探讨优势代谢物的代谢途径和富集通路,旨在全面鉴定具有不同淀粉品质的木薯中代谢物的自然变异及相关的调控机制,为更好地进行木薯品种改良、品种选育奠定基础,同时本研究结果也可为3个木薯品种深加工利用提供参考。
1 材料与方法
1.1 材料
木薯块茎选自海南省儋州市海南大学农科基地木薯种植资源圃3个品种‘KU50’‘SC205’‘SC9’,分别取相同种植条件下8个月龄木薯块茎,然后进行剥皮、洗净处理,于–80℃下保存,后续用于代谢产物的测定。实验设3个生物学重复。
1.2 方法
1.2.1 样品提取 精确称量样本25 mg于2 mL EP管中,准确加入1 mL甲醇∶氯仿∶2%乙酸(5∶2∶1,∶∶)混合溶液(–20℃),加入60 μL的核糖醇(0.2 mg/mL)作为内标,加入100 mg玻璃珠[24-25]。放入高通量组织研磨仪中30 Hz震荡2 min,12 000 r/min离心10 min,收集合并2次上清液并加入500 μL ddH2O,400 μL氯仿,涡旋振荡1 min,12 000 r/min离心2 min,取上中层1100~1200 μL溶液用真空浓缩仪浓缩至尽干。进而加入40 μL甲氧基溶液涡旋振荡30 s,30℃反应1.5 h,最后加入80 μL BSTFA试剂(含1%三甲基氯硅烷),37℃条件下反应30 min,12 000 r/min离心3 min,取上清液90~100 μL加入到检测瓶中。每个待测样本各取20 µL混合成 QC样本(quality control,QC),用来校正混合样品分析结果的偏差以及由于分析仪器自身原因所造成的失误,用剩余待测样本进行GC-MS检测[26]。
1.2.2 样品检测 气相色谱采用HP-5MS毛细管柱(5%苯/95%甲基聚硅氧烷30 m×250 μm i.d.,0.25 μm film thickness,Agilent J & W Scientific,Folsom,CA,USA)以1 mL/min的恒流氦气来分离衍生化物质,1 µL样品以分流比20∶1的方式通过自动进样器注入。注射温度为280℃,接口设置为150℃和离子源调整到230℃。升温程序以60℃为初始温度,持续2 min,以10 ℃/min的速率上升到300℃并停留5 min。质谱范围从35~750/,采用全扫描方法进行[27-28]。
1.3 数据处理
通过GC-MS光谱全波段扫描代谢物质。通过Agilent MSD ChemStation工作站对原始数据进行特征提取,利用R(v3.1.3)的XCMS程序包得到包括质核比(mass to charge ratio,m/z)、保留时间(retention time)及峰面积(intensity)等信息的数据矩阵[29],导出数据至Excel 2010(标准品鉴定过的物质标记为红色字体),进而利用QC质谱和样本点PC1值的分布对项目的系统进行分析和评估。由图1可知,在PCA图中,QC样本相对于实验样本点聚到一起,且QC误差在2倍的标准偏差以内,在离群点内,说明本实验的系统误差在可控范围内,校正效果良好。进一步标准化处理如图2所示,在标准化前,代谢物含量的中位数和上下四分位点参差不齐,差异较大,但标准化后,基本均位于同一个水平上,接近正态分布。

图1 各样本点PC1分布(A)和各样本质控PCA图(B)
2 结果与分析
2.1 代谢物分析
通过GC-MS法对3个品种进行分离鉴定,共注释获得了代谢物77个。为更直观地比较各分组间代谢物组成结构差异,对3个品种中的代谢物含量进行比较分析(图3),位于前20的代谢物为蔗糖、果糖、半乳糖、肌醇、核糖醇、柠檬酸、葡萄糖、磷酸、焦谷氨酸、谷氨酸、L-谷氨酰胺、苹果酸、L-丝氨酸、L-丙氨酸、L-缬氨酸、4-氨基丁酸、L-色氨酸、L-苏氨酸、抗坏血酸、酪氨酸。在前20种代谢物中,糖及其衍生物、氨基酸、有机酸含量占比最高,其余代谢物被归类到Others中。
如图3所示,3个品种含量排前20的代谢产物中,‘KU50’‘SC205’含量较高(>10%)的代谢物均为蔗糖,‘SC9’含量较高(>10%)的代谢物为蔗糖、果糖、半乳糖。在相对含量中等(5%~10%)的代谢物中,‘KU50’有8种、‘SC205’有5种、‘SC9’有3种;在相对含量较低(5%)的代谢物中,‘KU50’有11种,‘SC205’‘SC9’均有14种。
‘KU50’和‘SC205’的优势代谢产物均为蔗糖且二者在块根中含量基本相当,‘SC9’为蔗糖和果糖;‘SC9’中的蔗糖、柠檬酸相对含量低于‘KU50’和‘SC205’的,但果糖、半乳糖、葡萄糖高于二者;‘SC9’中的果糖和葡萄糖相对含量高,可能是蔗糖水解产生或来自脂肪的转化;葡萄糖、果糖、半乳糖是对人体比较重要的单糖,因此,口感颇好的‘SC9’是目前市场上食用的主推产品。
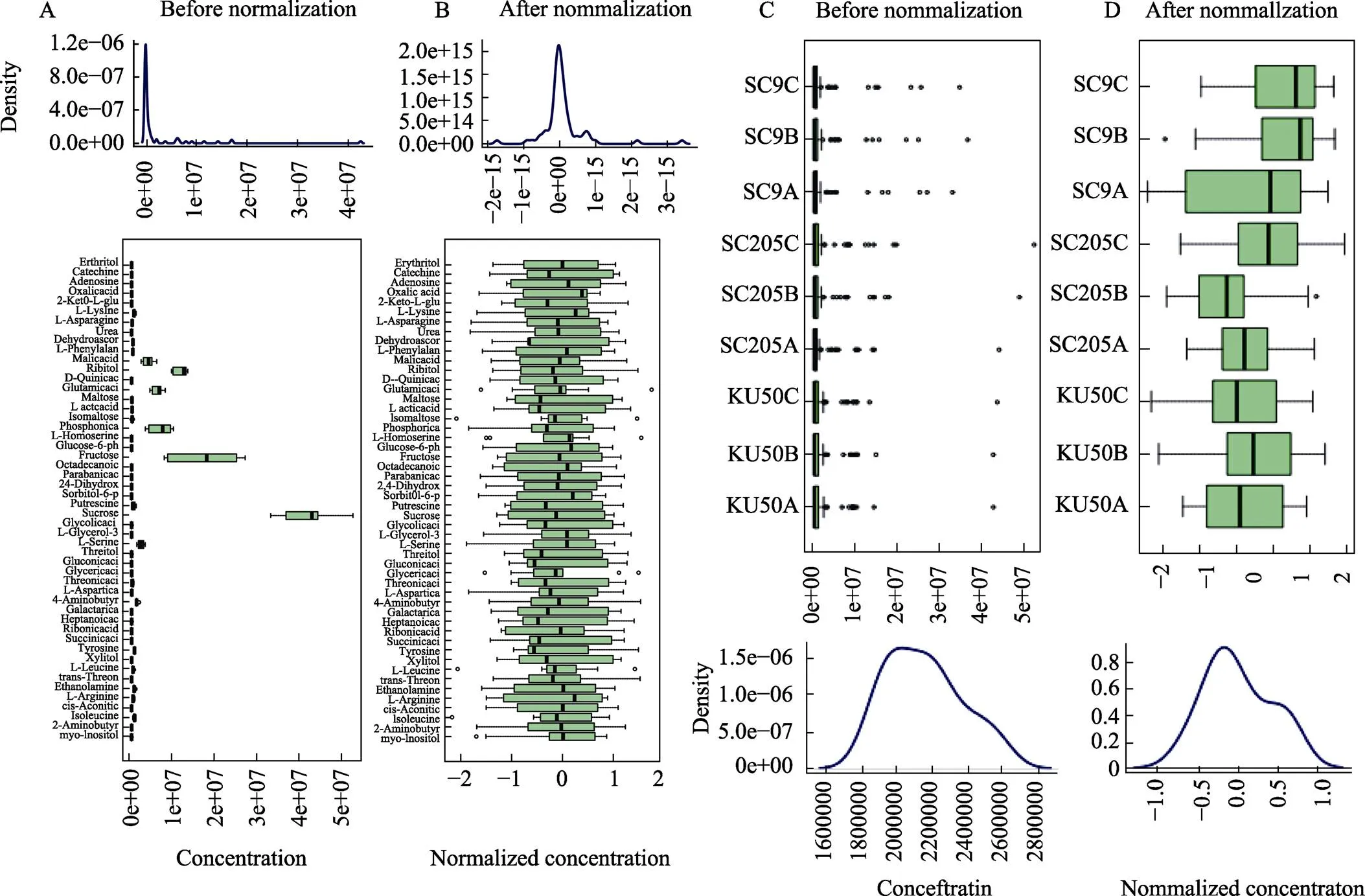
A:标准化校正前所有样本中各个代谢物的含量分布;B:标准化校正后所有样本中各个代谢物的含量分布;C:标准化校正前各个样本中所有代谢物的含量分布;D:标准化校正后各个样本中所有代谢物的含量分布。
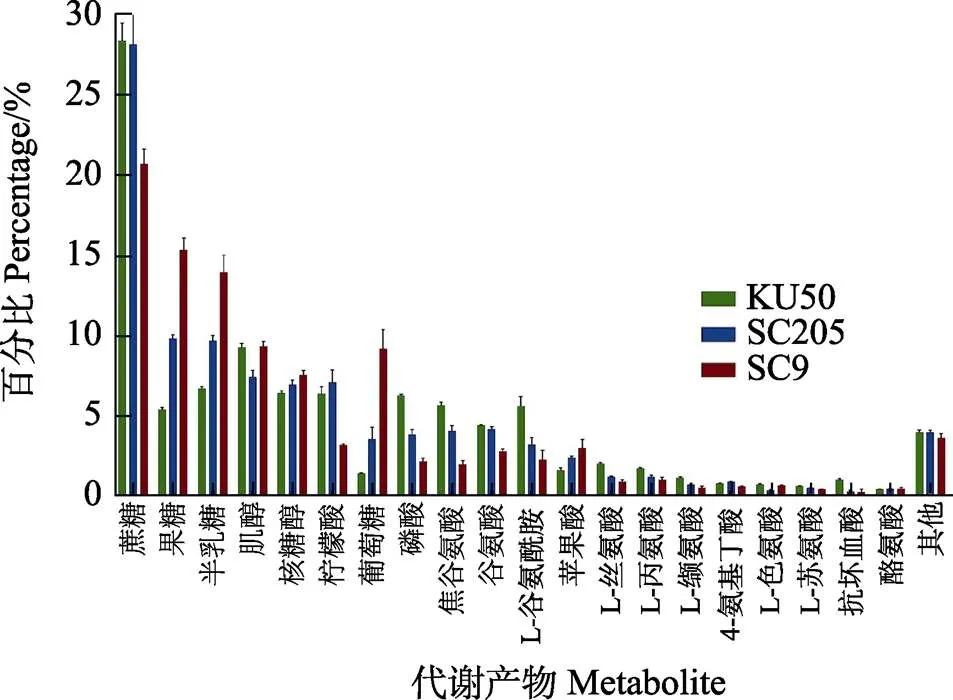
图3 3个木薯品种前20种代谢物名称及含量
将获得的所有代谢物用KEGG数据库br08001进行注释,得到代谢物所扮演的生物学角色,然后统计每个生物学角色的百分比含量。如表1所示,在3个品种中,扮演着特定角色的代谢物主要有碳水化合物、多肽、有机酸、维生素及辅助因子、脂类、核酸等。3个品种中,‘SC9’中的碳水化合物含量最高,为0.6594,但其余四类均低于二者;‘KU50’在多肽、维生素和辅酶因子方面均高于二者;而‘SC205’在有机酸、脂质方面含量最高。但在核酸含量方面,‘SC205’和‘SC9’的含量相同。
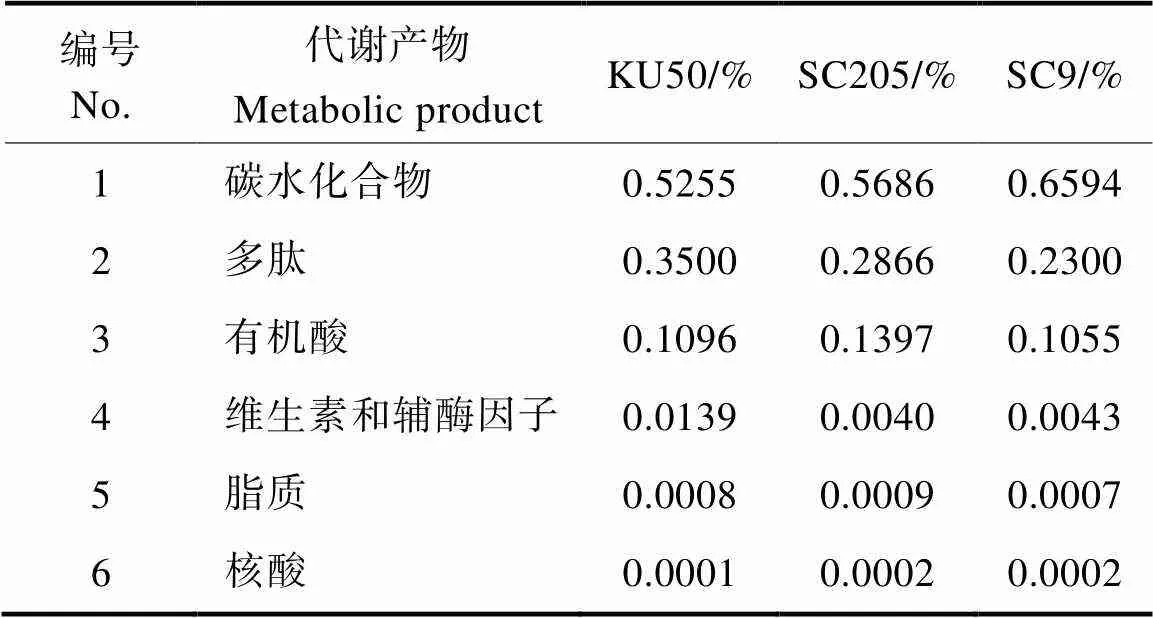
表1 扮演生物学角色的代谢物含量
2.2 热图聚类图分析
在样品代谢物含量聚类分析中,不同分组的样本聚类到不同位置,说明分组间代谢物组成结构差异较大。如图4所示,在‘SC9’样品中,‘SC9B’和‘SC9C’相似性较近,‘SC9A’相对较远;同样在‘KU50’和‘SC205’样品中,‘KU50A’和‘KU50B’相似性较近,‘KU50C’较远,‘SC205B’和‘SC205C’相似性较近,‘SC205A’较远。但3个品种间存在一定的差异,且差异显著。
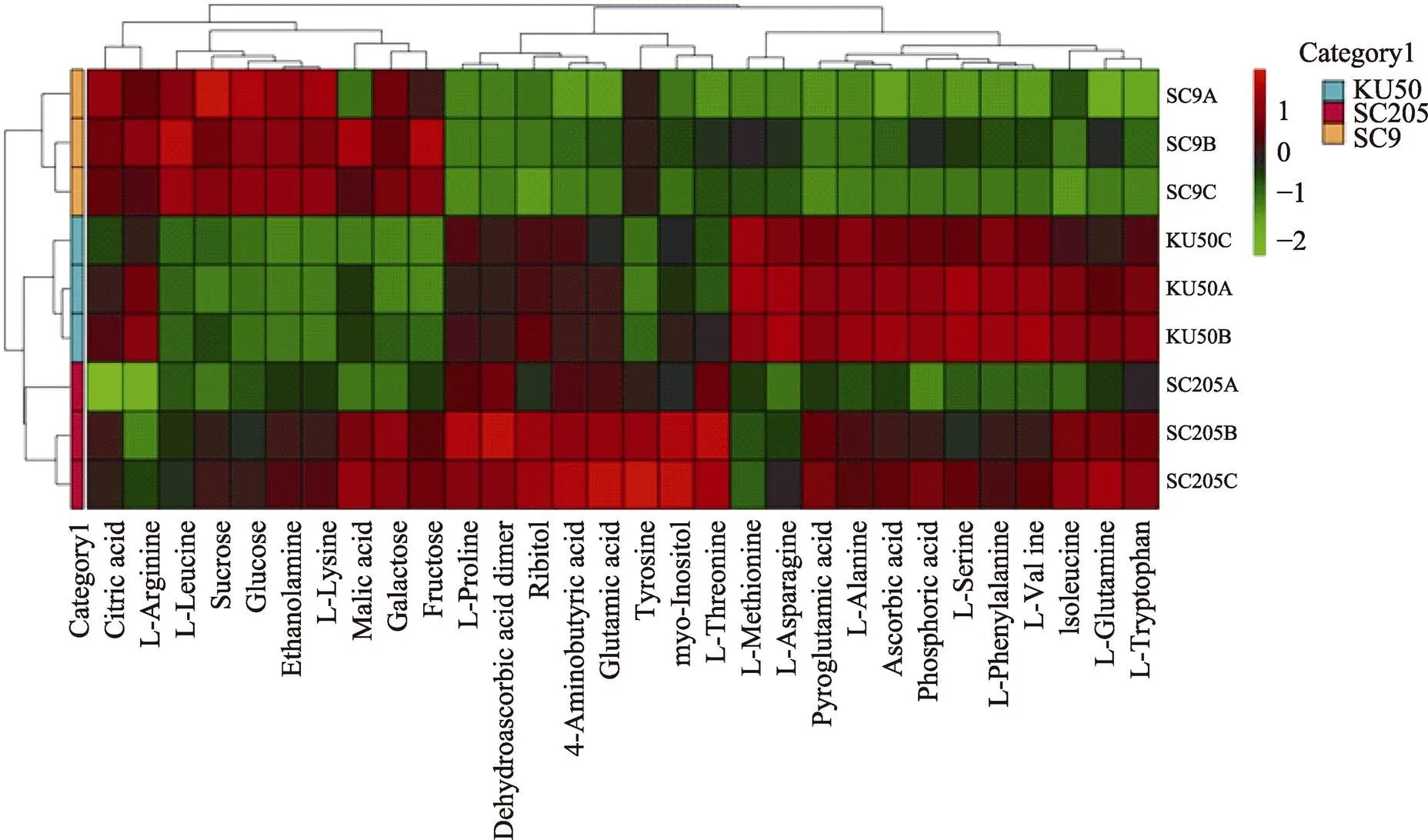
纵轴为样品名称信息,同时也包括了分组信息。横轴为代谢物。图中上方的聚类树为代谢物在各样本中分布的相似度聚类,左侧的聚类树为样品聚类树,中间的热图是代谢物含量热图,颜色与代谢物含量(Z-Score)的关系见图右上方的刻度尺。
2.3 样品PCA及代谢物的OPLS-DA分析
通过PCA分析,观察各样本间的总体分布趋势。如图5所示,图中3个分组的点云(point cloud)明显分布在不同区域,说明3个分组的代谢物组成结构差异显著。
为了筛选出组间不同的代谢物,对‘KU50’‘SC205’和‘SC9’3个品种数据进行处理,得到OPLS-DA评分后发现,不同分组样本点云分布在不同区域,OPLS-DA模型能明显区分3组样本,各个成员组间存在显著差异,且样品成员组均位于置信时间内。同时参数 R2Y(cum)=1,Q2(cum)=0.979,R2Y和Q2均大于0.5并且接近于1,说明该模型的稳定性比较好,且数据可靠。
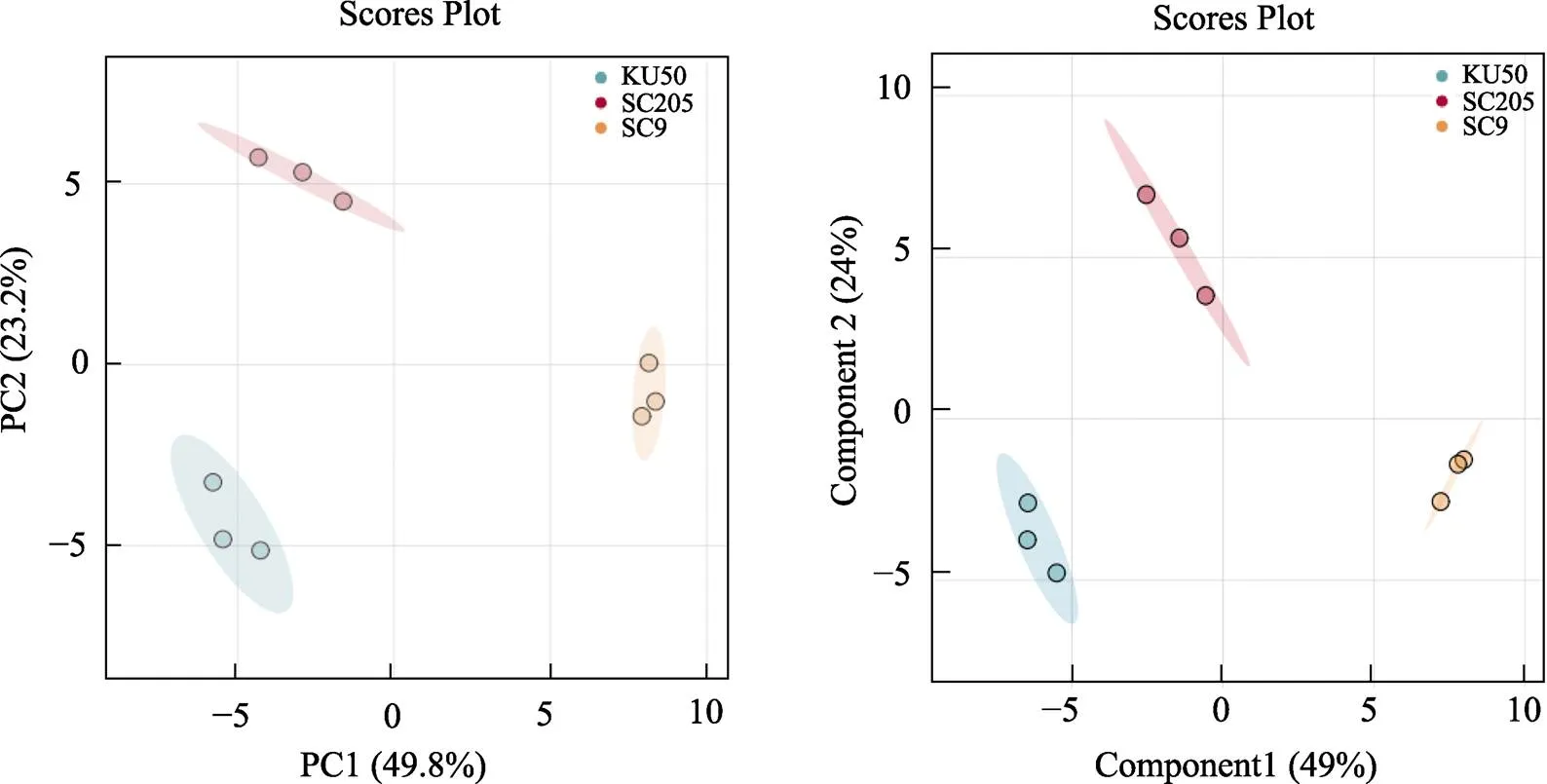
图5 PCA图和PLS-DA点云图
2.4 差异代谢物筛选及分析
本研究以VIP>1、<0.05为标准对3个品种进行差异代谢物筛选[13-14]。由图6可知,黄色区域(右上角标注名称处)是校正后<0.05,VIP>1的代谢物,共33种(表2)。主要包括糖类及其衍生物、有机酸及其衍生物、生物碱、核苷酸及其衍生物、氨基酸及其衍生物等5个类别。此类代谢物在分组间差异显著,在PLSDA分析中起重要作用,是重点关注的对象。

图6 PLS-DA代谢物重要性图
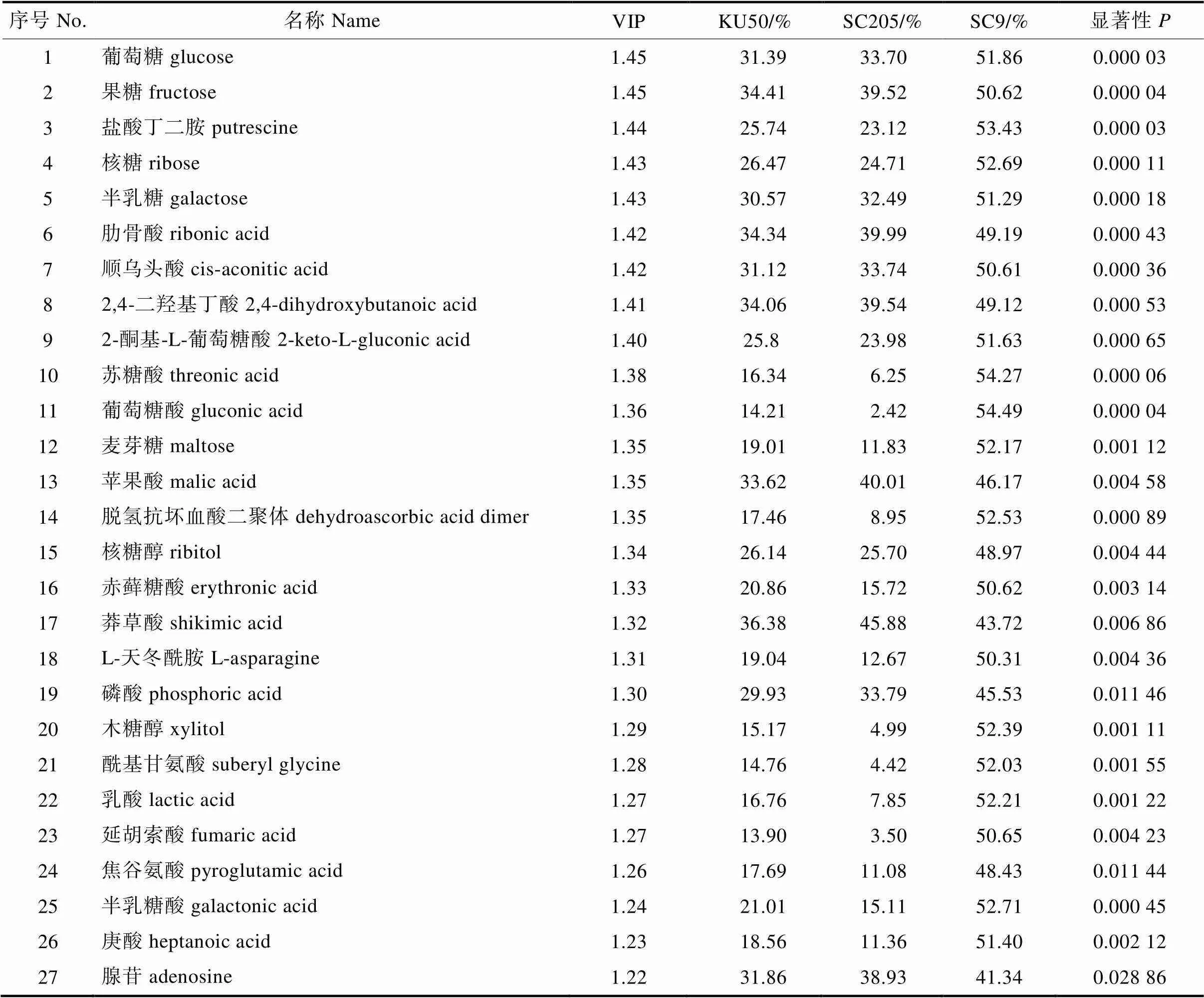
表2 PLS-DA中重要差异代谢物
续表2 PLS-DA中重要差异代谢物

Tab. 2 Important differential metabolites in PLS-DA (continued)
2.5 代谢通路及富集度分析
图7为3组显著差异代谢物KEGG富集图。图中每一个图形都是一个KEGG路径。横坐标为富集倍数,即富集率,是代谢通路中观测代谢物数/理论代谢物数比值,纵坐标表示路径的名称。值的大小用颜色表示,颜色越深,值越小。长方形越长代表富集到的物质越多。通路富集分析可获得38种差异代谢通路。
代谢物在某个通路中虽显著富集,但不一定在该代谢通路中起关键作用。代谢物对代谢通路的影响,可通过拓扑分析计算关注的代谢物在代谢通路中的作用大小(用Impact衡量)。本研究通过拓扑分析发现,当<0.05时,共有14个通路存在显著差异(表3)。其中丙氨酸、天冬氨酸和谷氨酸代谢途径富集度和重要性均最大,分别为15.732和0.657,说明此代谢途径在物质代谢过程发挥着重要作用,此途径共有8个代谢物参与;其次是TCA循环途径、氨酰tRNA生物合成途径、精氨酸和脯氨酸代谢途径等。在14个途径中,实际出现代谢物数最多的是氨酰tRNA生物合成途径,为16个;其次是精氨酸和脯氨酸代谢途径,为9个;最少的是氰基氨基酸代谢途径,为3个。
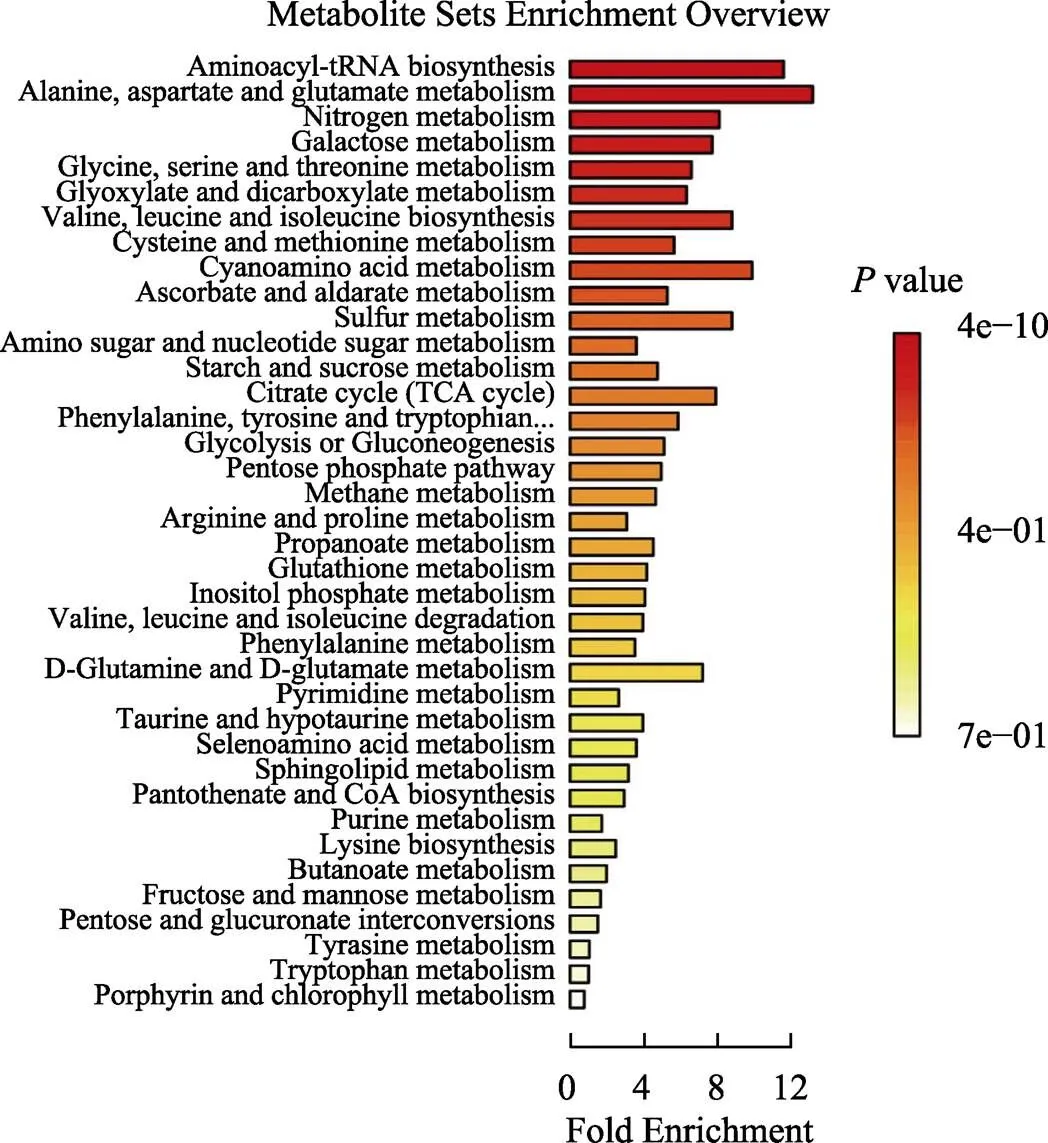
图7 ORA富集分析

表3 ORA富集分析和拓扑分析
3 结论
木薯是热带、亚热带地区主要的粮食作物。在我国,木薯主要用于淀粉和酒精加工。本研究选用3个木薯品种都具有淀粉含量多、产量高等优质特性,且‘SC9’的口感品质好。3个品种淀粉品质的不同可能与各品种的蛋白质和淀粉代谢有关。鉴于此,本研究利用非靶向代谢组学的方法,对3个木薯品种的8月龄块根的代谢产物进行系统分析,结果发现木薯块根中含有丰富的代谢产物。通过GC-MS的分离与鉴定,3个品种共注释获得77种代谢物。在3个品种的前20种代谢物中,糖及其衍生物、氨基酸、有机酸含量占比最高。其中‘KU50’和‘SC205’的优势代谢产物(相对含量>15%)均为蔗糖且二者在块根中含量基本相当,于前面所述二者具有淀粉含量多、产量高等特性相符。‘SC9’的优势代谢产物主要为蔗糖与果糖,‘SC9’中的蔗糖、柠檬酸相对含量低于‘KU50’和‘SC205’,但果糖、半乳糖、葡萄糖高于二者;‘SC9’中的果糖与葡萄糖相对含量高,可能是蔗糖水解产生或来自脂肪的转化,这与‘SC9’的口感品质好有一定的关系。并且葡萄糖、果糖、半乳糖是对人体比较重要的单糖,因此口感颇好的‘SC9’是目前市场受欢迎的主要食用品种。
代谢组学分析可根据代谢物的相对含量对样品进行比较分析,本研究以VIP>1.0作为检测差异显著代谢物的阈值,通过PCA及OPLS-DA分析发现,3个木薯品种块根代谢物组成结构差异显著,包括糖类及其衍生物、有机酸及其衍生物、生物碱、核苷酸及其衍生物、氨基酸及其衍等5个类别共33种代谢物和木薯品种相关。通过KEGG路径、通路富集分析发现这些代谢物共存在38种差异代谢通路,其中有14个通路存在显著差异(<0.05),特别是丙氨酸、天冬氨酸和谷氨酸代谢途径的富集度和重要性均最高,分别为15.732和0.657,共有8个代谢物参与此途径,这些代谢物主要是糖类、有机酸类和氨基酸类,这表明此代谢途径可能在木薯物质代谢过程发挥着重要作用。其次是TCA循环、氨酰tRNA生物合成、精氨酸和脯氨酸代谢等途径。在14个途径中,实际出现代谢物数最多的是氨酰tRNA生物合成途径,为16个;其次是精氨酸和脯氨酸代谢途径,为9个;最少的是氰基氨基酸代谢途径,为3个。不同木薯品种间具有较高的遗传多样性,通过对不同木薯品种代谢物差异分析,表明3个木薯品种可能含有不同的代谢物,尤其是糖类、氨基酸类化合物,未来需要进一步分析每个木薯品种的具体成分,可为后期更好的进行木薯品种改良、品种选育及木薯食品加工提供参考。
[1] 贾晶霞, 李雷霞. 世界及中国木薯生产概况[J]. 农业工程, 2015, 5(5): 124-126.
JIA J X, LI L X. Production situation of cassava in the world and China[J]. Agricultural Engineering, 2015, 5(5): 124-126.(in Chinese).
[2] 杨 丹, 李超萍, 韦 明, 黄贵修. 当前中国木薯种植业所面临的主要植保问题及其对策[J]. 热带农业科学, 2017, 37(5): 114-120.
YANG D, LI C P, WEI M, HUANG G X. Plant protection problems and their countermeasures in cassava planting industry in China[J]. Chinese Journal of Tropical Agriculture, 2017, 37(5): 114-120.(in Chinese)
[3] LEITE A L M P, ZANON C D, MENEGALLI F C. Isolation and characterization of cellulose nanofibers from cassava root bagasse and peelings[J]. Carbohydrate Polymers, 2017, 157: 962-970.
[4] NTUI V O, KONG K T, KHAN R S, IGAWA T, JANAVI G J, RABINDRAN R, NAKAMURA I, MII M. Resistance to(SLCMV) in genetically engineered cassava cv. KU50 through RNA silencing[J]. PLoS One, 2015, 10(4): e0120551.
[5] 任希望, 梁丽雯, 王鹤鸣, 廖华兰, 林道哲, 黎秀琼, 陈银华. 木薯细菌性枯萎病病原菌的分离与鉴定[J]. 热带生物学报, 2015, 6(1): 59-64.
REN X W, LIANG L W, WANG H M, LIAO H L, LIN D Z, LI X Q, CHEN Y H. Optimization of fermentation conditions for production of arginine deiminase from[J]. Chinese Journal of Tropical Biology, 2015, 6(1): 59-64.(in Chinese)
[6] 孟宇红. 4个木薯基因的表达分析与功能研究[D]. 海口: 海南大学, 2018.
MENG Y H. Expression profiles and functional analysis of fourmembers in cassava[D]. Haikou: Hainan University, 2018.(in Chinese).
[7] 罗兴录, 潘晓璐, 朱艳梅. 木薯内源ABA含量与块根淀粉积累关系研究[J]. 热带作物学报, 2018, 39(3): 472-479.
LUO X L, PAN X L, ZHU Y M. The relationship between endogenous abscisic acid content and starch accumulation in root tuber of cassava[J]. Chinese Journal of Tropical Crops, 2018, 39(3): 472-479.(in Chinese)
[8] 樊吴静, 罗兴录, 朱艳梅. 淀粉含量不同木薯品种内源IAA与淀粉合成关键酶活性[J]. 中国农业大学学报, 2016, 21(10): 30-36.
FAN W J, LUO X L, ZHU Y M. Endogenous IAA and the activities of starch synthesis key enzymes in cassava varieties with different starch content[J]. Journal of China Agricultural University, 2016, 21(10): 30-36. (in Chinese)
[9] HOLMES E, NICHOLSON J K, NICHOLLS A W, LINDON J C, CONNOR S C, POLLEY S, CONNELLY J. The identification of novel biomarkers of renal toxicity using automatic data reduction techniques and PCA of proton NMR spectra of urine[J]. Chemometrics and Intelligent Laboratory Systems, 1998, 44(1/2): 245-255. [9].
[10] LOWE R G T, LORD M, RYBAK K, TRENGOVE R D, OLIVER R P, SOLOMON P S. Trehalose biosynthesis is involved in sporulation of[J]. Fungal Genetics and Biology, 2009, 46(5): 381-389.
[11] CARRATURO F, LIBRALATO G, ESPOSITO R, GALDIERO E, GUIDA M. Metabolomic profiling of food matrices: preliminary identification of potential markers of microbial contamination[J] Journal of Food Science, 2020, 85: 3467-3477.
[12] JIANG H, YANG Y, HOU A J, ZHANG J X, WANG S, MAN W J, ZHENG S W, YU H, WANG X J, YANG B Y, WANG Q H, KUANG H X. Botany, traditional uses, phytochemistry, analytical methods, processing, pharmacology and pharmacokinetics of Bupleuri Radix: a systematic review[J]. Biomedicine & Pharmacotherapy, 2020, 131: 110679.
[13] LARIVE C K, BARDING G A, DINGES M M. NMR spectroscopy for metabolomics and metabolic profiling[J]. Analytical Chemistry, 2015, 87(1): 133-146.
[14] QI C X, BAO.J, WANG J P, ZHU H C, XUE Y B, WANG X C, LI H, SUN W G, GAO W X, LAI Y J, CHEN J G, ZHANG Y H. Asperterpenes A and B, two unprecedented meroterpenoids fromwith BACE1 inhibitory activities[J]. Chemical Science, 2016, 7: 6563-6572.
[15] WOLFENDER J F, NUZILLARD J M, HOOFT J D, RENAULT J H, BERTRAND S. Accelerating metabolite identification in natural product research: toward an ideal combination of liquid chromatography–high-resolution tandem mass spectrometry and NMR profiling, in silico databases, and chemometrics[J]. Analytical chemistry, 2018, 91: 704-742.
[16] 孙祥瑞, 张 淼, 孔令强, 高寒放, 徐春明. 代谢组学在食品科学与工程领域的研究进展[J]. 中国食品添加剂, 2021, 32(9): 175-181.
SUN X R, ZHANG M, KONG L Q, GAO H F, XU C M. Research progress of metabolomics in food science and engineering[J]. China Food Additives, 2021, 32(9): 175-181. (in Chinese)
[17] FU T X, FENG Y C, ZHANG L Y, LI X, WANG C Y. Metabonomics study on rice from different geographical areas based on gas chromatography-mass spectrometry[J]. Shipin Kexue/Food Science, 2019, 40(12): 176-181.
[18] TANG H R, WANG Y L. Metabonomics: a revolution in progress[J]. Progress in Biochemistry and Biophysics, 2006, 33(5): 401-417.
[19] 何秀全, 谭德冠, 孙雪飘, 彭 明, 张家明. 应用GC-MS技术分离鉴定木薯叶片代谢物的极性组分[J]. 热带作物学报, 2012, 33(3): 422-426.
HE X Q, TAN D G, SUN X P, PENG M, ZHANG J M. Isolation and identification of polar metabolites in cassava leaf using GC-MS method[J]. Chinese Journal of Tropical Crops, 2012, 33(3): 422-426. (in Chinese)
[20] 吴 岩, 陈 青, 梁 晓, 伍春玲, 刘 迎, 窦宏双, 范东哲, 耿梦婷, 陈银华. 木瓜秀粉蚧为害对不同木薯品种次生代谢物质含量的影响[J]. 热带作物学报, 2021, 42(10): 2966-2971.
WU Y, CHEN Q, LIANG X, WU C L, LIU Y, DOU H S, FAN D Z, GENG M T, CHEN Y H.infestation influences the content of secondary metabolites in different cassava cultivars[J]. Chinese Journal of Tropical Crops, 2021, 42(10): 2966-2971. (in Chinese)
[21] GAJECKA M, MARZEC M, CHMIELEWSKA B, JELONEK J, SZAREJKO I. Plastid differentiation during microgametogenesis determines green plant regeneration in barley microspore culture[J]. Plant Science, 2020, 291: 110321.
[22] 林立铭, 王琴飞, 余厚美, 徐 缓, 张振文. 食用木薯块根冻结特性及代谢产物分析[J]. 食品工业科技, 2022, 43(15): 1-8.
LIN L M, WANG Q F, YU H M, XU H, ZHANG Z W. Freezing properties and metabolites analysis of edible cassava block roots[J]. Food Industry Technology, 2022, 43 (15): 1-8. (in Chinese)
[23] UARROTA V G, MORESCO R, COELHO B, NUNESE D C, PERUCHL A M, NEUBERTE D O, ROCHA M, MARASCHIN M. Metabolomics combined with chemometric tools (PCA, HCA, PLS-DA and SVM) for screening cassava (Crantz) roots during postharvest physiological deterioration[J]. Food Chemistry, 2014, 161(6): 67-78.
[24] WANT E J,WILSON L D,GIKA H,THEODORIDIS G,PLUMB S R,SHOCKCOR J,HOLMES E, NICHOLSON J K. Global metabolic profiling procedures for urine using UPLC-MS[J]. Nature Protocols, 2010, 5(6): 1005-1018.
[25] WANT E J, MASSON P, MICHOPOULOS F, WILSON I D, THEODORIDIS G, PLUMB R S, SHOCKCOR J, LOFTUS N, HOLMES E, NICHOLSON J K. Global metabolic profiling of animal and human tissues via UPLC-MS[J]. Nature Protocols, 2013, 8(1): 17-32.
[26] SANGSTER T, MAJOR H, PLUMB R, WILSON A J, WILSON I D. A pragmatic and readily implemented quality control strategy for HPLC-MS and GC-MS-based metabonomic analysis[J]. Analyst, 2006, 131(10): 1075-1078.
[27] SMITH C A, WANT E J, O’MAILLE G, ABAGYAN R, SIUZDAK G. XCMS: processing mass spectrometry data for metabolite profiling using nonlinear peak alignment, matching, and identification[J]. Analytical Chemistry, 2006, 78(3): 779-787.
[28] CHONG J, XIA J. MetaboAnalystR: an R package for flexible and reproducible analysis of metabolomics data[J]. Bioinformatics, 2018, 34(24): 4313-4314.
[29] WESTERHUIS J A, VELZEN E J J V, HOEFSLOOT H C J, SMILDE A K. Multivariate paired data analysis: multilevel PLSDA versus OPLSDA[J]. Metabolomics, 2010, 6(1): 119-128.
Analysis of Metabolites of Three Different Cassava Varieties
WU Jinshan1,3, WANG Siqi1, GENG Mengting1, SONG Jiming2, HUANG Jiaquan1, JIA Yingxue3, ZHANG Yijie1, ZHANG Xiaofei4, CHEN Yinhua1*
1. College of Tropical Crops, Hainan University, Haikou, Hainan 570228, China; 2. Institute of Tropical and Subtropical Cash Crops, Yunnan Academy of Agricultural Sciences, Baoshan, Yunnan 678000, China; 3. College of Forestry, Hainan University, Haikou, Hainan 570228, China; 4. International Center for Tropical Agriculture (CIAT), Cali A.A 6713, Colombia
In this study, the root tubers of three cassava varieties (‘KU50’‘SC205’ and ‘SC9’) were used as the experimental materials. The metabolites of 8-month-old cassava tubers were analyzed by chromatography-mass spectrometry with non targeted metabolomics. A total of 77 differential metabolites were obtained through identification, mainly involving sugar and its derivatives, amino acids, organic acids, etc.. The dominant metabolites (relative content > 15%) of ‘KU50’ and ‘SC205’ were sucrose, and the contents were basically the same. The dominant metabolites for ‘SC9’ were sucrose and fructose. The relative contents of sucrose and citric acid in ‘SC9’ were significantly lower than those of ‘KU50’ and ‘SC205’, but the contents of fructose, galactose and glucose were higher than those of ‘KU50’ and ‘SC205’. Principal component analysis (PCA) found that there were significant differences in the composition and structure of root metabolites among the three cassava varieties. Among the 33 metabolites, there were mainly five categories, including sugars and the derivatives, organic acids and the derivatives, alkaloids, nucleotides and the derivatives, amino acids and the derivatives. A total of 14 metabolic pathways with significant differences were annotated through GO, KEGG and pathway enrichment analysis, of which 16 metabolites were enriched in aminoacyl tRNA biosynthesis pathway, nine in arginine and proline metabolism pathway and three in cyano amino acid metabolism pathway. By analyzing the types, relative contents, main metabolites and significantly different metabolites of root tubers of the varieties, this paper would enrich the material basis of starch quality formation of different cassava varieties and provide a reference for cassava variety improvement, variety breeding and cassava food processing in the later stage.
cassava; metabolites; metabolic pathway; difference analysis
S533
A
10.3969/j.issn.1000-2561.2022.11.020
2022-02-25;
2022-04-15
国家木薯产业技术体系(No. CARS-11-HNCYH);国家重点研发计划项目(No. 2018YFD1000500)。
吴金山(1984—),男,博士,副教授,研究方向:植物营养。*通信作者(Correponding author):陈银华(CHEN Yinhua),E-mail:yhchen@hainanu.edu.cn。
