真实世界临床研究的分类和设计要点浅谈
2022-12-16王瑞平
王瑞平
(上海市皮肤病医院临床研究与创新转化中心 上海 200443)
随着信息化技术的发展和大数据时代的来临,医学研究数据的可及性和采集便捷性大幅提升,真实世界研究(real world study, RWS)成为医学研究的热点之一。RWS是通过收集真实世界环境中与患者有关的数据,即真实世界数据(real world data, RWD),通过数据清洗、治理和统计分析,获得医疗产品的使用价值及潜在获益和风险的临床证据。基于RWS产生的真实世界证据(real world evidence, RWE)提供了洞察药物和医疗器械在日常医疗实践中实际的使用方式、使用问题以及毒性和疗效结果的真实信息。因此,RWS是临床试验和药品上市后再评价药物疗效的一种现代医学研究新方法。RWS作为临床研究的一种新形式同样需要遵循临床研究的一般原则,经过良好的设计、高质量的数据和可靠的统计方法从而产生高质量RWD。本文从RWS的概念入手,介绍真实世界临床研究的分类,设计特点和要点,并举例说明,以期为研究人员真实世界临床研究提供依据和参考。
1 RWS概念
RWS是指运用流行病学研究方法,在真实无偏倚或偏倚较少的人群中收集与患者有关的数据,通过分析,获得医疗产品的使用价值及潜在获益或风险的临床证据,是临床试验和药品上市后再评价药物疗效的一种现代医学研究新方法。RWS概念的提出可追溯至1993年,Kaplan等[1]首次以发表论文的形式明确提出了RWS的概念。十余年来RWS逐渐兴起,尤其是2016年底,美国国会公布的《21世纪治愈法案》提出,将采用RWE用于药品医疗器械审批,引发业内极大关注[2]。2019年4月,美国FDA基于RWD批准了辉瑞的爱博新一项新适应证后,RWS成为制药巨头拓展的重要方向[3]。
2007年,RWS的概念首次出现在中文科技文献[4]。随着欧美国家对RWS相关法案的提出和实践,我国学者也逐步开展了对RWS的探索和应用。2018年8月,在第八届中国肿瘤学临床试验发展论坛上,吴阶平医学基金会和中国胸部肿瘤研究协作组携手发布中国首个《中国真实世界研究指南(2018年版)》[5]。2019年4月,国家药品监督管理局启动实施中国药品监管科学行动计划,把“将真实世界数据用于医疗器械临床评价的方法学研究”列为首批9个行动计划项目中的一项,标志着中国药品监管部门正式启动将RWD/RWE用于审评审批方面的探索与研究[6]。2019年12月,国家药品监督管理局医疗器械技术审评中心发布《真实世界数据用于医疗器械临床评价技术指导原则(征求意见稿)》[7]。2020年1月,国家药品监督管理局的第一号文件、国内首个《真实世界证据支持药物研发与审评的指导原则(试行)》[8]发布,就此,我国药品的研发与评价进入一个新的阶段。2020年8月,国家药品监督管理局药品审评中心发布《真实世界研究支持儿童药物研发与审评的技术指导原则(试行)》[9]。2020年11月,国家药品监督管理局发布《真实世界数据用于医疗器械临床评价技术指导原则(试行)》[10]。2021年3月,国家药品监督管理局印发《国家药监局关于认定第二批重点实验室的通知》[11],海南RWD研究与评价重点实验室获得国家药监局认定,标志全国首个RWD研究与评价重点实验室落户海南,RWS在我国进入新阶段。
2 RWS分类和特点
2.1 RWS分类
如前所述,RWS的方法仍归属于经典的流行病学研究,包括描述性研究和临床试验研究。如图1所示,根据研究者在开展RWS设计时是否采取干预措施,RWS可以分为观察性真实世界研究(observational real world study, ORWS)和干预性真实世界研究(interventional real world study, IRWS)。对于ORWS,可以根据是否设置对照组分为描述性研究(descriptive study)和分析性研究(analytical study)。描述性研究包括“基于健康信息系统(health information system, HIS)数据分析”“现况研究(cross-sectional study)”和“纵向研究(longitudinal study)”,而分析性研究包括经典的病例对照研究(case control study)和队列研究(cohort study),纵向研究和队列研究又可以统称为注册登记研究。对于IRWS,主要采用实用性临床试验(pragmatic clinical trial, PCT)开展。传统临床试验要求有严格定义和筛选的受试者、有经验的研究者以及较小的样本量开展,检验理想条件下干预措施的疗效,容易高估临床获益和安全性,可能不适合指导临床实践。为了揭示干预措施在真实世界人群中的有效性,PCT的开展十分必要,其研究对象的纳入条件相对宽泛,干预措施贴近临床实际,研究结论有更好的临床适用性,受到广泛关注。

图1 RWS分类
2.2 RWS的特点
例如经典流行病学,其对“病因探索”和“干预效果评价”的研究方案选择一般遵循“描述性研究-分析性研究-实验性研究”的顺序,从揭示现象到探索病因,由浅入深。在缺少研究经费支持、研究者的临床研究经验不足或对科学问题认知较浅的情况下,研究者可选择“基于HIS数据分析”的RWS方案开展研究。如在李家诚等[12]一篇题为“便秘患者的特征及中药治疗用药归经特点分析”的研究中,作者便是利用医院HIS系统数据,经数据清理和统计分析,探讨了便秘患者的临床特征,中药治疗疗效及药物归经特点。该类RWS的优点是,研究数据基于HIS系统既往产生数据,反映临床客观事实,获取方便,数据量大,研究成本低,适合临床关注问题的前期探索。但由于缺少前期研究设计,数据质量较差,多中心研究时设计数据标准化问题,数据库清洗须花费较大精力。
现况研究:又称为横断面研究,是描述性研究最常用的类型,一般通过描述某个特定时间点或时期和特定范围人群中的疾病或健康分布情况,以及暴露因素在人群中的分布特点,来初步探讨暴露与疾病或健康的关系。由于现况研究,不设置对照组,仅能计算疾病的患病率,因此也称为患病率研究。例如笔者作为通信作者于《Frontiers in Medicine》发表的一篇研究“银屑病患者吸烟率及其与银屑病严重程度关系:横断面调查”[13]就是一项横断面研究。
纵向研究:是指在不同的时间点对同一人群的疾病、健康状况和某些因素进行调查,以了解这些因素随时间的变化情况。例如对事先建立的银屑病患者队列人群每间隔一年开展一次随访,观察银屑病患者的疾病复发特征,代谢综合征发病情况等,就属于纵向研究。纵向研究在时间上是前瞻性的,在性质上属于描述性研究,可以是若干次横断面结果的串联分析。通常,纵向研究可以用于病因分析,研究疾病的发生、发展和转归研究。
病例对照研究:是分析性研究最基本、最重要的一种研究类型。如图2所示,病例对照研究以现有确诊患有某种疾病的患者作为病例,以未患有该种疾病但具有可比性的个体作为对照,通过询问、实验室检测、环境因素暴露测量等方式收集既往各种可能的危险因素暴露史,测量比较病例组和对照组中各因素的暴露比例差异,若经统计学检验差异有统计学意义,则可以认为暴露因素与疾病之间存在统计学关联。在评估各种偏倚对研究结果的影响后,借助病因推断技术,综合判定某个或某些暴露因素是否为疾病的危险因素,达到探索或检验疾病病因假设的目的。
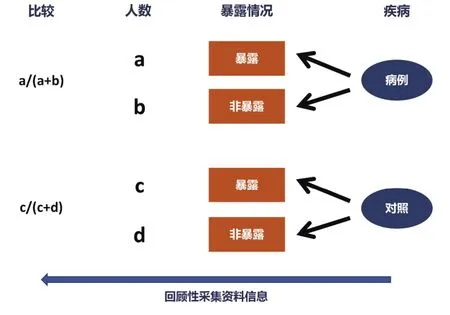
图2 病例对照研究原理示意图
队列研究是分析性研究另外一种重要研究类型。如图3所示,队列研究是在一个特定人群中选择所需的研究对象,根据研究对象目前或过去某个时期是否暴露于研究的因素或不同的暴露水平将研究对象分为不同组别,如暴露组和非暴露组,高剂量暴露组和低剂量组;通过询问、实验室检测和问卷调查等方法采集相关信息;随访观察一段时间后,观察登记不同暴露人群的结局事件发生情况,比较各组结局的发生率,从而评估和检验危险因素与结局的关系。

图3 队列研究原理示意图
PCT是指尽可能接近真实世界临床实践的临床试验,又称实效临床试验,其概念由Schwartz和Lellouch在1967年首次提出[14]。PCT整体上仍须遵循随机对照实验(randomized controlled trial, RCT)研究设计的指导原则,其实用性主要体现在研究者与受试者招募、干预措施及其实施、研究随访和研究结果的确定与分析等方面。2005年,由25个国际研究者和方法学专家组成团队提出了PRECIS(pragmatic-explanatory continuum indicator summary)工具,帮助研究者从9个维度了解某项临床试验的实用程度,在试验设计阶段明确试验设计目标及其结果的实用性,以保证临床试验的实施和最初预期研究目标一致。此外,随机对照试验报告统一标准(consolidated standards of reporting trials, CONSORT)声明专家组亦发布了基于CONSORT声明的实用性补充条款,帮助研究者评估临床试验结果的实用性。
3 PCT临床研究特征和设计要点
不同类别RWS的设计应相应地参考同类的流行病学研究开展研究设计,包括研究现场的选择,研究对象的确定,样本量估算,资料采集,干预措施实施和评估(IRWS),质量控制和统计分析等内容。本文仅介绍PCT的设计要点,其余类别的RWS设计要点和规范可参考其他工具书和教材。
PCT是测量干预效果(effectiveness)的临床试验,指在常规条件或实际临床情况下,干预措施产生的效果。而解释性RCT评价的干预措施的特异性疗效(efficacy),是指干预措施在严格控制的理想条件下,在经过严格标准筛选后的受试者产生的治疗作用。PCT的特征包括:①PCT本质上属于RCT研究,因此必须随机分组;②PCT主要用于评估临床中实际应用2种或多种干预措施综合临床效果的差异;③因其设计为贴近临床实际的RWS,常用标准治疗作为对照,不设安慰剂对照;④没有受试者盲法,克服信息偏倚的能力弱于常规RCT研究,常通过信息采集者、结局评价者、统计分析人员盲法提高研究结果的可靠性。表1概括了PCT和RCT的特点和差异性比较,供参考。

表1 RCT和PCT的比较
在开展PCT研究设计时,应遵循“代表性、真实性、可比性和显著性”的指导思想。代表性是保证研究结果科学性的基础,研究者应重视研究对象的随机化选择,提高样本代表性。同时在研究开展过程中,关注研究对象的失访率,评估脱落对研究结果的影响。真实性是反映客观事物的正确程度。研究者在开展研究设计时应重视资料收集和试验指标的测量方法,采取措施控制研究过程中可能存在的3种类型偏倚。可比性是科学性的表现。两事物之间有比较才能有鉴别,有比较才能发现差异,而比较的前提是两事物之间具有可比性。临床研究强调全过程的可比性(对象选择、测量、资料收集)。显著性要求研究者在进行PCT设计时应从统计学显著性检验角度,评价抽样误差大小(α=0.05),在样本量估算和统计分析描述中给予体现。具体到设计的细节,研究者同样应根据PICO原则和CONSORT声明,从“研究对象选择”“纳入标准和排除标准”“样本量估算”“随机化分组”“盲法及设置”“干预措施实施”“疗效评估”“质控控制”“数据集”“统计分析”等10个维度进行认真考量,撰写并执行规范的PCT。
尽管PCT具有较好的外推性,但其实施过程中也存在一些挑战:第一,研究设计限制较少,研究方案较简单,研究者和受试者存在异质性,尤其当干预效果依赖于实施人员的专业性时,例如手术类临床试验,样本量需要足够大才能揭示研究的异质性并保证检验效能;第二,干预措施通常不设盲,可能引入更多偏倚,但可对结局指标的测量实施评估者盲法;第三,研究数据的收集主要依赖于电子医疗信息和健康档案系统,部分国家和地区数字化和信息化水平较低时难以开展;第四,研究终点的选择应为重要临床事件,部分由患者自报,其收集、判定、分析和解读受到数据类型和质量的影响而面临挑战。
