基于免疫应激的补骨脂特异质肝毒性作用
2022-12-16高姝燕麦丽克姆麦图如孜霍仕霞张兰兰李治建2
高姝燕,麦丽克姆·麦图如孜,王 春,霍仕霞,张兰兰,窦 勤,张 云,李治建2,
[1.新疆医科大学药学院,新疆 乌鲁木齐 830011;2.新疆维吾尔自治区维吾尔医医院,新疆 乌鲁木齐 830049;3.新疆维吾尔自治区维吾尔医药研究所,新疆 乌鲁木齐 830011;4.新疆维吾尔自治区药物研究所,新疆 乌鲁木齐 830000;5.齐鲁工业大学(山东省科学院)生物研究所,山东 济南 250103]
特异质肝损伤( Idiosyncratic drug-induced liver injury,IDILI)是一种不可预测的药物不良反应,可导致急性肝功能衰竭,与药物剂量无明显关系,仅在少数病人身上发生[1]。近年来,传统中药引起的IDILI报道呈上升趋势,这使中药新药开发和临床应用面临严峻挑战。
补骨脂,为豆科植物补骨脂(PsoraleaCorylifoliaL.)的干燥成熟果实,其味辛、苦,性温,主要归肾、脾经,可用于治疗阳痿遗精、肾脾虚弱、小便无度、腰膝冷痛、虚寒咳嗽、五更泄泻等疾病[3]。收录在2020年版《中国药典》中的含有补骨脂的相关成方制剂多达41种[3]。在临床中多用于治疗皮肤病和骨关节炎等免疫炎症性疾病。
临床应用过程中发现,补骨脂可引起多种不良反应,其中肝损伤最为明显[4],主要表现为胆汁淤积型和肝细胞坏死型肝损伤[5]。补骨脂引起肝脏损伤的发生与用药时间、用药剂量无明显相关性,服用补骨脂的病人多出现机体免疫失衡,提示了补骨脂诱发IDILI风险。且已有研究表明,在脂多糖(lipopolysaccharide,LPS)诱导的免疫应激条件下,淫羊藿与补骨脂配伍使用可导致严重的肝损伤,主要机制可能是调节免疫炎症和代谢功能障碍[6]。然而,补骨脂单独作用是否会引起IDILI并未明确指出。为此,本研究通过LPS诱导的大鼠免疫应激模型,考察补骨脂肝毒性作用的特点及其毒性机制,为临床合理使用补骨脂及其制剂提供参考依据。
1 材料与方法
1.1 动物雄性SPF级SD大鼠(n=70),体质量(180~200)g,购于新疆医科大学动物实验中心(生产许可证号:SCXK(新)2018-0002)。饲养于新疆维吾尔医药研究所药品安全评价中心SPF级实验室,许可证号:SYXK(新)2018-0001,12 h/12 h明/暗光照,周期环境温度(20~26)℃,提供过滤的饮用水,自由饮食。本研究经新疆维吾尔医药研究所伦理委员会批准。
1.2 药品与试剂补骨脂(购自新疆新奇康药业股份有限公司,由新疆维吾尔自治区维吾尔医药研究所霍仕霞研究员鉴定为补骨脂的干燥果实,批号:20191219);LPS(Sigma公司,批号:L2880)。
丙氨酸转氨酶(ALT)检测试剂盒(IFCC法,批号:140121001)、天冬氨酸转氨酶(AST)检测试剂盒(IFCC法,批号:140220013)、碱性磷酸酶(ALP)检测试剂盒(速率法,批号:140320010)、总胆汁酸(TBA)检测试剂盒(循环酶法,批号:143220011)均购自深圳迈瑞生物医疗电子股份有限公司;BCA蛋白定量试剂盒购自北京索莱宝科技有限公司(批号:PC0020);ELISA白介素-1(IL-1,批号:JL20896)、白介素-12(IL-12,批号:JL20874)、肿瘤坏死因子(TNF-α,批号:JL13202)均购自江莱生物科技有限公司;一抗ras同源家族成员A(RhoA)购自北京博奥森生物技术有限公司(批号:bs-1180R);DAB显色试剂盒(批号:ZLI-9018)、胰蛋白酶消化液(批号:ZLI-9010)购于北京中杉金桥生物技术有限公司、RNApure Tissue & Cell Kit 动物组织/细胞RNA提取试剂盒(批号:CW0584S)购自江苏康为世纪生物科技有限公司。
1.3 仪器全自动生化分析仪:7100型,日立公司;低速大容量离心机:TGL-5-A,上海安亭科学仪器厂;普通光学显微镜:DM4000,德国莱卡公司;切片机:RM2245,德国莱卡公司;生物组织自动包埋机:KD-BMII,浙江金华科迪仪器设备有限公司;生物组织自动脱水机:KD-TS3D,浙江金华科迪仪器设备有限公司;摊片烤片机:KZPG-1A,天津天利航空机电有限公司;酶标仪:multiskan FC,赛默飞世尔科技(中国)有限公司;qPCR实时定量系统:CFX96,美国伯乐公司。
1.4 方法
1.4.1补骨脂水提取物(WEFP)制备 补骨脂干燥果实,粉碎后经10倍量纯化水煮沸提取3次,3次提取液混合后蒸发、回流、烘干得生药量为7.74 g·g-1的棕褐色干燥粉末。经HPLC检测WEFP含补骨脂素3.06 mg·g-1、异补骨脂素2.20 mg·g-1、补骨脂酚14.65 mg·g-1,用动物饮用水配制使用[11]。
1.4.2动物分组和给药 将 70只雄性SD大鼠随机分为:CON组、LPS组、WEFP组、LPS+WEFP组,CON与LPS每组20只,其余各组每组15只。LPS、LPS+WEFP组大鼠尾静脉注射4 mg·kg-1LPS,对照组与WEFP组给予等体积生理盐水;2 h后WEFP组与LPS+WEFP 组ig给予1.1 g·kg-1(等于8.514 g生药·kg-1,按体表面积换算,约为大鼠等效剂量的7.9倍)的WEFP,对照组与 LPS 组给予等体积的生理盐水,各组每日给药1次,连续给药7 d。
1.4.3体质量记录及一般状态观察 给药期间,每日称量并记录大鼠体质量,并对动物进行体征观察。
1.4.4胆汁流速检测 末次给药当日23 ∶00左右禁食,次日称量大鼠禁食体质量后,用20%乌拉坦0.6 mL·100 g-1腹腔注射进行麻醉。仰卧固定,于上腹部切口,分离胆总管,通过胆总管插管(PE管),收集插管后2 h胆汁于预先称质量的无菌塑料试管中,精密分析天平测定每只动物胆汁的总质量=(含胆汁试管质量-空试管质量),分别计算出胆汁的密度、体积和胆汁流量。
胆汁密度的测定:移液器吸头预先称质量,用精密移液器(40~200 μL)吸取200 μL胆汁于吸头中,再次测定总质量,则200 μL胆汁质量=含胆汁吸头质量-空吸头质量,按密度=质量/体积的公式,计算出胆汁密度,单位以kg·L-1表示。
胆汁总体积的计算:按体积=质量/密度的公式,计算出胆汁总体积,单位以mL表示。
按胆汁总体积/(收集时间×肝脏质量)的公式,计算单位时间(min)和肝质量(g)内的胆汁分泌量,即胆汁流量,单位以μL·min-1·g-1表示。
1.4.5肝脏系数及血清ALT、AST、ALP、TBA含量检测 胆汁收集完毕,将以上动物进行腹主动脉取血,3 000 r·min-1离心10 min得到上清液,置于全自动生化仪中测定 ALT、AST、ALP、TBA含量。取出全部肝脏称质量,计算肝脏质量系数=[肝脏质量(g)/体质量(g)×100%]。
1.4.6肝组织病理学检查 分别给药2 h、14 h、5 d、8 d,取各组肝脏用10%中性福尔马林固定、脱水、石蜡包埋、切片,采用HE染色,用电子显微镜进行组织病理学观察。取各组肝脏制备的切片脱蜡和水化,PBS清洗后抗原修复。滴加RhoA一抗,4 ℃ 过夜,滴加聚合HRP标记抗兔IgG二抗,DAB 显色,苏木精复染,梯度酒精脱水、透明、树脂封片。电镜下观察免疫阳性区域。采用Image Pro Plus5.0图像分析软件测定免疫阳性面积,以评价蛋白表达水平。
1.4.7肝脏组织内IL-1和TNF-α含量检测 组织样本制备10%的组织匀浆液:准确称取大鼠肝组织200 mg,按质量(g) ∶体积(mL)=1 ∶9的比例,加入9倍体积预冷的PBS缓冲液,制成10%的匀浆液,取出混匀抽提l min,3 500 g离心10 min,取上清液BCA定量,按照试剂盒说明书检测IL-1和TNF-α含量。
1.4.8实时荧光定量定量PCR(qPCR) qPCR检测给药d 8肝脏组织中Toll样受体4(TLR4)、细胞间黏附分子(ICAM-1)、RhoA、法尼醇X受体(FXR)、Na+-牛磺胆酸共转运蛋白(NTCP)、多耐药蛋白-2(MRP2)和胆盐输出泵(BSEP)mRNA表达变化,提取肝脏组织总RNA,反转录成cDNA,以cDNA为模板进行扩增,检测mRNA表达量。引物序列见Tab 1。
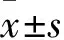
2 结果
2.1 WEFP对免疫应激大鼠体质量的影响与CON组相比,给药14 h,LPS和LPS+WEFP组大鼠体质量明显下降(P<0.01);给药5 d,LPS组大鼠体质量出现增长,LPS+WEFP组大鼠体质量持续下降(P<0.01);给药8 d,LPS+WEFP 组大鼠体质量明显低于CON组(P<0.05)。与WEFP组相比,给药第14 h、d 5后,LPS+WEFP组体质量明显降低(P<0.05,P<0.01),见Fig 1。
2.2 WEFP对免疫应激大鼠胆汁流速的影响给药14 h后,与CON组相比,WEFP组胆汁流速无明显性差异,而LPS+WEFP组胆汁流速明显下降(P<0.01)。给药5 d后,各组胆汁流速恢复正常,见Fig 2。
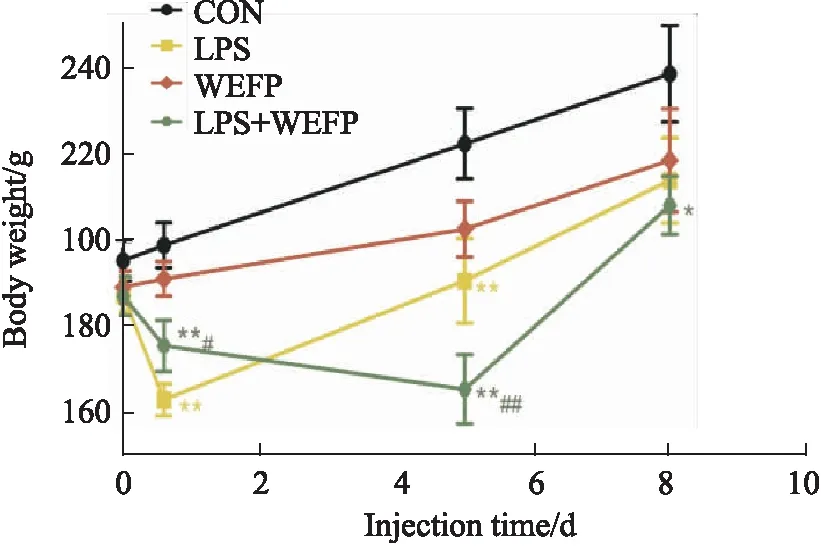
Fig 1 Effects of different administration groups on body weight of rats
2.3 WEFP对免疫应激大鼠肝脏系数的影响给药14 h后,与CON组相比,LPS+WEFP组大鼠肝脏系数均明显升高(P<0.01);与WEFP组相比,LPS+WEFP组肝脏系数也明显升高(P<0.01)。给药5 d后,LPS+WEFP组肝脏系数与CON组和WEFP组相比明显升高(P<0.01)。持续给药8 d后,各组肝脏系数恢复正常,见Fig 3。
2.4 WEFP对免疫应激大鼠血清ALT、AST、ALP、TBA含量的影响血清生化结果见Tab 2~5。经LPS诱导2 h后LPS与CON组相比血清ALT、AST、ALP和TBA含量并无明显性改变,提示低剂量的LPS未造成肝脏损伤。给药14 h后与CON组相比,LPS+WEFP组ALT、AST和ALP含量均明显增加(P<0.05或P<0.01),且LPS组和LPS+WEFP组TBA含量明显增加(P<0.05或P<0.01)。给药5 d后,与CON组相比,LPS+WEFP组TBA含量明显升高(P<0.01),LPS+WEFP组ALT、AST和ALP含量明显减少(P<0.05或P<0.01)。给药后d 8,与空白对照组相比,WEFP组和LPS+WEFP组ALT含量减少(P<0.05),LPS+WEFP组AST、ALP、TBA含量减少(P<0.05)。

Fig 2 Effects of different administration groups on bile flow velocity **P<0. 01 vs CON group; ##P<0. 01 vs WEFP group.

Fig 3 Effects of different administration groups on liver coefficient in rats **P<0. 01 vs CON group; ##P<0. 01 vs WEFP group
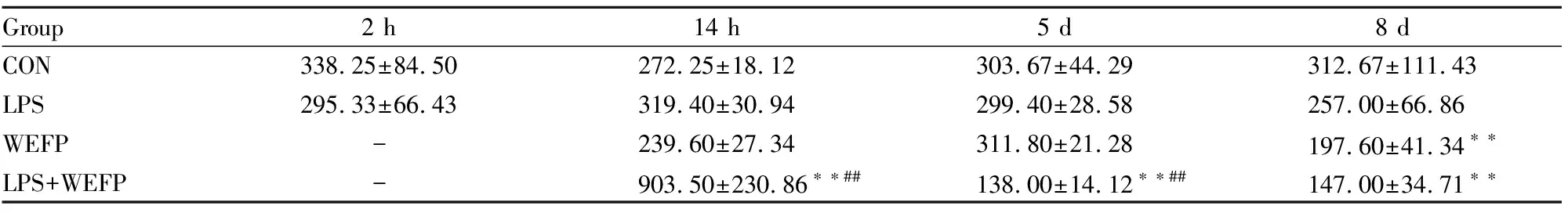
Group2 h14 h5 d8 dCON338.25±84.50272.25±18.12303.67±44.29312.67±111.43LPS295.33±66.43319.40±30.94299.40±28.58257.00±66.86WEFP-239.60±27.34311.80±21.28197.60±41.34∗∗LPS+WEFP-903.50±230.86∗∗##138.00±14.12∗∗##147.00±34.71∗∗

Tab 3 Serum AST ( U·L-1 ) values of rats in each group at different time points n=5)

Tab 4 Serum ALP ( U·L-1 ) values of rats in each group at different time points

Tab 5 Serum TBA ( U·L-1 ) values of rats in each group at different time points

Fig 4 Typical histopathological section photographs of rat liver specimens for HE analysis (magnification 200×, 100×)
2.5 WEFP对免疫应激大鼠肝脏病理损伤的影响通过显微检查肝脏组织以分析肝脏的损伤程度。如Fig 4所示,CON组肝脏切片显示正常的肝细胞结构。LPS组和LPS+WEFP组给药14 h出现轻微炎症细胞浸润。WEFP处理的大鼠肝脏样本除WEFP组在给药第8 d表现出轻度脂肪变性外,其余与CON组大鼠的肝细胞形态相比没有明显病理学改变。LPS+WEFP组大鼠的肝脏样本出现中央静脉内膜脱落,以及门静脉区域的炎症细胞浸润;在给药d 5出现肝细胞局灶性坏死,脂肪变性和胆汁淤积。
2.6 WEFP对免疫应激大鼠肝脏组织内IL-1和TNF-α含量的影响给药5 d后,LPS+WEFP组与CON组和WEFP组相比,肝脏中IL-1含量明显增加(P<0.01或P<0.05)。给药8 d后,与CON组相比,WEFP组IL-1含量有增加趋势但无差异,但LPS+WEFP组肝脏中IL-1含量明显增加(P<0.01),见Fig 5A。
大鼠给药2 h、14 h、5 d后,各组肝脏中TNF-α含量均无明显变化;在给药d 8,LPS+WEFP组与WEFP组相比肝脏中TNF-α含量明显增加(P<0.05),见Fig 5B。
2.7 WEFP对免疫应激大鼠肝脏组织中RhoA蛋白表达的影响RhoA染色位于细胞质中呈棕褐色,主要见于窦周,以沿间隔分布的梭形间质细胞表达为主,部分肝细胞、窦内皮细胞、血管内皮细胞和胆管上皮细胞的膜上表达也有所增强,见Fig 6A。给药14 h 后与CON组相比,LPS组和LPS+WEFP组大鼠肝组织RhoA表达明显增加(P<0.01)。给药5 d后,与CON组相比,LPS组、WEFP组、LPS+WEFP组RhoA蛋白表达均明显增加(P<0.01);与WEFP组相比,LPS+WEFP组RhoA表达明显增加(P<0.01)。给药8 d后,与CON组相比,WEFP组和LPS+WEFP组RhoA表达明显增加,见Fig 6B。
2.8 WEFP对免疫应激大鼠炎症、胆汁代谢关键调控基因mRNA表达的影响对各组与炎症相关基因表达进行分析。与CON组相比,LPS组和LPS+WEFP组肝脏组织中TLR4相对mRNA水平明显升高(P<0.01),LPS+WEFP组RhoA和ICAM-1相对mRNA水平明显升高(P<0.01)。与WEFP组相比,LPS+WEFP组RhoA、TLR4 、ICAM-1mRNA表达均明显升高(P<0.01),见Fig 7A。与胆汁酸代谢相关基因中FXR、MRP2和BSEP mRNA表达含量与CON组相比WEFP组无明显性变化,但LPS+WEFP组出现明显升高(P<0.05、P<0.01)。与CON组相比,各组NTCP mRNA表达未出现明显性改变,见Fig 7B。

Fig 5 Effect of different administration groups on IL-1 (A) and TNF-α (B) content **P<0. 01 vs CON group; #P<0. 05, ##P<0. 01 vs WEFP group.

Fig 6A Analysis of expression of RhoA in rat liver specimens by IHC (200×)

Fig 6B Area of RhoA protein expression n=3)
3 讨论
补骨脂被广泛用于许多传统中医药配方中,临床使用过程中造成的肝损伤具有偶发性、隐匿性、个体差异大等特点。课题组前期研究发现补骨脂醇提取物(EEFP)2.25 mg·kg-1,连续给药30 d,可诱发大鼠出现胆汁淤积肝损伤,与临床肝损伤表现一致,但其用药剂量为临床等效剂量的50倍,且给药时间较长,不能充分解释补骨脂在临床使用中肝损伤的发生原因[8]。此外,有研究报道,补骨脂可能会引起IDILI,但其毒性机制尚不明确[6]。为进一步考察补骨脂引起IDILI随时间变化的动态毒性特点和毒性机制,本研究应用LPS建立免疫应激动物模型与WEFP联合作用SD大鼠。研究结果显示,LPS和WEFP单独给药对ALT、AST和ALP含量无明显影响。相同剂量的LPS结合WEFP在给药第14 h后ALT、AST和ALP含量明显升高,继续给药5 d后明显降低,这是由于肝脏损伤引起肝细胞变性或坏死,细胞膜破裂,导致胞浆酶渗漏到血液中,引起血清酶升高。为了进一步证实这一结果,我们进行了肝脏组织病理学检测,结果发现LPS诱导炎症细胞浸润,WEFP组出现轻度的脂肪沉积,但并均未见肝细胞损伤;在LPS+WEFP处理的大鼠中,出现肝细胞坏死和胆汁淤积。以上结果提示,非肝毒性剂量LPS引起的轻微炎症反应可降低WEFP发生肝毒性阈值,导致肝细胞凋亡增加。
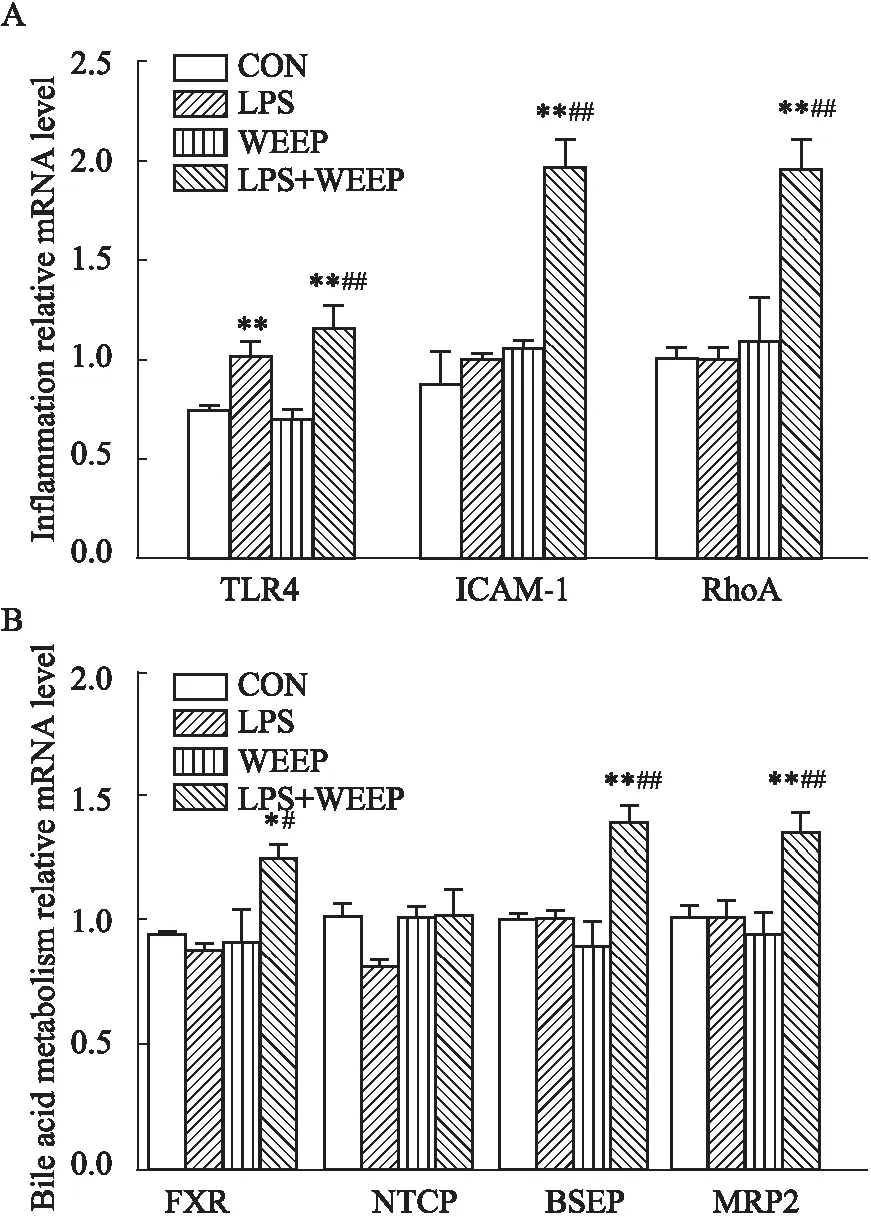
Fig 7 Effect of WEFP on expression of liver injury-related genes after continuous administration for 7 d in immunologically stressed rats
TLR4参与LPS信号传递,并作为CD14的细胞表面共受体,导致LPS介导的NF-κB激活并刺激单核细胞、巨噬细胞、中性粒细胞、淋巴细胞等释放大量的细胞因子和炎症介质,产生一系列炎症反应[9]。IDILI产生应激反应主要原因之一是激活肝脏中TNF-α和IL-1等细胞因子和趋化因子的释放,促进和放大炎症而加剧药物毒性反应[10]。本研究结果显示,与LPS单独给药组相比,WEFP同时作用能明显增加LPS处理大鼠IL-1、TNF-α的分泌,加剧炎症反应。ICAM-1是一种可诱导的细胞黏附的糖蛋白,当局部炎症发生时受到多种炎症因子刺激,导致细胞间ICAM-1表达上调,使白细胞和单核细胞稳定粘附于内皮细胞。RhoA可调控肌动蛋白细胞骨架的形成、细胞聚集、活性氧、形成和凋亡等。除此之外,RhoA在LPS诱导的炎症性免疫应激过程中发挥重要作用。RhoA信号通路被促炎症因子激活后诱导NF-κB自细胞质向细胞核移动,激活 NF-κB 通路促进炎症因子释放,导致炎症因子大量聚集导致炎症反应加剧。RhoA信号通路影响NF-κB的激活和ICAM-1的表达。研究表明,LPS通过TLR4作用,刺激RhoA表达,从而诱导NF-κB反式活化和ICAM-1基因表达[11]。本文实验结果显示,WEFP可明显增加免疫应激大鼠TLR4受体 mRNA的表达,进一步刺激大鼠体内RhoA和ICAM-1 mRNA的表达量增加。
促炎细胞因子通过影响导管胆汁形成,使胆汁酸代谢发生障碍,导致胆汁酸反流入血,血清TBA浓度升高,引起胆汁淤积[12]。FXR被称为“胆汁酸受体”,它可与胆汁酸结合,调节胆汁酸代谢,维持胆汁酸稳态。细胞内胆汁酸水平的异常升高,使胆汁酸与 FXR 的配体结合区结合增加,激活 FXR 的靶基因,继而负反馈调节胆汁酸的生成、分泌、重吸收,以维持机体胆汁酸和胆固醇的稳态平衡。多药耐药蛋白(MRPs)和BSEP是一种定位于肝细胞的蛋白质,在将胆盐运输到胆管的过程中发挥重要作用。研究结果显示,LPS+WEFP给药14 h胆汁流速出现明显下降,造成胆汁淤积;在给药8 d后胆汁流速逐渐恢复正常,同时mRNA结果显示LPS+WEFP作用可引起FXR、MRP2和BSEP表达升高。提示LPS+WEFP早期作用引起的胆汁酸代谢和转运失调造成的胆汁淤积,反馈性引起FXR、MRP2和BSEP表达升高,促进胆汁酸代谢和外排以维持机体胆汁酸稳态。
综上所述,非肝毒性剂量LPS引发的免疫应激状态降低WEFP发生肝毒性的阈值,导致IDILI。其毒性机制可能是通过激活RhoA,进一步调节NF-κB反式激活和ICAM-1的表达,诱导炎症反应加剧,导致胆汁酸外排受到阻碍,最终导致脏损伤。本文初步探索了WEFP诱发IDILI的发展过程及毒性作用机制,为解释补骨脂引起的肝损伤的作用机制提供了新的思路。