黄连复方汤治疗胃癌作用机制的网络药理学研究
2022-12-16申嗣琪李发展米阳郑鹏远
申嗣琪,李发展,米阳,郑鹏远
(郑州大学第五附属医院,河南 郑州 450000)
0 引言
国际癌症研究机构统计编制的Globocan2018年癌症分析报告显示:2018年全球超过100万例胃癌新病例和78.3万例胃癌死亡病例,胃癌成为全球第五大常见癌症和第三大癌症死亡原因[1]。胃癌由于早期缺乏相应症状,常确诊于晚期,因此肿瘤晚期的侵袭和转移是胃癌患者死亡的主要原因之一,胃癌晚期的治疗常使用序贯化疗[2],但化疗药物为细胞毒性药物,常导致抗癌过程中产生骨髓抑制等严重副作用,降低了患者生活质量甚至影响了抗癌效果[3]。研究发现,中药具有多成分、多途径、协同增效的特点,某些成分可有效防止肿瘤细胞的扩散和转移,有着巨大的研究价值和应用前景[4]。
黄连复方汤来源于《圣济总录》卷一七八,包含黄连、干姜、艾叶、乌梅四味中草药,具有平调寒热、和胃降逆的功效,常用于治疗感冒、腹泻、腹痛等[5,6],有研究发现乌梅和黄连均有一定抗肿瘤作用[7,8],但因药方活性成分多、作用靶点繁复,具体机制并未明确。
“网络药理学”这一概念由英国学者Hopkins首先提出[9],认为药物治疗疾病的作用过程是“多成分-多靶点-多途径”的[10],因此网络药理学研究具有整体性和系统性,与中医药的辨证论治原则、整体观念相合,可用于发现复杂中药中的活性成分,进而识别靶标和预测适应证[11]。本研究以网络药理学方法筛选出了黄连复方汤治疗胃癌的活性成分和主要作用基因靶标,预测了黄连复方汤治疗胃癌的网络药理学作用机制。
1 方法
1.1 胃癌靶点-缺氧基因提取
从G S E A(Gene Set Enrichment Analysis)的基因集数据库中,提取缺氧相关的基因。在TCGA(The Cancer Genome Atlas Program)的胃癌数据库中寻找缺氧基因对应样本表达量,进行差异分析,筛选出正常组织和胃癌组织差异表达的缺氧基因。
1.2 药物活性成分及靶点筛选
使用中药系统药理学数据库与分析平台(TCMSP,http://tcmspw.com/tcmsp.php)分别检索黄连复方汤含有的四种中药成分:黄连、干姜、艾叶、乌梅,筛选其中同时符合口服生物利用度(OB)≥30%和类药性(DL)≥0.18条件的活性成分,整理并收集对应的基因靶点。
1.3 蛋白互作(PPI)网络构建与分析
将所获药物活性成分靶点与差异表达的缺氧基因导入Cytoscape 3.7.2软件,绘制中药成分与缺氧基因的联系图。在此软件内,使用插件BisoGenet 3.0.0,勾选HPRD、BIND、DIP、MINT、INTACT、BIOGRID数据库,设置显示输入的节点及相邻节点,构建差异基因的蛋白互作网络,使用插件CytoNCA分别按照Degree count(61-Max)和Betweenness count(70-Max)进行筛选。
1.4 基因富集分析
GO(Gene ontology)分析将基因功能分为生物过程(Biological process,BP)、细胞组分(Cellular component,CC)、分子功能(Molecular function,MF)三部分,KEGG(Kyoto Encyclopedia of Genes and Genomes)数据库是系统分析基因功能、链接基因组信息和功能信息的数据库。在R软件中,使用“clusterProfiler”,“richplot”and“ggplot2”对黄连汤复方相关的靶点基因进行GO功能和KEGG通路聚集分析,α=0.05为检验标准,以P<0.05为筛选阈值。
2 结果
2.1 缺氧基因提取及差异分析
将正常组织和胃癌组织中缺氧基因的表达情况绘制火山图,以FDR<0.05,|logFC|>1为条件筛选出胃癌组织中显著上调或下调的缺氧基因,并绘制出相应火山图和热图(图1)。结果显示,相较于正常组织,在胃癌组织中差异表达的缺氧基因一共42个,其中上调和下调的基因各21个。

图1 缺氧基因表达差异分析
2.2 词活性成分及基因靶点
符合OB≥30%,DL≥0.18的黄连复方汤活性成分共18个,包括Huanglian(黄连)7个,Ganjiang(干姜)5个,Aiye(艾叶)6个,Wumei(乌梅)6个,见表1。活性成分对应765个基因靶点,去重后获得186个基因靶点。

表1 黄连复方汤活性成分及对应基因靶点
2.3 PPI筛选与分析
将药物活性成分基因靶点与胃癌组织差异表达的基因做交叉分析,绘制药物活性成分与缺氧基因的联系图(图2),其中JUN作为活性成分山柰酚、β-谷甾醇的基因靶点,FOS、HK2、SERPINE1、CAV1、CDKN1A、JUN、IGFBP3、VEGFA作为活性成分成分槲皮素的共有靶点。

图2 活性成分与基因联系图
绘制差异基因的蛋白互作网络图(图3 a),并通过CytoNCA插件对PPI网络进行功能分析,按照deg r ee值(DC>61,图3 b)和betweenness值(BC>7 0,图3c)筛选排序。其中,按degree值排名前1 5的靶点基因为CDKN1A(277)、JUN(273)、NTRK1(242)、TP53(237)、FOS(215)、C A V 1(1 9 9)、E S R 1(1 8 9)、A P P(1 8 2)、EP300(165)、UBC(158)、EGFR(158)、HSP90AA1(158)、CDK2(152)、FN1(140)、CREBBP(134);按betweenness值排名前15的靶点基因为TP53(247.91)、EP300(139.08)、ESR1(1 3 5.1 0)、EGFR(1 3 4.6 1)、HSPA8(1 2 5.8 3)、NTRK1(1 2 5.7 5)、NPM1(12 4.53)、HSP 90A A1(118.7 6)、CDKN1A(1 0 4.3 5)、UBC(1 0 1.7 2)、JUN(90.35)、COPS5(87.77)、TUBB(84.96)、APP(84.45)、MYC(82.29)。

图3 差异基因的蛋白互作网络(PPI)
2.4 GO富集分析和KEGG通路富集分析
将GO分析与KEGG分析结果(按P值升序排列)分别绘制成气泡图、柱状图,图中气泡大小及柱状长短代表富集基因靶点的多少,气泡及柱体颜色差异代表基因靶点富集的显著性大小。
G O富集分析结果(图4)列出黄连复方汤治疗胃癌涉及的前5条生物过程(B P),前5个细胞组分(C C)以及前5项分子功能(MF)。BP中,主要是对老化(aging)、对氧气水平的反应(response to oxygen levels)、泌乳(lactation)、体液分泌(bodyfluid secretion)、乳腺发育(mammary gland development)等生物过程进行调节。CC中,主要对血小板α-颗粒腔(platelet alpha granule lumen)、血小板α-颗粒(platelet alpha granule)、RNA聚合酶Ⅱ转录调节复合物(RNA polymeraseⅡtranscription regulator complex)、分泌颗粒腔(secretory granule lumen)、细胞质囊泡腔(cytoplasmic vesicle lumen) 等细胞组分有显著作用。MF中,主要对SMAD相关蛋白结合(R-SMAD binding、SMAD binding)、纤维连接蛋白结合(fibronectin binding)、RNA聚合酶Ⅱ激活转录因子结合(RNA polymeraseⅡactivating transcription factor binding)、激活转录因子结合(activating transcription factor binding)等分子功能有显著作用。

图4 GO富集分析
KEGG通路富集分析结果(图5,6)表明,黄连复方汤治疗胃癌涉及富集潜在基因靶点最多的10条通路依次为缺氧诱导因子1信号通路(HIF-1 signaling pathway)、血剪切应力和动脉粥样硬化(Fluid shear stress and atherosclerosis)、卡波西肉瘤相关疱疹病毒感染(Kaposi sarcoma-associated herpesvirus infection)、肾细胞癌(Renal cell carcinoma)、p53信号通路(p53 signaling pathway)、结直肠癌(Colorectal cancer)、类风湿关节炎(Rheumatoid arthritis)、内分泌抵抗(Endocrine resistance)、糖尿病并发症中的AGE-RAGE信号通路(AGE-RAGE signaling pathway in diabetic complications)、恰加斯病(Chagas disease)。提示黄连复方汤可能通过以上通路治疗胃癌。
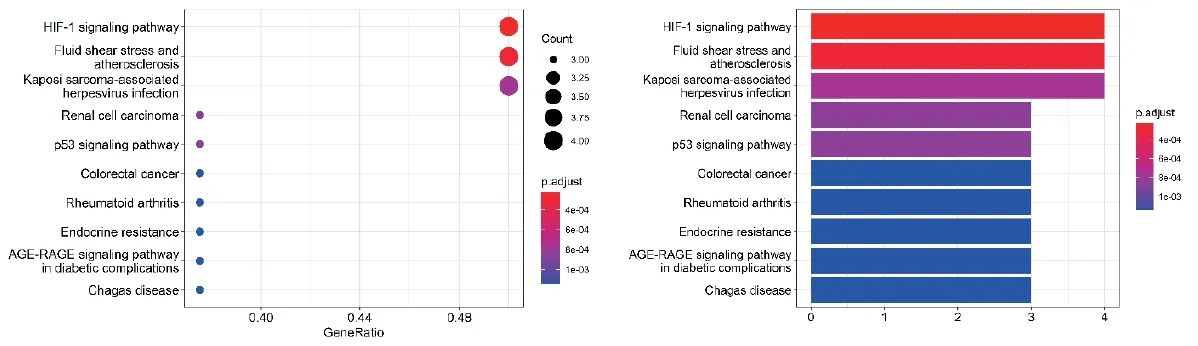
图5 KEGG通路富集分析
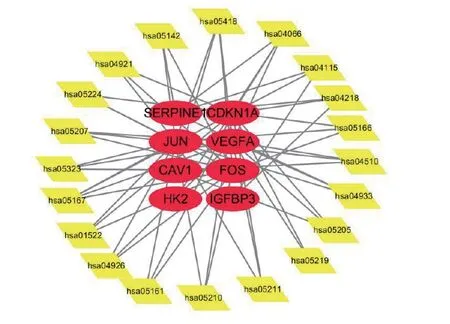
图6 “基因靶向KEGG通路”相互作用的网络图
3 讨论
中药多为口服制剂,在体内需经过吸收、分布、代谢及排泄过程到达靶器官或组织发挥作用,此过程称为中药的药动学特征(即ADME过程),其中口服生物利用度(OB)与类药性指数(DL)是中药ADME过程的关键指标[4]。
本研究以OB≥30%和DL≥0.18为条件筛选到的黄连复方汤治疗胃癌的主要活性成分为山柰酚、β-谷甾醇和槲皮素等,均已被研究证实具有抗肿瘤、抗氧化、抗炎、抗菌、增强免疫功能等作用[12-19],说明这几种活性成分可能是黄连复方汤治疗胃癌的药效基础。通过活性成分与基因联系图和蛋白互作网络(PPI)分析发现JUN、CDKN1A、FOS、HK2、SERPINE1、CAV1、IGFBP3、VEGFA等可能是黄连复方汤治疗胃癌的作用靶点。以PPI分析所得degree值排名靠前的关键靶点为例:Kaya等研究表明,CDKN1A基因是参与癌症发病机制的重要肿瘤抑制因子[20],Shi等研究表明,由CDKN1A基因编码的p21蛋白是CDK抑制剂的重要成员,p21被广泛称为肿瘤抑制因子,但p21还可以通过促进细胞周期进展抑制细胞凋亡,以及有利于迁移而起到致癌因子的作用,因此p21在癌症中起到了抑制因子或启动子的双重作用[21],需要进一步研究以确定其作为单个癌实体治疗分子靶标的效用。研究表明,AP-1转录复合物主要由JUN和FOS蛋白家族的成员组成,而AP-1转录复合物参与细胞增殖、分化和凋亡过程,与癌症的发展和转移密切相关,但与此同时,JUN、FOS蛋白被认为可以发挥肿瘤抑制功能[22,23]。
GO富集分析中,BP分析表明,细胞的老化及对氧气水平的反应等生物过程受到最显著的影响,说明这些基因主要参与细胞基础活动的调控;CC分析表明,说明这些基因主要与血小板α-颗粒腔、血小板α-颗粒等细胞间质和细胞质相关细胞组分的形成或作用通路有关;MF分析表明,这些基因主要参与药物产生药效过程中的蛋白、酶、转录因子等分子功能。
KEGG通路分析结果表明黄连复方汤治疗胃癌相关缺氧基因富集的主要通路包括HIF-1信号通路、血剪切应力和动脉粥样硬化、p53信号通路等。以HIF-1信号通路为例进行分析:缺氧始终存在于肿瘤微环境中,是实体瘤的内在特征之一,与肿瘤的侵袭性表型有关[24],对缺氧的大多数反应是一系列缺氧诱导因子(HIF)引起的,这些转录因子诱导各种基因的表达,这些基因有助于细胞适应缺氧环境,其中HIF-1在癌症进展中的作用已经得到充分证实,HIF-1作为信号传导中心,协调影响肿瘤发生的许多转录因子和信号分子的活动,包括肿瘤的转移和复发等[25,26]。
4 小结
黄连复方汤中的山柰酚、β-谷甾醇和槲皮素成分可能作用于JUN、CDKN1A等缺氧基因是黄连复方汤治疗胃癌的作用机制,主要为对细胞老化及对氧气水平的反应过程的调控,并涉及HIF-1信号通路、血流剪切应力和动脉粥样硬化等。本研究为研究黄连复方汤治疗胃癌提供了初步探讨与预测,可为后期相关研究提供理论支持。
