超声征象对非肿块型乳腺癌与肉芽肿性小叶性乳腺炎的鉴别诊断价值
2022-12-15常建东许梅娜周瑞娟陈瑞福
林 韵,常建东,许梅娜,周瑞娟,陈瑞福,林 云
乳腺癌是女性最常见的恶性肿瘤,其发病率和死亡率呈逐年上升的趋势[1]。然而有些乳腺癌超声表现为非肿块型病变(non-mass lesion,NML),在两个不同的扫查方向上不具备空间占位效应,这种情况占所有乳腺病变的10%~15%[2]。NML包括多种病理改变,如导管原位癌、浸润性小叶癌、纤维囊性改变及纤维化等[3]。关于非肿块型乳腺癌(non-mass breast cancer,NMBC)[4]的知识鲜有文献提及,在美国放射学院乳腺影像报告与数据系统(ACR BI-RADS)对超声的分级中没有正式描述[5],然而其图像缺乏特异性,目前尚无统一标准,是近年来的研究热点。本研究通过对NMBC和肉芽肿性小叶性乳腺炎(granulomatous lobular mastitis,GLM)的常规超声、彩色多普勒超声表现进行分析,探讨超声对这两种疾病的鉴别诊断价值。
1 资料与方法
1.1 一般资料 回顾性分析2021年1月—2021年12月于北京中医药大学厦门医院胸外乳腺科就诊、经穿刺或术后病理证实为NMBC及GLM的患者共57例,均为女性,年龄21~69岁,平均(39.15±9.67)岁。病灶66个,其中NMBC 29个,GLM37个,病灶直径6~80 mm,平均(29.77±16.90)mm。
1.2 纳入与排除标准 1)纳入标准:经手术或穿刺后病理证实为NMBC[2,4]或GLM患者。2)排除标准:曾接受过治疗的肿块型乳腺癌及GLM患者;合并糖尿病、心脏病、肝肾功能衰竭患者;合并精神障碍无法沟通者。
1.3 方法
1.3.1 超声检查 采用法国声科Aisplorer声蓝超声诊断仪进行检查,探头频率12.0~18.0 mHz。将患者的乳房充分暴露在外,探头上涂抹耦合剂,首先进行常规超声检查,记录所有病灶的形态、大小、回声、钙化和周边回声有无增强,皮肤、乳头有无受累,是否有窦道,有无导管扩张,有无肿大淋巴结等信息,然后进行彩色多普勒检查,观察病灶内部及周边血流分布情况,测量血流阻力指数值,血流分级采用Alder分级,最后依据2013年美国放射学会的BI-RADS 分级对病灶进行分类[5]。所有病灶征象由2名具有5年以上工作经验的主治医师独立分析诊断,当结果不一致时,依据第三位高级医师的意见,讨论后得出结论。
1.3.2 病理检查方法 病灶标本以中性甲醛进行固定,随之进行石蜡包埋切片,切片厚度为4~5 μm,使用苏木精-伊红(hematoxylin-eosin,HE)染色法染色,在光镜下观察病灶组织形态。
1.4 统计学方法 应用SPSS 26.0统计软件进行数据分析,计数资料以例数(百分率)[n(%)]表示,组间比较采用χ2检验,当病例数小于5时,采用Fisher精确检验,P < 0.05为差异有统计学意义。
2 结果
2.1 病理结果 1)NMBC病灶共29个,其中乳腺导管内癌9个,乳腺导管内癌合并浸润性导管癌10个,浸润性导管癌6个,浸润性小叶癌2个,浸润性微乳头状癌1个,炎性乳腺癌1个。2)GLM病灶共37个。
2.2 两组患者超声声像图特点比较 1)NMBC超声表现:29个病灶中,超声表现为形态不规则(93.10%)的低回声区(79.31%),边缘模糊(55.17%)或成角(55.17%),内部伴有微小钙化(55.17%),周边组织回声增强(34.48%),伴腋窝淋巴结肿大(31.03%),血流丰富(41.38%),可见穿支血流(31.03%),血流阻力指数>0.7(20.69%)。2)GLM超声表现: 37个病灶中,超声表现为形态不规则(97.29%)的低回声区(75.67%),边缘模糊(62.16%),周边组织回声增强(64.86%),可见窦道形成(29.73%),伴腋窝淋巴结肿大(56.76%),血流丰富(70.27%)。NMBC与GLM超声征象中非平行、成角、毛刺、微小钙化、周边组织回声增强、窦道、腋窝淋巴结肿大、丰富血流、穿支血流及阻力指数>0.7的比例差异有统计学意义(P< 0.05);两组其余超声征象比较差异无统计学意义(P> 0.05)。见表1。
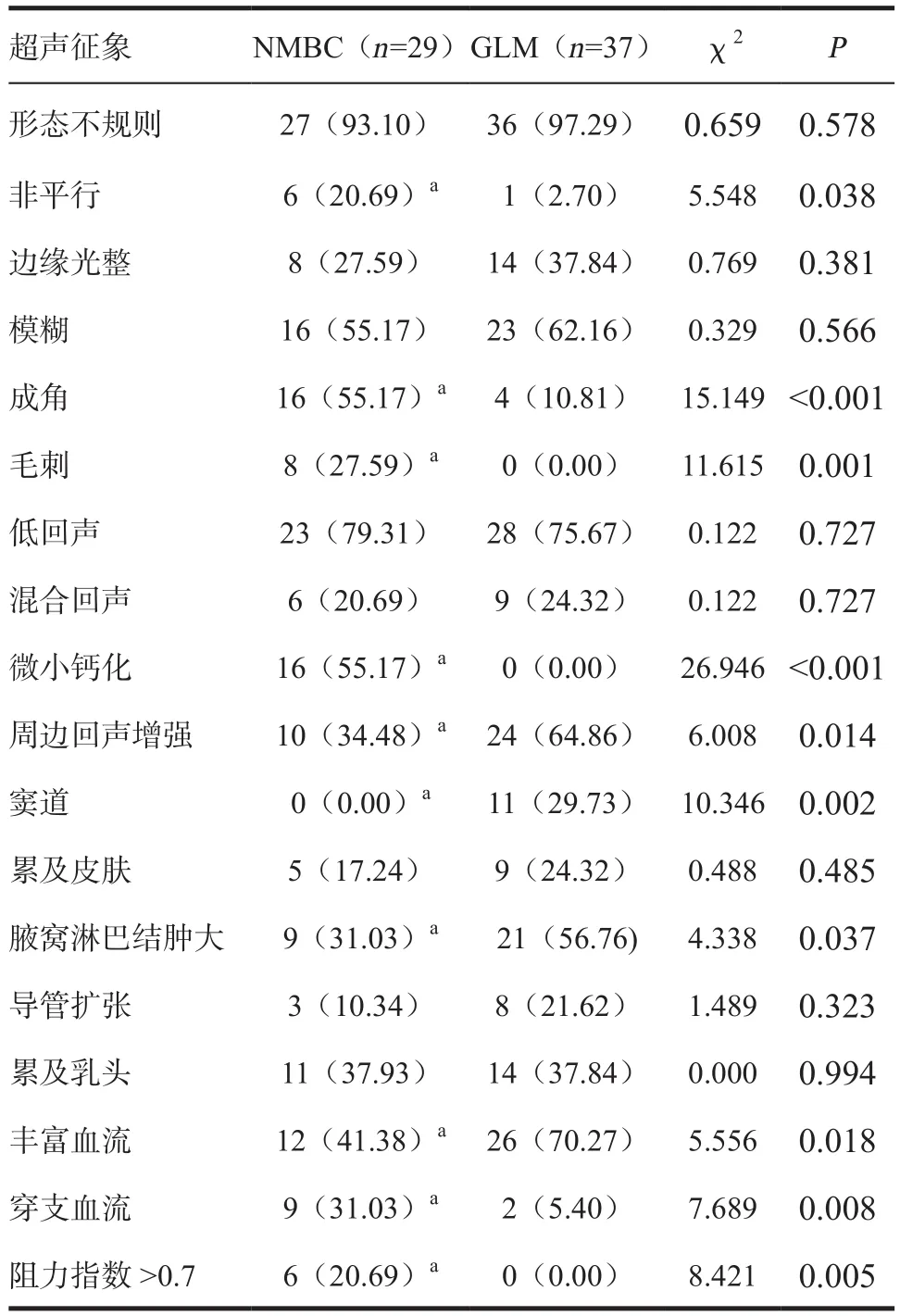
表1 NMBC与GLM超声征象比较 [n(%)]
3 讨论
NMBC与GLM的声像图不易鉴别,为临床诊断及治疗带来挑战。有研究表明,无周期型疼痛、肿块直径>5 cm,发病时间<12个月,超声显示低回声区域伴散在钙化点的非肿块型乳腺疾病患者为高风险患者[6]。
3.1 NMBC的超声征象 本研究中非肿块型乳腺癌组共26例,病灶29个,病理类型主要是导管原位癌(ductal carcinoma in situ,DCIS)合并浸润性导管癌(34.48%,10/29)及DCIS(31.03%,9/29)。超声表现以低回声区伴微小钙化为主(51.72%,15/29,图 1)。Watanabe等[7]研究了705例DCIS,发现60%的DCIS病变表现为非肿块异常,最常见的是低回声区和导管异常。本研究中NMBC组病灶呈节段性分布,病理基础是病灶起源于终末导管与小叶的连接处,沿着乳腺导管及其分支发展,呈浸润性生长,可累及同一导管或同一象限乳管,呈节段性不均匀低回声灶,一般不相通,有时跳跃分布。本研究中错误诊断3例中1例误诊为乳腺炎,1例误诊为良性病灶,1例漏诊。印象深刻的是1例误诊为乳腺炎(图2),病理证实为炎性乳腺癌(inflammatory breast cancer,IBC)。IBC典型临床表现为皮肤广泛炎症改变,皮肤发红,皮温升高,乳房红斑和水肿,是由于皮肤真皮淋巴管被癌细胞侵袭所致[8]。超声表现为皮肤增厚,乳腺广泛实质回声增强。另外漏诊1例仅显示导管异常,分析原因在于对NMBC认识不透彻,缺乏警惕性,临床征象与乳腺炎患者及其发展相似。有研究表明,弹性成像联合BI-RADS分类诊断NMBC的敏感度、特异度、准确率分别为81.25%、80.95%、81.13%,均高于单一弹性成像或BI-RADS分类[9]。
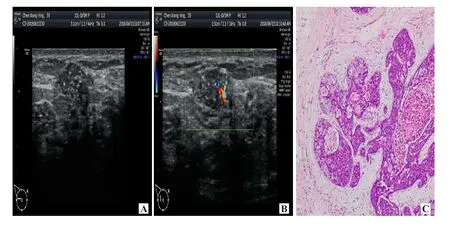
图1 典型病例(女,40岁,非肿块型乳腺癌)超声表现及病理图
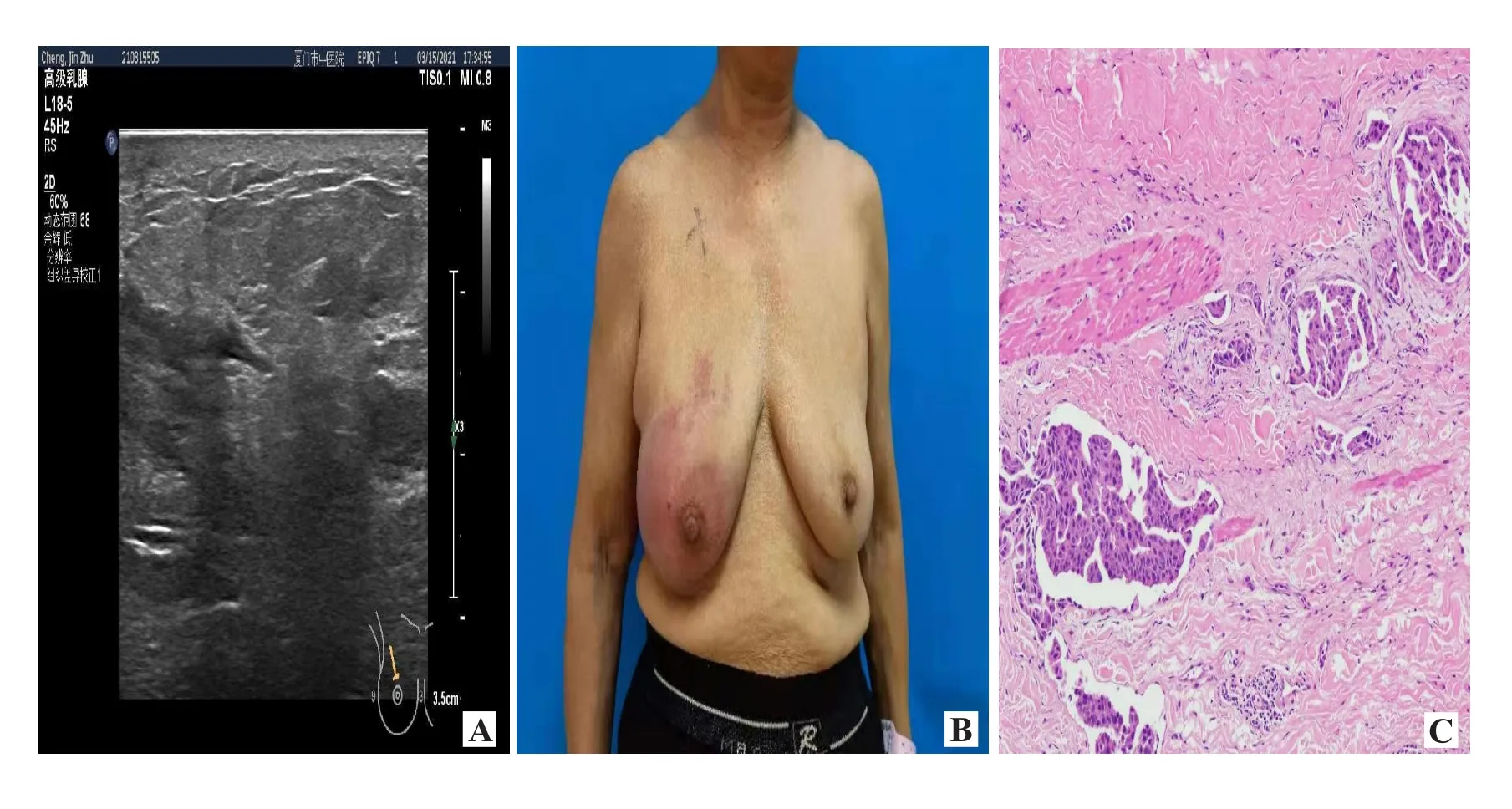
图2 典型病例(女,73岁,炎性乳腺癌)超声表现及病理图
3.2 肉芽肿性小叶性乳腺炎超声征象 本研究中肉芽肿性小叶性乳腺炎组共31例,病灶37个,75.68%(28/37)的病灶主要表现为低回声区(图3),该患者病灶广泛,累及外下象限及内下象限两个象限。本研究中GLM组病灶呈弥散性放射状分布,其病理基础是病灶发生于乳腺终末导管小叶单位,低回声区内纵横交错,相互交通,分布累及多个象限。本研究中2例误诊为恶性病变(图4),局灶性结节明显,占位感明显,形态不规则,边缘成角,此类病例肿瘤与炎症病灶区分不开时,可做超声造影。

图3 典型病例(女,21岁,肉芽肿性小叶性乳腺炎)超声表现及病理图

图4 典型病例(女,34岁,肉芽肿性小叶性乳腺炎)超声表现及病理图
3.3 NMBC与GLM鉴别诊断 NMBC具有肿瘤特征,两组非平行、成角、毛刺、微小钙化、腋窝淋巴结肿大比例差异有统计学意义(P < 0.05)。乳腺癌病灶常在周围发生浸润性生长和扩散,病灶内的间质反应和肿瘤周围的小梁结构逐渐被拉向肿瘤,因此病灶呈形态不规则,且多毛刺(图5)[10]。NMBC低回声区分为斑点状,地图状,边缘模糊伴有微小钙化。GLM是相互影响交通非肿块型低回声区,周边黏液水肿带,管壁具有显示不清、局部增厚、匍匐样生长的特点,并沿着皮肤乳管方向发展生长。当乳腺癌合并变性坏死时,实性肿块也可出现囊性或出血改变,与脓肿期GLM难以区分,冲击触诊时可见GLM脓肿随压力变化,坏死组织来回移动,密集点状回声缓慢蠕动。本研究中,GLM组周围组织回声增强、窦道征象出现多于NMBC组,NMBC组穿支血流、阻力指数> 0.7的比例高于GLM组,差异有统计学意义。彩色多普勒显示NMBC组血管走行不规则,位于实性部分中央,恶性NML细胞分泌大量血管内皮生长因子,诱导病变周边大量异常血管生成,可显示异常穿支及放射状血管[11],频谱测量多为表现高速、高阻血流。而GLM组血流走行于脓肿管壁周边[12],边缘型血管走形与乳管平行,与皮肤平行,分散在病变周边,血管异型性分布不均,管径粗细不均。

图5 典型病例(女,69岁,非肿块型乳腺癌)超声表现及病理图
本文的不足之处在于样本量小,需要更大的样本量研究。非肿块型乳腺癌与肉芽肿性小叶性乳腺炎鉴别困难时,需进一步行超声造影及弹性成像等新技术辅助诊断[13],必要时可以穿刺活检[14]。
综上所述,超声征象对于非肿块型乳腺癌和肉芽肿性小叶性乳腺炎的鉴别诊断及临床治疗提供有价值的信息。
