糖尿病足患者感染病原微生物分布及耐药性规律分析
2022-12-15杨光耀邓莉娟王雪皖邵涵滢张春梦贾梦奇
杨光耀,鞠 上,邓莉娟,李 创,王 宁,张 莹,周 彤,王雪皖,邵涵滢,张春梦,贾梦奇,王 刚
糖尿病足感染(diabetic foot infection, DFI)被认为是糖尿病相关住院的最常见原因,约80%的非创伤性下肢截肢与DFI相关[1]。合并下肢感染的糖尿病足(diabetic foot, DF)患者截肢的危险是未发生感染者的154.5倍[2]。一项关于DF患者大截肢危险因素的Meta分析显示,DF患者大截肢与感染(OR: 2.52,95%CI:1.71~3.71)有关[3]。抗生素治疗是控制DFI的重要手段之一。美国感染病学会(infectious diseases society of America,IDSA)建议对诊断为DFI的患者应进行微生物培养和药敏分析,以进一步指导、调整初始抗生素的治疗[4]。临床工作中,常常使用棉拭子取糖尿病足创面(diabetic foot wound, DFW)的分泌物进行培养与药敏试验,但需要3~7 d的时间。在局部分泌物培养结果确定之前,先经验性选择广谱抗生素治疗,待结果确定后,结合患者的临床反应调整抗菌治疗方案[5]。不同时间段、不同地区、不同医疗机构乃至不同科室,DFI的细菌谱和细菌耐药各有不同。因此,本研究收集了我院DFI患者分泌物培养及药敏结果,以分析致病菌分布及耐药性规律,指导临床治疗,降低DF患者的截肢率及住院费用。
1 资料与方法
1.1 一般资料 收集北京中医药大学东直门医院周围血管科2020年1月—2021年6月收治的DF住院患者的临床资料。纳入标准:1)符合《中国糖尿病足诊疗指南》中的DF诊断标准[6];2)IDSA分级为3~4级;3)溃疡面积在(1 cm×1 cm)~(10 cm×10 cm);4)入院治疗前取分泌物做培养+药敏试验;5)临床病历资料完整。排除标准:1)合并静脉性、肿瘤性、放射性及免疫性因素引起的溃疡患者;2)溃疡创面分泌物培养+药敏试验结果示污染或可疑污染;3)患者入院前1周内应用抗生素者。
1.2 研究方法
1.2.1 取材方法 使用生理盐水棉球擦洗伤口上的分泌物及腐肉后,取一次性采样拭子用Levin法取伤口分泌物,即在伤口中心基底部旋转5 s,并稍用力按压,吸取伤口分泌物后,放入无菌棉拭子管内。常温下保存,并立即转送至微生物室进行分泌物及耐药菌培养。
1.2.2 检验方法 接收标本后,将棉拭子头端置于肉汤中震荡10 min,后将肉汤标本接种于血琼脂平板、巧克力平板及麦康凯平板,孵箱培养24 h。菌种鉴定采用BD-phoenix100全自动微生物分析系统,以及配套革兰阴性菌鉴定及药敏卡(GNI)、革兰阳性菌鉴定及药敏卡(GPI),进行药敏试验。多重耐药菌的报告参照Magiorakos等[7]在2012年3月于《Clinical Microbiology and Infection》杂志上发表的多重耐药(multidrug resistant, MDR)暂行标准定义。
1.3 病例收集录入 按照纳入排除标准选择出符合病例,采用Excel 2019由双人填写病例报告表并录入数据库,按照标准建立数据库。
1.4 统计学方法 应用Excel 2019及SPSS 21.0统计学软件对数据进行统计分析,计数资料以例(%)表示。
2 结果
2.1 入组及完成情况 严格按照纳排标准,共收集92例病例标本,其中2例培养无细菌;余90例标本使用分泌物检测共得到123株病原微生物。其中革兰阳性(G+)细菌44株,占比35.8%,革兰阴性(G-)细菌79株,占比64.2%。
2.2 病原菌及多重耐药菌分布情况 92例标本共培养出123株病原微生物,平均每例标本得到约1.34株病原微生物。MDR发生率39%(48/123)。
44株G+细菌中,发现频率最高的是粪肠球菌和金黄色葡萄球菌。MDR检出率36.4%(16/44),其中排名前三的分别是葡萄球菌属的溶血葡萄球菌、表皮葡萄球菌及肠球菌属的屎肠球菌,分别是 80%(4/5)、80%(4/5) 及 50%(1/2), 见表1。G+细菌中,肠球菌属发现高水平庆大霉素耐药(high-level gentamicin resistance, HLGR)2株,其中粪肠球菌与屎肠球菌各1株。葡萄球菌属共报道耐甲氧西林葡萄球菌(methicillin resistant staphylococcus, MRA)共13株,其中耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus, MRSA)共4株,β内酰胺酶阳性2株,均为路登葡萄球菌。
79株G-菌中,发现频率前三的细菌分别是大肠埃希菌、黏质沙雷氏菌和铜绿假单胞菌。肠杆菌科细菌检出率最高,为77.2%(61/79)。MDR检出率39.2%(31/79),其中排名前三的分别是约氏不动杆菌、大肠埃希菌及肺炎克雷伯菌,分别是100%(1/1)、80%(8/10)及 71.4(5/7),见表1。G-细菌共报道超广谱β-内酰胺酶(extendedspectrumβ-Lactamase, ESBL)阳性9株,都属于肠杆菌科,其中大肠埃希菌共5株,肺炎克雷伯菌共4株。

表1 病原菌及多重耐药菌分布
2.3 主要G+细菌抗生素耐药情况 选取G+细菌中出现频率较高的金黄色葡萄球菌、表皮葡萄球菌、溶血葡萄球菌和路登葡萄球菌,进一步分析其抗生素耐药情况。四种细菌对青霉素都是100%耐药。金黄色葡萄球菌耐药抗生素前三位分别是青霉素、红霉素和苯唑西林。表皮葡萄球菌耐药抗生素前三位分别是青霉素、红霉素和复方新诺明。溶血葡萄球菌耐药抗生素前三位分别是青霉素、红霉素和苯唑西林。路登葡萄球菌对大多数抗生素均敏感,但对青霉素却是100%耐药。如表2,使用耐药细菌株数(占该类总细菌株数比例)表示。

表2 主要G+细菌抗生素耐药情况[n(%)]
2.4 主要G-细菌抗生素耐药情况 选取G-细菌中出现频率较高的大肠埃希菌、肺炎克雷伯菌、柯氏枸橼酸杆菌、摩氏摩根氏菌、阴沟肠杆菌及黏质沙雷氏菌,进一步分析其抗生素耐药情况。六种细菌对氨苄西林的耐药率除大肠埃希菌为90%外,其余都是100%。大肠埃希菌耐药抗生素并列前三位的分别是氨苄西林、四环素、环丙沙星及左氧氟沙星。肺炎克雷伯菌对环丙沙星、左氧氟沙星、头孢噻肟、头孢唑林、复方新诺明、莫西沙星、头孢吡肟、氨曲南、氨苄西林舒巴坦、庆大霉素的耐药率都是42.9%。柯氏枸橼酸杆菌耐药抗生素并列前三位的分别是氨苄西林、头孢唑林、环丙沙星、氨苄西林舒巴坦。摩氏摩根氏菌、阴沟肠杆菌及黏质沙雷氏菌对氨苄西林、头孢唑林、氨苄西林舒巴坦、阿莫西林克拉维酸的耐药率都达到了100%。同时,摩氏摩根氏菌和黏质沙雷氏菌对四环素全部耐药。如表3,使用耐药细菌株数(占该类总细菌株数比例)表示。
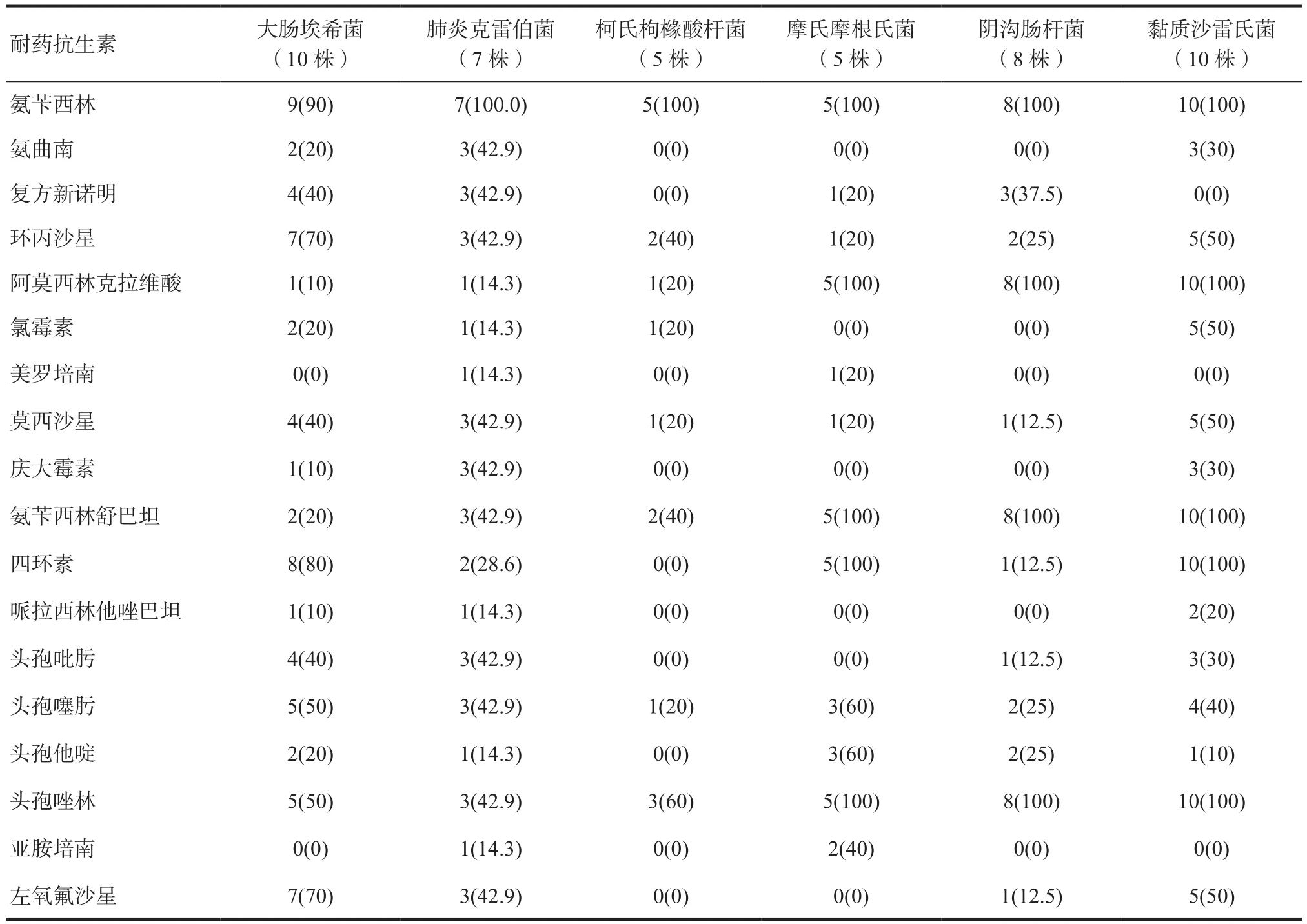
表3 主要G-细菌抗生素耐药情况[n(%)]
3 讨论
糖尿病患者免疫力低下,高血糖状态,血管条件差,溃疡后易发生混合感染及条件致病菌感染,而感染则会进一步加重病情,影响预后[8]。DFI由于合并了缺血、骨髓炎等临床表现,治疗上颇为棘手,临床上常用广谱抗菌药物则无疑增加了患者感染多重耐药菌的风险[9]。因此,需要定期对DFI患者感染病原菌分布及耐药性进行监测,以进一步指导DF的抗菌药物治疗。
DFI的病原菌以G+菌还是G-菌为主,尚没有统一的研究结论。部分研究结果得到糖尿病足感染最常见的病原菌是G+菌[10-11],相反也有研究认为G+菌占比小于G-菌[12-14],与本研究结果相一致。IDSA发布的DFI管理共识指出,G+需氧球菌是DFI最常见的病原菌,在慢性感染或者抗菌药物治疗后出现的感染中,G-需氧杆菌较为多见[4]。Huang等[15]的研究认为随着DFW深度的增加,G-菌的检出率逐渐升高。本研究得到的G-菌检出率较高可能与纳入的患者均为IDSA3~4级的患者有关,该类患者的感染程度较重,容易侵及肌腱、关节、骨骼等深部组织,溃疡深度较深。
DFW培养得到的细菌中最常见的是肠杆菌科或葡萄球菌属细菌,在未进行细菌培养时,经验性用药应当首先选择可以覆盖这些细菌的抗菌药物。本研究显示MDR发生率39%,与国外相关研究相仿[16-17]。溶血葡萄球菌、表皮葡萄球菌、屎肠球菌、约氏不动杆菌、大肠埃希菌及肺炎克雷伯菌都是MDR感染的常见细菌。DFI治疗中,如果培养得到这些细菌,应当及时根据药敏结果选择敏感抗生素进行治疗。
杨雪梅等[18]的研究显示金黄色葡萄球菌、表皮葡萄球菌、溶血葡萄球菌对青霉素的耐药率分别为34.21%、27.27%、33.33%,对红霉素的耐药率分别为47.37%、45.45%、40.00%。楼百层等[19]的研究发现金黄色葡萄球菌对青霉素G的耐药率为78.6%,对红霉素的耐药率为28.6%。本研究发现葡萄球菌属细菌对青霉素都是100%耐药,对红霉素也表现出较高的耐药率。如培养得到葡萄球菌属细菌,经验性用药应当少选用这些抗生素,及时控制中重度的糖尿病足感染,避免感染扩散,以降低截肢的风险。如果在较为复杂的DFU中培养出MRSA,临床一般推荐使用万古霉素或利奈唑胺治疗,因为在以往研究中MRSA对这两种药物表现出较好的敏感性,这与本研究的结果类似。万古霉素对老年患者有耳毒性与肾毒性的风险,应当尽可能减少应用,且两种药物的注射剂均属于特殊使用级,临床使用时,应严格按照适应证选择药物。
楼百层等[19]的研究报道G-菌对头孢吡肟、头孢曲松和环丙沙星等抗菌药物有较高的耐药率。本研究发现,主要G-菌对氨苄西林、氨苄西林舒巴坦、阿莫西林克拉维酸及头孢唑林具有较高的耐药性,其中摩氏摩根氏菌、阴沟肠杆菌及黏质沙雷氏菌对以上几种抗生素的耐药性甚至达到了100%,这是由于以上几种细菌对氨苄西林天然耐药。针对细菌的天然耐药,临床用药应当加以重视,避免选择该类抗生素,延误治疗。目前临床上常用的其他抗生素如头孢他啶、哌拉西林他唑巴坦、莫西沙星等药物还具有一定的敏感性,但也应关注其耐药情况,规范抗生素的使用。
综上所述,DFI病原菌主要为G-菌,对部分β内酰胺类抗生素及其衍生物具有较高的耐药性。临床医生应当注意加强微生物培养和药敏,结合患者的临床表现合理选择抗菌药物,以降低MDR的发生率,提高DFI的治愈率,降低患者医疗花费。
