2型糖尿病模型大鼠心肌微血管病变的观察*
2022-12-15张梦笛崔鑫钰袁悦莹张雨婷于雪吴晏
张梦笛,崔鑫钰,袁悦莹,张雨婷,于雪,吴晏
北京中医药大学,北京 100029
糖尿病是全球流行的慢性终身代谢性疾病,近年来,我国糖尿病患者数量急剧增加,带来沉重的经济负担。糖尿病患者发生心血管疾病的比例和严重程度都高于非糖尿病患者,心血管并发症是糖尿病患者死亡的主要病因[1-2]。微血管病变是糖尿病心血管并发症的一个重要类别,血管生成因子表达减少和血管生成受损是其主要表现。在糖尿病进程中,心脏微血管病变通常先于大血管,这使得心脏更易受到缺血性损伤[3-4]。高血糖可破坏微血管内皮细胞完整性,导致毛细血管和小动脉严重受损,同时阻碍新生血管生成,微血管密度降低[5]。心肌微血管数量的逐渐减少导致心肌灌注降低,最终引发心脏功能障碍和进行性心力衰竭。同时,血管生成障碍又加重了糖尿病的临床表现,如心肌缺血、坏死等。因此,保护心脏微血管对于延缓或减轻糖尿病心血管并发症至关重要[6]。促进心脏血管生成和改善微循环功能已成为改善糖尿病引起的不良心血管事件的潜在靶点[7-8]。
糖尿病大鼠模型是进行药理研究的常用动物模型。目前,对于糖尿病引起的心肌微血管病变的研究较少,并且既往实验多采用1型糖尿病模型进行研究。然而,2型糖尿病占糖尿病发病总数的90%~95%[9],是最为普遍的糖尿病类型。虽然1型糖尿病和2型糖尿病均可引起心血管并发症,但是二者的疾病特征与机制并不完全相同。采用更为贴合人类2型糖尿病病变特点的动物模型探讨其糖尿病心肌微血管病变的特点与机制是临床前药物评价以及药理机制研究的工作基础,具有重要意义。本研究采用经典的高脂饲料喂养合并单次腹腔注射小剂量链脲佐菌素的方法复制2型糖尿病大鼠模型,于模型成功建立12周后观察心功能与毛细血管密度的改变,并对血管生成相关机制进行了初步探讨,旨在探寻具备2型糖尿病心肌微血管病变的实用动物模型,为相关药物研究提供工作基础和实验依据。
1 材料
1.1 动物雄性SPF级SD大鼠18只,体质量(200±20)g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0006。大鼠饲养在北京中医药大学SPF级动物房,使用许可证号:SYXK (京) 2020-0033,温度(23±2) ℃,湿度(55±5)%,12 h/12 h明暗交替,自由饮食、水。动物实验经北京中医药大学伦理委员会审批通过,伦理审批号:BUCM-4-2020091503-3148。实验过程均严格遵循3R原则,给予人道关怀。
1.2 试剂链脲佐菌素(streptozotocin,STZ,德国sigma公司,货号:S0130);口服葡萄糖粉剂[广西梧州制药(集团)股份有限公司,国药准字:H45021416];柠檬酸钠缓冲液(北京索莱宝科技有限公司,0.1 mmol·L-1,pH4.5,货号:C1013);Masson染色试剂盒、苏木素伊红染液、血小板内皮细胞黏附分子-1(platelet-endothelial cell adhesion molecule-1,PECAM-1,又名CD31)兔多克隆抗体(武汉赛维尔生物科技有限公司,货号:G1006、G1005、GB11063-2);β-肌动蛋白(β-actin)鼠单克隆抗体、血管生成素-1(angiopoietin-1,Ang-1)兔多克隆抗体、酪氨酸激酶受体-2(tyrosie kinase with Ig and EGF homology domain,Tie-2)兔多克隆抗体(美国Proteintech公司,货号:20536-1-AP、23302-1-AP、19157-1-AP);血管内皮生长因子(vascular endothelial growth factor,VEGF)鼠单克隆抗体(美国Santa Cruz公司,货号:sc-7269);磷酸化血管内皮生长因子受体2(phospho-VEGF receptor 2,p-VEGFR2)、麦胚凝集素(wheat germ agglutinins,WGA)兔多克隆抗体(英国abcam公司,货号:ab5473、L5142);Wes全自动蛋白质定量试剂盒(美国Protein Simple公司,货号:SM-W001);高脂饲料[胆固醇1%、猪油10%、蛋黄粉5%、胆酸钠0.5%、基础饲料 83.5%,斯贝福(北京)生物技术有限公司]。
1.3 仪器Onetouch Ultraeasy型血糖仪、Onetouch Ultra型试纸(美国强生公司);JT-12S型脱水机、JB-L7型包埋机、JJQ-P3116型病理切片机(武汉俊杰电子有限公司);ICC50HD型光学显微镜(德国Leica公司);Pannoramic SCAN型数字切片扫描仪(匈牙利3DHISTECH公司);Wes型全自动蛋白质印迹定量分析系统及配套试剂(美国ProteinSimple公司);Vevo2100型小动物超声影像系统 (加拿大Visual Sonics公司)。
2 方法
2.1 动物分组与造模18只大鼠适应性饲养1周后,根据体质量均衡原则分为正常组(8只)和模型组(10只)。正常组予以普通饲料喂养,模型组予以高脂饲料喂养。4周后,模型组大鼠禁食12 h,腹腔注射35 mg·kg-1STZ建立2型糖尿病模型,模型建立7 d后检测空腹血糖,血糖值≥11.1 mmol·L-1为造模成功[10];正常组腹腔注射相应剂量的柠檬酸钠缓冲液。模型成功后,正常组给予普通饲料,模型组给予高脂饲料继续喂养12周。
2.2 口服糖耐量实验模型建立12周后,测量大鼠的体质量(body weight,BW),并进行口服糖耐量实验,具体如下:两组动物禁食不禁水12 h,尾尖部静脉取血测定血糖后按2 g·kg-1剂量灌胃给予葡萄糖溶液,并于灌胃后30 min、60 min、120 min尾尖采血检测血糖变化,用Graphpad prism软件计算曲线下面积(area under curve,AUC)。
2.3 心脏功能检测将大鼠麻醉后置于平台上,采用Visual Sonics Vevo 2100小动物超声影像系统经胸骨旁短轴切面进行二维M型超声心动图检查,使用Vevo 2100分析软件进行数据分析,计算左心室射血分数(ejection fractions,EF)和短轴缩短率(short-axis fractional shortening,FS)。
2.4 HE染色与Masson染色超声检测后,经大鼠腹主动脉取血后,处死动物迅速分离心脏,随后放入预冷的生理盐水中,反复冲洗至心脏中无血液,漂净并擦干水分后,迅速取大鼠左心室心肌组织,部分放入4%多聚甲醛进行固定,部分立即放入液氮中保存备用。取固定好的心脏组织,常规脱水、包埋、切片,并进行HE染色与Masson染色,并于400倍光学显微镜下观察大鼠心肌组织结构及胶原纤维含量变化,每个样品选取5个视野,并采集图像,使用Image J软件分析胶原容积分数(collagen volume fraction,CVF)。
2.5 免疫组化染色法检测心肌组织CD31的表达石蜡切片经二甲苯和梯度酒精脱蜡至水后,置于柠檬酸抗原修复液中修复抗原,自然冷却后PBS洗涤3次,每次5 min,3%双氧水溶液室温避光孵育25 min阻断内源性过氧化物酶,3%BSA室温封闭30 min,甩除后加50 μL CD31一抗(稀释比例为11 000),4 ℃孵育过夜后,滴加HRP标记的二抗(稀释比例为1200)覆盖组织,室温孵育50 min,DAB显色,显微镜下控制显色时间,冲洗切片以终止显色。苏木素复染,梯度酒精、二甲苯及中性树胶脱水、透明、封片。用数字切片扫描仪扫描染色切片,CD31阳性细胞呈棕黄色,每张切片随机选取3个视野在400倍下进行毛细血管计数,除以视野面积(约0.18 mm2)即为毛细血管密度。
2.6 WGA染色检测心肌细胞肥大情况石蜡切片经二甲苯和梯度酒精脱蜡至水,置于EDTA抗原修复液中抗原修复,自然冷却后PBS洗涤3次,每次5 min,切片甩干后滴加WGA染液,避光37 ℃恒温孵育30 min,DAPI复染细胞核,PBS洗涤后滴加自发荧光淬灭剂5 min,流水冲洗10 min,用抗荧光淬灭封片剂封片。采用数字切片扫描仪扫描染色切片,并使用3DHISTECH配套分析平台CaseViewer 2.4.0对心肌细胞面积进行测量。绿色表示心肌细胞边界,400倍下每张切片随机选取3个视野,每视野取10个细胞,量化平均心肌细胞面积(μm2),以确定是否存在心肌细胞肥大改变。
2.7 Wes全自动蛋白质印迹定量分析系统检测心肌组织中VEGF、p-VEGFR2、Ang-1、Tie-2的表达采用Wes全自动蛋白质定量试剂盒使用Wes全自动蛋白质印迹定量分析系统[11]进行蛋白表达水平检测,每个样品上样量为3 μL(5×Master Mix 0.6 μL,样品原液与0.1×Sample Buffer共 2.4 μL,以95 ℃、10 min条件变性)。一抗使用试剂盒自带的Antibody diluent 2进行稀释(β-actin、Ang-1、Tie-2稀释比例为1100;VEGF、p-VEGFR2稀释比例为150)。样品及一抗制备好后,按照封闭液、一抗、二抗、样品、发光液、清洗液的顺序逐孔加入12~230 kDa Wes测定板,机器自检无异常后,放入测定板及毛细管,开始检测后,机器通过毛细管抽取400 nL样品,按分子量大小对蛋白质进行电泳分离,然后通过使用HRP偶联的二抗对心肌组织中VEGF、p-VEGFR2、Ang-1、Tie-2进行基于HRP的检测。以β-actin作为内参蛋白,用目的蛋白与内参蛋白灰度值的比值表示该目的蛋白的表达量。

3 结果
3.1 各组大鼠一般状况比较模型建立12周后,与正常组相比,模型组大鼠BW明显降低(P<0.01)。注射STZ 7 d后,模型组共有8只大鼠空腹血糖值符合模型成功判定标准,且与正常组相比,模型成功大鼠的血糖值明显升高(P<0.01),并出现明显的多饮、多食、多尿的症状。模型建立12周后,与正常组相比,模型组大鼠的空腹血糖明显降低(P<0.01)。口服糖耐量实验发现,两组大鼠的血糖值均先升高后降低,正常组大鼠的血糖在30 min时达到峰值,而模型组大鼠的血糖在60 min时才达峰值;与正常组相比,模型组大鼠AUC显著升高(P<0.01)。综合大鼠体质量、空腹血糖和糖耐量实验结果可知,2型糖尿病模型建立成功且保持稳定。见表1,图1。

表1 各组大鼠空腹血糖及体质量比较

注:n=6;A:血糖变化;B:AUC变化;与正常组相比,**P<0.01图1 各组大鼠口服糖耐量比较
3.2 各组大鼠心功能比较经超声心动图检测大鼠心功能发现,与正常组相比,模型组大鼠的左心室射血分数和左心室短轴缩短率均明显降低(P<0.01),提示模型大鼠已出现明显左心室收缩功能障碍。见图2。
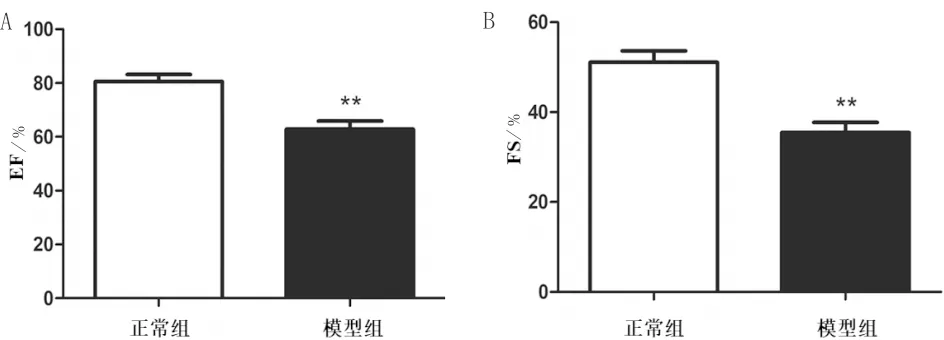
注:n=6;A:EF比较;B:FS比较;与正常组相比,**P<0.01图2 各组大鼠心功能指标比较
3.3 各组大鼠心肌纤维化和心肌细胞肥大比较HE染色显示:正常组大鼠心肌细胞排列整齐,细胞形态正常、边界清晰;而模型组大鼠心肌组织染色不均匀,肌束排列紊乱,出现大量结缔组织增生。Masson染色评估大鼠心肌纤维化情况,图中呈蓝色的为胶原纤维,呈红色的为肌纤维和红细胞,结果显示:正常组大鼠心肌组织分布均匀,结构清晰,细胞排列整齐,心肌细胞间质和周围血管无明显蓝色胶原纤维;而模型组的心肌组织尤其是微血管周围有大量胶原纤维沉积,心肌组织结构破坏。与正常组相比,模型组大鼠CVF明显升高(P<0.01)。免疫荧光染色显示,与正常组相比,模型组大鼠心肌细胞面积明显升高(P<0.01)。见图3-图5。

图3 各组大鼠心肌组织HE、Masson染色图(×400,n=6)
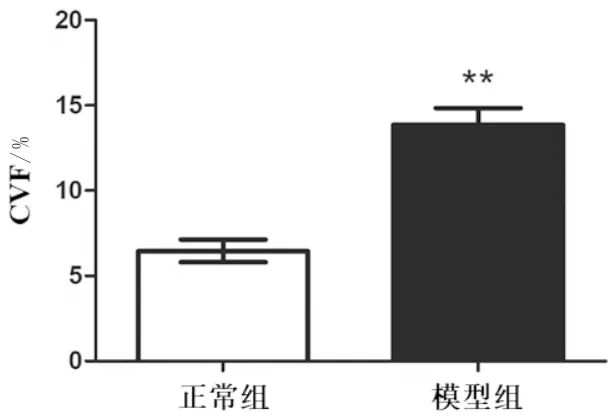
注:n=6,与正常组相比,*P<0.05,**P<0.01图4 各组大鼠胶原容积分数比较

注:n=6;A:WGA染色图(×400);B:心肌细胞面积比较;与正常组相比,*P<0.05,**P<0.01图5 各组大鼠心肌细胞WGA染色图及面积分析
3.4 各组大鼠心肌组织CD31的表达水平比较作为内皮细胞的标志物,CD31阳性代表毛细血管密度的变化,因此采用CD31染色检测大鼠心肌毛细血管密度。结果显示,与正常组相比,模型组大鼠心肌组织中CD31阳性细胞密度显著降低(P<0.01)。见图6。
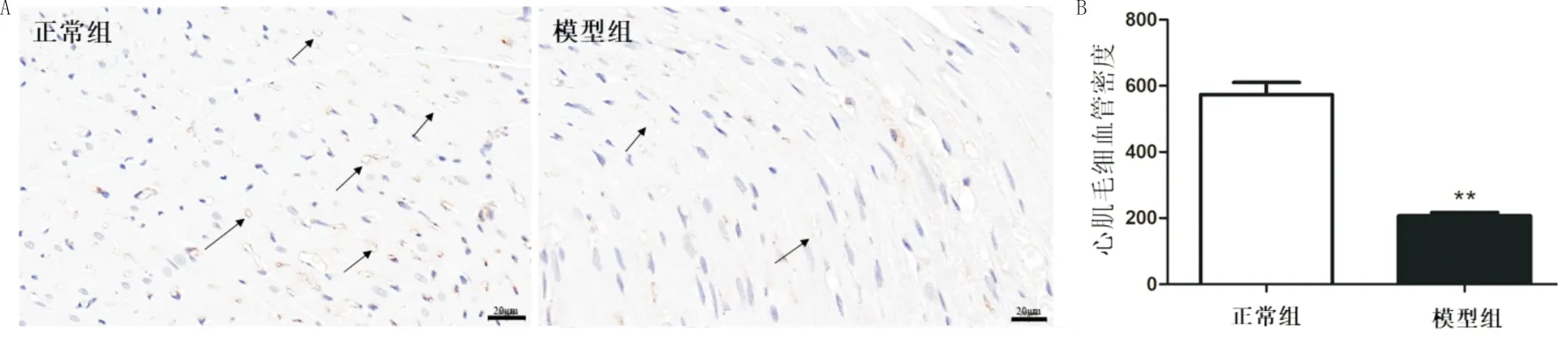
注:n=6;A:CD31染色示意图(×400);B:毛细血管密度比较;与正常组相比,*P<0.05,**P<0.01图6 各组大鼠心肌组织CD31表达水平比较
3.5 各组大鼠心肌组织VEGF、p-VEGFR2、Ang-1、Tie-2蛋白表达水平比较Wes全自动蛋白质印迹定量分析结果表明,与正常组比较,模型组大鼠心肌组织中VEGF、p-VEGFR2、Ang-1、Tie-2蛋白表达水平均明显降低(P<0.05)。见图7。

注:n=6;A:各蛋白条带图;B:各蛋白表达水平比较;与正常组相比,*P<0.05,**P<0.01图7 Wes全自动蛋白质印迹定量分析系统检测心肌组织中相关蛋白表达
4 讨论
本研究采用高脂饲料喂养合并小剂量注射STZ的方法建立2型糖尿病大鼠模型。注射STZ后,模型组大鼠体质量明显降低,空腹血糖明显升高,并出现明显的多饮、多食、多尿症状,提示2型糖尿病模型复制成功。在糖尿病模型建立12周后,心脏超声结果显示,左心室射血分数和短轴缩短率比值明显降低,心功能下降;病理结果显示有心肌细胞肥大与心肌纤维化改变,由此可明确,本研究建立的2型糖尿病模型大鼠存在心功能受损。进一步研究发现,模型大鼠心肌毛细血管密度显著降低,通过对血管生成相关蛋白进行检测可知,与VEGF和Ang-1及其受体表达降低有关。综上所述,糖尿病心功能障碍、心脏重构与微血管病变有关,包括血管生成因子表达减少、微血管稀疏等。
糖尿病患者血管内皮生长因子发挥生理作用与维持正常的心肌毛细血管密度和左心室功能有关[12]。VEGF作为重要的血管内皮生成因子,在生理或病理情况下对血管生成都具有中心调控作用[13],可刺激内皮细胞生长,促进血管新生[14]。VEGFR2是VEGF促进内皮细胞增殖和迁移的主要特异性受体及关键信号传导因子[15]。VEGFR2与VEGF结合后形成二聚体,并发生磷酸化[16],p-VEGFR2继而调控下游信号通路,通过增殖、迁移和抗凋亡等途径维持内皮细胞生存,促进新生血管形成[17-18]。既往研究显示,糖尿病可引起VEGF/p-VEGFR2水平明显下调[19-21],导致血管生成受损,心肌毛细血管密度降低[14];VEGF表达水平和毛细血管密度的显著降低可导致DCM患者左心室功能障碍[22]。
VEGF/p-VEGFR2信号系统在血管新生过程中起主导作用,而Ang-1/Tie-2信号通路在血管成熟与稳定中起关键作用[23]。糖尿病血管生成异常与Ang-1/Tie-2信号通路传导受损密切相关[24-25]。Tie-2是内皮特异性受体酪氨酸激酶,Ang-1是其关键配体,Tie-2与Ang-1结合后发生磷酸化,在血管发育成熟中发挥重要作用。Ang-1 通过募集平滑肌细胞到新生血管中,使其形成肌性小动脉和静脉,促进新生血管在初始阶段进一步发育成熟[26],达到改善心肌血流、修复心肌的目的[27-30],激活Ang-1/ Tie-2信号通路可显著提高毛细血管密度[25,31]。
在糖尿病进程中,心脏微血管损害的发生早于大血管[32],故糖尿病患者心脏中血管内皮生长因子表达降低、微血管生成减少、血管密度降低[33-35]是引起心血管并发症、心脏功能障碍和进行性心力衰竭的重要因素[12,36],并最终导致心血管并发症发病率和死亡率增加[4]。促血管生成因子及其受体的异常表达及信号传导障碍是糖尿病诱发血管生成障碍的主要原因。本研究中Wes全自动蛋白定量检测结果表明,与正常组相比,模型组大鼠心肌组织中VEGF、p-VEGFR2、Ang-1、Tie-2的蛋白表达均明显降低,提示心肌血管生成相关信号通路VEGF/VEGFR2与Ang-1/Tie-2受损,可能与2型糖尿病介导的心肌血管生成障碍相关。
本研究采用高脂饲料喂养合并单次腹腔注射小剂量STZ的方法复制2型糖尿病大鼠模型,结果显示,在模型建立12周后,模型动物出现明确的心肌微血管病变与心功能损伤,是符合2型糖尿病心肌微血管病变相关药理研究需要的理想动物模型。
