干旱胁迫对白花前胡种子萌发和幼苗生理生化特性的影响
2022-12-15曹艳东
高 昆, 曹艳东
(1.山西大同大学 生命科学学院, 山西 大同 037009; 2.山西大同大学 设施农业技术研发中心, 山西 大同 037009; 3.大同乡村振兴研究院, 山西 大同 037009)
0 引言
【研究意义】从古至今,我国推崇中药治病,在应对2020年以来爆发的新冠疫情,中药治疗发挥了重要作用。我国是世界上水资源紧缺的国家之一,水分的短缺严重制约着药用植物的生长,影响其产量和品质。因此,当前亟需选择一些耐旱的品种进行规模化种植,满足中医药行业的需求。白花前胡(PeucedanumpraeruptorumDunn)属伞形科(Apiaceae)前胡属(PeucedanumL.),是一种重要的多年生草本植物[1],又被称为鸡脚前胡、官前胡和山独活。其生长在海拔250~2 000 m的山坡上或半阴性的草丛中,为宿根植物;在土层疏松、深厚且肥沃的夹沙土中生长良好[2];其喜冷凉湿润气候,具耐寒冷、耐热、耐干旱和耐贫瘠的特性[3]。白花前胡分布范围较广,但由于各地的气候环境条件存在差异,其抗逆性也存在差异。因此,研究缓解逆境(如干旱)对白花前胡胁迫的技术措施,对促进其品种选育、保护资源具有重要现实意义。【前人研究进展】白花前胡的根是常见中药之一,不仅具有降气化痰、散风清热的功效,还具有抗心脑缺血、抗癌、平喘及降血压和心衰概率等功效[4]。目前对白花前胡的研究大多集中于其生物学特征[5]、化学成分[6-8]、药理作用[9-10]及种植技术[11-20]等方面。郑颖等[11]研究发现,黔北地区白花前胡获取最高产量的种植模式为覆银膜+漂盘育苗移栽或覆银膜;纯收益最高的模式为覆银膜处理,覆黑膜处理其次。李姚碧琪等[12]研究认为,盐胁迫下白花前胡上调表达香豆素合成途径关键酶基因,从而提高植株对盐胁迫的耐受性。刘家水等[13]研究认为,选种、播种时间、种植模式及肥料种类和施肥方式等均是影响白花前胡早期抽薹的主要因素。杜胤等[14]介绍了白花前胡在林下仿野生种植的技术措施。吴沿胜等[15]探索了宁前胡叶片、茎段和根的愈伤组织诱导快速繁殖技术,各部位愈伤组织在最佳诱导条件下的最高诱导率分别为95.56%、80.00%和78.89%。王盼等[16]研究遮阳对白花前胡叶片光合特性的影响提出,白花前胡对光适应性较强,建议选择光照充足的开阔田地进行栽培。简啟萍等[17]认为,不同播种期对白花前胡的生长和产量有较大影响,适宜播种期为2月至3月上旬,在此条件下抽薹率不高且能获得较高产量。杨柳等[18]认为,不同产地前胡的白花前胡甲素和乙素的含量高海拔地区普遍较低海拔地区高,高海拔地区前胡合格率更高。【研究切入点】目前虽已有白花前胡种植技术的研究报道,但关于其抗逆性方面的研究,特别是抗旱性的相关研究鲜见报道。【拟解决的关键问题】采用不同浓度PEG-6000溶液人工模拟干旱处理白花前胡种子,通过分析发芽率、发芽势和发芽指数等指标,了解干旱胁迫对种子萌发的影响;采用土培法结合自然干旱,研究土壤自然干旱下白花前胡幼苗丙二醛、可溶性蛋白、叶绿素、相对电导率等的含量和过氧化物酶活性等生理生化指标的变化,旨在探明白花前胡种子萌发和幼苗生长对水分的需求,为白花前胡抗旱品种选育及种植适宜水分条件选择提供科学依据。
1 材料与方法
1.1 试验材料
1.1.1 白花前胡 白花前胡种子,万草种业有限公司生产,网购。
1.1.2 仪器设备 DDS-11A数显电导率仪,上海雷磁公司生产;SPAD-502Pluse便捷式叶绿素测定仪,托普云农代购。
1.1.3 试剂 硫代巴比妥酸,三氯乙酸,考马斯亮蓝G-250;100 mmol/L磷酸缓冲液(pH 6.0),愈创木酚;30%过氧化氢,市购。
1.2 试验设计
1.2.1 不同浓度PEG-6000溶液对白花前胡种子萌发的影响 采用水培法培育种子,试验设7个处理,T1~T6PEG-6000溶液的浓度分别为3%、5%、8%、10%、15%和20%,以蒸馏水为对照(CK),每个浓度3次重复,共21组。在消毒干燥的培养皿中铺4层纱布,将备用种子整齐地放入培养皿中,每个培养皿35粒,在培养皿中分别加入相应的PEG-6000溶液,对每个培养皿进行称重,记录其初始重量。之后放入22℃的恒温光照培养箱中培养,每天上午称重,用蒸馏水补充散失的水分至初始重量,保证PEG-6000浓度的恒定。
1.2.2 干旱胁迫处理对白花前胡幼苗生理生化特征的影响 采用土壤自然干旱的方法对白花前胡幼苗进行干旱胁迫。试验设3个处理,即对幼苗分别进行2 d、4 d和6 d干旱处理,然后测定各处理幼苗的相关生理生化指标。每个处理3次重复,以正常浇水的为对照(干旱处理0 d,CK),共12组。
1.3 试验方法
1.3.1 材料预处理 试验于2021年3—5月在大同大学植物学实验室进行。挑选籽粒饱满且没有损伤的种子,用自来水浸泡18 h[20],之后将水倒掉,种子备用,按种子萌发试验设计要求进行试验。将备用种子置于花盆(直径15 cm,高度14 cm)中,上面盖一层薄土,再浇水,并用扎孔的塑料薄膜覆盖在花盆上以达到保温和保持土壤水分的效果,待幼苗长出后撤掉塑料薄膜;至幼苗长出第3片叶子时选取植株大小基本一致的幼苗,一次性浇透水后备用,按幼苗生理生化试验设计要求进行试验。
1.3.2 指标测定 每天观察种子发芽情况,以种子明显露白为发芽标准,从种子发芽开始每2 d记录1次种子的发芽数,及时挑出发霉的种子,直到全部种子不再发芽为止;计算种子发芽率(GR)、发芽势(GE)和发芽指数(GI)[21]。取白花前胡植株相同或相近部位的叶片,采用数显电导率仪测定相对电导率[22],采用便捷式叶绿素测定仪测定叶绿素含量[23],采用硫代巴比妥酸法[24]测定丙二醛含量,采用考马斯亮蓝G-250染色法[25]测定可溶性蛋白含量,采用愈创木酚比色法[26]测定过氧化物酶活性。
GR=发芽种子的总数/供试种子总数×100%
GE=发芽高峰期发芽的种子数/供试种子总数×100%
GI=∑(Gt/Dt)
式中,Gt为种子在第t天的发芽数,Dt为发芽天数。
1.4 数据统计与分析
使用Excel 2019和SPSS 25对数据进行计算并绘制图表。
2 结果与分析
2.1 不同浓度PEG-6000处理白花前胡种子的萌发效果
2.1.1 发芽率 不同时段各浓度PEG-6000处理白花前胡种子的发芽率存在差异。观察发现,经不同浓度PEG-6000溶液模拟干旱胁迫处理,T5(15% PEG-6000)和T6(20% PEG-6000)在第14天时分别只有2粒和3粒种子发芽,但之后全部死亡,而同一处理中其余种子不萌发。除T4在第12天后种子才开始萌发外,其余各处理均在第8天时开始发芽。从图1看出,各处理种子的发芽率均随处理时间延长呈逐渐升高趋势;在处理前10 d时各处理发芽率为CK>T3>T1=T2>T4,第12天时为CK>T1>T3>T2>T4,第14天至第20天时为CK>T1>T2>T3>T4;在处理第8天至第24天时,各处理的发芽率均低于CK;处理第20天为发芽高峰期,各处理发芽率均达总发芽率的50%以上。从第24天开始,各处理发芽率为T1>CK>T2>T3>T4,T1的发芽率超过CK,其余处理仍低于CK。发芽终止(第34天)时,CK、T1、T2、T3和T4的发芽率分别为85.71%、91.43%、75.24%、63.81%和46.66%,T1的发芽率是CK的1.06倍,T2、T3和T4的发芽率分别比CK低12%、26%和45%。从表1看出,T1的发芽率最高,显著高于其余处理;CK其次,与各处理差异显著;T2、T3、T4间差异显著。说明,PEG-6000模拟的干旱显著影响白花前胡种子的萌发,较低浓度(3%)可以促进种子的萌发,浓度为5%~20%时抑制种子萌发;当浓度为10%时,发芽起始时间延迟,发芽结束时间提早;浓度为15%和20%时几乎完全抑制种子萌发。综上得出:白花前胡种子能够耐受一定程度的干旱,适度的干旱有利于种子萌发。
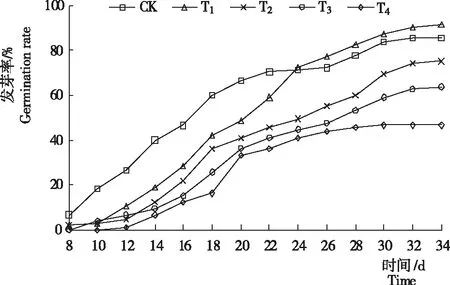
图1 不同时段各浓度PEG-6000处理白花前胡种子的发芽率
2.1.2 发芽势 白花前胡种子在第20天时发芽达最高峰,此时的发芽率为其发芽势。由表1可知,T1~T4的发芽势为33.33%~66.67%,为CK>T1>T2>T3>T4,即随着PEG-6000溶液浓度升高,各处理种子发芽势均呈下降趋势,T1、T2、T3和T4的发芽势分别较CK下降27.15%、38.58%、45.72%和50.00%。CK与各处理间差异显著,各处理除T3和T4间差异不显著外,其余处理间差异显著。说明,PEG-6000模拟的干旱显著抑制白花前胡种子的萌发,而且高浓度(15%和20%)可导致种子难以萌发。
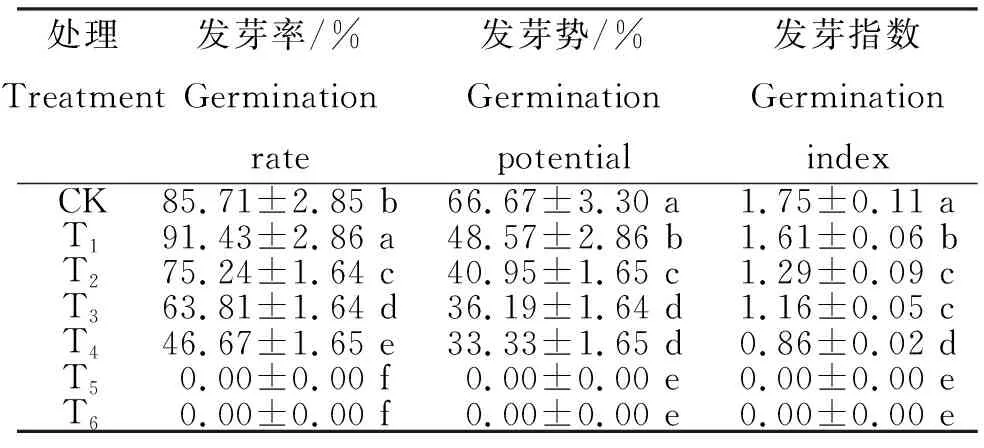
表1 不同浓度PEG-6000处理白花前胡种子的发芽率、发芽势和发芽指数
2.1.3 发芽指数 由表1可知,T1~T4的发芽指数为0.86%~1.75%,为CK>T1>T2>T3>T4,即随着PEG-6000溶液浓度升高,各处理种子发芽指数均呈下降趋势。其中,CK最高,为1.75,显著高于其余处理;T1、T2、T3和T4的发芽指数分别为CK的92.00%、73.71%、66.28%和49.14%,T1与各处理间差异显著,T2与T3差异不显著但均显著高于T4。说明,干旱胁迫可降低白花前胡种子的发芽指数,且浓度越高降低的程度越大。
2.2 干旱胁迫处理白花前胡幼苗生理生化指标的变化
从图2看出,干旱胁迫处理白花前胡幼苗各生理生化指标的变化存在差异。
2.2.1 相对电导率 各处理白花前胡幼苗相对电导率为17.49%~46.89%,随干旱时间延长,相对电导率呈逐渐上升趋势,为6 d>4 d>2 d>CK(0 d)。其中, CK的相对电导率最低,为17.49%;干旱处理6 d时达最高,为46.89%; 2 d、4 d和6 d的相对电导率分别较CK增加35.4%、105.0%和168.1%。CK的相对电导率显著低于6 d,与其余处理无显著差异;6 d时的相对电导率显著高于除4 d外的其余处理。表明,在干旱处理6 d时白花前胡幼苗的细胞膜受损最严重。
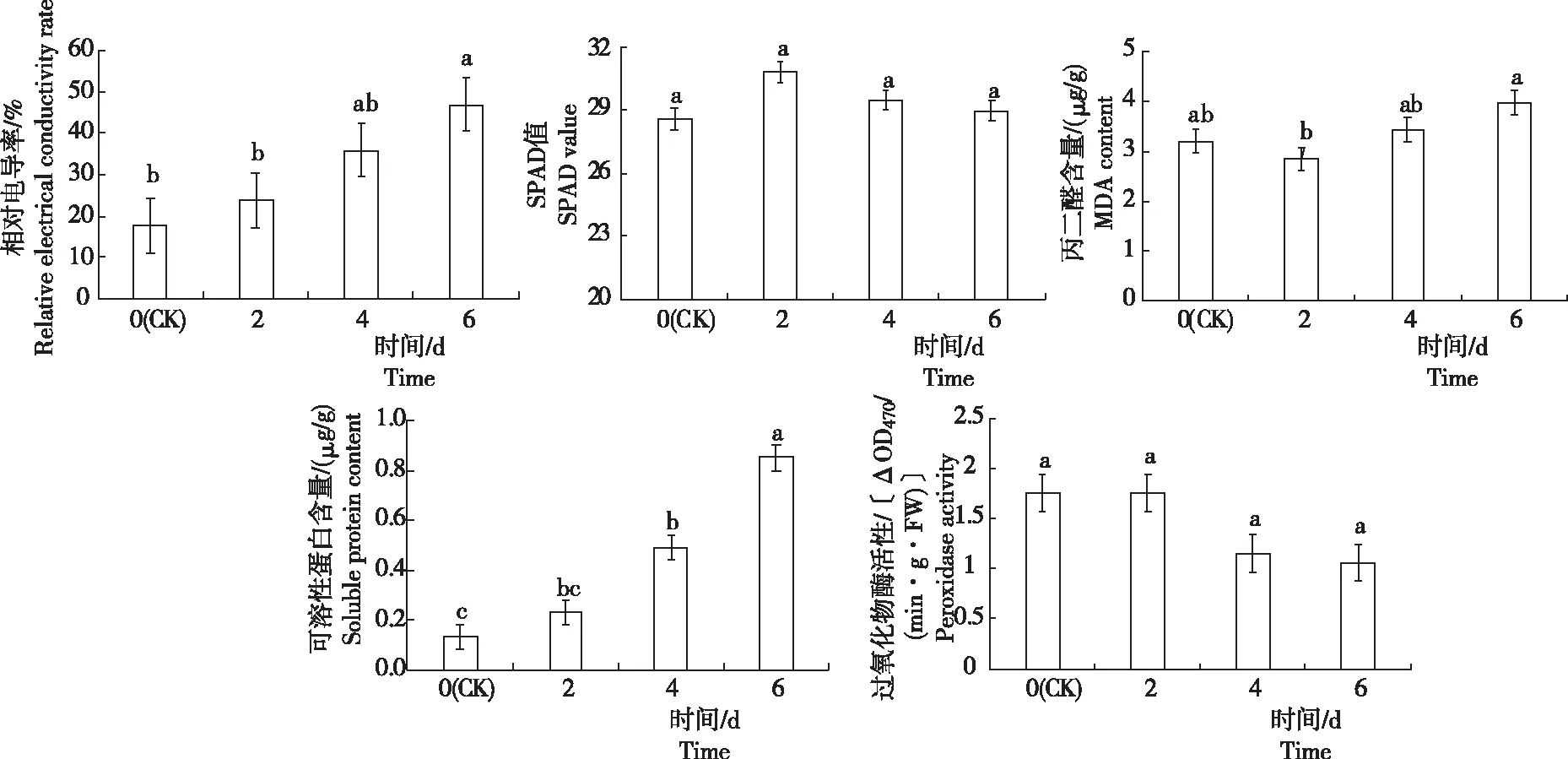
注:不同小写字母表示处理间差异显著(P<0.05)。
2.2.2 叶绿素含量 各处理白花前胡幼苗的SPAD值为28.60~30.85,随干旱时间延长,SPAD值呈先升后降趋势,为2 d>4 d>6 d>CK(0 d)。其中,在干旱处理2 d时SPAD值达最高,较CK提高7.9%;之后随着自然干旱时间延长,SPAD值呈下降趋势,但干旱4 d和6 d时仍分别较CK提高3.1%和1.3%;各处理间均无显著差异。说明,白花前胡幼苗可以通过提高叶绿素的含量抵抗干旱胁迫。
2.2.3 丙二醛(MDA)含量 各处理白花前胡幼苗的MDA含量为2.848~3.976 μg/g,随着干旱时间延长, MDA含量呈先降后升趋势,为6 d>4 d>CK(0 d)>2 d。其中,干旱处理6 d时MDA含量达最高,较CK增加24.17%;干旱处理2 d时MDA含量最低,较CK减少11.06%;干旱4 d时MDA含量较CK增加7.03%。除干旱处理2 d和6 d之间存在显著差异外,CK与其余处理间均无显著差异。说明,随着干旱时间延长,白花前胡幼苗细胞膜的过氧化加剧。
2.2.4 可溶性蛋白含量 各处理白花前胡幼苗可溶性蛋白含量为0.134~0.851 mg/g,随着干旱时间延长,可溶性蛋白含量明显增加趋势,为6 d>4 d>2 d>CK(0 d)。其中,CK可溶性蛋白含量最低,干旱处理6 d时最高,干旱处理2 d、4 d和6 d可溶性蛋白含量分别是CK的1.71倍、3.66倍和6.13倍。CK与干旱处理2 d时无显著差异,与其余处理间均存在显著差异;干旱处理6 d时可溶性蛋白含量显著高于其余处理。说明,随着干旱加剧,白花前胡幼苗的可溶性蛋白质含量明显增加,以增强其抗旱性。
2.2.5 过氧化物酶活性 各处理白花前胡幼苗过氧化物酶活性为1.062~1.759 ΔOD470/(min·g·FW),随着干旱时间延长,过氧化物酶活性呈先增后减趋势,为2 d>CK(0 d)>4 d>6 d。其中,在干旱处理2 d时其活性达最高,较CK增加0.11%;干旱处理4 d时较干旱处理2 d时明显下降,降低34.45%;干旱程度继续加剧,过氧化物酶活性减少幅度降低,干旱处理6 d时过氧化物酶活性较干旱处理4 d时仅下降7.89%。CK与各处理间、各处理相互间均无显著差异。
3 讨论
种子萌发是植物生活史的起始阶段,除与种子本身特征有关,还有水分、温度、光照等环境因素有关。本试验以不同浓度PEG-6000溶液模拟白花前胡种子萌发的水分条件,结果显示,随着PEG-6000溶液浓度升高,白花前胡种子的发芽率在发芽初期到中期(24 d前)均低于CK,后期只有3% PEG-6000处理超过CK,其余仍低于CK,说明低浓度的干旱有利于种子萌发,但高浓度则抑制种子萌发,而且浓度越高抑制作用越明显,表现在10% PEG-6000时,发芽起始时间推迟,结束时间提前,整个发芽周期变短,发芽率降低;当PEG-6000浓度为15%和20%时,种子不能萌发直至死亡。白花前胡种子的发芽势和发芽指数均与PEG-6000溶液的浓度成反比,而且浓度越高,发芽势和发芽指数的降幅越大。说明,干旱条件下白花前胡种子的萌发明显受到抑制,出现发芽延缓,发芽不整齐,发芽率低的现象,与齐容镰等[27-28]的研究结果一致。
相对电导率是反映植物抗逆性大小的一个重要指标,干旱条件下,细胞膜受损,离子通透性增大,导致相对电导率升高。研究结果表明,随着干旱天数增加,白花前胡幼苗的相对电导率明显升高,与高昆等[29]的研究结果一致。可见,干旱胁迫严重破坏了白花前胡幼苗的细胞膜,使离子渗出,从而使相对电导率升高。
叶绿素含量大小可以直接表征光合作用的强弱[30],根据其含量变化可以推断出植株生长发育的快慢和质量。研究结果表明,白花前胡幼苗在自然干旱条件下,随着干旱时间延长,叶绿素含量变化呈单峰型曲线,在第2天达峰值,说明幼苗在干旱胁迫敏感期叶绿素含量增加,当适应干旱后叶绿素含量则下降,与王园园等[31]的研究结果一致。
植物器官在逆境条件下会发生膜脂过氧化作用,丙二醛是其产物之一。常用丙二醛的含量来表示细胞膜过氧化程度和植物对逆境条件反应的强弱。过氧化物酶是植物体内普遍存在的一种保护酶,可以催化很多反应,如清除有害的自由基,防止膜脂过氧化,保护膜的稳定性,但其活性在植物生长过程中会不断变化。因此,可以通过检测植物组织中过氧化物酶活性的高低判断植物的抗性大小。研究结果表明,随着干旱程度加剧,白花前胡幼苗的丙二醛含量呈先降后升趋势,而过氧化物酶活性呈先升后降趋势,与李新蕾等[32-33]的研究结果一致。由于在干旱处理下白花前胡幼苗酶活性的升高使植株细胞膜得到保护,所以干旱初期(第2天)丙二醛含量较低;当干旱时间继续延长时,由于植株细胞内活性氧自由基的产生以及清除的平衡被破坏[34],过氧化物酶活性降低,细胞膜过氧化程度加剧,丙二醛含量升高。
植物也可以通过调节细胞中渗透调节物质可溶性蛋白的含量来抵御干旱,本试验中白花前胡可溶性蛋白含量随着干旱胁迫的加剧逐渐增加,与孟衡玲等[35]的研究结果类似,因为可溶性蛋白质增加降低了细胞的水势,使细胞能吸收更多水分,从而减少水分流失,起到保水作用,应对干旱。
4 结论
模拟干旱条件,3% PEG-6000处理白花前胡种子的发芽率为91.43%,为CK(0% PEG-6000,85.71%)的1.06倍;除3% PEG-6000处理外,5%~20% PEG-6000处理白花前胡种子的发芽率均低于CK,为0%~75.24%,较CK下降12%~100%,且浓度越高,降幅越大,各处理与CK间及各处理间均差异显著;发芽势和发芽指数均与PEG-6000溶液的浓度成反比,3%~20% PEG-6000处理与CK比,发芽势下降27.15%~100%,发芽指数下降8%~100%,且二者各处理与CK间均差异显著。随着自然干旱时间延长,白花前胡幼苗叶片中丙二醛含量呈先降后升趋势,为6 d>4 d>CK(0 d)>2 d;SPAD值和过氧化物酶活性呈先升后降趋势,分别为2 d>4 d>6 d>CK和2 d>CK>4 d>6 d;相对电导率和可溶性蛋白含量分别为17.49%~46.89%和0.134~0.851 mg/g,均呈持续上升趋势。综上得出:适度干旱有利于白花前胡种子萌发,白花前胡幼苗能够忍受短时间的干旱胁迫,因此在种植时注意对其水分的供给。
