电能细胞的合成生物学设计构建
2022-12-14由紫暄李锋宋浩
由紫暄,李锋,宋浩
(1天津大学化工学院,天津 300072;2天津大学合成生物学前沿科学中心和系统生物工程教育部重点实验室,天津 300072;3天津大学化工协同创新中心合成生物学研究平台,天津 300072)

电能细胞广泛分布于细菌、真菌、古细菌中,目前已分离筛选出上百种具有电活性的微生物[1],包括向外界环境释放电子的“产电细胞”,以及从外界环境获取电子的“噬电细胞”[2]。产电细胞将有机物降解并释放电子,实现化学能到电能的转化;噬电细胞利用电能,将低能量密度底物还原为高值化学品,实现化学能到电能的转化[3-4]。以电能细胞为核心的微生物电化学系统作为重要的微生物电催化技术,为解决环境生态修复、“双碳”减排、绿色可持续化学品合成等国家重大需求,提供了极具发展潜力的解决方案[5],例如用于生物降解有机废物和收集生物电的微生物燃料电池(MFC)[6-7]、从有机废物中生产氢气的微生物电解电池(MEC)[8]、海水淡化的微生物脱盐电池(MDC)[9]、以电极作为电子汇或化学品生产源的非平衡电发酵[10-12],以及通过电还原CO2生产高附加值生物燃料的微生物电合成(MES)[13-15]等。此外,电能细胞还可以应用于生物医药和有机催化领域,例如基于电能细胞靶向性递送药物以杀伤肿瘤细胞治疗癌症[16],利用电能细胞特异性控制自由基聚合促进有机高分子催化[17],利用电能细胞进行生物合成金属纳米颗粒、高效降解偶氮染料等[18-19]。以上均是通过电能细胞提取、转化储存于有机物中的电子,并传递给外界环境中的电子受体,进而实现化学能到电能的双向转化。
当前,合成生物学改造的电能细胞在电能输出、产物合成等方面已显示出数量级的突破。然而,目前以电能细胞为核心催化剂的微生物电化学系统在实际环境处理与电能回收、化学品合成等方面的广泛应用仍存在较大瓶颈,其根本原因是电能细胞双向电子传递能力弱、物质-能量转化效率低。因此,通过模块化、系统化的合成生物学策略,构建一个电子传递效率高、物质-能量转换代谢强、应用范围广的电能细胞是未来该领域的重点研究方向和目标。相较于早期的综述大多聚焦于产电微生物筛选、胞外电子传递效率强化、生物电极材料修饰等研究工作[20-22],本文着眼于近5年产电细胞和噬电细胞合成生物学改造两方面的最新研究进展,通过拆解分析双向电子传递机制,分类汇总了电能细胞的合成生物学改造策略,即:①强化产电细胞的胞内电子生成、胞外传递效率,具体为拓宽底物谱、增强还原力转化、提高胞外传递能力、促进电极生物膜群体形成;②强化噬电细胞的胞外电子摄取-还原力转化-产物合成效率,包括促进噬电细胞电子摄取和还原力转化,调控细胞代谢路径电合成化学品和生物燃料。此外还讨论了这些策略的适用性和局限性,并展望了未来最具前景的研究发展方向。
1 电能细胞的双向电子传递机制
1.1 产电细胞电子传递机制
胞外电子传递(extracellular electron transfer,EET)是产电细胞将吸收的有机营养物经中心碳代谢循环释放电子,并传递给FAD、NAD+、NADP+以还原为FADH2、NADH、NADPH储存。通常产电细胞分解代谢产生的还原力大多以NADH形式存在,因此NADH通常被认为是细胞内主要的可释放电子池。储存于电子池中的电子在NADH脱氢酶的作用下汇入内膜上的醌池中,随后经膜上导电元件跨越绝缘的细胞膜结构,以多种方式传递到胞外电子受体。该过程涉及系统发育的多种细胞成分,迄今为止,有两种电子转移机制已被广泛认可:①直接接触式电子传递,即产电细胞通过外膜细胞色素或导电纳米线直接与电极接触传递电子[23-24];②间接接触式电子传递,即产电细胞通过可溶性电子传递载体(如黄素类、吩嗪类、醌类等)间接地与电极之间传递电子[25](图1)。

图1 双向电子传递机制由细胞色素或纳米线介导的直接电子传递机制(左);由电子传递载体介导的间接电子传递机制(右)Fig.1 Bi-directional electron transfer mechanism(Left)Direct electron transfer via cytochromes and conductive nanowires;(Right)Electron shuttles mediated electron transfer
(1)细胞色素介导的直接电子传递细胞色素蛋白是电能细胞表面的主要导电元件,因其位置特殊、功能明确,形成了最重要的直接电子传递方式[26]。底物氧化释放的电子,经过电子传递链中色素蛋白的氧化还原电位从低至高的顺序,传递至胞外电子受体[27]。目前已发现数百种色素蛋白,其中分子机制研究最为清晰的是,模式电活性微生物希瓦氏菌Shewanella oneidensis的金属还原MtrCAB途径和地杆菌Geobacter sulfurreducens的Pcc途径。在金属还原MtrCAB电子传递途径中,胞内NADH氧化释放的电子,经甲基萘醌池转移到内膜细胞色素CymA,随后通过周质空间细胞色素FccA和STC传递至外膜细胞色素复合体MtrCAB。最新结构学揭示,外膜MtrCAB色素蛋白多聚体由外膜十血红素细胞色素MtrC、周质十血红素细胞色素MtrA和嵌入外膜中的β-桶MtrB组成[27-28]。MtrB位于细胞外膜内负责连接MtrA和MtrC,使电子由周质空间传递至胞外[29-30]。此外,S.oneidensisMR-1基因组包含1个MtrC同源物(MtrF)、3个MtrB同源物(MtrE、DmsF、SO4359)和3个MtrA同 源 物(MtrD、DmsE、SO4360),在MtrCAB缺失的情况下,上述同源物为MR-1的胞外电子传递提供部分补偿路径[31-32]。G.sulfurreducens的Pcc电 子 传递 路 径 与MtrCAB相似,包含内膜色素蛋白ImcH、CbcL,周质空间色素蛋白PpcA-E,外膜色素OmaB、OmaC、OmcB、OmcC等[33-34]。目 前 已 报 道 的Geobacter的色素蛋白有超过110种,并含有多个同源物,这使得地杆菌具有多条“膜电子通道”[35],相比于S.oneidensis,具有更大的跨膜电子通量和更高的电子传递效率。虽然,c型细胞色素蛋白在EET过程中发挥主要作用,但是当氧化还原活性蛋白和电极表面之间的距离大于1.4 nm,电子传递速率随距离的增加而呈指数式下降[36]。这表明由细胞色素蛋白介导的直接接触式电子传递途径,只能发生在生物膜中内层靠近电极处的微生物,而位于生物膜外侧的细胞只能通过导电纳米线或电子传递载体进行远距离电子传递。
(2)导电纳米线介导的直接电子传递 微生物导电纳米线,最初由Lovley等于2005年在G.sulfurreducens细胞表面发现[37],可在细胞表面形成数十微米长的导电菌毛(electrically conductive pili,e-Pili)介导电子的远距离传导[38-39]。随后,研究者们[40-42]证实SynechocystisPCC6803、Peloomaculum thermopropionicum、Lysinibacillus variansGY32等也 可以产生数十微米长、直径100 nm的导电纳米线结构,这意味着导电纳米线并非Geobacter独有的,在细菌中可能是一种常见的远距离电子传递途径。此前,在S.oneidensis一直被认为含有与Geobacter同样的导电纳米线,但实验证明,S.oneidensis的“导电纳米线”仅是由于外膜的延伸,是一个扩展的周质空间,其上含有高密度的多血红素,可为远距离EET提供有效途径[43]。目前关于电子在导电纳米线中的传递机制仍有争论。一种观点认为,e-Pili主要由菌毛蛋白PilA单体组装而成,富含芳香氨基酸[44-46],芳香氨基酸残基形成的π-π键轨道相互重叠,电子在电子云中自由穿梭,以离域的形式沿着菌毛传递[47-49];而另一种观点认为,从电活性细胞中分离出的导电细丝,并非四型菌毛(TypeⅣpili,TFP),而是聚合的细胞色素OmcS或OmcZ,其内部的血红素结构无缝堆叠形成微米级的细丝,为电子流提供连续路径[50]。最近,Gu等[51]通 过 冷冻 电 镜 揭 示,G.sulfurreducens将pilA-N与pilA-C结合可形成异二聚体结构,该结构作为导电纳米线组装基座定位于周质空间内,辅助OmcS或OmcZ等色素蛋白完成组装并延伸至胞外电子受体上。而当OmcS、OmcZ等细胞色素缺失时,pilA可由周质空间延伸出胞外,但由于其结构不稳定仅有较低的电导率。通常,pilA仅在胞内发挥组装器的作用。因此,OmcS和OmcZ等导电色素蛋白纳米线可能是G.sulfurreducens直接电子传递的主要贡献者,但基于e-Pili的导电纳米线结构,无论是在地杆菌中作为色素纳米线延伸组装基座,亦或是作为其他电能细胞的胞外电子传递通道,均有不可忽视的研究价值。
(3)电子传递载体介导的间接电子传递电能细胞可利用自身分泌的或环境中存在的电子传递载体(黄素类[52]、吩嗪类[53]、醌类[54])介导间接电子传递。目前,针对电子传递载体介导电能细胞间接电子传递机制的研究,主要集中在Shewanella分泌的黄素类化合物和Pseudomonas分泌的吩嗪类化合物。最初认为这些氧化还原中间体,通过游离形式穿梭于电能细胞和电子受体之间,通过“双电子氧化还原反应”介导细胞电子传递[52]。然而,最近的研究发现,可溶性氧化还原分子化合物还可以作为外膜细胞色素蛋白的辅因子,与外膜色素蛋白结合形成半醌等物质,以“单电子氧化还原反应”方式进行电子传递,其速率是细胞色素蛋白直接导电速率的103~105倍[55-58]。对Shewanella外膜色素蛋白与黄素类化合物的作用关系进一步研究揭示,细胞色素蛋白与黄素的结合是一个可逆过程,细胞色素高保守区域CXXCH基序中的半胱氨酸巯基氧化形成的二硫键,是调控该可逆过程的核心部位。该核心区受外界微环境直接影响[59],当厌氧时,二硫键处于还原状态,促进黄素与色素蛋白的结合,形成单电子介导机制;而有氧条件下,氧化态的二硫键并不利于结合黄素分子,使其以双电子机制介导电子传递。此外,在S.oneidensisMR-1中发现了一种新的电子传递载体-ACNQ(2-amino-3-carboxy-1,4-naphthoquinone)。ACNQ作为电子传递载体不仅利于细胞外电子传递,且不会改变甲基萘醌的生成以及EET相关的细胞色素c表达[60]。Pseudomonas能够自身合成分泌吩嗪类化合物(例如,吩嗪-1-羧酸、吩嗪-1-羧酰胺和绿脓菌素)作为电子传递载体[61-62]。Verstraete等[53]揭示吩嗪类化合物能极大促进P.aeruginosa的胞外电子传递速率,而当吩嗪分泌不足时,突变菌株的功率输出降低近95%。除Shewanella、Pseudomonas这类典型的革兰氏阴性菌外,Light等[63]揭示在革兰氏阳性菌李斯特氏菌Listeria monocytogenes中也可通过基于黄素的EET过程,并且该研究团队确定了一个负责EET的8个基因位点。该位点编码一种特定的NADH脱氢酶,通过将电子引导至膜定位的醌池,将EET与有氧呼吸分离。其他基因则编码促进细胞外色素蛋白的组装,结合游离黄素分子穿梭,介导胞外电子转移。鉴于电子传递载体在微生物电化学系统中的高效作用,近些年,通过合成生物学方法重新设计基因调控线路强化电能细胞合成分泌电子传递载体,提高微生物与电极间的电子传递效率成为广泛的研究热点。
1.2 噬电细胞电子传递机制
噬电细胞因能够从胞外摄取电子转化为胞内还原力来催化还原CO2、N2等高氧化态物质合成高附加值化学品得到了广泛关注[64-65]。例如,噬电细胞能够从阴极吸收电子,分别将CO2还原为CH4、高级醇、脂肪酸、萜烯类、可降解塑料,将N2还原为NH3等高附加值化合物,从而扩展了微生物电化学系统的实际应用[66-67]。然而,这些微生物的细胞内电子转移的具体机制仍未被深度探索。目前的研究表明,噬电细胞可以通过细胞色素蛋白(直接电子转移)或通过氧化还原电子载体(间接电子转移)与电极表面建立电子传递(图1)[68]。
(1)直接电子摄取细胞色素蛋白作为电能细胞表面的主要导电元件,可支持细胞进行双向电子传递。在S.oneidensisMR-1中,其电子摄取过程包括跨膜电子传递和周质电子转移[69]。Mtr途径是负责电子跨膜传递的关键通道,当产生向内的电子通量时,电子随即通过MtrCAB复合体穿过外膜到达周质空间,随后位于周质中的细胞色素MtrA作为电子载体可直接将电子传递至内膜上的色素蛋白CymA,该过程不需要周质细胞色素FccA(延胡索酸还原酶)参与。而随后CymA和甲基萘醌池之间的相互作用允许电子重新进入周质空间并传递至周质色素蛋白FccA以还原延胡索酸[70]。与S.oneidensis通过相同路径介导双向电子传递不同,基于基因表达差异的分析,G.sulfurreducens的内向EET途径与外向EET机制有很大差异。编码细胞色素蛋白的基因GSU3274、GSU1906、GSU0216可能是影响G.sulfurreducens进行向内电子传递的主要原因[71]。其中,基因GSU3274编码的单血红素c型细胞色素PccH,由于其具有最低的还原电位,可赋予G.sulfurreducens从电极接受电子的能力。在PccH缺失的情况下,电子向内传递过程完全受到抑制,但对向外EET过程并不产生影响。由于PccH位于周质中,并不能直接将电子从电极捕获,因此电子转移的跨膜过程可能是由外膜上其他未知的氧化还原蛋白介导的,而PccH与其他蛋白质(例如,PpcA、PpcB和PpcE)的生理相互作用尚未被解析,核磁共振光谱尚未发现PpcD和PccH之间存在相互作用[72]。此外,光合细菌沼泽红假单胞菌Rhodopseudomonas palustrisTIE-1的电子摄取路径与S.oneidensis类似。R.palustris可利用光作为能源,利用Fe(Ⅱ)作为电子源进行生长代谢,其基因组包含一个pio基因簇,包括pioA(mtrA同源物)、pioB(mtrB同源物)和pioC(编码具有高氧化还原电位的铁硫蛋白的基因)。其中色素蛋白PioA和PioB位于细胞外膜负责氧化Fe(Ⅱ),将释放的电子穿过外膜转移到周质色素蛋白PioC,随后电子经PioC传递到细胞内膜上的光反应中心。同样在铁氧化菌Sideroxydans lithotrophicusES-1,其基因组包含一个mto基因簇,包括cymA、mtoA(mtrA同源物)、mtoB(mtrB同源物)和mtoD(编码单血红素c型细胞色素基因)。其中细胞色素MtoA位于外膜负责直接氧化Fe(Ⅱ),产生电子并传递给周质细胞色素MtoD,在MtoD的作用下将电子转移到细胞内膜上的CymA中发挥作用。根据目前研究推测,MtoA、MtoB、MtoD和CymA形成了一条电子传递链,将Fe(Ⅱ)的细胞外氧化与S.lithotrophicus胞内醌还原结合起来。目前针对细胞色素介导的电子摄取机制,仍处于探索、推测阶段。未来基于合成生物学的研究发展,有望发现更多参与该过程的关键辅因子,从而进一步揭示噬电细胞电子摄取机制。
(2)间接电子摄取电子传递载体是增强电极-微生物间接相互作用的重要成分,能够显著提升C1化合物的微生物电合成效率。在产乙酸菌、产甲烷菌中,通常由H2介导间接电子传递过程。在该过程中,需要阴极电位必须低于标准氢电极(standard hydrogen electrode,SHE)的590 mV,才能完成微生物电催化过程[68]。当阴极电位(相对于SHE)低于1500 mV,则甲酸盐可由CO2和H+电催化后生成,该策略已被应用于将电子通过甲酸盐从阴极传递到罗尔斯通氏菌Ralstonia eutropha以进行生物燃料的电合成[73]。而在Shewanella中,其自身分泌的氧化还原活性黄素,包括核黄素和黄素单核苷酸,可作为内源性电子传递载体,通过其氧化态和还原态循环加速双向间接电子传递过程[74]。此外,电子传递载体醌类衍生物,如对苯二酚(hydroquinone,HQ)和2-羟基-1,4-萘醌(2-hydroxy-1,4-naphthoquinone,HNQ),能够在柠檬酸杆菌(Citrobacter amalonaticus)和卵形孢子菌(Sporomusa ovata)共培养的条件下,调节细胞的间接电子摄取,促进高值化学品的合成[75]。电子传递载体介导的高效电子摄取路径,在电能细胞中展现出不同的偏好性和依赖性。而目前发现的几十种电子传递载体,在噬电细胞中的作用机制并未被完全解析,因此通过合成生物学策略,进一步揭示电子传递载体介导的噬电过程是未来重要的研究方向。
2 产电细胞合成生物学改造
以产电细胞为核心催化剂的微生物电化学系统,通过细胞摄取有机底物,转化为胞内还原力,经跨膜传递系统将电子传递至胞外电子受体,完成细胞放电过程。然而,由于该过程中,细胞代谢损耗导致电子生成通量低,绝缘的磷脂双分子层结构导致电子传递效率低,严重制约了有机物中化学能到电能的转化。本章节汇总了近年来运用合成生物学策略(表1):①强化胞内电子生成,通过提高细胞底物利用效率、扩充胞内可释放电子池,获得具有还原力再生速率高、底物代谢能力强的工程菌;②提高胞外电子传递效率,通过加速胞外电子传递速率、强化电活性生物膜形成能力,获得具有高功率密度输出、电流密度输出的工程菌,系统性增强产电细胞的化学能到电能的高效转化。

表1 产电细胞的合成生物学改造汇总Tab.1 Summary of engineering exoelectrogens by synthetic biology
2.1 底物利用效率的合成生物学强化
细胞的代谢通量和电子生产与物质代谢能力密切相关。在自然状态下,部分产电细胞由于缺乏天然底物转运蛋白或代谢相关的酶类,导致细胞可摄取底物的效率低且范围窄,这严重限制了产电细胞自身的能量转换效率以及大规模工业化应用。因此,通过合成生物学策略拓宽电活性细胞的可利用底物范围、物质代谢效率以及电子生成能力是产电细胞工程改造的重要方向之一。
2.1.1 强化底物代谢速率
产电细胞通常具有底物摄取速率慢、胞内电子通量低等问题,这成为制约产电细胞底物能量代谢的关键瓶颈。为此,研究人员针对电活性细胞底物代谢与电子生成间的关系,主要从增强底物摄取调节因子(关键酶等)、强化质子动力势、调节细胞膜通透性等3个方面展开细致研究。Kasai等[103]通过在S.oneidensis中研究编码乳酸转运蛋白基因lldP和乳酸脱氢酶基因dld的转录机制,首次揭示了胞内调节乳酸利用的关键因子——环磷酸腺苷受体蛋白(cAMP receptor protein,CRP),证明CRP通过直接与lldP的上游区域结合来正向调节lldP和dld基因的表达,进而调节S.oneidensisMR-1中的分解代谢过程和呼吸途径。随后,该课题组[76]在此基础上构建了一个过表达编码腺苷酸环化酶基因cyaC的MR-1突变体,使胞内cAMP浓度较野生型提高5倍以上,输出电流提高约2倍,参与EET过程和厌氧碳分解代谢的相关基因同时上调表达[图2(a)],进一步说明CRP作为一种全局转录调节因子具有提高细胞乳酸分解代谢和电化学活性的功能。除了挖掘胞内代谢的关键因子的功能作用、强化微生物细胞本源的底物摄取相关的功能基因外,近年来研究人员也开发出许多新策略以探究微生物生理代谢,为设计高代谢活性产电细胞提供新思路。例如,微生物细胞也可以使用复杂的光系统或者光依赖的质子泵改变膜电位以调控细胞生长。视紫红质作为一种光依赖性质子泵,具有增强质子动力势、提高胞内代谢能力的功能。研究人员将其引入S.oneidensisMR-1后显示,视紫红质的功能表达使细胞膜电位发生变化,电流产生显著增加,该过程主要是由于强化视紫红质的表达增加了质子的跨膜转运,使细胞两侧产生了更高的质子梯度,进而提高了细胞摄取乳酸的速率,促进了S.oneidensis的电子传递效率[77][图2(b)]。此外,针对产电细胞底物摄取转化速率慢等问题,最近的一项研究结果表明,根据电子产生动力学分析,电子产生量很大程度上取决于碳源的性质,而甲酸盐因其代谢路径简单,受酶促级联反应影响较小,电子产生速率较其他碳源(乳酸、丙酮酸等)快2.5倍,被认为是一种更为有效的碳源[104],因此,未来的研究工作可以考虑进一步强化甲酸利用,提高产电细胞高效底物摄取和转化速率。
2.1.2 拓宽底物利用范围
目前发现的电活性微生物大多使用乳酸、甲酸等有机酸作为电子供体,因缺乏其他底物转运蛋白或是代谢相关的酶类,而不能利用工业废水或生物质水解物中更为普遍、丰富且廉价的有机底物,如葡萄糖、甘油、木糖等。因此,如何改造电活性细胞扩大其底物利用谱,通过微生物电催化系统将其转化为更有价值的绿色能源成为研究热点。在Shewanella菌株中,经基因组比较分析发现,因其缺少糖酵解途径中的关键酶(葡萄糖激酶等),而优先代谢二碳或三碳化合物作为碳源。Howrad等[105]将S.oneidensisMR-1置于富含葡萄糖的培养基中进行适应性进化,经过长时间诱导发现驯化后的Shewanella获得了代谢葡萄糖的能力。基于Shewanella具备代谢葡萄糖的潜能,Choi等[78]在S.oneidensisMR-1中引入了来自运动发酵单胞菌Zymomonas mobilis葡萄糖转运蛋白和葡萄糖激酶,构建了能够利用葡萄糖的工程菌MR-1。该工程菌能够在厌氧条件下以葡萄糖作为唯一碳/电子源生长,并且在MFC上运行了大约100 h后产生0.085 mA最大电流。然而,与乳酸代谢相比,以葡萄糖为底物的工程菌代谢速率低,需要更多的时间来释放电子。因此,为了进一步提高葡萄糖摄取效率,将来自大肠杆菌Escherichia coli的葡萄糖代谢系统引入MR-1中,在+0.4 V电位下细胞能快速氧化葡萄糖并产生电流[106]。然而,实验数据揭示,从葡萄糖中获得的最大电流密度(77.3 μA/cm2)比从乳酸中获得的最大电流密度(140 μA/cm2)低55%,这表明葡萄糖的代谢效率仍然是电能细胞产电的限制因素。以上结果表明,传统的机械筛选、重组应用的手段虽能改造细胞并改善物质代谢能力,但具有明显的低效性和局限性,并非是最有效筛选和改造基因的方法。近年来,许多新颖的合成生物学基因编辑方法不断出现,为高效、快速地进行细胞工程改造提供平台。Yu等[107]开发了一款易于操作的碱基编辑系统pCBEso,该系统将Cas9切口酶[Cas9n(D10A)]和胞苷脱氨酶rAPOBEC1融合,可以在碱基编辑框内轻松高效地实现C至T的转换,而无需双链断裂或修复模板。随后,研究人员使用该工具确定了S.oneidensisMR-1中涉及N-乙酰氨基葡萄糖(GlcNAc)或葡萄糖代谢的关键基因[图2(c)],进一步构建了具有扩展碳源利用谱的工程菌株。结果显示当葡萄糖或GlcNAc作为唯一碳源时,其对多种有机污染物(偶氮染料和有机砷化合物)具有明显高于野生型的降解率。这项研究证实,基于合成生物学的工程改造可用于扩展电活性微生物细胞底物谱,为未来高效环境修复菌株的构建提供新思路。

图2 强化产电细胞底物利用能力Fig.2 Enhancement of the substrates utilization capacity of electrogenic cells
除了增强细胞对葡萄糖的吸收利用外,研究人员通过工程改造、自适应进化等策略广泛开发了产电细胞对于其他普遍、廉价有机物(甘油、木糖、乙酸)的摄取能力。例如,在S.oneidensis中将来自E.coli甘油代谢模块的glpF(甘油诱导酶)、glpK(甘油激酶)、glpD(3-磷酸甘油脱氢酶)、tpiA(磷酸丙糖异构酶)基因以及来自Z.mobilis乙醇代谢模块的pdc(丙酮酸脱羧酶)、adh(乙醇脱氢酶)基因组合后,打通了S.oneidensis甘油摄取和乙醇代谢,同时敲除细胞本身的乙酸代谢模块中的磷酸乙酰转移酶Pta[图2(d)],将过剩的胞内还原力以电子形式释放到胞外电极上,成功实现了甘油向乙醇的高效转化[108]。Sekar等[109]采用自适应性进化策略,在S.oneidensis中激活了原本沉默的木糖分解代谢途径。Li等[79]通过模块化组装策略,将来自中间假丝酵母(Candida intermedia)和丙酮丁醇梭菌(Clostridium acetobutylicum)的木糖转运蛋白,以及来自E.coli的异构酶途径和木糖发酵酵母(Scheffersomyces stipites)的木糖代谢途径组合[图2(e)],使得工程菌能够在木糖为唯一碳源和电子供体的环境中产生最大功率密度2.1 mW/m2。另一方面,乙酸广泛存在于工业废水和木质纤维素降解物中,1 mol乙酸完全降解可释放8 mol电子,被认为是一种有前途的碳源和电子供体。然而,厌氧条件下S.oneidensis仅优先使用乳酸作为碳源和电子供体,而几乎不能代谢乙酸。为了使细胞能够利用乙酸盐作为唯一碳源和电子供体,研究人员通过异源表达来自G.sulfurreducens中编码乙酸辅酶A转移酶的基因ato1和ato2,同时强化S.oneidensis内源的柠檬酸合酶基因gltA[图2(f)],成功实现S.oneidensis在厌氧和好氧条件下均能利用乙酸作为碳源,并产生最大功率密度8.3 mW/m2[80]。综合上述研究方法及结果显示,通过自适应性进化结合合成生物学理性设计,可不断拓宽电能微生物的可利用底物范围,对进一步扩展电能细胞在工业、环境等方面的实际应用具有重要意义。
2.2 胞内可释放电子池的合成生物学强化
电能细胞胞内NADH/NAD+的比例和胞内电子池容量大小是影响实际电子通量的决定性因素。然而,野生型产电细胞普遍存在还原力合成效率有限和转化再生速率低等问题,导致胞内物质代谢和能量转化效率不足,严重制约了产电细胞胞内电子生成通量和胞外电子传递效率。为此,研究人员采用合成生物学策略将理性设计和模块化工程相结合,扩充胞内可释放电子池,加快胞内还原力再生和转化速率,系统性提高胞内电子生成能力。
2.2.1 强化胞内还原力生成
NADH作为细胞内主要的电子存储池,其含量是决定胞内电子通量大小的根本因素。NADH/NAD+的比例直接受到胞内辅因子合成及胞内氧化还原过程的影响。为此,研究人员通过强化合成酶基因表达、开展多代谢途径耦合、挖掘可替代路径等策略,系统地优化细胞内NADH的生成水平。例如,Yong等[81]通过 强化P.aeruginosa中NAD+合成酶基因nadE的表达,使得细胞内电子池总量明显增加,并且协同促进了胞外电子传递载体绿脓菌素的合成和分泌。为了强化胞内还原力生成水平,扩充细胞内电子池NAD(H/+)的总量,Li等[82]采用合成生物学模块化工程策略,对NAD+的3条合成途径进行了理性设计和优化,将从头合成途径、补救合成途径和通用合成路径耦合,从3个模块的12个基因中系统选择了5个NAD+生物合成的关键基因ycel(双功能转运蛋白)、pncB(烟酸磷酸核糖转移酶)、nadM(NMN腺苷转移酶)、nadD*(NaMN腺苷酸转移酶)、nadE*(NAD+合成酶),通过组合5个基因以增强NAD+的合成能力[图3(a)]。与野生型S.oneidensis相比,工程菌株胞内电子池NAD(H/+)增加2.1倍,最大功率密度提高4.4倍。这些结果表明,增强细胞内NAD(H/+)合成使更多可用电子转移到EET途径中,从而提高细胞内电子通量和产电性能。最近,Ding等[86]新建立了从分支酸开始的新喹啉酸途径(称为C3N途径),为NAD+生物合成提供了替代途径。与NAD+从头生物合成相比,这种新的合成途径可以利用分支酸作为烟酰胺的前体,有效规避了对NAD+从头生物合成的限制性因素,并且仅由C3N途径产生的NAD(H/+)浓度增加了9.7倍。毫无疑问,上述研究均表明通过模块化工程策略或是开拓新型代谢路径,皆是增强胞内电子通量的有效手段。未来的研究可以进一步对细胞内的代谢流进行探究和揭示,以提供更加理性的合成生物学设计思路,不断增强胞内可释放电子池,扩宽还原力合成新路径,为电能细胞的大规模实际应用奠定基础。

图3 强化胞内可释放电子池Fig.3 Strengthening of intracellular releasable electron pools
2.2.2 提高胞内还原力转化
储存在胞内还原力中的电子,在脱氢酶的作用下,汇入醌池实现还原力到电子的转化。作为细胞内主要的电子源,NADH的转化效率直接影响细胞外电子传递效率。为了使胞内合成代谢更多地流向利于NADH再生的方向,研究人员主要通过筛选、增强、优化NADH合成路径中的关键基因,多路径提高胞内还原力转化效率。Li等[83]通过强化S.oneidensis中糖酵解、C1代谢、丙酮酸发酵和TCA循环途径加强NADH再生能力和还原力转化效率,经过上述4种途径的筛选,最终确定了由gapA2(NAD+依赖性甘油醛-3-磷酸脱氢酶)、pflB(丙酮酸甲酸裂解酶)、fdh*(NAD+依赖性甲酸脱氢酶)和mdh(NAD+依赖性苹果酸脱氢酶)等基因编码的关键NADH依赖性酶,显著参与了还原力的再生和转化过程[图3(b)]。通过组合表达4个关键基因后,工程菌内NAD(H/+)的比例提高4.3倍,电子转移速率明显加快,其输出功率密度较野生型提高3倍。此外,为了提高细胞整体电子通量,增强NADH氧化也是一个重要策略。Vamshi Krishna等[85]发现表达NDH-2基因(位于E.coli内膜的非质子泵NADH脱氢酶)可使更多的电子通过氧化呼吸链流入EET途径,而不受细胞膜高质子动力的影响。NDH-2酶的过表达导致整体电子通量显著增加,与野生菌株(0.52 µA)相比,工程菌电流增加了9倍(4.7 µA)。进一步的研究表明,NDH-2的表达不仅增强了细胞内NADH的氧化,降低了电荷转移电阻,同时也促进了电极生物膜的形成[图3(c)]。类似地,Shewanella loihicaPV-4中发现的具有较强催化活性NADH脱氢酶NADⅡ,在S.oneidensisMR-1异源表达后,极大增强了MR-1的还原力到电子的转化速率,其最大功率密度达到2277.4 mW/m2,较同等条件下野生型MR-1提高2倍[110]。上述结果证明这种调控细胞内还原当量的工程策略是调控提高电活性细胞电子传递效率的有效方法,为未来进一步增加细胞内电子池的容量和转化效率提供了新的方向。
2.3 胞外电子传递的合成生物学强化
产电细胞的胞外电子传递效率是影响生物电催化系统的核心因素,近年来针对这一关键影响因素,研究人员采用合成生物学策略,分别从优化色素蛋白元件、构建导电纳米线系统、促进电子载体合成及分泌、调控电活性生物膜形成等4个方面,进行多角度、全方位的提高微生物胞外电子传递效率和微生物电化学系统的产电性能。
2.3.1 优化色素蛋白系统介导的电子传递
细胞色素蛋白是电子跨越绝缘细胞膜的通道,连接了胞内电子生成系统与胞外电子传递系统。色素系统从空间上具体分为外膜细胞色素、周质空间细胞色素和内膜细胞色素复合物。近年来,研究人员分别针对外膜、内膜及周质空间中的细胞色素蛋白进行了异源表达、筛选优化、模块组装等,显著增强了产电细胞以色素蛋白介导的直接电子传递效率。例如,Ajo-Franklin组[87]最先将S.oneidensisMR-1的外膜色素蛋白MtrCAB复合体重组到大肠杆菌中[图4(a)],相较于野生型菌株,工程菌的金属离子还原速率提高8倍。但工程化的E.coli色素蛋白表达量有限,且表现出明显的生长抑制作用。因此,该课题组[111]建立1个由可调诱导系统和组成型启动子构成的菌株文库,筛选获得MtrC和MtrA表达水平较原工程菌提高2.2倍,且细胞生长得到明显改善的菌株。最新研究揭示E.coli细胞色素c成熟(cytochrome c maturation,Ccm)系统与S.oneidensis细胞色素c的兼容性较差,限制了工程E.coli的电化学性能。为此,研究人员设计构建了E.coli和S.oneidensis的Ccm融合表达系统,使得融合表达Ccm的E.coli色素蛋白CymA表达量增加60%,总电流增加了121%,单细胞的电子通量提高至12.3 fA[88][图4(b)]。
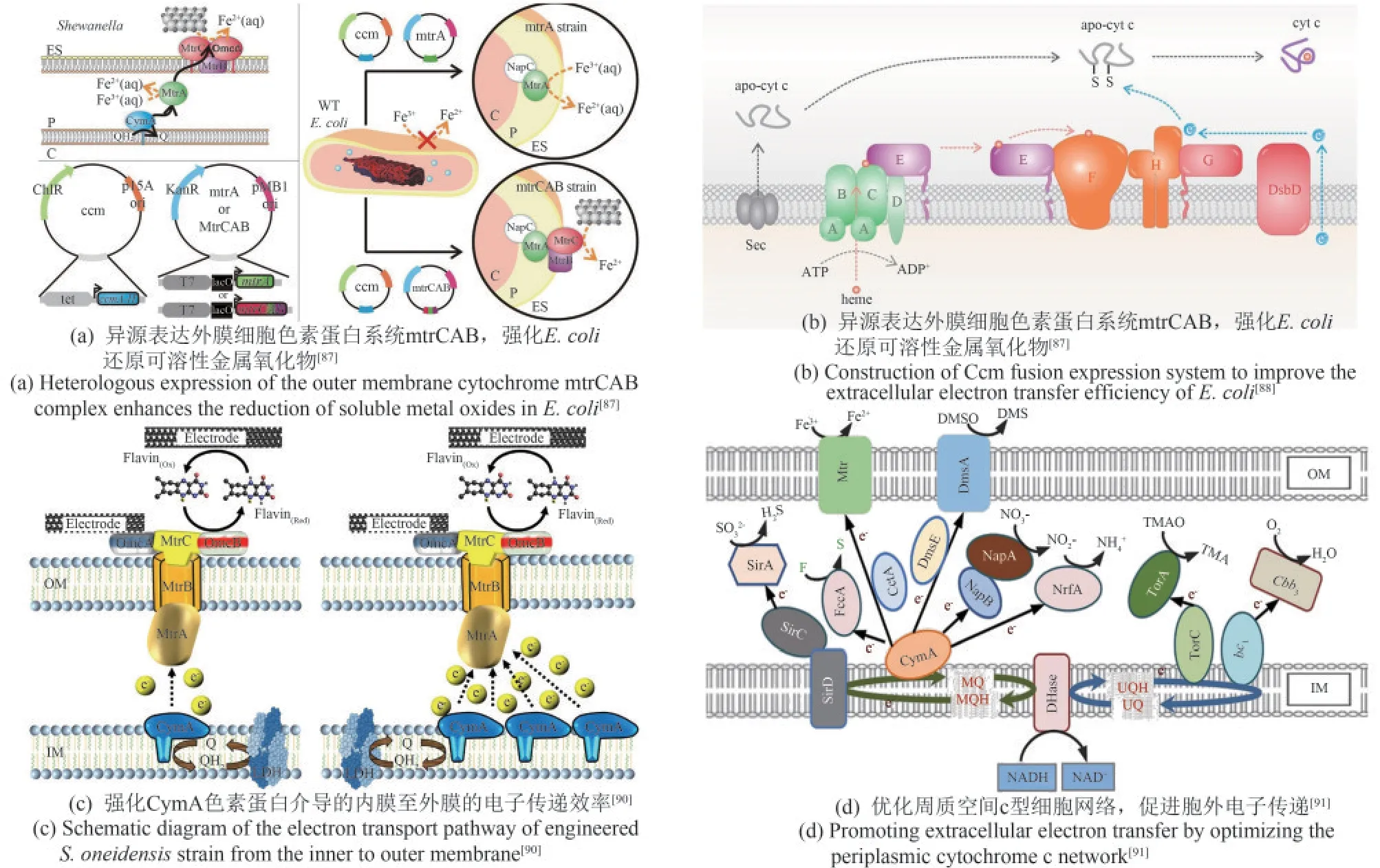
图4 优化色素蛋白介导的直接电子传递Fig.4 Optimization of cytochrome mediated direct electron transfer
另一方面,内膜c型细胞色素CymA将细胞代谢获得的电子传递给末端周质还原酶,是电子传递链中至关重要的一步。当cymA突变时,电流生成量减少约80%;反之,过表达cymA可提高最大输出功率至0.13 mW(野生型为0.11 mW)[90][图4(c)]。同样,优化周质色素蛋白网络也是增强EET的关键策略。周质空间中分布着多种c型细胞色素,构成一个复杂的电子传递网络。为了降低周质中电子传递网络的复杂性,消除周质空间中潜在的竞争反应,Gescher等[112]敲除周质色素基因nrfA、ccpA、napB和napA,并在相应敲除位点表达色素蛋白CctA。结果显示细胞外电子转移率随着cctA基因拷贝数的增加而逐渐增加,电流密度增加了23%。这表明降低周质细胞色素网络的复杂性可以改变细胞外氧化还原电位并加速电子转移。最新研究显示,周质色素CctA的过表达可以加速从CymA到MtrCAB的电子转移[图4(d)]。相比之下,周质中过多的色素蛋白NapB、FccA和TsdB则严重损害EET效率,使之降低50%以上,这表明冗杂的周质色素环境可能导致电子传递效率损失。基于这一发现,研究人员最终通过同时突变周质色素蛋白基因napB、fccA和tsdB并过表达cctA构建了高效电活性菌株,使得最高功率密度达到436.5 mW/m2,较野生型提高约3.62倍[91]。这一系列工作表明,微生物自然进化出的电子传输途径可能并非是最优路径,通过人工干预理性设计重建电子传输途径是解决当前生物电化学系统中电子传输能力低的问题的有效方法。
2.3.2 强化导电纳米线介导的电子传递
产电细胞除了能够通过细胞外膜表面的细胞色素蛋白进行直接电子传递外,也能通过基于导电菌毛e-Pili或细胞色素形成的导电纳米线进行传递[113]。然而,由于菌株间的差异性和生长条件的不同,细胞色素纳米线的表达丰度具有高度可变性,并且由于自身天然形成的精密排列结构,而导致实际工程改造存在困难[113-114]。相比之下,导电菌毛纳米线因其组成结构简单、机制研究相对清晰而极具工程化前景。因此,近年来针对导电纳米线的研究工作主要集中在调控菌毛单体蛋白(pilA)芳香族氨基酸含量、挖掘pili组装机制调控分泌系统、设计多肽结构修饰菌毛单体等方面,系统性强化菌毛导电率和拓宽纳米线的应用范围。例如,通过结构解析、计算模拟确定氨基酸靶点,进行定向突变筛选的策略方法,研究人员将色氨酸掺入菌毛中使得单个细丝的电导率提高超过80倍,通过在E.coli基因组中重新编码设计,对非标准氨基酸炔丙基氧基苯丙氨酸进行基因编码修饰,使菌毛作为功能支架,用于精确、特异性结合金纳米颗粒,形成有序的有机-无机杂化生物材料[图5(a)],使其导电性提高了170倍[115]。除了改变结构增加菌毛电导率外,促进菌毛合成组装近年来受到更多关注。例如,Liu等[116]首次在G.sulfurreducens中鉴定出一种菌毛合成的伴侣蛋白(short pilin chaperone,Spc),Spc可以通过静电相互作用与pilA结合形成稳定的Spc-pilA复合体以支持菌毛蛋白组装[图5(b)]。这一研究表明,菌毛的组装分泌是一个复杂过程,仅强化pilA自身的表达似乎无法完全实现菌毛的高效合成。由于Geobacter培养需要严格厌氧的环境,遗传操作和大规模培养难度高,为了获得大量导电菌毛拓展 新 的 应 用,Lovley等[117-118]采 用E.coli作 为底盘菌,在敲除自身菌毛蛋白的基础上,重构四型菌毛合成系统GspilA,从而获得了与G.sulfurreducens中表达相同的导电菌毛结构(直径3 nm)和电导率,该方法为常规培养条件下大规模制造新型e-Pili提供了新的途径[图5(c)]。除了设计菌毛结构以提升电活性细胞导电性外,采用多肽修饰菌毛单体结构可以增加菌毛的黏附力,促进电活性生物膜的形成和新型生物材 料 的 开 发。Ueki等[119]设 计 短 肽 标 签 与G.sulfurreducens菌毛的羧基端融合,在不影响其导电率的前提下,可产生特异性黏附力的导电纳米线结构。合成的基因片段包含pilA-6His和pilAHA,从而产生具有“His-tag”和肽“HA-tag”的导电菌毛[图5(d)],这些肽标签暴露于细胞外表面可以与金属和相应抗体结合,在开发新材料和装置方面具有重要应用价值。基于上述多样的研究设计可以看出,基于导电纳米线构建高电活性微生物细胞的方法为新型的微生物电催化提供了新的思路,而纳米线的多样化修饰也是将细胞黏附到特定表面、增强与胞外基质的相互作用以生产柔性导电产品的新途径。

图5 强化导电纳米线介导的电子传递Fig.5 Enhancement of electron transport mediated by conductive nanowires
2.3.3 强化胞外电子载体介导的电子传递
由于细胞膜中存在的空间阻碍作用,产电细胞除了通过直接接触式电子传递外,还可利用电子传递介体(黄素类、吩嗪类)介导间接电子传递过程[120]。近年来,研究人员通过强化电子载体合成路径,提高电子载体分泌能力,解决了因电子载体合成不足而导致的电活性效率低下的问题。以S.oneidensis为例,因其内源性核黄素表达量极低,Yang等[74]在S.oneidensisMR-1中异源表达来自枯草芽孢杆菌Bacillus subtilis中编码核黄素合成的核心基因簇(ribADEHC)[图6(a)],使工程菌合成的黄素浓度相较野生型增加25.7倍,双向电子转移率分别增加了约13.2倍(电子向外传递)和15.5倍(电子向内传递)。结果表明,强化电子传递载体的生物合成是提高胞外电子传递效率的直接有效策略。然而,胞内过多的氧化还原活性分子累积会引起细胞毒性,进而影响细胞生长代谢。为此,Yong等[121]异源表达来自P.aeruginosa孔蛋白OprF,可显著增加细胞膜通透性,使菌株更有效地分泌利用核黄素,从而提高系统的电子输出性能。在此基础上,Lin等[92]通过筛选最适的启动子和核糖体结合位点,进一步优化核黄素合成,结合外膜孔蛋白强化核黄素分泌路径,促进细胞黄素的生物合成和转运速率,构建S.oneidensis三维生物膜结构[图6(b)],极大提高了阳极细胞附着量,使得系统内最大输出功率密度较野生型提高约18.8倍,达到2.63 W/m2。最近的研究显示,S.oneidensisMR-1自分泌的黄素不仅作为电子载体,还可作为氧化还原辅因子与外膜细胞色素蛋白结合[57],显著提高胞外电子传递效率。而通过共同强化S.oneidensis的黄素生物合成基因簇(ribDCBAE)和色素蛋白生物合成基因簇(mtrCAB)[图6(c)],使电极上的生物附着量显著提高,电流输出密度增加了110%[122]。此外,P.aeruginosa主要通过自身合成分泌的吩嗪-1-酰胺、吩嗪-1-羧酸、绿脓菌素等氧化还原介质与电极进行间接电子传递[123]。Feng等[89]通过在E.coli中引入P.aeruginosa的PCA合成途径(phzA1B1C1D1E1F1G1),工程菌分泌的PCA浓度明显增强,使MFC功率密度提高10倍,达到181.1 mW/m2。最近,Fan等[93]开发iEditing快速基因组编辑工具将PCA合成基因簇和G.sulfurreducens的直接电子转移链ombB-omaB-omcB-omcS,整合至S.oneidensis基因组中[图6(d)],显著强化了细胞直接和间接电子传递效率,其PCA合成和细胞色素c表达量均显著高于对照组,产生最高电流密度达310.2 mA/m2,是野生型的1.84倍。未来针对电子载体的研究除了可以继续通过多样化的基因线路途经动态调控电子传递载体的表达和分泌,同时应关注电子载体在生物膜中的活性效率,运用化学方法或生物学方法将电子载体固定在生物膜内部,减少电子传递载体扩散,而降低电子传递损失,进一步为微生物电催化在微生物燃料电池、生物修复、生物电合成、纳米材料生产等方面的广泛应用奠定基础。

图6 强化胞外电子载体介导的电子传递Fig.6 Enhancement of shuttlemediated electron transport
2.4 电活性生物膜的合成生物学强化
电活性生物膜主要是通过胞外聚合物(extracellular polymeric substances,EPS)与电活性细胞交联形成的网状结构。其中,生物膜基质成分包括胞外DNA(extracellular DNA,eDNA)、胞外多聚糖、胞外蛋白等[124-125],含量约占生物膜有机物总量的90%以上[126]。同时,这些EPS成分还受到细胞内部调控元件的多维调控,在生物膜形成模式、成分组成、厚度稳定和代谢效率等多方面,进行时间和空间上的调控。本节综述了生物膜中EPS成分以及多种调控因子的研究进展。
2.4.1 调控胞外结构成分
(1)eDNA eDNA是EPS主要成分之一,由微生物通过自身分泌或裂解等方式释放到胞外的核酸分子。大量研究表明eDNA在稳定生物膜电荷、提供生物膜结构刚性、保护细胞免受宿主防御反应等方面起到至关重要的作用[127]。Furst等[128]利用eDNA具有黏附性的特点,通过借助DNA本身具有碱基配对原则,将S.oneidensis细胞有序且可调控地附着到电极表面,利用DNA本身可作为连接细胞和电极的高速电子通道辅助介导电子转移的特点,使得微生物电化学系统可重复地产生高水平的电流。除了作为生物黏合剂外,eDNA也是细胞-细胞或细胞-非生物界面相互作用的主要介质,eDNA能够与吩嗪结合使其保留在生物膜中,促进P.aeruginosa生物膜内部电子转移效率[129]。总体来说,针对电能细胞电子传递效率低,生物膜结构松散、不稳定等问题,工程细胞eDNA可能是一种潜在的优化策略。
(2)胞外多糖胞外多糖是EPS基质中的主要组成部分,与生物膜电导率和稳定性密切相关。为了促进多糖合成,Zhuang等[99]在G.sulfurreducens中,过表达基因GSU1501(多糖生物合成基因),使细胞外多糖分泌提高了25.5%,促进了具有更高厚度和活性的生物膜形成,同时提高了细胞外c型细胞色素的含量。与对照菌株相比,该突变体表现出更高的Fe(Ⅲ)氧化物还原能力和电流产生能力。除了上述启动子诱导表达基因等传统方法外,最新研究聚焦开发新型合成基因线路,通过实时动态的调控基因表达提升不同条件下的胞外多糖产量。Zhang等[130]利用CRISPRi/dCas9开发了调节胞外多糖合成的基因线路,通过使用遗传光开关抑制wcaf基因,调控大肠杆菌生物膜厚度。总体来说,胞外多糖可能是稳定电活性生物膜结构的关键因素。未来除了在继续探索多糖与胞外基质间的相互作用外,还可以继续开发多样化的基因调控线路,开发控制和维持生物膜稳定性的策略,为电活性生物膜在环境处理和生化合成相关的应用奠定基础。
(3)胞外蛋白在生物膜胞外基质中存在有大量蛋白质成分,主要分为促进生物膜形成的黏性蛋白(CdrA、AggA、BfpA等)和起稳定作用的结构蛋白(鞭毛、curli、菌毛等)。研究人员发现细菌的高度聚集状态与凝集素AggA的分泌有关,AggA的突变会导致生物膜超聚集特性的丧失[131]。而在P.aeruginosa中,CdrA作为一种主要的细胞外黏附素,可通过与多糖分子交联来增强细胞外基质的强度,将细胞锚定在基质中[132]。
除了发挥细胞间黏附功能的黏性蛋白外,生物膜基质中还存在有大量起结构支撑作用的结构蛋白(curli和鞭毛)。curli是许多肠杆菌科产生的细胞外基质的主要蛋白成分[133]。Yong等[134]将融合了金属结合域的curli杂化蛋白均匀表达于细胞表面,实现了细胞与不锈钢电极的高效结合,使阳极输出功率提高了约420倍。另一种胞外结构蛋白——鞭毛,也同样在电活性生物膜的形成过程(特别是初始黏附以及后期分散再形成新的生物膜过程)和电子传递过程中发挥重要作用[135]。Liu等[136]证明鞭毛促进了工程菌更厚的生物膜的形成,并作为生物膜基质支架以有序的方式容纳更多的细胞外细胞色素,从而增加了生物膜内的电子扩散速率。该研究也进一步证明鞭毛除了作为负责运动的细胞器外,还是促进细胞不同环境生态位中定植的重要因素,促进细胞在电极表面黏附以及细菌群落形成。上述研究结果表明,通过调控黏附蛋白和细胞外结构蛋白的表达可以调节生物膜的空间结构,以及调控生物膜中物质和电子的空间传输。
2.4.2 增强胞内调控因子
(1)细菌群体感应(quorum sensing,QS)QS是细菌细胞之间通过感受自诱导物来调控细菌群体行为的现象。典型的QS系统包括一个N-酰基高丝氨酸内酯(N-acyl-homoserine lactones,AHLs)型合酶和一个信号感应LuxR受体,当AHLs在细胞内不断累积后与受体蛋白LuxR结合,激活或抑制靶基因的表达,进而调控生物膜形成进程[137]。因此,AHLs信号是调控QS系统、影响电活性生物膜形成的重要因素。Jing等[138]发现外源性添加或内源性分泌AHLs可以缩短生物膜形成时间和增强生物膜电化学活性。其中内源性AHLs可以通过上调EPS合成的关键基因来提高胞外蛋白的相对丰度,而外源性AHLs通过促进酰胺Ⅱ的形成和强化羰基和酰胺之间的H键形成以促进生物膜形成。Li等[139]利用QS系统的遗传组件构建了群体检测系统实现细胞生长与代谢解耦,该系统将主要代谢通量从初始细菌生长转移到随后的胞外电子传递增强阶段,使菌株电子传递速率增强了4.8倍[图7(a)],甲基橙和六价铬的还原效率分别提高了18.8倍和5.5倍,在环境污染治理领域展现出极大的应用潜力。上述的合成生物学改造结果表明,基于QS系统的遗传调节工程改造不仅有助于改造微生物的电化学活性和代谢活性,同时能提高生物膜中的电极生物量和活死细胞比例,进而更有利于增强微生物电催化系统的生产。未来进一步探索QS系统特异性背后的分子机制,将深化我们对自然群落中的通信网络的认知,更有利于开发高效操纵自然群落的新型细胞通信工具。

图7 强化胞内调控元件介导的电活性生物膜形成Fig.7 Enhanced intracellular regulatory element to promote electroactive biofilm formation
(2)环状二核苷酸环状二核苷酸是一种在微生物细胞中调控多种生物学过程且高度通用的信号分子,目前研究发现了多种信号分子,主要有c-di-AMP、c-di-GMP、cAMP-GMP等。其中,c-di-GMP被认为广泛参与细菌生物膜形成过程,通过浓度变化调节细胞附着和分离状态进而控制生物膜的形态[140]。最近发现的bolA基因是一种重要的转录调节因子,可以平衡c-di-GMP浓度以促进生物膜形成[141-142]。Moreira等[143]揭示了bolA和c-di-GMP信号分子之间的直接联系,并发现它们同时参与了生物膜形成的调节。这两个因素通过负反馈调节相互平衡来切换生物膜的形成和运动模式。然而,通过机械地引入组成型或诱导型启动子来启动基因的表达,会出现不可避免的启动时间延迟,难以实现实时操纵细胞内c-di-GMP水平。相比之下,光遗传学方法是快速、无创和可靶向操作细胞的理想工具,相较传统工程改造具有较高的时空分辨率。Hu等[144]在E.coli中利用光敏色素c-di-GMP合成酶BphS和发色团胆绿素合成酶BphO构建新型逻辑门。其中BphS包含光感受器域(可与发色团胆绿素结合)和DGC输出域(促进c-di-GMP合成)[图7(b)],当体系中含有IPTG时,红外光开启c-di-GMP合成进而促进生物膜形成,使系统内电能输出能力进一步提高。随后,研究人员通过该系统调控生物膜形成,以催化吲哚转化为色氨酸,使色氨酸产量增加30%[145]。由于c-di-GMP信号通路调节的细菌行为存在多功能输出可能,未来的研究可以探索新型遗传工具的开发以解决现有的问题或补充现有技术。
(3)全局调控因子在微生物细胞中存在多种全局代谢调控的因子,这些调节因子可以靶向细胞多个代谢调节网络,从而调节细胞代谢生理、菌落形态以及电子传递过程。RpoS调节子是目前研究最深入的全局调节因子,作为一种典型的σ因子在细胞生长稳定期发挥作用。Yu等[100]通过敲除RpoS,获得的P.aeruginosa工程菌可形成致密而稳定的生物膜,且输出电流较野生型提高50%,达 到4.2 μA/cm2。此 外,cAMP-CRP复 合 体 在S.oneidensis中表现出可调节多种分解代谢和调控EET相关基因的表达[图7(c)],Cheng等[98]通过在S.oneidensis中引入来自土壤细菌Beggiatoasp.PS的腺苷酸环化酶的外源基因,显著提高了胞内的cAMP水平,积累的cAMP-CRP复合物正向调节编码c型细胞色素和黄素生物合成相关基因表达水平,使Cr(Ⅵ)还原速率提高3倍。同样,Luo等[101]将Deinococcus radiodurans中编码极端抗辐射性的全局调节器IrrE引入到P.aeruginosa中,结果显示,基因irrE可赋予细胞更高的电子传递载体的合成和分泌,并且显著影响了底物利用效率,改善了细胞生长状态和对各种环境压力的耐受性。定量RT-PCR分析表明,全局调节器IrrE能够开启参与不同代谢和信号通路的基因表达,包括生物膜形成、QS系统、转录调控、葡萄糖代谢和一系列应激反应[图7(d)],结果显示工程菌株功率密度提高了70%。为了进一步优化细胞对外源全局调节器IrrE的适应性,该课题组[102]通过易错PCR构建了IrrE突变文库,筛选出具有更高电活性和更优环境抗逆性的突变菌株。综合上述研究结果显示,通过优化设计全局调节因子来靶向胞内调控网络,进而强化微生物电活性是一种简便有效的方法,在实际应用中存在巨大潜力。
3 噬电细胞合成生物学改造
在全球变暖和温室气体积累的环境下,噬电细胞天然的电催化特性能够有效减少CO2排放、强化CO2捕获和转化,为双碳减排提供了新的策略[146]。以噬电细胞为生物催化剂的微生物电合成系统,通过从胞外电极上获取电子并转化为自身还原力,来催化CO2、N2等合成高附加值化学品,该过程包括胞外电子跨膜传递,胞内还原力转化,产物定向合成[147]。然而,由于该过程中电子跨膜传递速率慢、胞内还原力转化效率低、胞内能量流(即还原力NADPH和ATP)驱动高值化学品合成的定向性差等瓶颈,严重制约了电能到化学能的高效转化。因此,本章节汇总了近年来研究人员运用合成生物学策略(表2):①强化噬电细胞电子摄取和转化效率,获得具有电能转化效率高、胞内合成代谢速率快的噬电工程菌;②挖掘噬电细胞高值化学品合成最优路径,构建产物生成量大、定向性强的微生物细胞工厂,实现电能驱动的化学品高效定向生物合成。

表2 噬电细胞的合成生物学改造汇总Tab.2 Summary of engineering electrotrophs by synthetic biology
3.1 工程强化噬电细胞电子摄取和转化
噬电微生物细胞可通过直接或间接的方式摄取电子,而基于电子载体的间接传递方式,因其需要更高的电势差,以及天然的细胞毒性,极大地限制了其广泛应用。相比之下,通过细胞色素介导的电子传递路径可直接向微生物提供电子,更具可持续性和能源效益。为此,研究人员通过构建基于细胞色素直接噬电的电子传递路径,克服电子摄取屏障等方法强化噬电细胞电子传递效率。例如,Dong等[150]设计了一种基于细胞色素蛋白OmcS的直接噬电的跨膜噬电途径,在具有N2固定活性的工程化细长聚球藻(Synechococcus elongatusPCC 7942)中,表达来自于Geobacter的外膜细胞色素蛋白OmcS,使得工程化后的细胞表现出高效的跨膜噬电能力,其NH3产率较原始工程菌提高约13倍[图8(a)]。同样,Wu等[149]通过在E.coli中异源表达S.oneidensis的细胞色素蛋白MtrCAB、FccA、CymA,构建基于MtrCAB-FccACymA色素蛋白复合体的细胞噬电路径,使得E.coli能够噬取胞外电子并转化为自身还原力,构建了一个具有琥珀酸生产功能的电活性细胞工厂,琥珀酸产量较亲本提高1.6倍[图8(b)]。虽然引入Mtr途径后能够改善细胞琥珀酸生产效率,但由于对细胞噬电的电子传递机制的理解有限,其工程改造效率并没有实现数量级突破。因此,为进一步揭示电子摄取机制,Feng等[157]报道将来自S.oneidensisMR-1的MtrCAB途径蛋白整合到表达ccmABCDEFGH的E.coli中。通过电化学压力的选择,进化出具有良好电损伤抵抗力的菌株。进一步探究内向电子传递机理时,发现敲除napC(编码内膜c型细胞色素)和menA(甲基萘醌合成关键酶)后,几乎不产生琥珀酸,从而证明甲基萘醌是内向EET的关键成分[图8(c)]。除了利用细胞色素构建向内电子传递路径外,研究人员发现通过结合光合质子泵亦能辅助细胞克服电子摄取屏障,催化胞内还原力转化。例如,Tefft等[148]基于S.oneidensis天然的Mtr途径和NADH脱氢酶,通过异源表达光驱动质子泵蛋白视紫红质以产生质子动力,反向驱动NADH脱氢酶来催化细胞内的还原力生成。在光驱动质子泵的作用下,电极电子经Mtr蛋白复合体转移至内膜醌池,并在NADH脱氢酶作用下将电子从醌池转移至NAD+。随后通过强化丁二醇脱氢酶表达,并敲除氢化酶基因hyaB、hydA,使代谢流向2,3-丁二醇的合成途径,并且产量最终达到0.06 mmol/L[图8(d)]。这种能量转换技术在不添加电子介体的情况下为化学合成提供了足够的还原当量,进一步增加了实际生产中的可行性。上述结果表明,通过合成生物学策略,将外电极作为电子源驱动细胞内部异源还原反应,使得电能以有机物的形式储存于细胞中,为未来微生物电合成技术走向现实应用奠定重要基础。

图8 噬电细胞电子摄取和转化Fig.8 Inward electron transfer pathway construction in electrotrophs
3.2 工程噬电细胞代谢路径电合成化学品和生物燃料
噬电细胞作为核心催化剂的微生物电合成系统,提供了一种在生物电化学体系中由C1化合物以电力驱动合成有机化合物的技术。微生物电合成系统作为催化平台,为CO2等一碳底物的增值提供还原动力,以催化产生醇、酸等高附加值化学品。为进一步推动CO2固定和转化,实现双碳减排、构建清洁低碳能源体系的目标,近年来研究人员通过构建异源代谢合成路径、强化胞内还原力转化、提高电子噬取效率等策略系统性提高CO2固定化效率,以及微生物电合成高值化学品(高级醇、萜类化合物、番茄红素等)的能力。例如,为了将太阳能转化的电能更好地储存,Li等[73]通过将外源电能与生物CO2固定和燃料生产结合,在Ralstonia eutrophaH16中引入异丁醇合成路径中关键基因(alsS、ilvC、ilvD、kivd、yqhD),并敲除支路聚羟基丁酸酯合成基因簇(phaCAB),通过同时驱动电催化甲酸盐的生产耦合甲酸盐代谢转化为高级醇路径,使代谢流向异丁醇和3-甲基-1-丁醇合成路径[图9(a)]。最终工程化的R.eutrophaH16能够以电能和CO2作为唯一能源和碳源,产生超过140 mg/L的生物燃料,开启了将CO2电力驱动生物转化为各种化学品的可能性。同样,为了将太阳能驱动水分解产生的H2和O2转化为生物燃料,Torella等[151]开发了一款可扩展的集成生物电化学系统,将R.eutropha维持在高电位培养,以促进细胞生长且不产生ROS毒性。随后通过敲除基因phaC、phaB,以破坏聚3-羟基丁酸酯合成,并强化异丙醇合成路径基因phaA(酮硫解酶)、ctf(乙酰辅酶A转移酶)、adc(乙酰乙酸脱羧酶)、adh(乙醇脱氢酶)表达,使代谢流向R.eutropha的异丙醇合成路径[图9(b)],其异丙醇的最大生物电化学效率达3.9%,产量达到216 mg/L。此外,为了提高生物燃料生产的能量转换效率,研究人员开发了人工光合系统,利用光生电子为胞内代谢反应提供还原力驱动。例如,正丁醇因其具有较高的能量、较低的挥发性和亲水性被认为是一种优质的生物燃料。Bai等[156]将正丁醇生物合成途径(phaABJ、ter、adhE2)引入到光合自养生物沼泽红假单胞菌(Rhodopseudomonas palustrisTIE-1),通过代谢工程和新型混合生物电化学平台结合,分别在野生菌TIE-1、敲除固氮途径、乙酰辅酶A的菌株中实现了正丁醇生产,表明R.palustris可以使用不同的碳源(有机酸、CO2)、电子源[H2、Fe(Ⅱ)、电极]和氮源(NH+4、N2)来生产正丁醇。其中缺乏固氮途径的突变体丁醇产量最高达到0.91 mg/L,其电能转换效率达到131.13%。

图9 微生物电合成化学品和生物燃料Fig.9 Microbial electrosynthesis of chemicals and biofuels
除了催化生产生物燃料外,利用微生物电合成技术催化高附加值化学品合成也成为近年来的研究热点。以工业和医药领域的重要萜类化合物——α-葎草烯为例,为了提高α-葎草烯在微生物电合成中的生产效率。研究人员首先在R.eutropha异源构建甲羟戊酸途径,同时强化法尼基焦磷酸合酶(ERG20),IPP异构酶(fni)和α-葎草烯合酶(ZSSI)表达,使工程菌在自养条件下,最大α-葎草烯合成量达到6.3 mg/L。随后,研究人员[153]进一步确定了工程菌株在电自养条件下α-葎草烯的生产效率,通过接入外源电极促进水分解产生H2,为细胞提供还原力,同时向系统内通入CO2以供给细胞碳源,最终电自养条件下工程菌R.eutropha可生产10.8 mg/L的α-葎草烯,较自养条件提高近2倍。另一方面,为了减少温室气体排放,提高CO2捕获效率以促进微生物电合成高值化学品的生产。Chen等[152]构 建 了 甲 酸 脱 氢 酶(formate dehydrogenase,FDH)辅助的MES系统,FDH在阴极室催化CO2还原为甲酸,而甲酸盐可作为电子载体将来自阴极的电子传递至R.eutropha。为了提高该过程CO2转化效率,添加电子传递载体中性红(neutral red,NR)以促进FDH的辅助因子NADH的细胞外再生,并负责将电子从阴极间接传递至R.eutropha,强化细胞内还原力的水平,进一步提升微生物电合成的效率。同时,Calvin-Benson-Bassham(CBB)循环作为R.eutropha主要固碳途径,其1,5-二磷酸核酮糖羧化酶(Rubisco)在该过程中起到关键作用。为此,研究人员通过异源表达来自S.elongatusPCC7942的关键酶Rubisco,从而强化R.eutrophaCBB循环固定CO2的能力[图9(c)]。最终通过该酶辅助电合成系统,使得聚3-羟基丁酸酯(poly-3-hydroxybutyrate,PHB)的产量达到485 mg/L。此外,Zhang等[155]将微生物电合成引入真核生物酿酒酵母(Saccharomyces cerevisiae),以解决因还原力NAD(P)H供应不足而限制类固醇羟基化过程。细胞色素P450单加氧酶是催化该过程的关键酶,而细胞内还原当量NAD(P)H供应不足通常被认为是影响该酶催化的关键因素。为此,研究人员通过构建P450生物电催化系统,添加电子传递载体NR以促进电极向S.cerevisiae供给电子,提高胞内再生还原当量并调控羟基化过程,同时过表达氧化甾醇7α-羟化酶,使脱氢表雄酮(DHEA)能够羟基化为7α-OHDHEA,基于此生物电催化系统使得最终7α-OHDHEA的产率提高到288.6 mg/L,较原系统提高2.4倍,法拉第效率显著提高至57.9%。为了拓宽微生物电合成的多样化高值化学品,Wu等[154]在R.eutropha中建立了番茄红素从头合成路径,异源表达了来自Erwinia herbicola的生物合成途径CrtEBI2,通过与无机催化水电解相结合,使工程菌株能够利用H2作为还原力,CO2作为唯一碳源生产番茄红素[图9(d)]。由于产生的番茄红素可显著降低活性氧对细胞的损伤作用,进一步提高了微生物和无机催化间的生物相容性。最终,利用该系统能够从燃煤电厂的实际废气中生产出1.73 mg/L的番茄红素,该方法为将工业废气中的CO2高效转化为高值化学品建立了一条可持续的路线。上述研究表明,使用基因工程策略来调整电活性微生物的细胞内代谢途径,结合微生物电合成系统平台,可成为未来提供可持续能源、生物燃料以及高附加值化学品的强大技术。
4 电能细胞的应用展望
近年来,能源短缺和环境生态问题成为全球面临的挑战,在此背景下,电能细胞驱动的微生物电化学系统在新能源开发、环境监测、有机催化、生物医疗等多方面展现出广阔的应用前景。随着研究人员对电能细胞的生理代谢过程、电子传递机制的深入探索,未来其能量转化效率有望实现跨数量级突破,这将进一步加快以电能细胞为核心微生物电化学系统在生物制造和生物催化领域的进展,为可持续性生产绿色能源提供新思路。
合成生物学是生物学、化学和工程学的汇聚型新兴学科,它将生物学的研究性质与工程设计原则相结合,在指导微生物细胞改造上表现出多种显著的技术优势性和便捷性。电能细胞独特的电子传递能力对众多领域都有显著的促进作用,虽然以电能细胞为催化剂的生物电催化系统已经取得了显著成果,但仍然面临着巨大挑战,如界面电子传输能力有限、生物催化系统稳定性差、化学品合成速率低等。因此,通过融合合成生物学方法、化学方法、材料工程、计算机科学等多学科来解决上述问题似乎更有前景。目前,由于缺乏基因编辑工具和工程化策略,针对电能细胞的机制解析和工程改造仍有局限。未来的研究方向可以从以下几个方面作进一步思考:
(1)开发新型调控元件针对电能细胞的代谢调控的未来发展,挖掘和发现更多的细胞调控元件应该是未来研究的重点方向,细菌群落内代谢功能的变化在很大程度上取决于组成细胞中调节网络和生化网络的复杂性以及由此产生的合作行为。此外,由于基因表达激活不可避免的时间延迟,以及化学信号分子在溶液中有限的扩散速率。相比之下,利用光遗传学方法,开发新型调控元件,是快速、无创和可靶向操作细胞的有效工具,将合成生物学启发的工程方法与新工具的开发相结合,进一步拓展电能细胞在微生物燃料电池、生物修复、生物电合成、纳米材料生产等方面的应用。
(2)开展多学科交叉策略随着科技的革新,合成生物学研究不再是传统简单的基因工程操作技术,更多是与化学方法,材料工程相结合形成的跨学科交叉整合。特别是在电能细胞的设计与构建中,传统的设计往往是通过强化氧化还原辅因子以减少电荷迁移距离或强化电子传递载体合成以促进电子传递,然而这些方法普遍存在影响胞内代谢,阻碍细胞生长以及界面电子转移效率低等问题。基于材料工程开发的多种导电材料(例如石墨烯、聚吡咯、金属纳米颗粒等),能够辅助产电细胞有效降低界面电阻,减少能量损耗,引导微生物进化,构建人工杂合电活性生物膜优势群体,使得细胞能量转化效率大幅度提升。同样针对于噬电细胞的电子摄取能力弱、还原力供给不足等问题,许多光捕获材料(例如CdS、InP、PFP、PDI等)显示出明显优势,因其具有可调节的光带隙、良好的生物相容性、高效的电子转运能力,是构建半导体-微生物杂合体以驱动微生物电合成实现光电子到化学能高效转换的绝佳工具,在CO2固定、高值化学品合成中显示出巨大的潜力。
(3)推动多元化实际应用现阶段微生物电化学系统仍处于实验室发展阶段,面对实际工业生产的高电能供给仍有较大的差距。然而,单纯扩大微生物电化学系统体积、增大电极面积,反而会使系统内阻急剧上升,增加内部损耗,从而限制其电化学性能。以微生物燃料电池为例,相比于单体电池结构利用微生物燃料电池堆栈技术,通过串并联连接多个单体电池组成微生物燃料电池堆,则表现出更高的输出电流和较低的能耗损失。因此,通过对微生物电化学反应过程中的热力学、动力学计算,缩减反应过程中的能量损耗,设计优化反应器结构,有望实现驱动多设备运行。同时,随着合成生物学技术的开发,可进一步推动电能细胞在供电、传感、合成等实际应用。特别是在最新的碳达峰、碳中和的需求背景下,微生物电化学系统有望利用合成生物学技术,强化电能细胞CO2捕获能力,高效催化高附加值化学品生产,最大限度地减少人类社会生产活动的CO2排放量,为低碳循环经济提供新的可能性。
