“双碳”背景下聚球藻底盘研究的挑战与机遇
2022-12-14陶飞孙韬王钰魏婷倪俊许平
陶飞,孙韬,王钰,魏婷,倪俊,许平
(1上海交通大学生命科学技术学院,微生物代谢国家重点实验室,上海 200240;2天津大学生物安全战略研究中心,天津 300072;3中国科学院系统微生物工程重点实验室,中国科学院天津工业生物技术研究所,国家合成生物技术创新中心,天津 300308;4中国科学院深圳先进技术研究院,深圳合成生物学创新研究院,中国科学院定量工程生物学重点实验室,广东 深圳 518055)
当前,极端天气的出现日益频繁,气候变化已经从科学观测和理论的层面变成了人们可以切身感受的事实[1]。造成气候变化主因的碳排放因此受到了越来越多的关注,各国纷纷制定了自己的减排目标。在此背景下,我国提出了自己的减少碳排放的目标,计划在2030年左右实现“碳达峰”,在2060年左右实现“碳中和”[2-3]。实现这个目标需要着重在4个方面努力;其一是能源生产的脱碳,这个是指清洁能源的替代,用非化石资源的新能源替代传统能源;其二是能源消费的脱碳,主要是指各领域的电能替代,构建以清洁电力为基础的产业体系和生产生活方式,摆脱煤、油、气依赖;其三是非能利用领域的碳减排,是指传统产业向低耗能、低排放、高附加值方向加快转型,大幅减少工业过程中产生的碳排放;其四是自然碳汇和碳捕集,由于受资源、技术、经济性等因素影响,到2055年左右,我国能源生产、消费以及工业非能利用领域还有约14亿吨碳排放,需要通过自然碳汇、碳捕集等措施予以解决[4-5]。
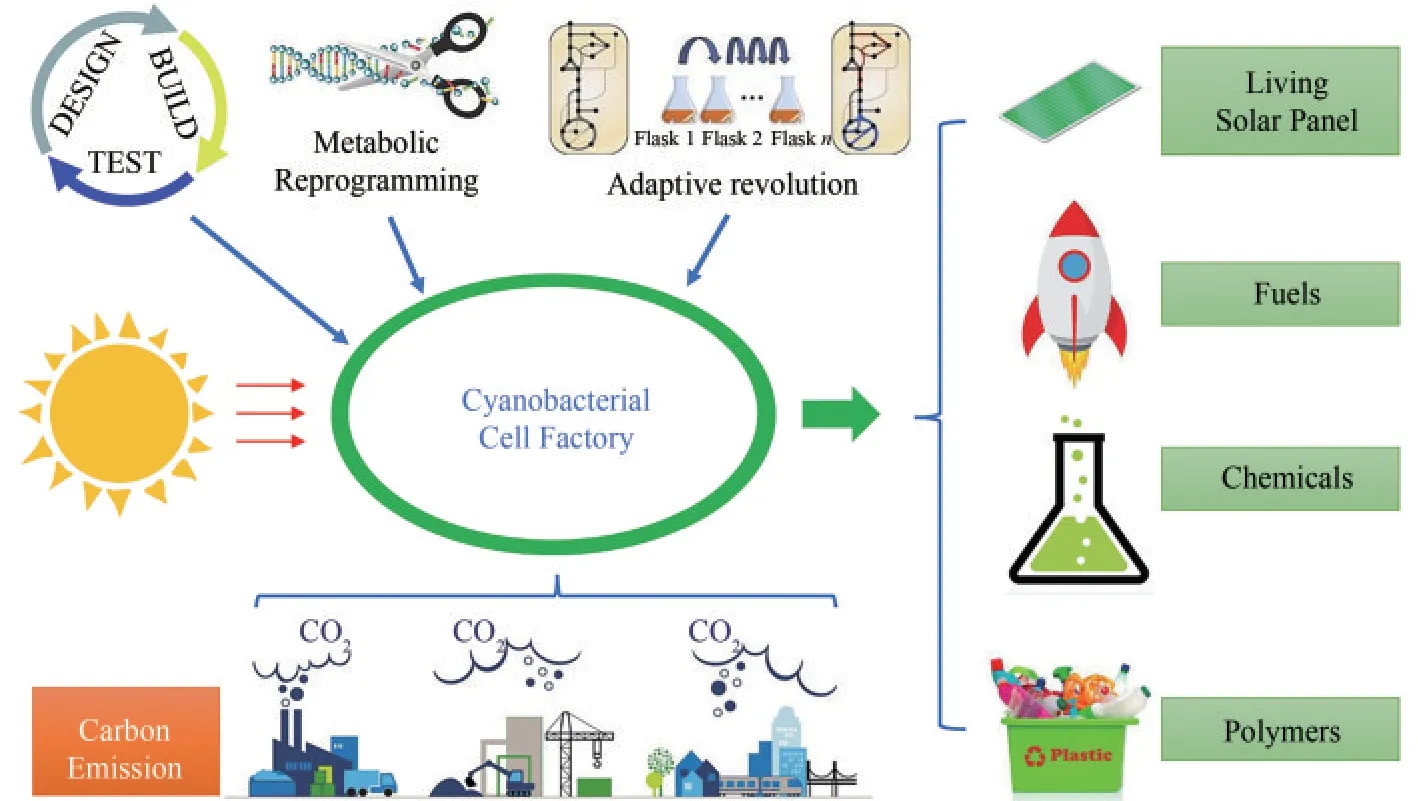
蓝细菌是一种原核的光合微生物,能够以阳光作为能源,以CO2为碳源自养生长,在自然界中广泛分布,种类繁多,承载着地球上重要的初级生产力,在地球碳循环、地球氧化型大气的形成等方面起到不可替代的作用[6-7]。它在多个基础研究和生物技术领域扮演了十分重要的角色,在当前快速发展的合成生物学领域已经成为第3类最重要 的 微 生 物 底 盘[8]。例 如,鱼 腥 藻7120(Anabaenasp.PCC 7120)是研究生物固氮和细胞分化的模式生物[9-10];聚球藻和集胞藻经常被用于研究光合作用的机制[11];淡水聚球藻7942(Synechococcus elongatusPCC 7942)和海水聚球藻7002(Synechococcussp.PCC 7002)等已经作为宿主进行能源和精细化合物生产[8,12];淡水集胞藻6803(Synechocystissp.PCC 6803)用于PHB(聚-β-羟丁酸)等多种化合物的合成[13]。目前使用蓝细菌作为宿主已经实现了数十种化合物的合成,其中能源类化合物如乙醇、丁醇、烷烃、脂肪酸、蔗糖、石竹烯等,大宗化学品如乳酸、甘油等,精细化学品如苯丙烷类化合物等,另外还有淀粉、胞外多糖、蛋白质等聚合物[14-15]。
经过多年的研究,用蓝细菌作为底盘构建光驱动细胞工厂,直接转化CO2生产化合物潜能已得到广泛的认可。尤其是聚球藻,由于具备良好的性能和可操作性,已经成为蓝细菌合成生物学领域的热门底盘[8,16]。随着研究的深入,以蓝细菌为底盘的光驱动合成所面临的问题也逐渐浮现,这其中最为重要的是效率问题和抗逆问题。首先,相较于异养生物,蓝细菌细胞工厂的产物浓度和生产强度都比较低,以乳酸生产为例,以葡萄糖为碳源的细菌可以在几十个小时内生产高达200 g/L的乳酸[17],而蓝细菌在2周的生产周期内只能生产不到2 g/L的乳酸[18]。这是蓝细菌合成生物学一直以来被人们广泛诟病的原因,即使考虑到蓝细菌的培养基成本和碳源成本的优势,这样的生产强度和产物浓度仍然是一个严重的制约因素。另外一个问题是在蓝细菌产业化中所面临的污染问题。蓝细菌的大规模培养需要用阳光作为能源,户外培养或者特殊的大规模光反应器是一个必然选择,再加上培养周期长,外源杂菌的污染就成为了极大的问题,容易造成培养的失败[19]。鉴于以上问题,以蓝细菌作为底盘的生物技术前景如何,究竟是否值得大力投入研究,一直是被业界所争论的话题。尤其是在当前“碳达峰”“碳中和”的“双碳”政策大背景下,发展新兴的生物技术已经成为了迫切的需求,各种新的低碳生物技术都方兴未艾,可以说蓝细菌生物技术的发展又到了一个新的十字路口[14,20]。基于此,本文就上述问题展开综述和讨论,以期把上述相关内容梳理出基本脉络。
1 光驱动细胞工厂的理性与愿景
1.1 光合作用是自然选择的有机物生产方式
放眼我们所处的宇宙,不难发现宇宙中能量十分富足但有机物极其稀缺。宇宙中从质量到能量的转化时时刻刻都在大规模地发生,每个恒星都可以持续不断通过发光发热的方式向外释放能量,这种基于热核反应的能量也是人类理想的终极能源[21]。相比于物理意义上的能源,有机物在宇宙中虽然普遍存在,但却十分稀少,主要是由非生物的化学反应产生[22]。人类的一切活动都离不开化合物的生产,特别是有机物的生产,比如食品、纤维、塑料、燃料等,这是由我们的生物本质所决定的[23]。如果暂时抛开当下能源挑战,从人类的长远发展来看,不难预见,当人类依赖热核反应或者其他方式真正实现能源自由的那一天到来时,物质资料的生产,特别是有机物的生产,仍然会是人类活动的重要方面,甚至于将是仅存的恒久话题。
地球的独特性之一在于存在生命可以利用光能生产有机物,这就是光合作用,它是目前所知利用光能生产有机物的主要天然实现方式,也是自然界存在的利用天然能源合成有机物的最高效的方式[22]。虽然除了光合作用还存在很多的光化学反应、电化学反应等可以实现简单有机物的合成,但是相比于光合作用,它们的规模和效率都微不足道[22]。光合作用的诞生对于地球来说是革命性的,它为地球上丰富有机物的出现奠定了基础,也根本上改变了地球的氧化还原环境[7]。从这个意义上说,光合作用是被自然界选择了的利用光能合成有机物的催化方式,这种方式对于地球的物理环境来说具有其优越性。当然,并不是说这种方式是不能超越的,只是说在当前的约束条件下它具有最大的合理性。事实上,当前的合成生物学就是期望通过人工的方式对自然进化予以超越[8,24-25]。我们不能否认未来可能存在比光合作用更有效率、更适合的利用能量合成有机物的方式,但仅就目前而言,光合作用系统仍然是人类最可及的体系。以这个天然的系统为基础进行改造和提升仍然最符合理性。
需要注意到,人类目前所能利用的主要能量来源从根本上说都是太阳能。生物质是通过植物的光合作用形成的有机物,可以看作是以生物质形式储存的太阳能;化石资源是远古生物光合作用形成的有机碳埋藏到地下形成的,根本上也是太阳能[22]。当我们以化合物作为最终的目标产品时,不难看出,所有的生产方式从根本上都是利用能量合成有机物的实现(图1)。显而易见,在能量利用的任何一个环节都会损失一定的能量,因为没有哪个能量转化步骤的效率是100%。因此,在能量使用中,更少的步骤往往意味着更高的效率。因此可以推断,在利用太阳能来合成有机物的过程中,直接用蓝细菌光驱动的方式由于需要的步骤最少,在能量总体利用效率方面具有潜在的巨大优势,即使当前这个优势还未充分得到体现。另外还需要意识到,尽管太阳输出到地球的能量总量很大,但是受到气候条件等因素限制,真正可以被使用的太阳能是有限的[26],对有限的太阳能的利用来说,总体效率的考量十分重要。
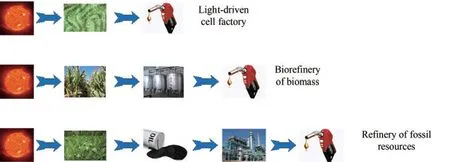
图1 利用太阳能合成有机化合物的几种不同路径Fig.1 Different ways for producing chemicals from solar energy
1.2 蓝细菌与土地气候的依赖
技术的实施依赖于一定的土地和气候条件,新的能源技术和绿色生产技术的实施也不例外,必须考量的因素就是土地和气候条件对能源开发利用的影响。事实上,这种影响已经造成新能源利用的一些困境,比如风电和光伏发电,受到气候的影响大,稳定性差,并入电网的比例不能超过15%[27-28]。物质资料的生产更是如此,例如粮食生产以及生物炼制所需的各种生物质资源的生产,都受到土地和气候条件的制约。开发新的技术摆脱这种制约才能利用有限的能源,实现物质资料生产效率的最大化。在农业生产中这一理念已经得到了实践证实,比如发展海水稻、旱地稻可以让粮食的生产一定程度上减少对淡水的依赖[29-30]。需要注意的是,大型藻类及植物和蓝细菌一样可以进行光合作用,对它们来说,“双碳”背景同样也为其合成生物学发展提供了宝贵的机遇。但是,相比较而言,蓝细菌细胞工厂摆脱时空依赖方面可以说具有与生俱来的优势。首先,蓝细菌是微生物,可以使用反应器来培养,不受湿度、温度、盐度等地理气候因素限制,规模可以任意放大,相同的土地面积上还可以使用立体培养的方式实现光能利用的最大化[31]。其次,蓝细菌本身具有生物多样性,能够适应不同的栖息地,这种具备不同适应性的蓝细菌可以用于开发适合不同条件的细胞工厂[32]。再次,蓝细菌细胞本身具有昼夜周期律,这与天然的昼夜规律、太阳能的释放规律吻合。蓝细菌相较于植物和大型藻也具有更高的效率[33]。总之,用蓝细菌细胞工厂来进行物质的生产,有利于最大程度地摆脱对气候和土地的依赖,从而实现物质生产效率的最大化。
1.3 蓝细菌生物技术在“碳中和”中的应用潜力
1.3.1 能源生产
在我国的“碳达峰”和“碳中和”路线中,要实现的是能源消费的电能化,也就是说能源产品的最终形式都要尽可能逐渐归一到电能上去,然后把电能提供给终端的能源使用者[4]。Sawa等[34]利用打印的方法把蓝细菌铺在碳纳米管表面制作了生物太阳能板,可以在光照下实现连续产电,这证明了利用蓝细菌实现发电的可能性。这种方法目前看来还只能为低功耗的场景提供电能,用途有限,但是产电的相关机制值得深入研究,尤其是合成生物学、材料科学、界面科学相关的技术加持,产电效率将会进一步提高,这种活的光伏发电装置,对于解决光伏发电中的太阳能板污染的相关问题或许是一种新的选择[35]。
在电能消费领域,电池能量密度是一个重要的问题,以实验室性能较好的锂电池为例,能量密度为600 W·h/kg[36],而汽油的能量密度可达12889 W·h/kg。因而对于能量需求大的应用场景,现有技术条件下实现电能替代比较困难,例如飞机、大功率的工程机械和装甲车等。在这些场合中使用液体燃料仍然是相当长时期的合理选择。在这种应用场景下要替换化石燃料,使用生物炼制来源的可再生液体燃料将是出路之一。以蓝细菌作为细胞工厂生产能源化合物已经发展多年,现在能够生产乙醇、氢气等多种能源化合物[12,37]。蓝细菌可以一步把太阳能转化为高能量密度的化合物,在太阳能的整体利用效率上比传统基于生物质的生物炼制具有优势,从这个意义上说,蓝细菌底盘可以在此方面有较大的发展潜力。
在新能源中风能和光伏发电从能源的丰富程度和技术成熟度上都接近实用化。尤其是对于我国来说,西部地区蕴藏的风能和光能资源是我国实现“双碳”目标的最大底气[2,4]。但是太阳能和风能发电、受到气候条件的强烈干扰,极不稳定,并入电网困难,素有“垃圾电”的称谓。高效、大容量、低成本的电能储存技术是解决这个问题的关键[27-28]。现在的电能储存方法主要是电池、超级电容器、压缩空气、抽水法等,这些方法都面临能量密度低的问题,难以满足大规模储能的要求[28]。如果能够把基于蓝细菌的液体燃料生产和光伏发电结合起来,在太阳能盈余的时候用太阳能驱动蓝细菌细胞工厂合成化合物对太阳能储存,在太阳能不足的时候用储存的化合物来发电,就可以解决太阳能发电的波动性问题,这将是一个值得研究的潜在方案。
1.3.2 非能源化合物制造
在碳排放的构成中,除了能源生产之外还有很大一部分来源于工业生产过程。目前,我国每年工业过程产生的碳排放大约为10亿吨左右[3-4]。针对工业过程的碳排放,可以从两个方面入手:一方面用生物炼制来源的还原剂替代化石来源的还原剂,比如在制炼钢中使用生物炼制的氢气作为还原剂;另一方面可以利用合成生物学开发新型的绿色制造工艺和技术。生物催化的最大特点就是高选择性,常温常压,碳原子经济性高,发展生物催化来替代原有的化学催化将帮助多个领域的减排[38]。蓝细菌细胞工厂作为一种绿色生产方式,在很多领域具有替换传统方式的潜能。首先,蓝细菌可以用来生产大宗非能源化合物。例如塑料等聚合物,用量巨大,是最重要的大宗化学品之一。利用蓝细菌已经可以实现多种聚合物单体的合成,比如乙烯、1,3-丙二醇、异戊二烯、乳酸、2,3-丁二醇等[14,18,39-41]。有些蓝细菌菌株可以直接在胞内积累天然的聚合物,比如集胞藻6803可以在胞内积累PHB颗粒,这是一种天然的可降解塑料,其最高产量现已达到81%的细胞干重[13]。其次,蓝细菌可以用于合成重要的精细化学品,这主要包括植物天然产物、蓝细菌次级代谢产物、医药中间体等[42-43]。蓝细菌在食品领域也有重要的应用,可以用于合成蛋白质、多糖、功能糖等[44]。
1.3.3 碳捕集和碳汇增强
在实现对化石碳资源使用的大幅度削减之后,最终还会有一部分碳排放无法避免,要解决这部分碳排放问题就需要进行减碳,主要是通过碳捕集和自然碳汇强化[4]。蓝细菌细胞可以直接把气体的CO2固定生成生物质或生物基产品,能够直接一步实现碳的捕集和固定,并且和特定的化合物生产偶联[45]。具体使用上,可以利用蓝细菌在两种场景下开展碳捕集。其一,可以在接近碳排放的地点建立蓝细菌大规模培养工厂,直接进行高浓度CO2的吸收固定,把CO2资源化。例如可以在大型的钢铁厂建立蓝细菌的反应器,直接利用工厂排放的高浓度CO2,把碳排放和碳捕集偶联起来,实现碳的零排放。另外还可以在日光充足的西部地区建立蓝细菌反应装置,从空气中直接捕集CO2合成生物质或者特定化合物,直接把富余的太阳能用于CO2固定。
在实现能源生产和大宗化学品生产的同时,蓝细菌细胞工厂还可实现碳捕捉和碳汇强化[46]。蓝细菌细胞工厂生产的能源类产品会经过燃烧重新排放碳,细胞物质经过炼制之后可以用作饲料等,最终也会经过动物消化等重新形成排放。但是,非能源的产品比如大宗材料单体等,则会以固定的碳形式存在,从大气中消除[46-47]。蓝细菌在自然界中是形成自然碳汇的重要驱动力,也可以通过对蓝细菌的干预增强,提升土壤水体的碳汇形成能力。比如在土壤中接种蓝细菌可以提高旱地土壤的碳汇形成能力[48]。蓝细菌细胞在环境治理中也有广泛的应用,污染处理过程中也可以形成碳汇,有报道称可以在污染治理的同时实现能源生产和CO2捕集[49]。
2 聚球藻的代谢潜能
2.1 生长速度潜能
生长速度是影响细胞工厂性能的关键因素之一[50]。相比于真核生物,原核生物作为底盘的一个显著优势即在于其生长速度。以大肠杆菌和酵母菌的对比为例,一般认为大肠杆菌的倍增时间约为20 min,酵母的倍增时间约为90 min[51-52]。这种复制速率差异的原因是系统性的,和细胞结构复杂度、基因组大小、DNA复制方式、细胞周期、胞内空间分布等都有密切的关系。以大肠杆菌DNA复制方式为例,它的DNA复制是一种连续的形成嵌套的复制结构,这和真核生物的DNA复制精确地控制在特定时期内有根本的不同[53-54]。显而易见这种系统原因所造成的速度差异,通过有限的遗传操作很难逾越,至少以现在对微生物细胞的认识水平和技术手段来说,难以在有意义的时长内予以实现。蓝细菌作为原核生物的一种,同样拥有原核生物的复制机制,现在报道的蓝细菌(聚球藻)最快的倍增时间为1.5 h[55-57],还远远没有达到一般异养细菌的生长速度。因此仅从生长速度方面来说,蓝细菌特别是聚球藻在生长速率方面还有巨大的潜能有待挖掘。也正是从这个意义上说,相比于真核微藻,蓝细菌在生长速度方面拥有更大的可挖掘潜力。
关于蓝细菌生长速度的限制因素已有一些很有意义的研究。Jahn等[58]通过蓝细菌的鸟枪蛋白质组研究了模式蓝细菌对光合碳源限制的适应过程,发现细胞能够按照生长优化的策略重组蛋白质组,但却会偏离这一策略保持蛋白质储备以应对可能的环境改变,他们同时还发现蓝细菌的生长速度主要受到光合碳源的限制。Burnap[50]针对蓝细菌基于蛋白质组约束建立了自养生物优化生长模型,可为自养蓝细菌的生长研究提供理论工具。值得注意的是最近的一些关于快速生长和大生物量蓝细菌的研究,已经初步揭示了聚球藻所蕴含的巨大生长潜能。比如新发现的聚球藻2973倍增时间可达1.5 h[57],聚球藻11901倍增时间为2 h,生物量可达33 g/L,这种速度已经非常接近酵母菌的速度,生物量甚至于不弱于异养生长的细菌[55-56]。这些研究清楚地表明了蓝细菌,尤其是聚球藻在生长方面的巨大潜能。一方面,这些新发现的菌株可以用于生长速度决定机制的机理研究,为进一步挖掘蓝细菌生长潜能提供基础。另一方面,这些菌株可以直接作为底盘,建立合成生物学平台,并最终发展成高效的光驱动细胞工厂。
2.2 光能利用
太阳的辐射能量散布在不同的波段,蓝细菌和其他的藻类仅能利用部分波段,主要是红光和蓝光波段。据测算,蓝细菌仅能利用阳光能量的3%~9%,相较于太阳能电池接近50%的光能利用率,这个利用率较低[59]。提高光能利用效率的重要手段之一是拓宽蓝细菌的可利用光谱,这也是蓝细菌研究的热点之一。拓宽光谱主要有3个思路:①寻找不同光谱利用的元件进行整合,比如叶绿素F可以帮助实现远红外波段的利用[60];②利用纳米和生物的结合,利用纳米材料的光电效应,在蓝细菌表面实现波谱转化或者光电转化,进而实现生物利用[61-62];③利用太阳能电池板和LED的高效率,通过光-电-光的转化,把不同波段的太阳能变成蓝细菌可高效利用的650 nm波段,实现太阳能的高效利用[63]。光谱拓宽的研究隐含着一个重要的问题,那就是“在漫长的进化过程中蓝细菌为什么没有进化出利用所有光谱的利用能力”。到底是蓝细菌的碳基生命的本质的限制,还是地球有限波动的物理条件没有提供足够的进化机会?这个问题目前为止还未得到解决。但无论如何可以肯定的是,我们离真正的蓝细菌光能利用效率的边界还有很长的距离。这一点无论是从蓝细菌的多样性,还是光合系统本身的可操控空间来说都是如此,即使只对光利用的系统进行优化也有相当大的空间提升光效率[64-66]。利用光-电-光转化的方式提升太阳能量利用效率的工程化条件是接近成熟的,它的障碍在于光元器件的整合设计、强光胁迫等问题的解决。同时也需要探讨最适光比例、光照方式等以实现全链条的最大效率。
2.3 固碳能力
在已发现的所有固碳途径中蓝细菌的天然固碳途径并不是最有效的,除了蓝细菌中的固碳途径还有5种其他生物的固碳途径,这为利用合成生物学手段对不同途径的整合与优化提供了丰富的素材[67-68]。鉴于此,一方面可以在蓝细菌中进行关键固碳酶的替换,比如可以通过酶的挖掘和人工设计获得高效的固碳酶,然后进行替换;另一方面可以在蓝细菌中引入额外的固碳途径[69]。随着代谢网络理论的发展和固碳途径的认识不断深入,根据计算理论设计构建人工的固碳途径也已经成为可能,已有一些研究成功设计了人工固碳途径[67-68,70]。碳固定效率提升的另一个方面是提升CO2的可获得性。蓝细菌天然存在碳浓缩机制,通过对这些机制和元件的深入研究,可以最大程度地提升蓝细菌对CO2的可获得性[69]。值得注意的是,碳浓缩机制仅在CO2浓度低的时候起到正面的作用,在高浓度CO2的条件下,碳浓缩机制的缺失或敲低更有利于CO2的利用[71]。敲除碳浓缩机制的另外一个好处是降低了工程蓝细菌在自然环境中的生存能力,从而可以减少工程蓝细菌对环境的影响[72]。增强CO2的利用还可以通过培养基的化学吸收实现,比如Ataeian等[45]筛选了一个耐碱的蓝细菌菌群,可以在pH为11.2的培养条件下快速吸收转化CO2,大大提高了碳的吸收效率。
2.4 蓝细菌底盘的多样性
微生物的代谢潜能蕴藏在微生物的多样性之中,多样性越高,就越有希望找到符合各种各样不同需求的基因资源,这是开发蓝细菌细胞工厂以满足“碳达峰”“碳中和”需求的理性所在[73]。作为蓝细菌的代表菌株,聚球藻在地球生物圈中丰度和多样性比较高,是海洋的主要初级生产力来源[74-75]。这就使得我们能够方便地获得适用于聚球藻的功能基因元件,并且方便地实现聚球藻细胞工厂的构建。另外,聚球藻的多样性说明这种底盘的强大环境适应能力和生态竞争能力,这从细胞工厂的大规模应用来讲是一个巨大的优势。再次,聚球藻的适应能力也决定了未来在各种不同环境应用的可能性。最后,从科学上讲,这个方面的研究对于地球碳循环的研究来说也具有很高的科学价值。另外一点值得关注的是聚球藻具有非常强的代谢可塑性,对其进行高盐、高光等驯化可以获得相应的适应性突变菌株[76]。鉴于上述特点以及聚球藻的基因操作技术相对来说较为成熟,作为宿主构建细胞工厂的研究比其他蓝细菌种属都要多。不难看出,综合来说聚球藻作为底盘进行合成生物学研究科学价值和应用潜力都是不容忽视的。
3 聚球藻与基因编辑技术
3.1 基因编辑
上述分析表明了对系统化开发聚球藻底盘的重要价值。底盘开发的重要前提是高效可靠的遗传操作技术。聚球藻基因组的高效改造和编辑,是重构聚球藻代谢调控网络、提高其代谢潜能的关键使能技术。传统的聚球藻基因组编辑方法主要依赖于自杀质粒携带的同源片段与染色体发生双同源重组,并使用抗生素抗性基因等筛选标记进行筛选,难以实现无痕编辑。因此,下一轮编辑时需要使用新的筛选标记,限制了对聚球藻的系统遗传改造。此外,由于聚球藻通常具有多拷贝的染色体,因此需要多轮的抗生素筛选分纯,才可以得到纯种基因型突变体[77-78]。CRISPR/Cas(clustered regularly interspaced short palindromic repeats/CRISPR-associated protein)系统已广泛应用于多种真核和原核生物的基因组编辑[79]。借助CRISPR/Cas系统的精确定位和高效DNA切割能力,可提高外源DNA编辑模板与染色体DNA的同源重组效率,简化基因组编辑操作流程,实现高效无痕的遗传改造[图2(a)]。
2016年,Hu Yu-Chen团队和Himadri B.Pakrasi团队分别在两株模式聚球藻S.elongatusPCC 7942和S.elongatusUTEX 2973中开发了基于酿脓链球菌(Streptococcus pyogenes)的CRISPR/Cas9系统的基因组编辑技术(表1)。S.elongatusPCC 7942的CRISPR/Cas9基因组编辑基于双质粒系统,由一个质粒表达Cas9和引导RNA(guide RNA,gRNA),另一个质粒提供编辑所需的同源重组片段和敲入的靶基因。Cas9和gRNA的表达均使用S.pyogenesCRISPR/Cas9系统的天然启动子,在S.elongatusPCC 7942可实现组成型表达。作者测试了敲除glgc的同时敲入ppc和gltA,从而提高菌株固定CO2合成琥珀酸的能力,对经过3代抗生素筛选的克隆进行验证,基因编辑效率达到100%[80]。S.elongatusUTEX 2973的CRISPR/Cas9工 具 质 粒pSL2546改 造 自 链 霉 菌(Streptomyces)的CRISPR/Cas9质粒pCRISPomyces,由一个质粒表达Cas9和gRNA,同时携带编辑模板。适用于链霉菌的启动子PrpsL(XC)和Pgapdhp(EL)在S.elongatusUTEX 2973也具有功能,分别用于Cas9和gRNA的组成型表达。作者使用开发的系统对nblA进行了敲除,不需要对编辑后的细胞进行多次抗生素筛选传代,即可实现100%的编辑效率[82]。

表1 基于CRISPR的聚球藻基因组编辑技术Tab.1 CRISPR-based genome editing technologies for Synechococcus
在构建聚球藻的CRISPR/Cas9系统的研究中,研究者发现CRISPR/Cas9系统对聚球藻的毒性较大,导致工具质粒转化困难[84]。分析原因,一方面,Cas9蛋白具有较强细胞毒性,在其他微生物中也有体现[85];另一方面,在聚球藻中Cas9蛋白的表达通常使用组成型启动子,没有受到严谨的控制,加剧了其毒性。Himadri B.Pakrasi团队在多株蓝细菌中测试了来自Francisella novicida的CRISPR/Cas12a(Cpf1)系统,发现其细胞毒性较小,同时可高效地在模式聚球藻S.elongatusPCC 7942和S.elongatusUTEX 2973中实现基因组编辑[81,83]。该系统由一个质粒表达Cas12a和gRNA,同时携带编辑模板,IPTG诱导型启动子Plac和组成型启动子PJ23119分别用于Cas12a和gRNA array的表达调控。作者测试了psbA的单点突变、eyfp的敲入和nblA的敲除,通过对经过3~4代抗生素筛选的克隆进行验证,发现编辑效率为60%~90%[83]。
3.2 碱基编辑
使用开发的CRISPR/Cas9和CRISPR/Cas12a系统,可在聚球藻中实现无痕的基因敲除、敲入或者替换。但是,该方法基于质粒提供的编辑模板与染色体DNA的同源重组,以及CRISPR/Cas系统对未发生同源重组细胞的反向筛选。受限于聚球藻的DNA转化效率和同源重组效率,难以实现多个靶点的同时编辑。碱基编辑(base editing)技术最初由哈佛大学的David R.Liu团队和神户大学的Akihiko Kondo团队独立开发,其结合了CRISPR/Cas系统的定位功能和碱基脱氨酶的脱氨功能,在不产生双链DNA切割,不依赖外源DNA模板的条件下,在染色体特定位点实现C→T的碱基转换[86-87]。之后,研究者又陆续开发了可实现A→G转换、C→A和C→G颠换的碱基编辑技术[88-90]。碱基编辑最初为治疗人类遗传疾病而设计,逐步应用于微生物的基因组编辑中,目前已在大肠杆菌(Escherichia coli)、谷氨酸棒杆菌(Corynebacterium glutamicum)、枯草芽孢杆菌(Bacillus subtilis)等模式微生物中得到应用[91]。由于不需要提供外源的DNA模板、不依赖双链DNA断裂和同源重组修复,碱基编辑可用于微生物中多靶点的同时编辑,并可在Biofoundry平台实现全流程的自动化编辑[92-93]。此外,碱基编辑可对靶基因的表达调控元件进行编辑,从而实现多至10个基因的表达调控元件的体内建库和进行表达调控,已经成为重要的合成生物学使能技术[94]。因此,有必要开发适用于聚球藻等蓝细菌的碱基编辑技术,实现多靶点的同时编辑,加速聚球藻的遗传改造和功能基因组学研究[图2(a)]。
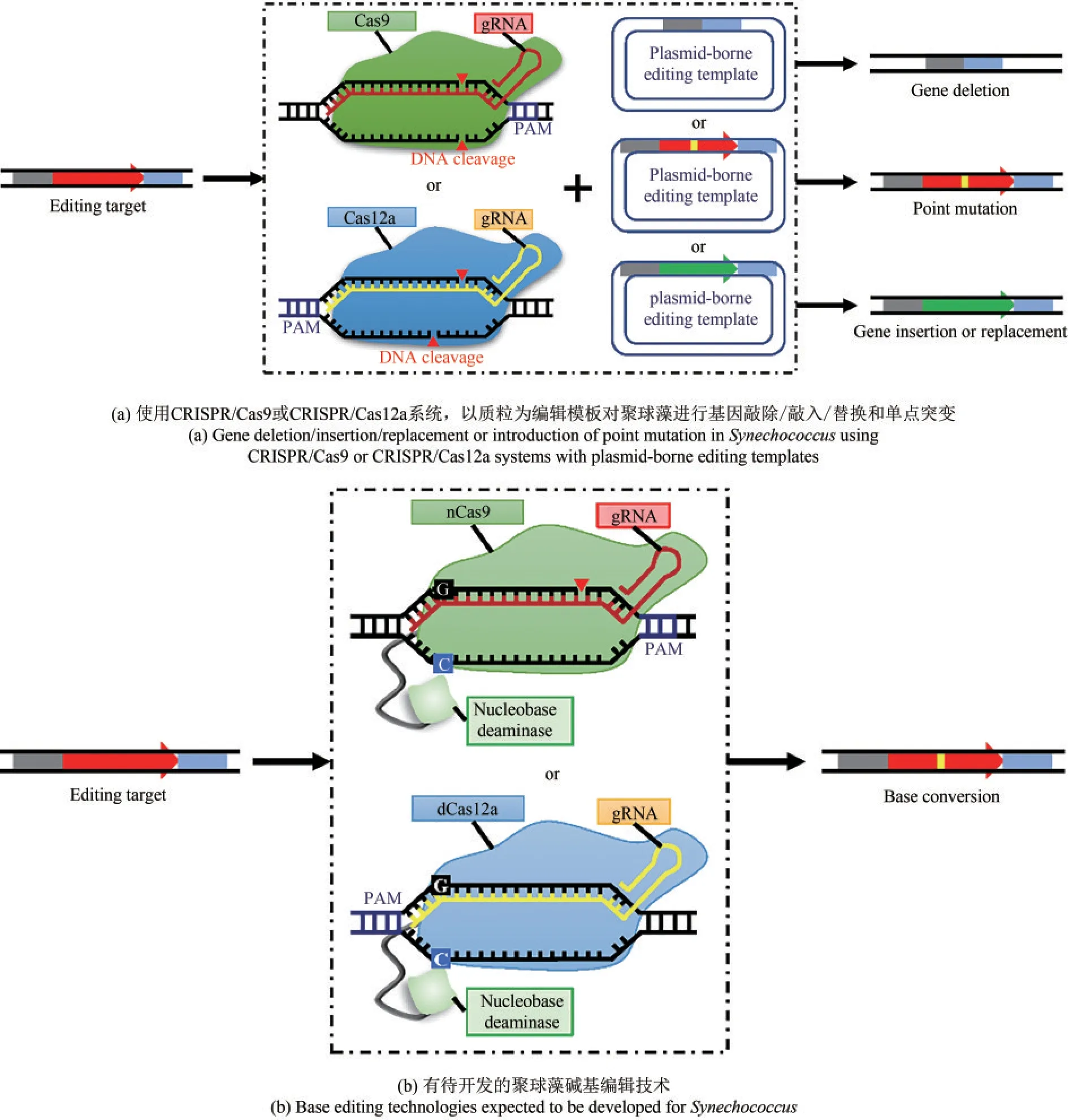
图2 使用CRISPR及衍生技术进行聚球藻基因组编辑Fig.2 Genome editing in Synechococcus using CRISPR and CRISPR-derived technologies
3.3 多基因调控
CRISPR/Cas系统不仅可用于基因组编辑,经过改造还可用于基因表达调控,实现基因沉默和激活[79]。2016年Hu Yu-Chen团队首先利用双链DNA切割功能失活的dCas9构建了S.elongatusPCC 7942的CRISPR干 扰 系 统(CRISPR interference,CRISPRi),可实现靶基因表达水平90%以上的弱化[95]。CRISPR/Cas12a系统不仅对聚球藻的细胞毒性较低,且由于Cas12a同时具有RNA切割功能,可加工gRNA array形成单个成熟的gRNA,方便同时靶向多个基因。2020年,成均馆大学的Han Min Woo团队和华盛顿大学的Himadri B.Pakrasi团队分别在两株模式聚球藻S.elongatusPCC 7942和S.elongatusUTEX 2973中 利用双 链DNA切割功能失活的dCas12a建立了CRISPRi技术,通过使用诱导型启动子控制dCas12a表达,实现了可控、高效的多基因表达弱化[96-97]。除CRISPRi外,CRISPR激 活(CRISPR activation,CRISPRa)系统已经成功应用于E.coli和产酸克雷伯氏菌(Klebsiella oxytoca)等细菌中[98]。但是,目前针对聚球藻的CRISPRa系统还有待开发。CRISPRi和CRISPRa技术具有gRNA的可追踪性,通过建立gRNA文库,可构建全基因组规模的基因表达扰动文库,高通量地进行功能基因组学研究和功能元件挖掘。目前已有针对集胞藻Synechocystissp.PCC 6803的全基因组规模CRISPRi文库,并用于乳酸耐受和高产相关基因的挖掘[99]。因此,有必要针对聚球藻建立全基因组规模的CRISPRi和CRISPRa文库,在全基因组规模上研究基因型与有益表型的关联性。
4 聚球藻与适应性进化
4.1 底盘进化
实验室进化是对聚球藻进行定向改造的另一项关键使能技术,可以直接根据研究者需要的功能设计筛选策略,即使在对相关元件的作用机制还没有进行详细解析的情况下,通常也可以通过该方法获得符合需求的突变体。实验室中微生物适应性进化最常用的方法是在一定的筛选压力下将微生物连续传代培养,通过微生物突变的富集获得能够适应筛选条件的表型[100]。目前为止以聚球藻为对象进行适应性进化的研究还比较有限,考虑到聚球藻和集胞藻都是研究最多的模式单细胞微藻,且二者之间有很多相似之处[101],因此集胞藻的适应性进化对于聚球藻的相关研究也具有很强的借鉴意义。聚球藻和集胞藻的适应性进化,主要是为了提高它们的光合效率以及对于生物合成过程中可能遇到的胁迫条件的耐受能力。
Dann等[102]利用化学诱变剂甲磺酸甲酯MMS和紫外线诱变相结合,连续传代培养后获得了能够耐受超过自然条件下陆上最高太阳光光强度[3000 μmol/(m2·s)]的集胞藻PCC 6803,从突变株基因组中检测到的突变位点涉及基因表达、光合作用、细胞代谢等多种不同功能分类的基因。Yoshikawa等[103]则直接利用集胞藻PCC 6803自然突变的积累,在高光照条件下连续传代培养后也获得了耐受光强度达到7000~9000 μmol/(m2·s)的突变株,经测序发现导致高光耐受的突变主要位于hik26和slr1916两个基因上,与前述研究中检测到的位点有所不同。
Srivastava等[104]进化聚球藻PCC 11801使其对丁醇和丁二醇的耐受浓度提高到原水平的2倍,其中丁醇耐受株还获得了对乙醇的耐受性。进化获得的菌株的突变主要位于胁迫响应的翻译起始因子和细胞代谢相关的酶类编码基因中。在其他种类的蓝细菌也开展了一些进化工作,可在聚球藻的进化中借鉴。Wang等[105]进化集胞藻PCC 6803使其对丁醇的耐受浓度提高2.5倍,并利用代谢组学方法对进化不同阶段所产生的突变株进行了分析,发现如3-磷酸甘油酸、NADPH等不稳定代谢物以及甘油、硬脂酸等稳定代谢物在进化过程中的差异化调控。Xu等[106]进化集胞藻PCC 6803使其对镉离子的耐受浓度提高到原来的2倍,且该突变株对锌和钴等重金属离子以及高光强的耐受能力也提高了;通过对基因突变的分析发现其中编码正离子或药物泵出系统的基因slr0454与突变株的镉离子耐受能力直接相关。Tillich等[107]进化获得了热耐受性的集胞藻PCC 6803突变株,并通过突变测序分析确定了一系列导致突变株产生耐热表型的基因。Hu等[108]在3%氯化钠的筛选条件下进化了集胞藻PCC 6803对高盐浓度的耐受性,并对突变株进行了代谢组和转录组分析,揭示了不同突变株在高盐胁迫条件下代谢物组成以及基因表达情况的不同,从侧面反映了产生高盐耐受表型的不同机理。Uchiyama等[109]则进化了集胞藻对酸的耐受性,获得能够在pH 5.5的条件下生长的突变株。
4.2 元件进化
以上研究中都采用连续传代培养的方式,且大多只依赖于聚球藻等蓝细菌在生长过程中天然的突变积累实现建库,由于蓝细菌的生长周期普遍较长,使得适应性进化的过程也十分漫长,通常需要花费数月甚至数年时间。而除了将聚球藻整体作为对象进行定向进化改造之外,一些关键元件也可以通过基因操作转移到其他生长更快且操作更加简便的模式微生物体系中进行进化操作。
已有研究通过在大肠杆菌中部分重建卡尔文循环,建立了大肠杆菌的生长与在该循环中起关键作用的核酮糖-1,5-二磷酸羧化酶/加氧酶(RuBisCO)的催化效率之间的关联。通过这样的构建,可以充分利用大肠杆菌系统基因操作便利的优势,采用易错PCR的方式对来源于聚球藻的RuBisCO进行扩增快速建立突变库,转化后筛选具有生长优势的菌株从而获得催化性能得到改善的突变体[110-111]。除大肠杆菌之外,酿酒酵母中的非饱和脂肪酸缺陷型菌株也可以作为底盘,用于进化来源于聚球藻PCC 6301的脂肪酸去饱和酶[112]。以上研究都是通过一定的方式将待进化的蓝细菌元件的功能与最常用的大肠杆菌或酿酒酵母的生长建立关联,从而构建了简便的筛选策略,再利用这两种模式生物基因操作便捷的优势,实现以蓝细菌本身为底盘难以达到的快速进化。近年来在大肠杆菌等模式微生物中的连续定向进化系统已有了快速的发展。其中,噬菌体辅助连续进化系统(phage-assisted continuous evolution,PACE)通过建立待进化生物分子的功能与噬菌体侵染能力之间的关联,并借助连续培养装置来实现自动建库和筛选,达到高效进化的目的(图3)[113-114]。该系统已广泛应用于RNA聚合酶、氨酰tRNA合成酶、Cas蛋白、碱基编辑器等重要生物工具酶类,以及抗生素合成通路的进化[115-117]。此外,包括基于CRISPR/Cas系统等基因编辑工具进行建库的方法也在不断涌现,且借助自动化实验平台等工具可以使得适应性进化操作更加快速高效[118]。利用这些实验系统和平台,有望大大加速聚球藻关键元件的进化。通过蓝细菌元件的分别进化和突变体组装以及重新组装后的工程菌株的整体适应性进化相结合的研究方式,可以为菌株的性能改造提供更多途径,也将为研究者积累丰富的关于蓝细菌基因功能及代谢调控的数据。

图3 噬菌体辅助连续进化(PACE)系统示意图MP—诱变质粒;AP—辅助质粒;SP—筛选噬菌体或其注入宿主细胞的基因组;POI—待进化的目标蛋白Fig.3 Schematic design of phage-assisted continuous evolution(PACE)MP—mutagenesis plasmid;AP—accessory plasmid;SP—selection phage or its genome inside the infected host cell;POI—protein of interest to be evolved
5 聚球藻的多元抗逆
聚球藻底盘在规模化培养中,面临来自环境(盐度、pH、重金属、温度及光照等)的多种非生物胁迫,因此,鉴定、解析及构建鲁棒性底盘,使其具备抗逆性能,尤其是对多种胁迫的协同抗逆性对其规模化应用十分必要(图4)。
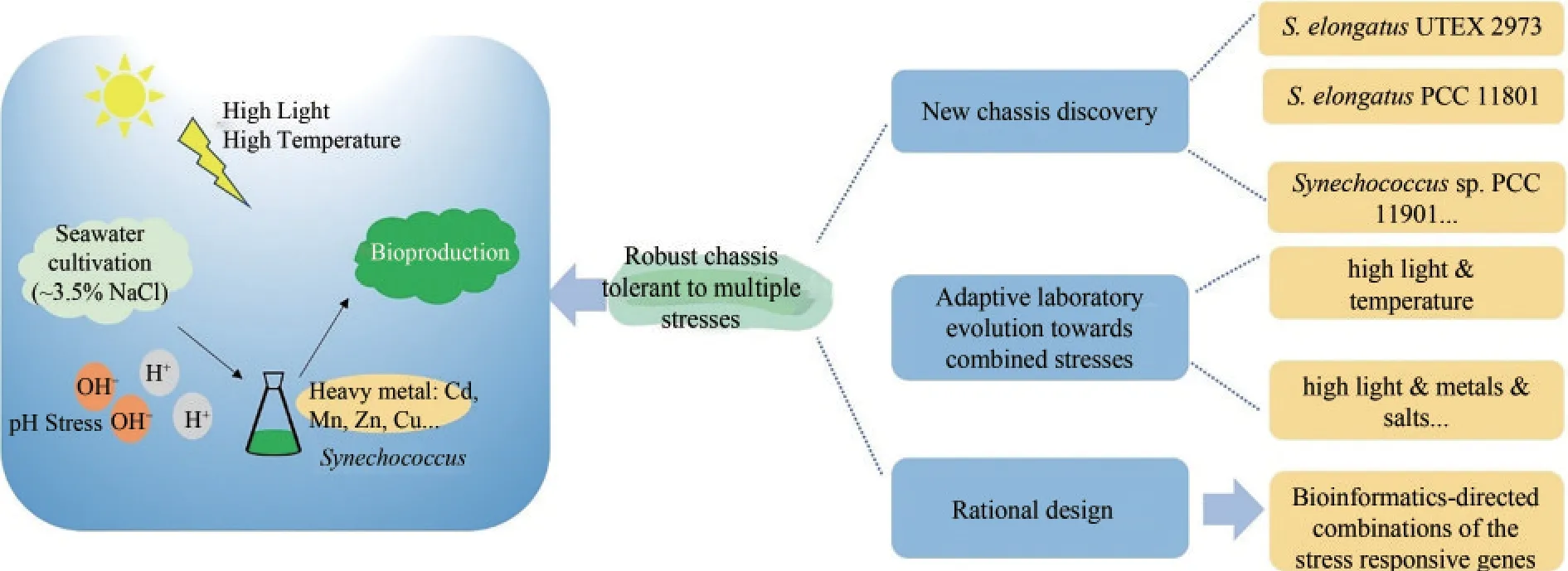
图4 聚球藻在规模化培养中面临的胁迫及潜在的解决策略Fig.4 Stress and potential solutions in large-scale culture of Synechococcus sp
5.1 聚球藻逆境胁迫响应基因的鉴定
聚球藻PCC 7942作为最为广泛使用的模式蓝细菌底盘之一,其完整基因组注释早在2005年就已完成,已被用于合成正丁醇[119]、异丁醛[120]、乳酸[121]等多种化学品,关于聚球藻PCC 7942的抗逆研究也广泛开展。2014年,Billis等[101]利用比较转录组学系统研究了聚球藻PCC 7942分别在无机碳减少、盐度增加、pH增加和光照减少的胁迫条件下24 h后细胞的基因表达响应。作者通过分析揭示了参与众多胁迫响应的关键基因并预测了未知功能蛋白与生化途径之间的关联,为进一步改造底盘对胁迫的抗逆能力提供了重要靶点[101]。2017年,Kobayashi等[122]研究了聚球 藻PCC 7942中双组分系统RpaB和Rre1在热激胁迫中的响应,通过免疫共沉淀和高密度微阵列分析等鉴定出Rre1的一系列结合位点,证实Hik34-Rre1是聚球藻PCC 7942中激活热激响应的关键信号模块。在此基础上,Yasuda等[123]又证实了RpaB可能广泛参与从暗到光以及光强上升条件下的转录调控,对于宿主的高光响应同样具有重要作用,这表明双组分系统在多元抗逆中均有参与,可能成为未来工程改造的靶点。之前的研究都集中在单一胁迫,而在规模化应用过程中,通常面临多种胁迫,因此鉴定多元逆境响应的元件更加重要。2020年,Guyet等[124]以海洋聚球藻WH 7803为对象,研究了其对光照、温度及紫外胁迫中两两组合胁迫下(低光低温、低光紫外、低光高温、高光紫外、高光低温、高光高温)的响应机制;研究发现,单一胁迫均对光系统造成损伤而紫外胁迫造成的损伤尤为严重;通过比较转录组学,鉴定到了一系列在组合胁迫下特异响应的基因,例如低温紫外和低温高光胁迫诱导下的DNA结合蛋白编码基因dpsA、多种组合胁迫下编码通用胁迫响应蛋白的基因uspG等,这些基因的鉴定为未来构建多元抗逆底盘打下了基础。
5.2 新型聚球藻底盘的鉴定及解析
近年来,随着研究的深入,不断有更优越的聚球藻底盘被鉴定,一方面这些菌株作为新型底盘可能更具优势,另一方面对这些底盘的解析可发掘高效元件用于理性改造其他聚球藻底盘。聚球藻UTEX 2973是2015年被报道的1种具备快速生长能力且耐受高温(42℃)高光[2000 μmol/(m2·s)]的蓝细菌底盘,其与聚球藻PCC 7942基因组相似度高达98%以上[56];聚球藻UTEX 2973倍增时间最短可达1.5 h,因此有可能成为更有应用前景的蓝细菌底盘[125]。前期工作通过光合参数测定、代谢流模型及转录组学等解析了聚球藻UTEX 2973与聚球藻PCC 7942间的差异,发现聚球藻UTEX 2973中光合系统I含量增加了1.6倍,细胞色素b6f含量增加了1.5倍,质体蓝素含量增加了2.4倍,使得菌株具备更强的光合及固碳能力[57,125-126]。聚球藻UTEX 2973虽然与聚球藻PCC 7942高度同源,但丧失了天然吸收外源DNA的能力从而限制了基因操作的便捷性。此后,与上述两底盘基因组相似度达83%的另一底盘——聚球藻PCC 11801被鉴定和解析。聚球藻PCC 11801可耐受超过38℃的温度及超过400 μmol/(m2·s)的光照;在1%CO2、1000 μmol/(m2·s)条件下倍增时间可达2.8 h,更重要的是,其关键中间代谢物水平较高且在高CO2和高温条件下生长速度更快,因此有可能成为户外培养和最终应用于生物炼制的有吸引力的底盘[127]。对于蓝细菌的规模化培养将耗费大量的水资源,采用海水培养将节约淡水资源,因此发掘优势海洋蓝细菌底盘十分必要。聚球藻PCC 11901是2020年被报道的1株新型海洋蓝细菌底盘,其在41°C、500 μmol/(m2·s)及1% CO2条件下倍增时间为2 h,并且干重高达33 g/L,同样有望成为新兴的蓝细菌底盘[55]。目前围绕聚球藻PCC 11801及聚球藻PCC 11901的解析工作开展较少,未来对其代谢模式及基因组的发掘工作将有助于发掘耐受高温、高光及高盐等的模块用于改造其他聚球藻底盘。
5.3 聚球藻底盘抗逆能力的定向改造
聚球藻UTEX 2973已具备高温高光的耐受能力,但其耐盐性能相对较低。为了提高底盘的耐盐能力,Cui等先后在聚球藻UTEX 2973中通过引入外源转运蛋白及渗透相溶性物质的策略进行探索:通过分别表达21个外源Na+/H+相关的转运蛋白并在盐胁迫下进行筛选,发现3个Mrp逆向转运蛋白可显著提高宿主的耐盐性,其中聚球藻PCC 7002来源的Mrp蛋白可使聚球藻UTEX 2973抗盐性提高57.7%[128];通过在聚球藻UTEX 2973中引入渗透相溶性物质甘油葡萄糖苷的合成途径,底盘抗盐性能提升了62%[129]。这些工作为提供更具环境鲁棒性的聚球藻底盘打下基础。考虑到聚球藻UTEX 2973与聚球藻PCC 7942间的高度同源性,利用前者优势模块对后者进行改造引起广泛关注。在解析聚球藻UTEX 2973基因组差异的基础上,Lou等[130]率先在聚球藻PCC 7942中引入聚球藻UTEX 2973中的差异基因并成功鉴定到后者中的ATP合酶亚基(AtpA)的突变是造成二者对高光高温耐受能力差异的最主要因素,通过在聚球藻PCC 7942中引入突变后的atpA可显著提升其高温高光耐受能力。随后Ungerer等[81]利用基因编辑的策略逐步在聚球藻PCC 7942中引入其与聚球藻UTEX 2973的差异基因,最终获得3个造成二者表型差异的基因。单基因或少数基因难以实现菌株的全局性变化,而适应性进化通过不断增加筛选压力,可富集有利突变,实现基因组的全局调整从而使得底盘抗逆能力得到稳定提升。在近期的工作中,Srivastava等[104]通过100代的连续进化,将聚球藻PCC 11801对正丁醇、2,3-丁二醇及乙醇的耐受能力分别提升至5 g/L、30 g/L及32 g/L,并发现了若干关键突变基因例如编码翻译起始因子编码蛋白rpoB及ABC转运蛋白编码基因等,这些基因未来也可用于其他聚球藻底盘的抗逆改造。
目前,具备多元抗逆能力的聚球藻底盘仍旧较少,如何鉴定、解析及构建多元抗逆鲁棒性底盘,可从以下几个方面思考(图4):
(1)新型底盘的发掘及解析聚球藻PCC7942、聚球藻PCC7002和集胞藻PCC6803作为经典的蓝细菌菌种被广泛用于合成生物学研究,然而作为工业底盘进行规模化应用仍有所欠缺,目前对于天然的新型蓝细菌菌株的鉴定已发掘了包括聚球藻UTEX 2973、聚球藻PCC 11801及聚球藻PCC 11901等更具优势的底盘,有望促进蓝细菌的规模化应用,未来,鉴定更多的底盘并对其进行机理解析将有助于对传统底盘的改造,同时开发配套的遗传工作工具也将助力新型底盘的开发和使用。
(2)多维定向进化定向进化虽然需要较长时间,却是获得鲁棒性底盘的最有效方式之一,目前针对聚球藻的定向进化工作相对较少,未来可首先围绕不同胁迫对聚球藻进行定向进化获得耐受性底盘,随后在获得单一胁迫耐受底盘的基础上继续进行多维进化从而获得多元抗逆底盘。
(3)理性设计现有的系统生物学工作已发掘了诸多与胁迫响应相关的基因,如何把这些关键基因有机整合对聚球藻底盘进行理性设计十分关键,在未来需要结合生物信息学理性分析代谢网络进行关键基因的整合从而助力多元抗逆底盘的构建。
6 聚球藻细胞工厂
自1979年聚球藻被发现以来,其生理、生化系统发育及分子生态学等方面取得了一系列重要进展。随着我国可持续发展战略的加速推进和CO2减排的迫切需求,绿色生物制造产业正在全面拓展与提升。其中将聚球藻开发成为高效光驱固碳细胞工厂,使其利用光能将CO2直接转化为生物基化学品,在绿色生产的同时助力碳中和目标的实现,成为极具前景的研究方向。
6.1 大宗化学品
2,3-丁二醇是极具应用潜力的平台化合物,从丙酮酸开始,2,3-丁二醇可以通过乙酰乳酸合成酶,乙酰乳酸脱羧酶和乙醇脱氢酶的催化合成来实现。乙酰乳酸合成酶催化两个丙酮酸分子缩合成一个乙酰乳酸,然后乙酰乳酸脱羧酶使其脱羧生成乙酰丙酮,最后一步用乙醇脱氢酶将乙酰丙酮还原为2,3-丁二醇。Oliver等[131]在聚球藻PCC 7942中进行了生产实验,20 d后2,3-丁二醇的产量达2.38 g/L。Li等[132]以聚球藻PCC 7942为底盘构建异丁醇产生菌株,通过敲除糖原合成途径中的葡萄糖-1-磷酸腺苷转移酶,使52%的碳流量被重定向到异丁醇生物合成途径,产量达550 mg/L。Lan等[133]在聚球藻PCC 7942中构建产3-聚羟基丁酸的两种途径,一种是丙二酰辅酶A依赖途径,3-聚羟基丁酸的产量最高达665 mg/L,另一种β-丙氨酸依赖途径产量稍低,为186 mg/L。
乳酸是一种手性α-羟基酸,有两种异构体D型和L型,被广泛应用于化妆品、医药、化工、纺织、食品等行业。最近一种极具应用前景的多聚形式——聚乳酸有望成为生物基塑料的生物可降解替代品,它的一步法合成是利用脱氢酶将细胞内的丙酮酸转化为乳酸异构体。Li等[18]将来自保加利亚杆菌ATCC11842的D-乳酸脱氢酶进行突变,辅助因子由NADH逆转为NADPH,将该工程酶引入聚球藻PCC 7942中,构建了从CO2生成D-乳酸的高效光驱动系统,将乳酸的产量提高了3.6倍以上。Wang等[41]以聚球藻PCC 7942为底盘过表达甘油-3-磷酸酶构建基因工程菌YW1,甘油产量达1.17 g/L,实现了利用CO2直接进行C3平台化学品的光合生产,并且在YW1菌株中扩展外源途径,进一步引导碳通量产生二羟基丙酮和3-羟基丙酸两种平台化学品,证明了由蓝细菌产生的甘油可以作为发酵原料。Roh等[134]在快速生长的聚球藻UTEX 2973中引入来源于罗尔斯通氏菌H16(Cupriavidus necatorH16)的phaCAB基因构建产β-聚羟基丁酸生产菌株,工程菌的产量达420 mg/L。
6.2 高值化合物
蓝细菌由于可以解决生物法制备天然产物所面临的植物酶源适配性、还原力的供应和昂贵底物的依赖等问题,因此成为植物天然产物生产的理想平台,已经被用来生产萜类和苯丙烷类等天然产物(表2)。Ni等[42]在光合微生物聚球藻PCC 7942中构建了1个光自养合成平台,直接将温室气体CO2转化为白藜芦醇、柚皮素、双去甲氧基姜黄素、香豆酸、咖啡酸、阿魏酸。这6种天然高值产物可以进一步衍生出其他珍贵的极具价值的天然产物。该团队[43]还通过引入2-苯乙醇途径和1个人工的解反馈抑制模块,创建了1个代谢陷阱,将30%以上的碳源重定向到低流量的莽草酸途径,从而直接利用CO2高效合成芳香类天然产物。

表2 聚球藻细胞为底盘生产的产品Tab.2 Chemical production using Synechococcus strain as chassis
异戊二烯是重要的化工原料,可通过形成聚合体合成橡胶、塑料及萜类化合物[135]。Gao等[39]将不同来源的异戊二烯合酶引入聚球藻PCC 7942,发现蓝桉树(Eucalyptus globulus)来源的ispS比其他来源的基因在蓝细菌中可溶性表达更好;随后,他们利用动态代谢流分析揭示MEP途径的瓶颈,构建了异戊二烯焦磷酸异构酶(IDI)和IspS融合酶并高表达了1-脱氧-D-木酮糖5-磷酸合酶基因(dxs)和4-羟基-3-甲基-2-烯基二磷酸合酶基因(ispG),重组菌株可以在21 h内光合生产1.26 g/L异戊二烯。
Davies等[136]在聚球藻PCC 7002中表达了留兰香(Mentha spicata)的柠檬烯合酶基因或者巨冷杉(Abies grandis)的α-红没药烯合酶基因(bis),分别可以得到4 mg/L柠檬烯和0.6 mg/L红没药烯。Takahama等[137]在聚球藻PCC 7942表达了丁香假单胞菌(Pseudomonas syringae)中的乙烯形成酶基因(efe),光合合成了约512 μg/(L·OD·h)的乙烯。Jacobsen等[138]在聚球藻PCC 7002中表达了大肠杆菌的磷酸甘露醇脱氢酶基因(mtlD)和艾美球虫(Eimeria tenella)的甘露醇磷酸酶基因(mlp),每天可以光合生产0.15 g/L甘露醇。将糖原合成途径失活后,甘露醇的产量可以提高3.2倍。
6.3 光驱动细胞工厂新策略
微生物共生在多种生态系统中发挥着重要作用,是当前正在兴起的一种新的新的合成生物学策略,在化学品的生物生产效率提升方面有独特的潜力。Smith等[139]研究了光合自养的聚球藻PCC 7942与重氮营养型固氮菌共培养情况,提出了交互取食(cross-feeding)模型。他们用固氮菌和聚球藻构建了一种新的共培养微生物体系,可在无固定碳与固定氮的条件下生长。这个共培养体系在无聚球藻条件下不能生长,两种菌也无法独自在没有固定的碳或氮的情况下生长。这个新体系具备直接利用空气、水、磷酸盐、微量金属和阳光生产工业产品的潜力,如生产聚羟基丁酸(PHB)和海藻酸盐。Weiss等[140]利用上述产蔗糖蓝细菌与异养盐单胞菌(Halomonas bolviensis)共培养,催化低价值碳水化合物转化生产高价值化合物。他们实现了一种生物塑料前体PHB的合成。他们同时证明海藻酸盐包裹聚球藻可提高蔗糖外排量,并增强共培养稳定性,最终PHB累积量可达细胞干重的31%,产率可达28.3 mg/(L·d)。这种共培养方法达到或超过了那些传统工程蓝细菌单一培养技术。更重要的是,这种方法能够抵抗外来微生物的污染,在不用抗生素或其他化学选择压力情况下,可连续生产超过5个月。
纳米技术与合成生物学的结合是光驱动细胞工厂发展的一种新策略。这个方法能够通过纳米颗粒的加入改变蓝细菌NADPH的供给,从而改善细胞工厂的性能。Velmurugan等[141]研究了金属氧化物对集胞藻产乙醇的影响,发现金属氧化物有可能在电子供体存在下产生NADPH,从而改善蓝细菌的生长和乙醇产量。这种乙醇合成的增强可以归因于乙醇合成途径中NADPH可获得性增加以及相关碳代谢途径的重新定向。工程菌株在最优光照强度和添加NADP与MgO条件下,可在25 d内积累乙醇5100 mg/L,比对照高2倍。该研究表明了用金属氧化物介导的蓝细菌胞外NADPH再生并增加细胞工厂产量的可行性。
7 总结
在“碳达峰”“碳中和”的“双碳”目标的导引下,开发高效、低成本绿色环保的新技术是至关重要的保障。蓝细菌细胞工厂由于自身特点在生产能源、制造非能大宗化学品、消除碳排放方面都具有独特的优势和巨大的潜力。在当前的“双碳”背景下,蓝细菌合成生物学面临着新的机遇,正在迎来新一轮的发展浪潮。聚球藻作为蓝细菌底盘典型代表,在多样性、适应性、生长代谢潜能、基因操作技术成熟度等方面都有很大的潜在优势。聚球藻底盘开发的挑战在于其生产强度和抗逆能力不能满足应用的需求。在聚球藻的底盘化开发中,应该瞄准效率和抗逆的核心问题,在光能捕捉、碳固定、生长速率、抗逆、进化、高效使能技术等方面重点攻关寻求突破,以充分挖掘释放聚球藻的代谢潜能。
