调控工程在光合蓝细菌中的应用
2022-12-14董正鑫孙韬陈磊张卫文
董正鑫,孙韬,陈磊,张卫文
(1天津大学化工学院合成微生物学实验室,天津 300072;2天津大学生物安全战略研究中心,天津 300072;3教育部系统生物工程重点实验室,天津 300072;4教育部合成生物学前沿科学中心,天津 300072;5化学化工协同创新中心,天津 300072)

化石燃料仍是当前人类社会生活依赖的主要能源,每年由化石燃料所产生的CO2超过300亿吨[1],CO2的过度排放加剧了温室效应,造成全球气候变化,甚至威胁人类生存环境。此外,化石燃料为不可再生资源,其大规模消耗带来潜在的能源危机,据估算全球化石燃料可能在50~100年后耗尽[2]。在能源与环境问题双重压力的背景下,开发清洁能源、改变能源结构迫在眉睫。我国政府于2020年第七十五届联合国大会提出,CO2排放量在2030年前达到峰值,争取在2060年前实现碳中和。在随后的2021年国务院政府工作报告,以及中央财经委员会第九次会议中均制定了相关政策。要实现“碳达峰”和“碳中和”的目标,将大气中的CO2重新转化为燃料或化学品从而实现CO2资源化利用,无疑是一举两得的策略。2018年,中国科学院液态阳光课题组施春风教授等[2]提出利用太阳能、CO2和水生产绿色燃料的“液态阳光”策略,以太阳能为驱动实现CO2资源化利用,更为理想地解决能源问题与CO2排放问题。在较低营养条件下,光合蓝细菌能够在太阳能驱动下,以CO2和H2O为原料合成有机物。随着合成生物学发展,已实现利用光合蓝细菌作为生物底盘进行近百种燃料和化学品的绿色生物合成,也被认为是实现“液态阳光”的技术方案之一[3]。因此,基于光合蓝细菌发展“液态阳光”技术,实现CO2的资源化利用,有助于解决能源问题与环境问题,助力“碳达峰”和“碳中和”的实现。
近年来,随着科研人员的努力,以光合蓝细菌为生物底盘已实现了近百种生物燃料和化学品的合成[4-6]。例如,在集胞藻PCC 6803中正丁醇在28 d产量达到4.8 g/L[7],在聚球藻PCC 7002中烷烃产量达到了7.5 mg/g[8],在聚球藻UTEX 2973中3-羟基丙酸产量达到68.29 mg/L[9],聚羟基丁酸酯在集胞藻PCC 6803中能够占细胞干重的81%[10]。这些生物燃料与化学品在光合蓝细菌中成功生产,表明光合蓝细菌作为“细胞工厂”进行高附加值化学品生产具有可行性,且在生物塑料生产方面具有天然优势。
尽管以光合蓝细菌为底盘进行了近百种化学品的生产,但其工业化程度较低。其主要原因为光合蓝细菌生长速度慢、生物量低和鲁棒性差等。例如,集胞藻PCC 6803的倍增时间为4.3 h[11],聚球藻PCC 7942的倍增时间为4.9 h[12],而大肠杆菌的倍增时间为20 min[13],酿酒酵母的倍增时间大约为90 min[14]。工业化过程中光合蓝细菌在大规模培养过程中要面临环境变化引起的高光、高温、低温、高盐以及高碱等非生物胁迫[15-16],限制其生长及最终生物量,同时在产品生产过程中,丁醇[17]、3-羟基丙酸[18]、乙醇[18]等产品的积累也会抑制其生长。光合蓝细菌基因操作后不能脱除抗性标签,限制了光合蓝细菌基因改造的程度,难以实现菌株生产、生长以及耐受的同时优化。因此,为了对光合蓝细菌细胞工厂进行更深层次优化,寻找新的解决方案势在必行。
调控工程(regulatory engineering)基于天然调控系统,通过对天然调控系统元件进行设计,实现对调控系统的信号感知、信号转导或调控因子作用过程的干预,完成对多基因表达水平的调控,最终实现对全局代谢网络的调控。在大肠杆菌生产靛蓝的研究中,Chen等[19]采取共培养的生产方式,将靛蓝合成前体物质色氨酸的生产优化与靛蓝合成途径优化分别在两个菌株中进行,其中色氨酸生产途径优化包含5个基因的过表达,靛蓝合成途径包含1个基因的过表达,最终产量达到55.4 mg/L。由此可见,微生物中高附加值产品的生产往往需要对整体代谢网络进行重新调整,这一复杂过程的实现需要同时对多个基因的表达水平进行调控,而通过对相关基因进行逐一调控费时费力,效率不高,为平衡菌株生长与产品产量需将前提供应与生产在两株菌中进行。在上述研究基础上,Chen等[19]对靛蓝生产菌株中编码RNA聚合酶的α亚基的基因rpoA进行随机突变、筛选,靛蓝产量达到了80.6 mg/L。此外,基于调控工程实现菌株对代谢网络进行自适应调控是实现智能化细胞工厂的关键,Jia等[20]在大肠杆菌中使用RNA温度响应开关与群感系统结合组成的基因线路,控制不同温度下表达不同的热耐受基因的表达,实现了大肠杆菌的梯度耐热。Bao等[21]用群感系统控制调控RNA,将生长过程与生产过程分离,低密度菌体时不对生产途径的竞争途径进行抑制,保证底盘的快速生长,当菌体密度达到阈值后,群感系统控制调控RNA开始表达,对产品生产的竞争途径进行抑制,在大肠杆菌生产松萜的应用中,松萜产量提高了365.3%。在异养微生物中对调控系统的研究充分说明了调控工程的应用潜力,在光合蓝细菌中有望通过调控工程取得更大研究进展。
目前,在蓝细菌中基于合成生物学方法进行化学品生产以及底盘鲁棒性提高的相关报道已有许多[5,17,22],在取得进展的同时也面临着很多挑战。以光合蓝细菌中异丁醇生产为例。在聚球藻PCC 7942中,Li等[23]将糖原合成关键基因glgC进行敲除后,使更多碳源流向异丁醇合成途径,在50 mmol/L NaHCO3的条件下异丁醇产量达到了550 mg/L。为进一步提高聚球藻PCC7942中异丁醇的产量,Wu等[24]在2% NaCl培养条件下培养工程菌株,在盐胁迫条件下促进了工程菌株脂质降解,增加了异丁醇合成所需的NADH,并增加了膜通透性,有助于异丁醇排出,降低异丁醇毒性,最终异丁醇产量达到637 mg/L。在加盐培养环境下,光合蓝细菌底盘整体代谢模式和膜特性的改变有益于异丁醇的生产,表明了光合蓝细菌在全局水平调控有进一步提高异丁醇产量的优化空间。值得注意的是,加盐培养条件尽管提高了异丁醇产量,但同时抑制了菌株生长,异丁醇产量的提高,也会对细胞产生毒性。从全局代谢调控的水平上对响应盐信号后对异丁醇生产有益的模块给予一个模拟盐信号刺激,而不利于生长以及生产的盐响应模块不能接受该模拟信号,同时加强异丁醇耐受调控模块,提高底盘对异丁醇的耐受性,从而进一步提高异丁醇产量是一个较为理想的状态。因此,发展调控工程实现对全局代谢网络的精准调控对蓝细菌细胞工厂的发展很有必要。
为了应对环境胁迫,细胞会通过整体代谢网络的改变来实现对于代谢的精准调控。细胞接收刺激信号后会通过胞内的调控系统进行一系列复杂过程对相关基因进行差异性表达,如图1所示。细胞对环境适应过程往往是多基因差异性表达的结果。例如,在单一盐胁迫条件下,集胞藻PCC 6803约有100个基因参与到这一调控过程[25]。鉴于调控系统的精准性和广泛性,调控工程有望实现基因的多层次调控以及代谢流重新分配,进一步提高蓝细菌生产能力。近年来,围绕光合蓝细菌调控工程在非生物胁迫以及代谢调控方面的研究取得诸多进展。为此,本文对蓝细菌中调控工程应用与前景进行阐述,对蓝细菌底盘构建的挑战进行了总结和分析,以期促进鲁棒性蓝细菌底盘的构建及其未来的规模化应用。

图1 蓝细菌调控系统Fig.1 Cyanobacterial regulatory systems
1 蓝细菌中代表性的调控系统
蓝细菌在自然界中分布广泛,包括海洋、陆地和河流等,能够适应不同的环境以维持生存[26]。为维持细胞稳态,处于不同环境下的蓝细菌必须能够接收外界环境条件变化的信号,并通过调控系统完成靶基因差异性表达,实现细胞代谢模式的精准改变。蓝细菌中能够在不同环境下实现全局代谢模式精准改变的调控系统引起了人们的广泛兴趣。目前,蓝细菌中广泛研究的调控系统主要包括双组分信号转导系统(two-component systems,TCS)、σ因子和sRNA调控系统,在适应环境胁迫过程中扮演重要角色[27-29]。
1.1 TCS在环境适应中的作用
双组分调控系统在大肠杆菌、枯草芽孢杆菌、噬菌体、酵母、植物以及低等动物中均有发现,但在细菌中最为常见,尤其是在革兰氏阴性菌中[30]。经典的TCS主要包括负责感知并转导信号的组氨酸激酶(histidine kinases,Hik)与接收信号并改变胞内生理机能的响应调控蛋白(response regulators,Rre)两部分。TCS信号转导过程如图2所示,Hik接受环境刺激后,以三磷酸腺苷(ATP)为底物,将磷酸基团转移到组氨酸残基,进行自磷酸化,形成高能量磷酸基团,随后磷酸基团转移到Rre的天冬氨酸残基。Rre构型发生改变后,结合到调控基因的启动子区域,完成信号转导与调控基因差异表达[31]。目前,在多种微生物体内发现了TCS以及不同TCS的响应条件,例如酵母热休克响应机制[32]、大肠杆菌酸适应机制[33]、谷氨酸棒状杆菌缺氧调节机制[34]等。
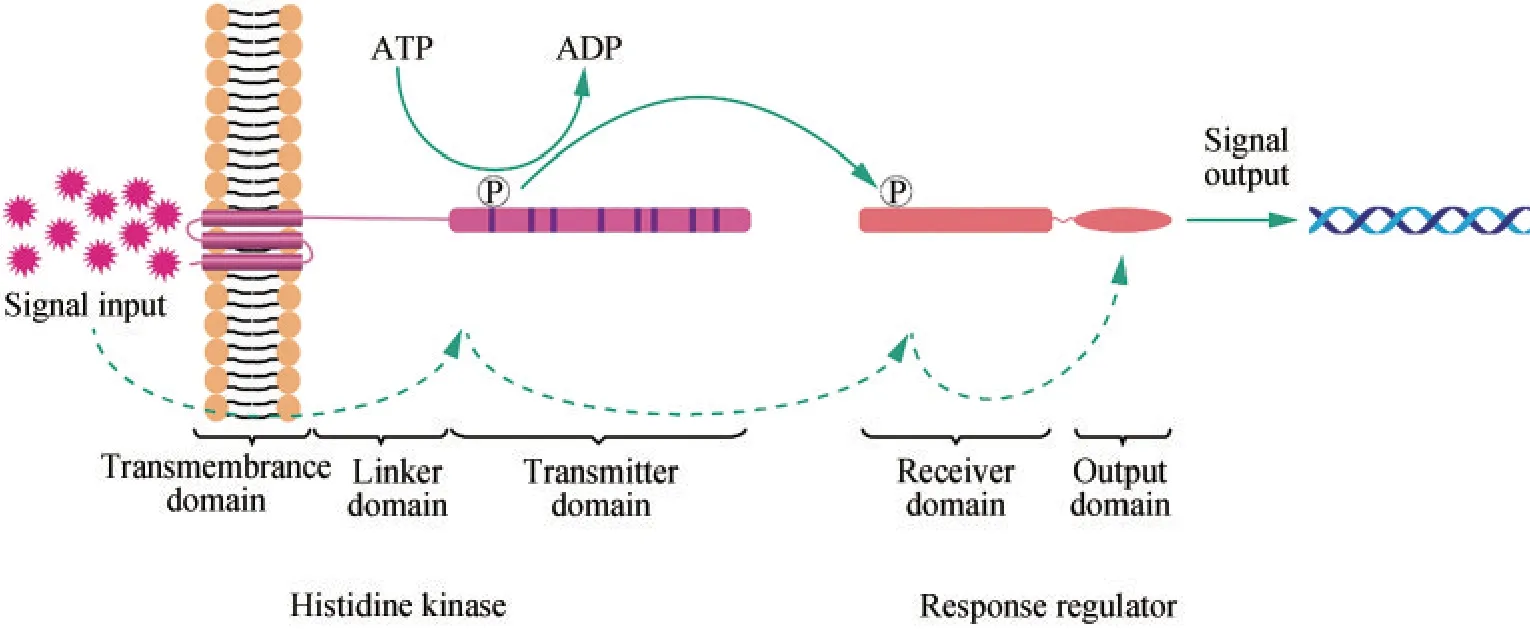
图2 TCS信号转导过程Fig.2 TCS signal transduction process
光 合 蓝 细 菌 中TCS的 研 究 在Kaneko等[35]1996年完成集胞藻PCC 6803的全基因组测序后,得以快速发展。在聚球藻PCC 6301中鉴定出37个与TCS相关的基因,而这株菌与模式菌株聚球藻PCC 7942基因组非常相似[36]。基因组分析后预测,在集胞藻PCC 6803中至少有90个基因与TCS有关[37],但目前大部分TCS基因的调控功能尚不明确。集胞藻PCC 6803全基因组测序的完成和TCS相关基因的预测让TCS突变体库的构建成为可能。作者课题组通过在集胞藻PCC 6803中构建了44个Rre缺失突变库,鉴定出与丁醇耐受相关的响应调控蛋白Slr1037[38]和与酸耐受相关的响应调控蛋白Slr1909[39],并对Rre缺失突变的中心碳代谢以及能量代谢进行分析[40-41]。随着蓝细菌中TCS研究工作的开展,其调控机制与靶基因被解析清楚[27],揭示了TCS在调控网络中的重要地位,为在蓝细菌中使用TCS工程,实现精确的代谢网络调控提供了理论支持和参考依据。
1.2 σ因子的分类及其调控过程
σ因子是原核生物体内一类调控蛋白,参与RNA聚合酶(RNAP)全酶的形成[42]。σ因子调控过程如图3所示,RNAP核心酶复合体与σ因子结合后形成全酶,在σ因子的引导下,RNAP锚定到特定基因的启动子区域,启动基因转录。启动特定基因表达的σ因子并非是特定的,取决于启动该基因表达的环境信号。在不同环境下,激活不同的基因表达模式,维持细胞稳态,以应对环境变化。
RNAP的核心酶由6个单独的亚基构成[43],如图3所示。RNAP的核心酶与σ因子结合形成RNAP,进而具备激活靶基因转录的功能。大肠杆菌中σ因子主要分为RpoD(σ70)与RpoN(σ54),而蓝细菌中没有发现与RpoN(σ54)具有相似结构的蛋白[44],仅存在RpoD(σ70)家族的σ因子。依据结构差异σ70家族主要分为4个亚家族。第1组σ因子称为初级σ因子,分为4个结构部分:σ1、σ2、σ3、σ4,在细菌中广泛存在,负责组成型基因的转录,这些基因在细胞生长过程中具有重要作用[45]。第2~4组σ因子称为选择性σ因子,具有特定的功能。初始状态抗σ因子与选择性σ因子结合,抑制选择性σ因子发挥作用,在接收到环境变化信号后,选择性σ因子被释放,与RNAP结合激活靶基因转录[46]。这类σ因子如同分子开关,能够引导RNAP开启或关闭一类基因的转录。第2组σ因子与第1组σ因子在结构上相差最小,仅缺少σ1.1区域,大部分的选择性σ因子属于第2组,能够与第1组σ因子竞争调控某些基因的表达[47]。第3组σ因子主要调控初级σ因子不参与调控的基因,在结构上与第1组σ因子相比缺少了σ1区域。第4组σ因子称为胞质外作用σ因子,负责感应胞质外环境变化,能与第1组σ因子在调控基因上产生竞争,在结构上与第1组σ因子相比缺少了σ1与σ3区域[48]。
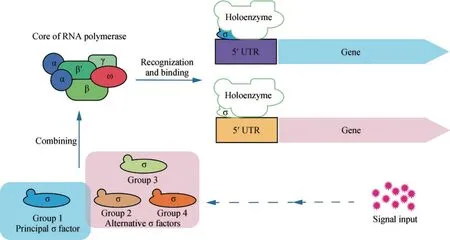
图3 σ因子调控过程Fig.3 Sigma factor regulation process
σ因子作为一种胁迫响应元件,在面临环境胁迫时,能够调控代谢途径,以应对环境变化。因此,在以光合蓝细菌为底盘进行产品生产的调控中,使用σ因子工程调控靶基因的转录具有可行性。目前,多种σ因子在蓝细菌中的调控作用已被报道,例如SigB能够响应热刺激、盐胁迫以及温度等环境变化[49-50],SigC与热适应相关[51],SigD与SigE能够响应光诱导[50],SigF与盐胁迫适应以及分泌系统相关,缺失SigF的菌株在盐胁迫条件下出现严重缺陷[52-53]。在聚球藻PCC 7942中,4个σ因 子(RpoD2、RpoD6、RpoD5和SigF2)在RpaA的调控下调控生物钟[54],σ因子SinA与聚球藻的热适应相关[55]。随着蓝细菌中σ因子研究的进行,其调控过程和靶基因相继得到解析,有助于对蓝细菌σ因子调控网络的理解,为蓝细菌中σ因子调控工程提供参考。
1.3 sRNA的分类及其调控过程
生物体内除常见的mRNA、tRNA、rRNA外还存在具有调控功能的非编码RNA,在原核生物体内这些具有调控功能的非编码RNA长度通常为50~500个核苷酸[29],一般将长度大于200个核苷酸的非编码RNA称为长链非编码RNA[56],这些具有调控功能的调控RNA统称为sRNA。其调控过程如图4所示。sRNA通常不具有开放读码框,不编码蛋白质,部分sRNA可直接与DNA结合,抑制转录过程,大多数情况下通过完全或不完全的碱基互补配对识别并结合到目标mRNA,具有抑制翻译过程或维持mRNA稳定的作用,参与到基因的转录后调控阶段[57]。sRNA参与调节的另一种形式是与蛋白结合改变蛋白结构从而调控蛋白的催化活性[58]。sRNA在蓝细菌调控网络中占据非常重要的地位,在集胞藻PCC 6803中,通过对转录组进行分析,推测sRNA调控了集胞藻PCC 6803中10%的基因[59]。sRNA参与光合蓝细菌在多种环境下的响应调控,例如CoaR参与丁醇胁迫条件下的调控[60],RblR参与光合作用过程调控[61],Nc117参与短链醇耐受调控过程[62]等。

图4 sRNA调控过程Fig.4 sRNA-mediated regulatory process
在集胞藻PCC 6803、聚球藻PCC 7942和聚球藻UTEX 2973中,通过比较分析发现诸多潜在调控RNA位点[63-64],为后续sRNA的研究提供了研究方向。sRNA参与了蓝细菌在多种环境下调控过程,在盐、碱、热、低营养等环境刺激下,转录组具有明显差异,其中的潜在sRNA也发现具有明显不同[65-66],揭示了sRNA在蓝细菌适应环境变化中具有重要作用。sRNA在不同环境条件下的表达模式也受到整个调控网络的控制,在同一环境条件下,存在多种调控方式的共同作用,通过其他形式调控sRNA的表达量来进一步调控效应蛋白的表达[67]。
2 蓝细菌的调控工程
以蓝细菌为底盘进行各种化学品的生产近年来已取得较大进展,但蓝细菌的大规模培养以及产率问题严重制约着工业化进程。为进一步提高蓝细菌底盘的鲁棒性以及产品产率,一方面要寻找性能更为优异的蓝细菌底盘[68-69],而另一方面要对蓝细菌代谢网络进行优化。局部代谢调控在蓝细菌代谢工程中已取得显著成果,为进一步提高蓝细菌底盘鲁棒性优化代谢网络,以蓝细菌调控系统为着手点,进行蓝细菌全局范围内的代谢调控是进一步提高蓝细菌耐受性以及产品产率的重要方法[70-73]。
2.1 TCS工程在蓝细菌中的研究与应用
TCS作为细胞内具有感知外部环境变化以及信号转导功能的系统,调控代谢网络以适应环境变化方面的重要性毋庸置疑。目前,在蓝细菌中已对多种TCS在不同环境下的功能进行了鉴定,其中部分TCS已作为工程方法在蓝细菌中进行了应用。
2.1.1 TCS工程在金属离子调控中的作用
蓝细菌正常生理活动需要一定量金属离子的参与,但过量的金属离子会对细胞产生毒性。例如,铜离子具有维持细胞色素氧化酶和质体蓝素的正常功能的作用,在集胞藻PCC 6803中,Hik31-Rre34具有监测胞内铜离子浓度、调控铜离子转运蛋白的功能。Hik31能够特异性响应铜离子并与铜离子结合,监测胞内铜离子浓度,胞内铜离子浓度升高后,Hik31将信号转导至Rre34,Rre34结合到铜离子转运蛋白copBAC的启动子区域,提高CopBAC的表达量,进而降低胞内铜离子浓度[74]。copM与Hik31-Rre34在同一操纵子,具有结合一价铜离子与二价铜离子的能力,在Rre34缺失突变体内过表达CopM能够缓解铜离子敏感表型同时胞内铜离子浓度恢复到正常水平[75],而Rre34能够结合CopM-Hik31-Rre34操纵子启动子区域,调控该操纵子的表达[74]。
因工业生产过程中镉的使用,镉离子在环境中广泛存在,且比铜离子毒性更强。Sll0649是集胞藻PCC 6803中的一个响应调控蛋白,参与镉离子耐受调控过程,同时与胞内Cu2+、Cd2+、Fe2+、Mn2+、Zn2+等多种二价金属离子稳态相关,能够结合到sll1598和slr0798(分别编码Mn2+和Cu2+转运蛋白)的上游区域,敲除sll0649基因后,菌株会对上述金属离子更加敏感[76]。因此,Sll0649在维持集胞藻PCC 6803胞内二价金属离子稳态方面扮演重要角色,为TCS工程调控蓝细菌胞内二价金属离子稳态提供了方向。
2.1.2 TCS工程在抗紫外辐射调节中的作用
太阳光中的紫外光(UV),尤其是其中的UV-B辐射(280~320 nm),对蓝细菌的生存提出挑战。类菌胞素氨基酸(MAA)具有吸收UV-B辐射、保护细胞的作用[77],在蓝细菌受到UV-B辐射时能够在胞内积累且有助于细胞脱水后恢复。在Nostoc flagelliformeCCNUN1中,对参与到紫外辐射信号转导过程的LuxR家族的Rre OrrA进行过表达后,提高了MAA合成相关基因的表达量,菌株的UVB辐射耐受性与脱水后恢复能力增加[78]。该研究在Nostoc flagelliformeCCNUN1中鉴定出了由mysC1、mysC2、mysA、mysB和mysD组成的MAA生物合成基因簇,并证明MAA的生物合成响应UV-B辐射,且响应过程受到Rre OrrA调控,进一步确定了Rre OrrA能够作用到MAA合成基因的启动子位置。MAAs类物质在提高蓝细菌抗干旱以及耐辐射能力方面具有极大潜力,同时可以作为具有高附加值的防晒霜有效成分进行生产[79]。
2.1.3 TCS工程调控蓝细菌丁醇耐受
TCS工程能够提高蓝细菌底盘对毒性产品的耐受性。在蓝细菌进行丁醇生产的过程中,丁醇作为产物对蓝细菌生产具有毒性,限制蓝细菌的生长,进一步限制了其产量的进一步提高,如何提高蓝细菌对丁醇的耐受性成为提高丁醇产量的关键。
在集胞藻PCC 6803中通过对Rre缺失突变库进行筛选,筛选出Slr1037与Sll0039缺失突变体对丁醇更为敏感[38,80]。在集胞藻PCC 6803中,对编码响应调控蛋白的slr1037和sll0039基因分别进行过表达,突变菌株对丁醇耐受性均有所提高,当这两个基因同时过表达时,丁醇耐受性较野生型提高133%[37]。值得注意的是,在集胞藻PCC 6803中丁醇耐受性不仅受到Rre Slr1037与Sll0039的调控,还受到sRNA CoaR的调控[60],其中CoaR对丁醇耐受有负调控效果,在slr1037的缺失突变体中抑制CoaR的产生能够恢复丁醇耐受性,通过蛋白组学比较发现Rre Slr1037与sRNA CoaR存在潜在的共同调控靶点[67]。由此可见,蓝细菌对丁醇耐受性的调控是一个复杂过程,包含了至少两种调控方式,且两种调控过程存在串扰。
2.1.4 TCS工程调控蓝细菌盐耐受以及碳代谢
盐胁迫的改善对蓝细菌使用海水进行大规模养殖具有非常重要的意义[22],同时盐胁迫条件下的代谢模式有利于一些产品例如蔗糖、甘油葡萄糖苷(GG)的生产[24],而盐胁迫下调控系统及其代谢模式的研究有助于调控工程在蓝细菌中的使用。在集胞藻PCC 6803盐胁迫条件下TCS的研究中,通过对Hik缺失突变体库进行筛选,发现了Hik33、Hik34、Hik16和Hik41能够感知盐胁迫环境,控制了集胞藻PCC 6803中20%与盐诱导基因的表达,其中Hik33感知钠离子而Hik16与Hik41仅感知NaCl[81]。Hik34在感知盐胁迫条件后能够将信号传递给Rre1,进一步调控乙醇脱氢酶AdhA的表达[82]。此外通过对潜在丝氨酸/苏氨酸激酶突变体库筛选后,发现SpkG也具有感知盐胁迫的功能[83]。
研究发现,盐胁迫条件下Hik2与Hik34共同调控Rre1[84],而Hik2感受器受Na+的严格诱导[85]。盐胁迫条件下细胞容易发生聚团现象,形成生物膜抵抗外界环境影响,在集胞藻PCC 6803中Hik36-Hik43和Rre6组成的双组分系统能够感知外部环境变化后提高胞外多糖以及抑制与菌毛形成相关蛋白PilT2的合成,促进生物膜的形成[86]。
在聚球藻PCC 7942中Synpcc7942_1125与Synpcc7942_1404基因缺失突变体能够增加盐耐受性,增加菌株内糖原的积累量,降低光损伤。有趣的是,Synpcc7942_1125与Synpcc7942_1404不调控蔗糖(可作为渗透保护剂)合成基因的表达,且双突变体不能进一步增加单突变体的效果[87]。在鱼腥藻PCC 7120中,Rre OrrA能接收盐胁迫信号,促进蔗糖的积累以维持渗透压的平衡,过表达Rre OrrA后提高了蔗糖的积累量[88]。同时,OrrA促进σ因子SigB2的产生,而SigB2进而促进蔗糖的积累。SigB2缺失突变体在盐胁迫初期,蔗糖积累延迟,证明其在盐胁迫响应初期具有重要作用[88]。由此可见,在不同胁迫时间段,应采用不同的调控策略以保证菌株的生存。此外,OrrA在干旱条件下同样具有信号转导调控基因表达的作用[89],表明其具有增加底盘多元抗逆的潜力。
目前,通过TCS工程方法,调节细胞代谢网络,优化产品产量已在蓝细菌中进行了初步应用。在集胞藻PCC 6803中,Rre37参与氮缺乏条件下的代谢调控,单独过表达Rre37能够改变参与三羧酸循环和丙酮酸代谢相关基因的表达[90]。最近报道,将Rre37与SigE在集胞藻PCC 6803中同时进行过表达能够提高琥珀酸产量,在黑暗厌氧条件下琥珀酸产量达到420 mg/L[91],为琥珀酸生产提供了一个良好的底盘。
2.2 σ因子工程在蓝细菌中的研究与应用
第1组σ因子与第2组σ因子在结构上非常相似,主要负责调控胞内组成型启动子控制的基因的表达,这些基因通常是细菌正常代谢所需的。在蓝细菌中,第2组σ因子往往参与到环境变化信号响应调控过程,如营养、光和温度等[27]。
2.2.1 σ因子工程在蓝细菌抵抗非生物胁迫中的作用
在集胞藻PCC 6803中,构建第2组σ因子的4种三重敲除菌株(ΔsigCDE、ΔsigBDE、ΔsigBCE、ΔsigBCD),在不同光照条件及盐胁迫条件下进行生长表型的测定,4种突变体在低光条件下生长速度降低,推测这4种σ因子可能参与了光适应调节模块。有趣的是,仅有SigB存在的突变体在盐耐受表型上较野生菌株有小幅度提高,说明SigB在盐适应过程中具有非常重要的作用[92]。在鱼腥藻PCC 7120中存在属于第2组σ因子的SigB2也能够响应盐胁迫信号,并参与渗透相容性溶质蔗糖的代谢调控,促进盐胁迫条件下蔗糖的积累[88]。更为有趣的是,在集胞藻PCC 6803中SigB还具有增加其他胁迫条件下菌株适应性的能力,仅过表达SigB显著提高了菌株热耐受与丁醇耐受,将46℃条件下细胞CFU(colony-forming units)值提高了20倍,在2.5%丁醇中处理1 h的条件下过表达SigB的突变株存活率提高了15倍[93]。
此外σ因子在蓝细菌适应氧化胁迫条件中均发挥着重要作用。在集胞藻PCC 6803中,第2组σ因子均参与氧化应激过程调控,其中SigB和SigD起主要作用,而SigC和SigE起次要作用,ΔsigBCE菌株在单线氧、高光诱导氧化胁迫和H2O2氧化胁迫条件下的生长优于对照,而ΔsigCDE菌株在H2O2氧化胁迫条件也较对照菌株也体现出生长优势,其主要原因是仅有一个第2组σ因子存在时,其表达量有所提高[51]。
2.2.2 σ因子工程调控蓝细菌的中心碳代谢
σ因子作为代谢调控工具已经在蓝细菌中有了初步应用。SigE在集胞藻PCC 6803中参与到碳代谢网络调控,在对sigE敲除突变株、sigE过表达突变株以及野生型进行蛋白组学分析发现,SigE具有调控糖原降解以及与光合作用相关蛋白丰度的功能[94]。在集胞藻PCC 6803中,SigE与Rre37共同表达时能够提高琥珀酸产量[91],单独过表达SigE增加了在氮饥饿条件下生物塑料聚羟基丁酸酯的合成[95]。SigE因子在蓝细菌中普遍存在,但在不同蓝细菌中扮演的调控角色有所差异,在鱼腥藻PCC 7120中的SigE与异形胞的形成相关,而在聚球藻PCC 7002中的SigE负责调控某些基因在平台期的特定转录[96-97]。
2.3 sRNA工程在蓝细菌中的研究与应用
非编码RNA在细菌体内大量存在,其中具有调控作用的sRNA还未完全解析。sRNA参与了基因表达的转录、翻译以及转录后多个过程的调控,对于胞内稳态的维持作用不言而喻。sRNA与mRNA相互作用的机制较为简单,已经在蓝细菌中开发出对应的调控工具[98]。
2.3.1 sRNA工程在Fe2+缺乏环境下的作用
水环境中铁离子缺乏往往是限制蓝细菌的生长条件之一,铁离子缺乏影响了光合反应中Fe2+或Fe/S复合物依赖性蛋白的活性。在集胞藻PCC 6803中,sRNA IsrR对在铁离子缺乏、高光胁迫以及氧化胁迫条件下积累的蛋白质IsiA进行负调控,过表达sRNA IsrR突变株在H2O2的条件下响应时间延长,而过表达sRNA IsrR的反义RNA的突变体的响应时间缩短[99-100],响应时间的减少更有利于菌株对环境的适应。
2.3.2 sRNA工程在蓝细菌光适应以及碳固定中的作用
光照条件影响蓝细菌光合反应过程,不同光照条件下参与光合反应的酶的表达量具有差异,这种差异的产生主要由不同光照条件下菌株对相关基因进行精确的差异性表达产生,这个调控过程有sRNA的参与。D1蛋白是光合系统Ⅱ的一个关键亚基,由psbA编码,调控psbA的表达是蓝细菌响应光照条件变化调节光合反应过程的一种方式。在集胞藻PCC 6803中,存在sRNA PsbA2R和PsbA3R,分别调控基因psbA2和psbA3的表达,光照条件下PsbA2R和PsbA3R上调,促进靶标基因的表达,而在黑暗条件下PsbA2R和PsbA3R下调,降低靶标基因的表达[103]。敲除PsbA2R后,psbA2的表达量较对照菌株下降了50%,光合系统Ⅱ的活性下降了15%[103]。
蓝细菌在自然界中不仅有黑暗和光照条件的变化,还要应对太阳直射产生的高光条件。因此提高蓝细菌高光耐受也是提高工程蓝细菌鲁棒性的一个重要方面。sRNA能够调节蓝细菌在不同光照条件下光合系统蛋白的表达量,在高光条件下起到光保护的作用。在集胞藻PCC 6803中,sRNA PsrR1在高光刺激后,能够在短时间内表达,结合到psaL、psaJ、chlN和cpcAmRNAs的核糖体结合区域,抑制mRNA的翻译,进而适应高光环境[104]。
sRNA还能够调控光合系统与碳反应之间的平衡。RuBisCO是光合生物体内非常重要的一种酶,能够催化CO2固定途径的第1步反应。在集胞藻PCC 6803中,sRNA RblR在高光条件下具有高表达量,能够通过碱基互补配对结合到编码了RuBisCO大亚基的rbcL基因的mRNA,增加其稳定性,进而促进RbcL的合成[61],增加CO2固定效率。高光条件下RuBisCO含量增加,促进CO2固定消耗光合系统产生的能量以及还原力,对维持整个系统的平衡具有重要的意义。
蓝细菌中同一种sRNA可能参与多种胁迫条件下的调控。在蓝细菌中sRNA Yfr1能够与编码钠离子依赖的碳酸氢盐转运蛋白sbtA基因的mRNA结合,抑制sbtA的翻译过程,将sRNA Yfr1敲除后,在正常条件下藻蓝蛋白与叶绿素a的含量降低,但能够正常生长,而在铁离子缺乏、盐胁迫、活性氧胁迫以及钙离子缺乏多种胁迫条件下生长受到抑制[105]。
2.3.3 sRNA工程在化学品生产优化中的作用
蓝细菌在进行化学品生产过程中,不仅要面临自然条件下的非生物胁迫,还要面临生产过程中代谢产物积累所带来的胁迫。在正丁醇生产过程中,随正丁醇产量的增加,对蓝细菌产生抑制作用,提高底盘正丁醇耐受性是进一步提高正丁醇产量的关键。在集胞藻PCC 6803中,过表达sRNA CoaR后,sRNA CoaR与辅酶A合 成相关的基因slr0847和slr0848的mRNA的启动子位置结合加强,沉默辅酶A合成相关的基因的表达,导致辅酶A积累量减少,同时降低了脂肪酸代谢和能量代谢,使菌株的正丁醇耐受性降低[60],而敲除sRNAcoaR能够提高其对正丁醇耐受性[67]。CoaR对辅酶A合成量的调控也证明了其在碳流调控方面同样具有潜力。
在集胞藻PCC 6803中,对sRNA Nc117进行过表达,提高了对短链醇的耐受性,而sRNA Nc117的表达促进了编码D-甘油-α-D-甘露庚糖1-磷酸鸟苷基转移酶基因slr0007的表达,进而促进LPS合成途径,推测LPS的合成是提高短链醇耐受性的原因[62,64]。
(5)加强缺陷处理后的养护,防止出现二次缺陷,已处理混凝土表面快要出凝时在表面涂刷一层养护剂,保证涂刷均匀,不漏刷。
3 挑战与展望
近年来合成生物学研究的发展极大促进了光合蓝细菌的应用基础研究。值得指出的是,有关蓝细菌细胞工厂构建及其挑战已有很多优秀的论文和综述发表[106-108],感兴趣的读者可以进行阅读。本文中,我们将聚焦在蓝细菌中应用调控工程的挑战与展望。
虽然不少TCS、σ因子以及sRNA的功能及其调控响应机制被逐渐定义,但尚不满足光合蓝细菌中调控系统发展的需要,仍有大量调控系统元件机器功能未表征。最新研究表明,在酵母中通过随机装配耐受相关抗逆基因线路、实验室进化和多步筛选得到了具有多重耐受性的菌株,实现智能抗逆菌株的构建[109]。而在光合蓝细菌中仍需研究不同环境下响应模块开发新的调控工具,以促进光合蓝细菌多元抗逆底盘的开发。以蓝细菌为生产底盘进行产品生产时,往往发现在某一胁迫环境下更加有助于化学品的生物合成,通过调节外部胁迫环境平衡生长与产量之间的关系可以取得较高产品产率[24,110],但当前调控工程在光合蓝细菌中对多基因精确调控的研究不足,很难开发和应用这样的调控工具。人工sRNA在光合蓝细菌中已有广泛应用,具有可编程性,极大便利了研究者的使用[111]。因此,为增加调控工程的灵活性,在光合蓝细菌中开展对调控系统功能蛋白工程改造的研究也是必要的。
3.1 调控系统功能的阐明
光合蓝细菌中调控系统功能未知是影响调控工程应用的主要障碍。对调控系统功能的研究主要包括两个步骤:①调控系统元件及功能预测;②对预测元件功能进行实验验证。
光合蓝细菌中调控系统组成部分繁多,逐一鉴定过于烦琐。借助生物信息学方法,对光合蓝细菌调控系统及功能进行预测,能够减少实验量,提高效率。筛选后的调控系统元件需要进行功能验证。在之前研究中,针对未知功能的调控系统元件构建突变体库[76,80,112],使用不同环境条件进行筛选确定不同调控系统元件的功能,但此方法筛选通量低。因此,如图5(a)所示,在光合蓝细菌中基于CRISPR技术,开发单碱基编辑和CRISPRi等技术,在光合蓝细菌中快速完成建库工作,有望实现对预测调控系统单元的快速筛选[113-115]。最后,通过对高通量筛选出的调控系统单元进行调控途径研究,解析调控系统单元在特定调控过程中的作用。
3.2 调控工程相关工具的开发
基于天然调控系统元件,设计基因线路,实现不同条件下特定代谢通路的激活[图5(b)],进一步开发能响应环境和生理变化对胞内能量、碳流进行分配,平衡生长与生产关系的智能细胞工厂。
研究得较为广泛的淡水蓝细菌的模式菌株集胞藻PCC 6803和聚球藻PCC 7942为多拷贝菌株,拷贝数与菌株生长周期和环境因素有关[116-118],而基因组拷贝数在菌株基因组改造、纯合工程菌株筛选中具有重要意义。在聚球藻PCC 7942中,DnaA在光照条件下与DNA复制起始位点结合诱导DNA复制,在黑暗或电子传递链受到抑制时,DnaA与DNA复制起始位点的结合受到抑制[119]。因此,有望通过调控工程改变信号通路,以达到能够控制光合蓝细菌基因拷贝数的目的。
此外,基于调控系统开发新的技术方法。sRNA与靶标依靠碱基互补配对进行作用,其工作原理较为简单。基于此,通过人工设计sRNA靶定到靶基因的mRNA抑制基因的表达,已在蓝细菌中进行使用[111]。CcaS/CcaR属于TCS系统,能够响应绿光诱导,表达控制基因。基于CcaS/CcaR工作原理,控制异丁醇合成关键基因的表达,实现生长与生产过程分离,将异丁醇产量提高到238 mg/L[120]。
因此,基于调控系统工作原理开发更多功能模块实现复杂基因线路是调控系统研究的一个重要方向。
3.3 多基因的调控
光合蓝细菌中部分调控系统单元功能已进行了验证,见表1。对同一胁迫环境的响应有多种调控系统的参与,例如盐胁迫条件下,Hik2、Hik16、Hik33、Hik34、Hik36、Hik41、Hik43、Rre1、Rre6、SigB和Yfr1等均参与到了适应性调控过程中基因表达的不同阶段。因此,在进行调控工程时可将多种调控系统元件进行耦合,实现对多个代谢过程同时进行调控[图5(c)]。比如,在集胞藻PCC 6803中对丁醇耐受性的研究中,sRNA与TCS系统均参与到调控过程[67],通过对两个调控系统的同时干预,极大地提高了丁醇的耐受性。与丁醇耐受调控过程相同,在盐胁迫、高光胁迫或氧化胁迫环境条件下,有不同调控系统的参与,对这些调控系统单元进行合理的组合适配有望进一步提高菌株耐受性。

表1 蓝细菌中调控系统及功能Tab.1 Functions of regulatory system units in cyanobacteria
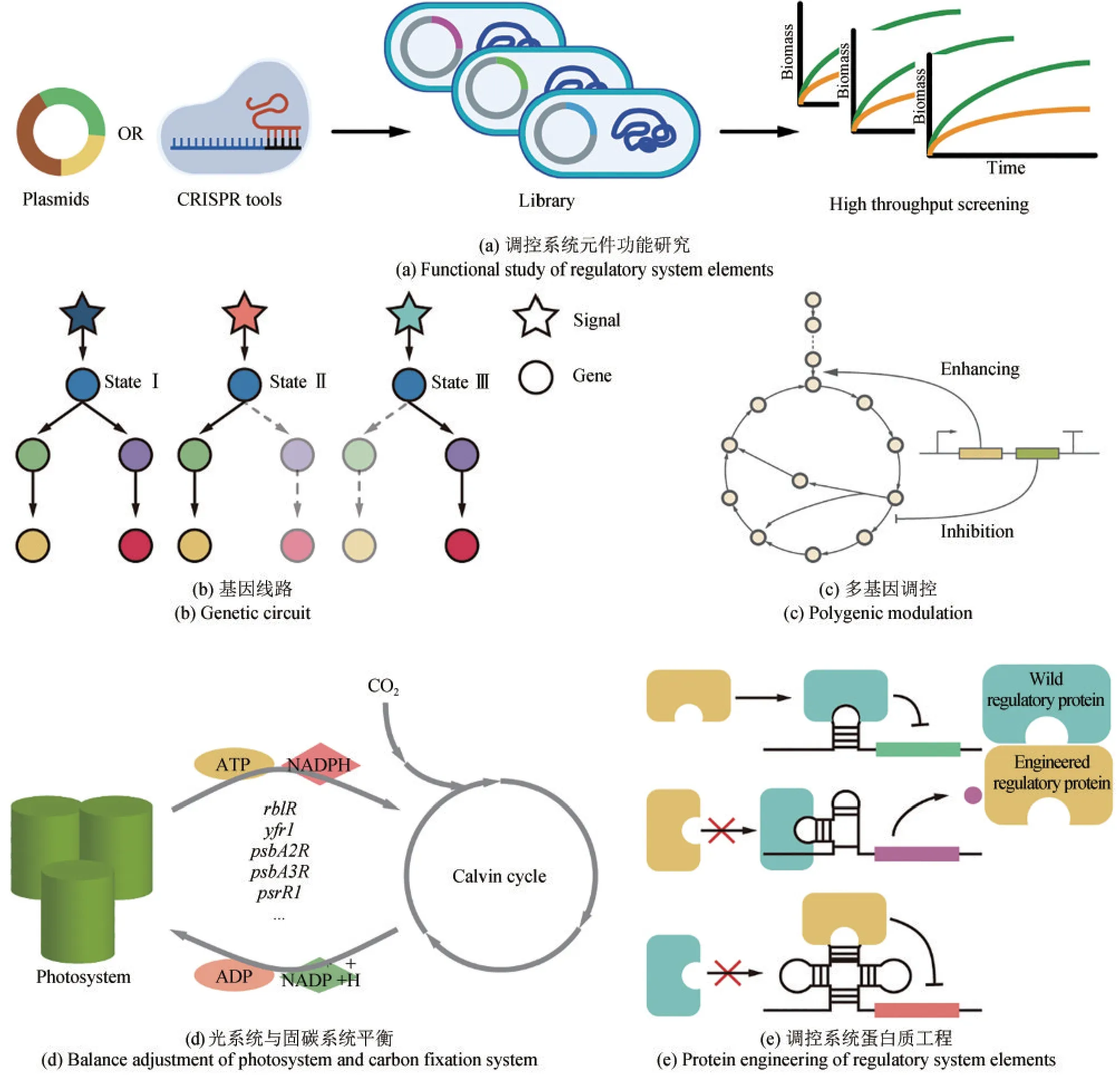
图5 调控工程展望总结Fig.5 Prospect of regulatory engineering research
以光合蓝细菌为底盘进行产品生产时,产品产量提高的同时会抑制底盘生长导致单位培养体积产品产量降低[120-121],影响碳平衡和能量平衡。而调控系统参与光合系统电子链与碳固定的平衡调节,如RblR[61]。因此,可以通过调控工程优化电子链与碳固定之间关系,优化生长与生产之间的关系。可采取生长与生产分离的策略,引入群体感应系统,在生长初期能量和碳源仅供底盘生长,当达到一定浓度时,激活生产模块,此时大量的能量和碳源流向产品,使产量达到最大。此外,活性氧(ROS)在多种胁迫环境下产生,如高光、盐以及铜离子缺乏等[15,22]。胁迫环境下ROS升高可能是胁迫环境对菌株抑制的主要毒性体现,因此ROS积累问题是增加多种耐受性的潜在靶点。氧化还原调控过程有多种调控系统的参与,这些调控系统具有非常大的潜力降低ROS积累,进而提高菌株耐受性。
使用调控工程,开发多元抗逆蓝细菌底盘。为满足工业生产环境需求,提高蓝细菌在多元耐受条件下的耐受性,开发多元耐受的蓝细菌底盘是必不可少的工作。针对多元耐受蓝细菌底盘开发工作,构建智能抗逆蓝细菌底盘[20,109,122]。针对已知作用的调控系统元件,借助人工智能对光合蓝细菌调控系统进行合理设计组合,并与实验室进化相结合,进行多元耐受底盘的开发。
3.4 调控系统的蛋白质工程
在调控系统中,许多蛋白参与调控过程,因此通过蛋白工程,对调控蛋白进行改造,如图5(e)所示,设计满足研究者需要的蛋白是进一步推进调控工程的重要步骤。对编码σ因子、调控蛋白和RNA聚合酶等与调控相关的基因进行易错PCR建库后筛选相关表型的非理性蛋白质改造的工作目前已经取得一定成果[19,70-73,123-124]。而调控系统蛋白质的理性设计是未来发展的重要方向。将机器学习与调控蛋白工程相结合,通过机器学习引导调控蛋白的工程改造,优化蛋白质功能,是未来发展趋势之一[125]。近年来,使用蛋白质工程对天然蛋白进行改造提高酶活性、增强酶稳定性、扩大酶谱成为了一种重要方法[126]。将机器学习与蛋白进化相结合,对调控蛋白进行设计,实现调控蛋白的可编程,是未来调控工程的一个发展方向。
3.5 系统调控工程
系统调控工程是以多方面多层次工程改造细胞调控系统的方式,对菌株全局代谢网络进行调整的技术概念。调控工程的初级目标是能够人工设计调控系统单元,对既定靶标进行直接作用。随着要求的提高,调控系统工程以不同条件下的代谢组学、转录组学、蛋白组学以及代谢流分析等大量组学数据为基础,构建光合蓝细菌调控系统与代谢网络之间的关系模型,对调控系统变化后的代谢模式进行预测,在全局范围内实现代谢网络的人工设计。光系统能够接受光强信号进行调节[15],适应不同光照强度,而暗反应过程主要利用光系统产生的能量将CO2固定。最近有文章报道,光亦能调控卡尔文循环过程[127]。光系统效率与碳固定系统相比要高得多,在高光条件下往往需要光系统通过各种形式耗散多余的能量,避免光系统受到损伤。近来有研究表明,通过引入异源合成途径能够有效提高光系统效率,在一定程度上降低光损伤[128]。因此,平衡光系统与碳固定系统对于光合效率的提高有重要意义,如图5(d)所示。光信号可以调控光系统与碳固定系统,引入异源途径,将异源途径的表达与内源响应光信号的调控系统进行嵌合,使异源途径接受光信号调控,进而提高光合蓝细菌高光适应能力以及光合效率。在上述调控系统得到充分解析的情况下,结合系统生物学,未来有望实现基于调控工程的细胞全局调控,平衡光反应与暗反应之间的关系。
4 总结
调控工程是提高底盘耐受性,优化底盘生长与产品产量,促进光合蓝细菌底盘商业化的可行方法。当前,利用调控工程对产品产量、耐受性以及生长进行理性设计,使三者关系达到最优,还具有一定的难度。因此,要加强调控系统元件功能研究工作,刻画光合蓝细菌调控系统网络,与机器学习等先进科学技术相结合,开发快速高效的遗传操作技术,以及微流控等高通量筛选技术,加快调控系统网络的研究工作。在当前研究基础上,加快已知功能的调控系统单元转化,将不同调控系统元件进行耦合。同时,积极结合计算机科学,对调控系统进行模型构建,对调控系统单元变化进行预测,修复调控系统模型,以求能实现对调控模型的精准预测。综上,未来可望通过调控系统工程进一步的工作,推动具备规模化应用潜力的蓝细菌底盘的构建,促进CO2的资源化利用,助力国家“碳达峰”及“碳中和”目标的实现。
