幽门螺杆菌CagA与YWHAE互作区段的确定
2022-12-14张晓艳温春燕佘菲菲
张晓艳,温春燕,陈 豪,佘菲菲
胃癌,全球最常见癌症中排名第5,死亡率位居第4,严重威胁着人类健康[1]。幽门螺杆菌(Helicobacterpylori,H.pylori)是胃癌发生的I类致癌原。该菌的细胞毒素相关蛋白(cytotoxin associated antigen A,CagA),是其最重要的毒素之一,已证实是致癌蛋白,在胃癌发生发展的机制研究中备受关注[2-3]。
YWHAE全称酪氨酸3-单加氧酶/色氨酸5-单加氧酶激活蛋白ε肽(Tyrosine3-monooxygenase/tryptophan5-monooxygenase activation protein,epsilon),为14-3-3蛋白家族ε亚型,是生物进化中的保守蛋白。该蛋白能与多种细胞蛋白相互作用,调控细胞信号转导、凋亡、迁移等过程,在肝癌、肾癌、乳腺癌等肿瘤中高表达,具有促癌作用[4]。但在胃癌研究中,不同团队报道不一。Leal MF团队[5-6]发现,临床样本中,YWHAE在胃癌组织中的表达明显低于癌旁组织;胃癌细胞中,下调YWHAE可上调细胞周期分裂蛋白CDC25B,并促发原癌基因MYC的表达,进而诱导细胞增殖、侵袭和迁移。Gong XX团队[7]报道,在细胞和裸鼠水平,抑制YWHAE表达可抑制胃癌细胞增殖、生长;Yang M团队[8]报道,YWHAE受到核凋亡诱导因子1(NAIF1)的负调控,在胃癌细胞中呈现高表达。胃癌中,YWHAE抑癌还是促癌,亟待深入探讨。
CagA蛋白通常可分为N-末端保守区(约占70%)和C-末端可变区(约占30%)。已有研究表明[3],其N-末端可与RUNX3、ASPP2、β1整合素等互作,促进RUNX3、ASPP2的降解,参与CagA移位和细胞内浆膜面定位等;其C-末端可与CSK、SHP2、c-Met等互作,具有抑制SFK、FAK活性,增强细胞活性等功能;而SHP1、TAK1则与CagA的N-末端与C-末端均分别存在结合,具有介导CagA的酪氨酸去磷酸化,参与激活细胞NF-κB等作用。确定CagA与宿主蛋白互作的结合区段,是CagA与宿主蛋白相互作用机制研究的重要组成,有助于深入阐明CagA的致癌机制。
本研究团队,在CagA的致胃癌机制研究中发现,YWHAE可与CagA互作,并激活胃癌细胞NF-κB的活性[9],但二者互作的具体机制尚未阐明。因此,本研究拟在酵母细胞、哺乳动物细胞水平,通过酵母双杂交、免疫共沉淀及双荧光素酶报告基因检测等方法,研究与YWHAE互作的CagA区段,旨在探讨CagA与YWHAE互作的机制,以期进一步揭示幽门螺杆菌相关胃癌的发生发展机制。
1 材料与方法
1.1 主要菌株、质粒、病毒和细胞 酵母菌株AH109和Y187(Clontech)。质粒pGBKT7-cagA、pcDNA3.1+cagA-FLAG、pcDNA3.1+cagA-N-FLAG、pcDNA3.1+cagA-M-FLAG、pcDNA3.1+cagA-C-FLAG和pGADT7-YWHAE、pcDNA3.1-myc-YWHAE[我室(消化道恶性肿瘤教育部重点实验室)构建并保存][9-10],pNF-κB-Luc(Clontech),pRL-TK(Promega)。细胞COS-7和AGS(中科院上海细胞库),AGS-siNC和AGS-siYWHAE细胞(我室构建并保存)[11]。
1.2 主要试剂 酵母培养基及相关添加剂(Clontech),3-AT、ONPG、F12K培养基(Sigma),DMEM培养基、胰酶(GIBCO),胎牛血清(FBS)(PAN),FuGENE○R6 Transfection Reagent、the Dual-Luciferase Reporter Assay System (Promega),Western及IP细胞裂解液(碧云天),Protein A&G Agarose(Santa cruz)。
1.3 酵母细胞水平检测CagA与YWHAE互作的区段
1.3.1 CagA分段蛋白在酵母细胞中的表达鉴定 为检测与YWHAE互作的CagA区段,将CagA蛋白分为CagA-N、CagA-M、CagA-(N+M)、CagA-C不同的区段[12]。以pGBKT7-cagA[9]为模板,PCR扩增分段蛋白基因(所用引物“P1-P6”和目的片段详情见表1和图1-A),将各基因片段分别插入pGBKT7质粒中。按照《Yeast Protocols Handbook》(Clontech)的方法,各重组质粒分别转化酵母AH109细胞,并进行Western blot检测:使用Rabbit anti-CagA (b-300) 抗体(针对CagA 1-300氨基酸,1∶200, Santa Cruz)检测CagA-N、-M和 (N+M)分段蛋白的表达;使用Myc-Tag (9B11) 抗体(1∶1 000,Cell Signaling Technology)检测CagA-C蛋白的表达(Myc为表达载体的标签蛋白)。
1.3.2 酵母双杂交检测CagA互作区段 采用“the GAL4 yeast two-hybrid system”进行酵母双杂交检测CagA互作区段。按照《Yeast Protocols Handbook》,为避免因CagA分段蛋白具有反式激活GAL4反应元件的特性而造成酵母双杂交结果假阳性,首先采用“滤纸法”定性检测各转化菌株的β-半乳糖苷酶(β-galactosidase,β-gal)活性判断 CagA分段蛋白是否具有该反式激活特性:将CagA分段蛋白及CagA蛋白重组质粒各自转化的酵母菌株AH109[pGBKT7-cagA]、AH109[pGBKT7-cagA-N]、AH109[pGBKT7-cagA-M]、AH109[pGBKT7-cagA-(N+M)]和AH109[pGBKT7-cagA-C]单克隆,各自划双斜线接种于Whatman○R3M滤纸上(滤纸提前贴于SD/-Trp平板),30 ℃培养20 h;将滤纸,于液氮中15 s、室温30 min,置Z buffer检测液进行显色检测。AH109[pCL1](SD/-Leu平板)为阳性对照, AH109[pGBKT7-lam]与AH109[pGBKT7]为阴性对照。其次,将CagA分段蛋白重组质粒转化的AH109菌株与酵母Y187[pGADT7-YWHAE]菌株,分别进行酵母一对一交配实验[9],简述即:Y187[pGADT7-YWHAE]×AH109[pGBKT7-cagA-N]、Y187[pGADT7-YWHAE]×AH109[pGBKT7-cagA-M]、Y187[pGADT7-YWHAE]×AH109[pGBKT7-cagA-(N+M)]、Y187[pGADT7-YWHAE]×AH109[pGBKT7-cagA-C], Y187[pGADT7-YWHAE]×AH109[pGBKT7-cagA]和Y187[pGADT7-T]×AH109[pGBKT7-53]均为阳性对照,Y187[pGADT7]×AH109[pGBKT7]为阴性对照。最后,挑取上述交配产物的菌落(杂合子克隆),采用“ONPG液相分析法”定量检测β-gal活性,判断与YWHAE互作的CagA区段,即:每种交配,挑取QDO/X-α-gal/3-AT平板上杂合子克隆各5个,若QDO/X-α-gal/3-AT平板上无克隆,则挑取SD/-Leu/-Trp平板上的杂合子克隆各5个,进行液体培养并定量(检测OD600值),然后洗涤、离心浓缩,进而液氮冻融裂解,用Z buffer(含终浓度4 mg/mL的ONPG)进行计时显色反应,酶标仪检测(OD420值),计算各样品β-gal活性单位[β-galactosidase units=1 000×OD420/(t×0.5×OD600)],判断互作情况。

表1 CagA分段蛋白基因PCR扩增引物Tab.1 Details of the PCR primers used for amplification of truncations of the gene encoding CagA
1.4 哺乳动物细胞水平检测与YWHAE互作的CagA区段
1.4.1 免疫共沉淀(co-immunoprecipitation,Co-IP)检测 采用Co-IP检测与YWHAE互作的CagA区段,方案参照前期研究[9]:将CagA分段蛋白哺乳动物细胞表达载体(pcDNA3.1+cagA-N-FLAG、pcDNA3.1+cagA-M-FLAG、pcDNA3.1+cagA-C-FLAG,pcDNA3.1+cagA-FLAG为阳性对照,pcDNA3.1+FLAG为空白对照)各自与YWHAE表达载体pcDNA3.1-myc-YWHAE(pcDNA3.1-myc为空白对照)共转染Cos-7细胞(2×106个/组),每组DNA总量15 μg(表达载体间等摩尔,并用Herring sperm DNA平衡总量),转染试剂(FuGENE○R6 Transfection Reagent)30 μL,按转染试剂说明书操作。转染后48 h,收获细胞,用Western及IP细胞裂解液[含1×PMSF 和Cocktail蛋白酶抑制剂(Roche)]裂解。裂解的可溶性产物,分别先经预清除(1 μg normal IgG和20 μL Protein A&G Agarose),再进行Co-IP [5 μg anti-FLAG抗体(Sigma)和20 μL Protein A&G Agarose],最后用标签抗体anti-FLAG和anti-Myc进行Western Blot检测。
1.4.2 双荧光素酶报告基因检测分析 为了进一步在哺乳动物细胞水平确定和YWHAE互作的CagA区段,进行双荧光素酶报告基因检测分析[13]CagA候选区段(N段和C段)与YWHAE互作对细胞NF-κB激活的影响。
上调细胞YWHAE表达水平进行检测:选用AGS细胞(1.5×105个/组),用FuGENE○R6 Transfection Reagent,共转染YWHAE表达载体(0.75 μg),和CagA-C表达载体(0.25 μg)或CagA-N表达载体(0.75 μg),以及pNF-κB-luc (0.2 μg,报告质粒)和 pRL-TK (0.02 μg,内参质粒,平衡转染效率),并用Herring sperm DNA平衡DNA总量,对照设置参照“Co-IP检测”。转染后48 h,收获细胞,用the Dual-Luciferase Reporter Assay System 试剂盒检测萤火虫荧光素酶及海肾荧光素酶活性,并分析。
下调细胞YWHAE表达水平进行检测:选用AGS-siYWHAE细胞(1.5×105个/组;AGS-siNC细胞为对照),共转染CagA-C或CagA-N表达载体(pcDNA3.1+FLAG为对照),以及pNF-κB-Luc和pRL-TK(各质粒剂量同“上调”方案)。实验同时设置转染CagA蛋白(CagA-Full,0.25 μg)表达载体组的平行对照。转染后48 h,收获细胞,检测并分析。
2 结 果
2.1 酵母细胞水平确定与YWHAE互作的CagA区段
2.1.1 CagA分段蛋白在酵母细胞中表达 成功构建的pGBKT7-cagA-N、pGBKT7-cagA-M、pGBKT7-cagA-(N+M)和pGBKT7-cagA-C重组质粒,分别转化AH109酵母菌株,经Western Blot检测,证明CagA分段蛋白基因在AH109中能相应表达(图1-A和B)。
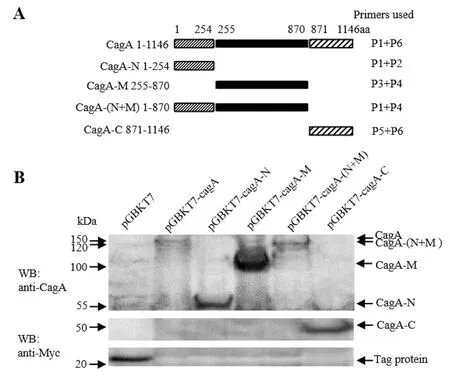
A: CagA分段模式图 B: Western Blot检测图1 Western Blot检测CagA分段基因在酵母AH109中的表达Fig.1 Western Blot analysis of fragments of the CagA gene in AH109
2.1.2 酵母双杂交检测确定互作的CagA区段 经滤纸法定性检测酵母转化子胞内β-gal活性,AH109[pGBKT7-cagA]、AH109[pGBKT7-cagA-N]、AH109[pGBKT7-cagA-M]、AH109[pGBKT7-cagA-(N+M)]和AH109[pGBKT7-cagA-C]与阴性对照AH109[pGBKT7-lam]和AH109[pGBKT7]在检测时间内均始终呈无色,证明CagA-N、CagA-M、CagA-(N+M)、CagA-C蛋白与CagA蛋白一样,不会反式激活GAL4反应元件(图2 A),可进行后续的酵母双杂交实验。
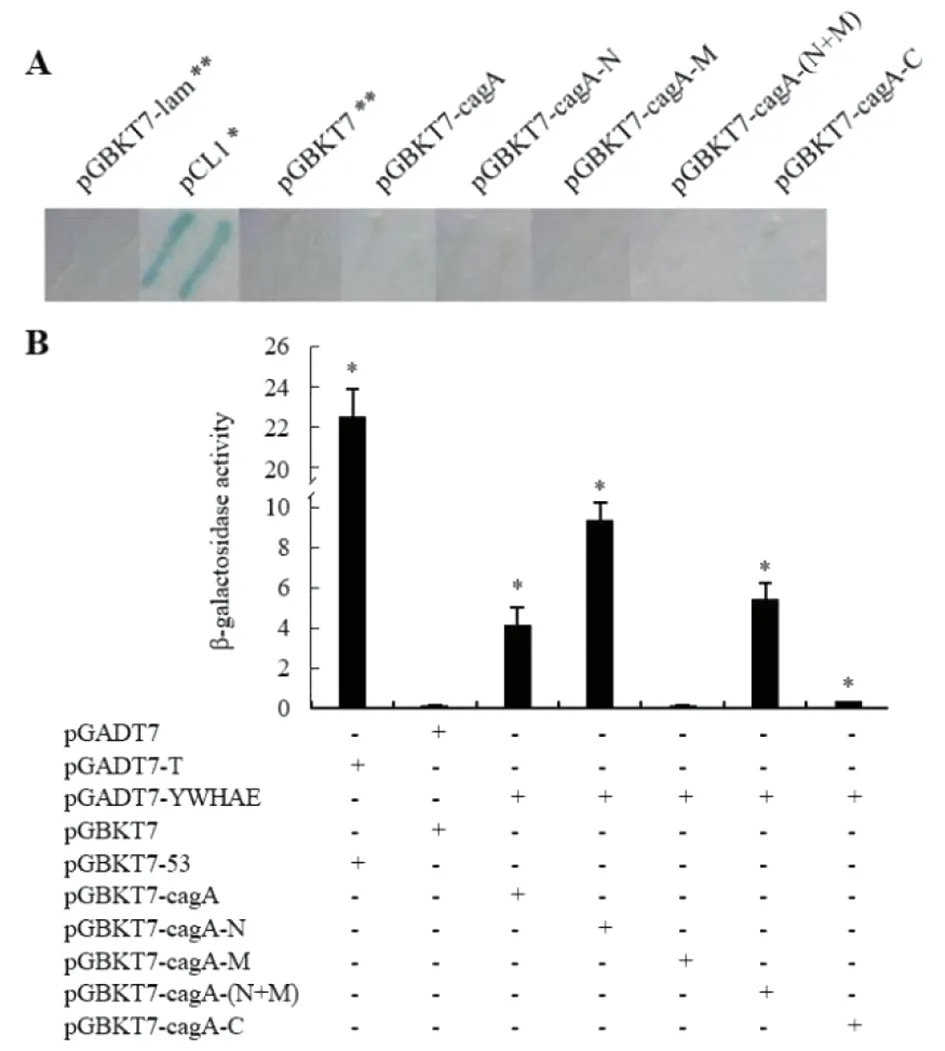
A:滤纸法定性检测:* AH109[pCL1]为阳性对照,检测液加入1h即呈现蓝色;** AH109[pGBKT7-lam]和AH109[pGBKT7]为阴性对照,检测液加入8h始终呈无色;AH109[pGBKT7-cagA-N]、AH109[pGBKT7-cagA-M]、AH109[pGBKT7-cagA-(N+M)]和AH109[pGBKT7-cagA-C],与AH109[pGBKT7-cagA]一样,检测液加入8 h始终均呈无色。B:液相分析法定量检测:*与Y187[pGADT7]×AH109[pGBKT7]相比,P<0.01。独立样本t检验,n=5。图2 β-gal活性检测与YWHAE互作的CagA区段Fig.2 β-Galactosidase assays of the CagA fragments interacting with YWHAE
进而,采用液相分析法定量检测各杂交组酵母二倍体胞内β-gal活性,结果显示,Y187[pGADT7-YWHAE]×AH109[pGBKT7-cagA-N](t=23.19,P<0.001), Y187[pGADT7-YWHAE]×AH109[pGBKT7-cagA-(N+M)](P<0.001)和Y187[pGADT7-YWHAE]×AH109[pGBKT7-cagA-C](t=13.955,P<0.001),与 Y187[pGADT7-YWHAE]×AH109[pGBKT7-cagA](t=9.767,P<0.001)一样,都高于阴性对照组Y187[pGADT7]×AH109[pGBKT7],而Y187[pGADT7-YWHAE]×AH109[pGBKT7-cagA-M]与阴性对照组间差异无统计学意义(图2B)。实验结果提示,在CagA与YWHAE蛋白相互作用中,CagA蛋白的N(1-254aa)段和C(aa 871-1146)段均参与其中。
2.2 哺乳动物细胞水平确定与YWHAE互作的CagA区段
2.2.1 Co-IP检测确定CagA互作区段 为了进一步确定和YWHAE互作的CagA区段,将CagA分段蛋白的表达质粒各自与YWHAE的表达质粒共转染COS-7细胞,用anti-FLAG抗体和Protein A&G Agarose进行Co-IP,结果显示CagA-N和CagA-C蛋白均与完整的CagA蛋白一样,可将过表达的外源性YWHAE蛋白沉淀,而CagA-M蛋白则无法沉淀(见图3)。证明,在哺乳动物细胞内CagA的 N段和C段是与YWHAE发生互作的区段。
2.2.2 双荧光素酶报告基因检测分析确定CagA互作区段 为进一步确定和YWHAE互作的CagA区段,检测CagA-C、CagA-N对经YWHAE介导激活细胞NF-κB的影响。
共转染YWHAE表达载体和CagA分段蛋白CagA-C或CagA-N表达载体(CagA全长蛋白,即CagA-Full表达载体组,为阳性对照),以及pNF-κB-Luc载体,用萤火虫荧光素酶检测评价CagA-C、CagA-N分别与YWHAE相互作用对NF-κB的影响。结果显示(图4A),CagA分段蛋白CagA-C或CagA-N组的结果和CagA-Full阳性对照组的结果类似,即,当CagA分段“C”、“N”各组单转染CagA-C或CagA-N表达载体时,分别可见NF-κB活性增高(与空载体对照相比,tC=3.676,P=0.021;tN=4.392,P=0.012);当CagA分段“C”、“N””各组单转染YWHAE表达载体时,可见NF-κB活性也增高(与空载体对照相比,tC=6.046,P=0.004;tN=7.81,P=0.001);当CagA分段“C”、“N”各组共转染YWHAE表达载体和CagA-C或CagA-N表达载体时,NF-κB活性也增高(与空载体对照相比,tC=17.595,P<0.001;tN=12.44,P<0.001),且均高于各自单转染CagA-C(t=13.267,P<0.001)或YWHAE表达载体组(t=8.308,P=0.001),CagA-N(t=28.238,P<0.001) 或YWHAE表达载体组(t=10.683,P<0.001)。
同时,当慢病毒介导的siRNA下调内源性YWHAE表达时(图4B),转染CagA-C或CagA-N表达载体,NF-κB活性均无增高,与转染CagA-Full表达载体组(t=2.18,P=0.081),即阳性对照组的结果一致。相对应的,当维持内源性YWHAE表达水平时,与空载体对照相比,转染CagA-C(t=4.394,P=0.007)、CagA-N(t=3.209,P=0.024) 或CagA-Full(t=4.816,P=0.005)表达载体,各自NF-κB活性均增高。
证明CagA-C、CagA-N与YWHAE相互作用可激活NF-κB,确定CagA可通过CagA-C、CagA-N段与YWHAE相互作用。

CagA各分段蛋白和YWHAE表达载体共转染Cos-7细胞,将共转染细胞裂解,用anti-FLAG抗体进行免疫沉淀,借助anti-FLAG或anti-Myc抗体进行Western Blot检测。图3 免疫共沉淀检测Fig.3 Co-IP assays

A: YWHAE表达上调增强CagA-C、CagA-N对NF-κB的激活: 采用AGS细胞,共转染YWHAE(Myc标签)和CagA分段蛋白(CagA-C或CagA-N,CagA-Full为阳性对照;Flag标签)表达载体,以及pNF-κB-Luc(报告载体)和pRL-TK(用于平衡转染效率)。空载体共转染组作为阴性对照。转染48 h后,收获细胞,检测相对荧光素酶的活性。B: YWHAE表达下调抑制CagA-C、CagA-N对NF-κB的激活: 采用AGS-siYWHAE细胞(AGS-siNC细胞为对照),共转染CagA分段蛋白(CagA-C或CagA-N,CagA-Full为阳性对照;Flag标签)表达载体,以及pNF-κB-Luc和pRL-TK。空载体共转染组作为阴性对照。转染48 h后,收获细胞,检测相对荧光素酶的活性。* P< 0.05,与对应的空载体对照组相比;# P< 0.01,与对应的“CagA fragment-YWHAE”组相比。配对t检验,n≥5。图4 双荧光素酶报告基因检测Fig.4 Dual luciferase reporter assays
3 讨 论
蛋白质相互作用的研究技术较多,包括酵母双杂交、免疫共沉淀、GST pull-down、免疫荧光共定位、蛋白质芯片、串联亲和纯化等,不同技术有其各自的优缺点。本研究致力于检测鉴定与YWHAE相互作用的CagA区段,吸取不同技术的优点,从不同细胞水平开展实验。
本研究中,首先选用酵母细胞水平进行初筛,其具有诸多优势,酵母细胞具真核细胞的属性,接近体内环境,相对哺乳动物细胞,其培养简单、经济;不需蛋白抽提、纯化等繁琐操作;同时不需吸附、洗涤步骤,相对信号衰减少,提升了检测的灵敏性。酵母双杂交通常经检测细胞β-gal活性来判断蛋白相互作用,可检测基因表达产物相互作用的累积效应,可测获暂时或微弱的蛋白相互作用,常用方法包括琼脂平板法、滤纸法和液相法等。前2种方法多用于大规模筛查,属定性检测;后1种方法常用于小规模样品检测,属定量检测。本研究选用液相法,一方面是因为本研究针对YWHAE与CagA区段的互作检测,样品数量少;另一方面是因为液相法(仪器检测,定量)较滤纸法(肉眼判断,定性)更为客观、灵敏,与琼脂平板法相比也更敏感。通过液相法筛查,本研究发现CagA蛋白的N端与C端均存在与YWHAE相互作用的区段,此同CagA与SHP1、TAK1的互作模式[3]存在相似。
本研究虽然在酵母水平检测到了与YWHAE互作的CagA蛋白区段,但酵母细胞内蛋白的翻译后加工修饰体系与哺乳动物细胞存在差异,哺乳动物细胞内的互作检测更接近人体内的情况。因此,本研究进一步采用哺乳动物细胞系统对酵母系统筛查的结果进行鉴定。先通过经典的Co-IP实验,将CagA蛋白区段与YWHAE分别进行一对一互作鉴定。在该项实验中选用了Cos-7细胞,其源于经病毒SV40(起始失活突变)基因转化的非洲绿猴肾成纤维细胞系,能表达SV40的T抗原,任何含SV40复制起点的转染质粒,如本研究中选用的pcDNA3.1载体质粒,均能以高拷贝数进行复制,确保了外源目的蛋白的高效表达。本研究借助pcDNA3.1质粒与Cos-7细胞的组合,顺利开展了Co-IP实验,证实了CagA蛋白的N、C两端均与YWHAE存在相互作用。
但Cos-7细胞,与幽门螺杆菌感染的环境还是存在差距,因此,本研究进一步选用了AGS细胞,一种常用的人胃腺癌细胞系,进行功能检测验证。通过共转染含有5个NF-κB结合位点串联重复序列的萤火虫荧光素酶基因报告质粒(pNF-κB-luc)[13],使细胞NF-κB活化效应得以放大,提高了检测效率,最终证实,在AGS细胞内CagA的N、C两区段均可经YWHAE介导激活细胞NF-κB,具有类似CagA全长与YWHAE互作的细胞功能[9],从功能上验证了CagA的N、C两端均可分别与YWHAE互作。
综上所述,本研究充分利用不同的蛋白相互作用研究方法,借助不同表达检测系统的优势,从多角度探明CagA通过其C-末端的“C区段”和N-末端的“N区段”与YWHAE相互作用,将有助于进一步阐明CagA与YWHAE互作的功能效应、深入揭示幽门螺杆菌CagA的致癌机制。而关于CagA的“C区段”和 “N区段”,能否单独或组合替代CagA全长蛋白成为抗癌机制研究的靶点,还有待进一步的探究。
利益冲突:无
引用本文格式:张晓艳,温春燕,陈豪,等. 幽门螺杆菌CagA与YWHAE互作区段的确定[J]. 中国人兽共患病学报,2022,38(11):975-981. DOI:10.3969/j.issn.1002-2694.2022.00.126
