柴达木大肥菇胞内多糖改善氧化应激作用
2022-12-13胡世成张奋搏谢惠春焦迎春
胡世成,张奋搏,谢惠春,焦迎春
(青海大学农牧学院,青海 西宁 810000)
如今,快节奏的生活环境使机体极易处于氧化应激状态,如疲劳、缺氧、过量饮食、作息不规律等均会使机体发生氧化应激反应[1]。当机体处于不利环境时,体内活性氧自由基(reactive oxygen species,ROS)大量产生,其生成速率超过机体自身的清除速率,导致氧化系统和抗氧化系统失衡,大量的ROS进入细胞参与生化反应,从而诱发氧化应激[2]。研究发现在疲劳和缺氧状态下,机体对氧气的摄取和消耗增加,引起ROS的大量积累导致细胞膜和线粒体受损,使机体发生代谢紊乱、免疫力下降,甚至会出现器质性病变[3]。因而有越来越多的研究者通过抗氧化剂来缓解氧化应激作用,改善机体健康状态[4],同时也在不断探索具有防护氧化应激损伤作用的天然活性成分。
柴达木大肥菇[Agaricus bitorquis(Quél.)Sacc.]又称双层环伞菌,是一种生长于青藏高原柴达木盆地的珍稀野生食用真菌[5]。柴达木大肥菇富含蛋白质、纤维素及氨基酸等多种营养物质,同时含有多糖、酚酸、萜烯等活性成分[6],其中多糖是其主要的活性成分且含量较高。研究证实食用菌多糖具有多种活性功能,如抗氧化、抗肿瘤、抗炎及调节免疫等[7]。研究发现,柴达木大肥菇的菌丝体多糖、子实体多糖、发酵液多糖均具有抗氧化[8]、抗疲劳[9]、耐缺氧[10]等活性,其中从菌丝体中提取的胞内多糖(intercellular polysaccharides,IPS)功能活性尤为突出,是柴达木大肥菇中极具开发潜力的组分之一。傅里叶红外光谱和核磁共振光谱[8]的结果表明,胞内多糖分子量约为120 kDa,主要由甘露糖、葡萄糖、阿拉伯糖、葡萄糖醛酸和半乳糖醛酸组成,主链主要由D-葡聚糖构成,支链由α-1,6糖苷键连接。然而,对IPS抗氧化应激活性研究鲜见报道。综上,本研究推测柴达木大肥菇多糖的抗氧化应激作用可能与其调节机体应激代谢和较强的抗氧化水平有关。
本研究以柴达木大肥菇胞内多糖为研究对象,借助小鼠力竭游泳及常压缺氧模型诱导小鼠产生氧化应激反应,测定并分析实验小鼠运动及缺氧条件下机体代偿代谢的相关生理生化指标,解析柴达木大肥菇多糖抗氧化应激活性与增强机体代谢的关联机制,为柴达木大肥菇多糖作为天然抗氧化应激功能食品因子的开发和青藏高原珍稀食用真菌资源研发提供参考。
1 材料与方法
1.1 材料与试剂
柴达木大肥菇菌种:青海大学食品科学与工程实验室保藏,编号CCTCCM-2018250-ZJU-CDMA-12;柴达木大肥菇胞内多糖[Agaricus bitorquis(Quél.)Sacc.intercellular polysaccharides,IPS]:青海大学食品科学与工程实验室制备。
健康昆明小鼠100只,雄性和雌性各半,小鼠体重为(25±5)g,购自甘肃中医学院,许可证号为 SCXK(甘)2011-0001。饲养环境适宜、通风、安静,温度为18℃~25℃,湿度为35%~50%,实验所用饮用水、生理盐水均进行灭菌处理。
红景天胶囊:北京同仁堂健康药业股份有限公司;活性炭:上海麦克林生物技术有限公司;三氯甲烷、正丁醇(均为分析纯):天津市博迪化工有限公司;小鼠基础饲料:江苏协同生物公司;肝糖原(hepatic glycogen,HG)测定试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒、尿素氮(blood urea nitrogen,BUN)测定试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)测定试剂盒、血乳酸(lactic acid,LAC)测定试剂盒、乳酸脱氢酶(lactate dehydrogenase,LDH)测定试剂盒、一氧化氮(nitric oxide,NO)测定试剂盒、丙二醛(malonic dialdehyde,MDA)测定试剂盒、过氧化氢酶(catalase,CAT)测定试剂盒:南京建成生物工程研究所。
1.2 仪器与设备
721N紫外可见分光光度计:上海佑科仪器仪表有限公司;R-1001VN旋转蒸发仪:郑州长城科工贸有限公司;SB-3200TDT超声清洗器:宁波新芝生物科技股份有限公司;各型微量移液器:德国艾本德公司。
1.3 方法
1.3.1 多糖的制备
参考文献[10]的方法,使用超声辅助热水浸提法[水温 60℃、超声功率 126 W、料液比 1∶36(g/mL)、提取时间15 min]提取得到胞内粗多糖溶液,在胞内粗多糖溶液中加入溶液体积6%的活性炭[11],在温度60℃条件下水浴脱色5 min,褐黄色粗多糖溶液脱色为浅黄色或无色多糖溶液为止。参考文献[12]中的Sevage法脱除胞内粗多糖溶液中的蛋白。取经过上述处理后的粗多糖溶液,采用大孔树脂吸附层析法纯化[13],以0.5 mL/min的流速洗脱,得到柴达木大肥菇胞内纯化多糖,-80℃冻干后备用。
1.3.2 模型建立与动物分组
通过小鼠力竭游泳和常压密闭缺氧处理建立氧化应激模型。力竭游泳处理[14]使用小鼠负重游泳的方法,将每组小鼠称重并进行负重,负重质量为小鼠体重的5%,然后将小鼠分别置于装有25℃水的桶中,一桶一鼠,记录小鼠力竭游泳时间;缺氧处理[14]使用常压密闭缺氧的方法,将每组的10只小鼠,分别放入含有15 g氢氧化钠的广口瓶中,在瓶底放一张滤纸,将瓶口用凡士林密封,当各组实验小鼠停止呼吸,处死并记录存活时间。所有动物实验均符合动物伦理学标准。
在满足无特定病原体(specific pathogen free,SPF)级要求的动物房,将100只小鼠放入饲养,保证通风且安静,雌雄分养,提供足够的基础饲料和灭菌饮用水,定期清理鼠笼和动物房。适应性喂养后,将小鼠随机分为柴达木大肥菇胞内多糖低剂量组(intercellular polysaccharides low,IPSL)、中剂量组(intercellular polysaccharides middle,IPSM)、高剂量组(intercellular polysaccharides high,IPSH)、空白对照组(CONTROL)和阳性对照组(RHODIOLA)5个组别。其中低、中、高剂量组是将纯化后的胞内多糖,制备成浓度分别为25、50、100 mg/kg的溶液,连续灌胃小鼠35 d;阳性对照组采用红景天胶囊并参考说明书推荐用量配制成200 mg/kg的灌胃液,按小鼠体重10mg/kg的剂量灌胃,现用现配,连续灌胃35 d;空白对照组以同等体积的生理盐水进行灌胃。
1.3.3 生理生化指标测定
待小鼠负重游泳结束,捞起小鼠并让小鼠休息30 min。将小鼠用乙醚麻醉后通过眼球取血,同时将血清分离出来,置于-80℃冰箱中冷藏备用以检测LAC和BUN含量以及LDH活性。取血后立即将小鼠解剖,取出小鼠肝脏,检测MDA含量,SOD、CAT和GSH-Px的活性。待小鼠缺氧死亡后,通过眼球取血,摘取小鼠脑组织,迅速将小鼠脑组织放入液氮罐保存备用。之后按照试剂盒操作说明,对小鼠体内MDA、NO、BUN和LAC的含量以及LDH、SOD、CAT和GSH-Px的活性等指标进行测定。
1.4 数据统计分析
通过SPSS 23.0处理数据及其标准差,差异显著水平为P<0.05,差异极显著水平为P<0.01;使用Origin(2018 C)软件制作数据图;数据以平均值±标准差表示。
2 结果与分析
2.1 IPS对小鼠力竭游泳时间和缺氧存活时间的影响
IPS对小鼠力竭游泳时间和缺氧存活时间的影响结果见图1。

图1 IPS对小鼠力竭游泳时间和缺氧存活时间的影响Fig.1 Effect of IPS on exhaustive swimming time and hypoxia survival time in mice
力竭运动会增加氧气的摄取和消耗,这会诱发应激源活性氧的大量形成,导致信号传导异常或细胞功能障碍,会在不同程度上对机体肝脏、骨骼肌等组织造成损伤[15]。小鼠力竭游泳时间是小鼠运动耐力的直接表现,同时也间接反映力竭运动诱导的氧化应激对机体的损伤程度[16]。由图1A可知,与空白对照组相比,胞内多糖低、中、高剂量组小鼠力竭游泳时间均极显著延长(P<0.01),分别为 49.48、70.34、92.32 min,随着剂量增加到100 mg/kg时,小鼠力竭游泳时间延长率达到215.52%;其中胞内多糖低剂量组时间短于阳性对照组,无明显差异。柴达木大肥菇胞内多糖可以提高小鼠运动耐力,延长力竭游泳时间的结果与较多文献报道一致,郭俊平等[17]发现桑黄多糖可以延长疲劳小鼠运动时间,延长率为70.62%;曹亮[18]研究发现羊肚菌多糖可以缓解小鼠疲劳状态,力竭游泳时间延长率达到188.05%。柴达木大肥菇胞内多糖延长小鼠运动耐力效果较为突出,这可能是因为其分子量处于缓解疲劳活性的合适范围。真菌多糖的分子量过大或者过小均会影响其生物活性功能的表现程度,如果分子量过小,真菌多糖的组成单一,则会无法形成产生活性的聚合结构;如果分子量过大,则分子体积过大,会对多糖跨越多重细胞膜障碍进入生物体内发挥生物活性产生不利影响[19]。而不同的多糖所形成的活性最佳范围不同,所以会出现不同物种间的差异。
2.1 两组PDCD4表达率比较 良性对照组44例患者中,40例呈PDCD4阳性表达,阳性表达率为90.91%,EOC组92例患者中,42例呈PDCD4阳性表达,阳性表达率为45.65%。两组的PDCD4表达水平比较差异有统计学意义(χ2=25.465,P<0.05)。见图1。
缺氧会诱导机体氧敏感性途径活化,体内的线粒体电子传递系统中可利用的氧气减少,生成大量自由基,影响机体正常的氧化分解供能作用[20]。小鼠缺氧存活时间常用于评价缓解缺氧的作用[21],是缺氧所引起的氧化应激反应的观测指标。由图1B可知,与空白对照组相比,胞内多糖低、中、高剂量组小鼠缺氧存活时间显著延长(P<0.05),分别为 46.09、48.53、50.33 min,随着剂量的增加,小鼠缺氧存活时间呈上升趋势;胞内多糖干预组和阳性对照组比较时,低剂量组缺氧存活时间短于阳性对照组,无明显差异,而中、高剂量组缺氧存活时间显著延长(P<0.05),其中胞内多糖高剂量组是阳性对照组的1.64倍。这与文献研究结果一致,沙爱龙等[22]研究发现阿里红多糖可以延长小鼠存活时间至28.12 min,本研究中胞内多糖高剂量组的结果是其1.79倍;曹亮[18]研究发现随着羊肚菌多糖用量的增加,小鼠缺氧存活时间也随之延长。以上结果可能是因为每个多糖的分子量不同,而分子量是多糖具备生物活性的关键因素,这可能与多糖分子形成的高级构型有关。
综上可知,柴达木大肥菇胞内多糖可以较好地提高小鼠运动耐力,并且明显延长小鼠缺氧的存活时间,提高疲劳和缺氧所引起的氧化应激条件下代偿代谢水平,表明胞内多糖对氧化损伤小鼠具有较好的保护作用。
2.2 IPS对小鼠氧化应激指标的影响
IPS对小鼠体内SOD、GSH-Px、CAT的活性以及MDA含量的影响结果见图2。
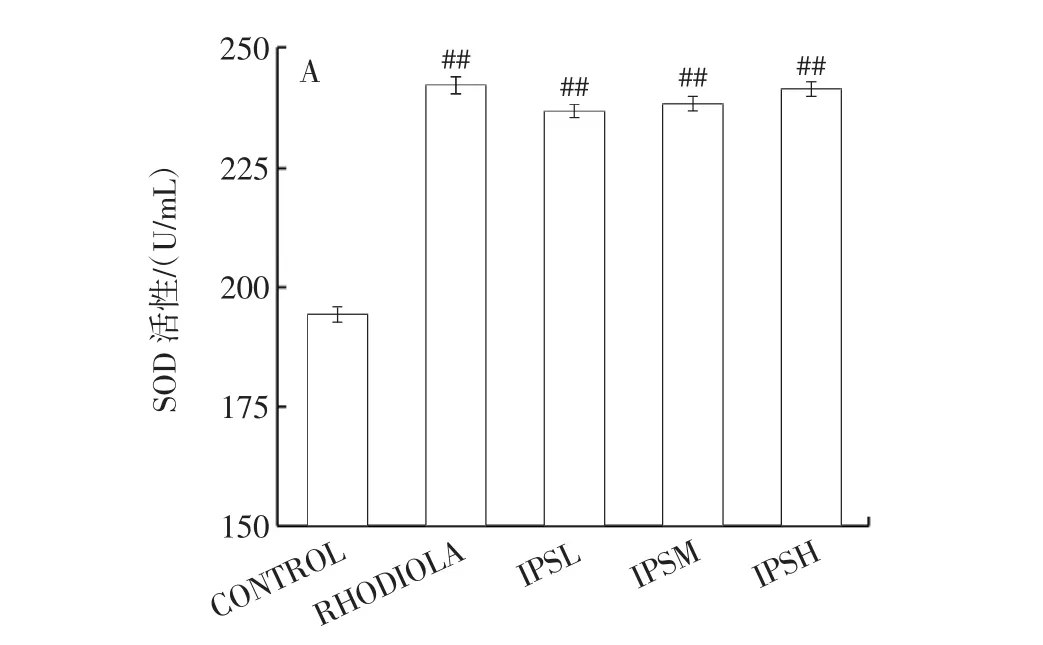

图2 IPS对小鼠体内SOD、GSH-Px和CAT活性以及MDA含量的影响Fig.2 Effects of IPS on activities of SOD,GSH-Px and CAT and content of MDA in mice
GSH-Px、SOD及CAT是机体的抗氧化酶系,是常用来评价机体氧化及抗氧化体系是否处于平衡状态的重要指标[16]。MDA含量变化可以反映细胞膜受损伤的严重程度[23]。由图2A可知,胞内多糖干预组与空白对照组比较,胞内多糖低、中、高剂量组小鼠肝脏中SOD活性增加极显著(P<0.01),且随着胞内多糖剂量的增加,作用效果越明显;但胞内多糖不同剂量组小鼠肝脏中SOD活性,均低于阳性对照组且无明显差异。由图2B可知,与空白对照组相比,胞内多糖低、中剂量组小鼠肝脏中GSH-Px活性差异显著(P<0.05),分别达到了15.34、17.08 U/mL,而胞内多糖高剂量组小鼠肝脏中GSH-Px活性差异极显著(P<0.01),是空白对照组和阳性对照组的1.63倍和1.35倍;由图2C可知,相较于空白对照组,胞内多糖低、中、高剂量组小鼠肝脏中MDA含量均极显著降低(P<0.01),其中小鼠肝脏中MDA含量随着胞内多糖剂量的增加而降低,胞内多糖高剂量组含量降至0.55nmol/mg prot,降低了87.81%;由图2D可知,将胞内多糖3个剂量组与空白对照组进行比较,胞内多糖低、中、高剂量组小鼠肝脏中CAT活性均极显著增加(P<0.01),高剂量组小鼠肝脏中CAT活性达到177.05 U/mg prot,是空白对照组的1.34倍,是阳性对照组的1.11倍。本实验结果与文献结果相一致,谭秀娟等[24]研究发现芜根总多糖可以显著提高缺氧小鼠体内SOD和GSH-Px活性,降低MDA含量;刘雨萌等[25]研究显示枸杞子多糖可以有效提高缺氧小鼠体内SOD、GSH-Px活性,降低MDA含量。
综合表明,柴达木大肥菇胞内多糖可以提升小鼠抗氧化能力,避免MDA的堆积[26],从而降低氧化损伤,缓解小鼠氧化应激反应。此外,一项针对山参多糖的小鼠抗疲劳实验发现,山参多糖抑制有害代谢物积累以及减轻氧化损伤,可能与激活腺苷酸激活蛋白激酶(adenosine 5'-monophosphateactivated protein kinase,AMPK)信号通路、改善葡萄糖摄取和线粒体功能有关[27],这为后续研究相关机制带来启发。
2.3 IPS对小鼠血清生化指标的影响
图3为IPS对小鼠血清中BUN、LAC含量以及LDH活性的影响结果。
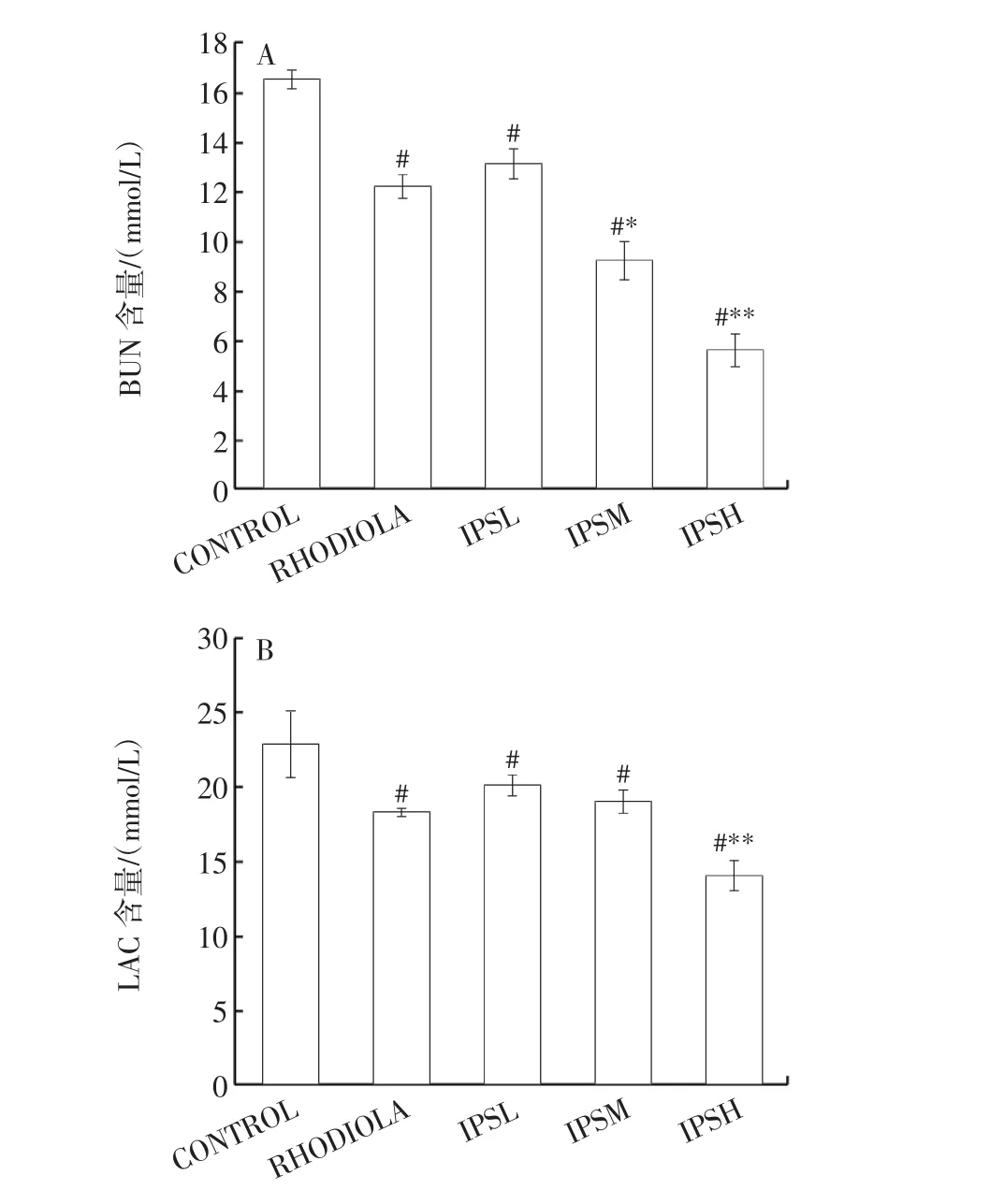
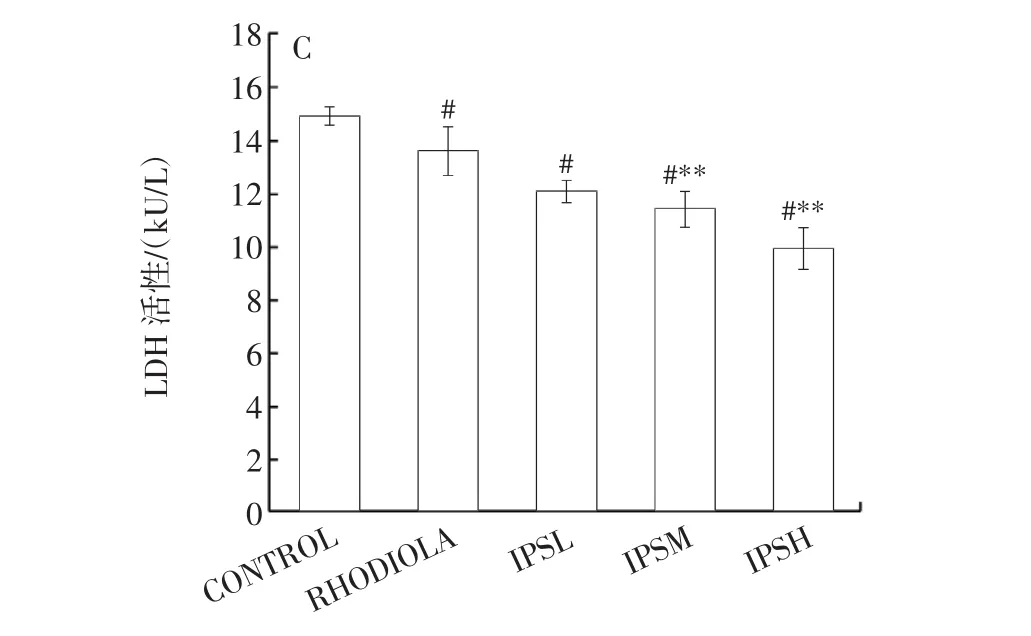
图3 IPS对小鼠血清中BUN和LAC含量、LDH活性的影响Fig.3 Effects of IPS on the contents of BUN,LAC and LDH activity in serum of mice
血乳酸水平和尿素氮含量是对机体有氧代谢能力和疲劳程度的反映[28]。当机体处于疲劳诱导的氧化应激状态时,机体发生代偿代谢不能获得充沛的能量,所以需要通过加强蛋白质与氨基酸的代谢分解来补充缺失的能量,尿素氮便是此代谢过程的产物,随着代谢时间的延长其浓度也逐渐升高。LDH活性可以评价机体无氧代谢能力,同时也可以评价机体运动负荷强度和运动损伤程度[29]。由图3A可知,与空白对照组相比,胞内多糖低、中、高剂量组小鼠血清中BUN含量均显著降低(P<0.05),分别下降了 20.57%、44.22%、66.31%,其中胞内多糖高剂量组小鼠血清中BUN含量下降至5.57 mmol/L;与阳性对照组相比,胞内多糖中剂量组小鼠血清中BUN含量显著下降(P<0.05),高剂量组极显著下降(P<0.01),低剂量组无明显差异。由图3B可知,与空白对照组相比,胞内多糖低、中、高剂量组小鼠血清中的血乳酸含量均显著降低(P<0.05),且分别下降11.63%、16.64%、38.32%,其中,高剂量组下降效果最为突出;胞内多糖干预组与阳性对照组相比,胞内多糖高剂量组小鼠血清中血乳酸含量下降了23.14%,下降至14.05 mmol/L,血乳酸浓度与机体疲劳程度呈正相关,当机体过度运动后,血乳酸浓度上升从而使机体的疲劳感加剧[30],如果此时从体外补充抗氧化剂,血乳酸浓度则会下降,从而缓解疲劳症状。由图3C可知,与空白对照组相比,胞内多糖低、中、高剂量组小鼠血清中LDH活性均显著降低(P<0.05);而与阳性对照组相比,低剂量组无显著差异(P>0.05),中、高剂量组差异极显著(P<0.01)。本研究结果与文献结果一致,郝艳娟等[30]研究黄瓜籽对小鼠抗疲劳活性发现,黄瓜籽可以减少疲劳小鼠体内BUN和LAC含量,分别降低至4.27 mmol/L和4.49 mmol/L,均能明显提高疲劳小鼠运动耐力,但本研究结果较低,可能是因为不同原料中营养物质组成不同,黄瓜籽中富含脂肪酸等具有药用价值的活性成分。谭秀娟等[24]研究发现,芜根总多糖可以明显降低疲劳小鼠体内LDH活力,降至17.55 kU/L,这与本研究结果一致,且柴达木大肥菇胞内多糖的作用效果较为突出。
本研究表明,柴达木大肥菇多糖能够明显缓解小鼠负重运动造成的疲劳,有效提高小鼠代偿代谢水平,且随着使用剂量的增加,作用效果越突出。多糖可能是通过减少机体因过度运动所引起的代谢产物堆积,从而缓解运动疲劳造成的机体损伤[31]。
2.4 IPS对小鼠脑组织中NO的影响
图4为IPS对小鼠脑组织中NO含量的影响结果。
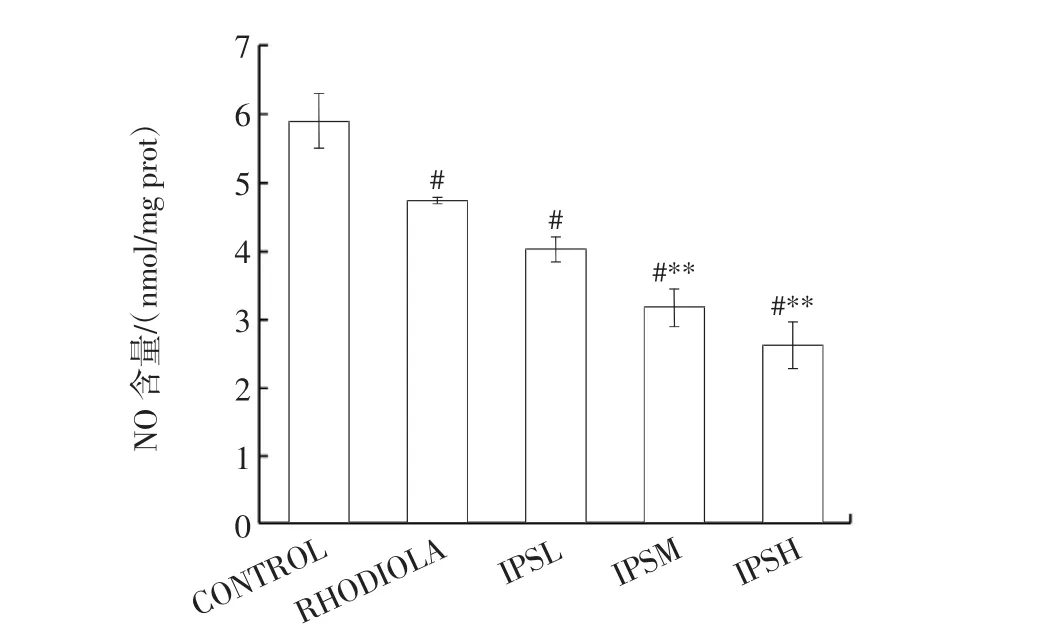
图4 IPS对小鼠脑组织中NO含量的影响Fig.4 Effect of IPS on NO content in brain tissue of mice
当机体处于缺氧所引起的氧化应激状态时,一氧化氮合酶催化生成的NO可对神经起到毒性作用,造成损伤[32]。由图4可知,与空白对照组相比,胞内多糖低、中、高剂量组小鼠脑组织中NO含量差异显著(P<0.05),与阳性对照组相比,低剂量组无明显差异,中、高剂量组差异极显著(P<0.01)。人体肠道内栖息着多种共生微生物,统称为肠道菌群,其在盲肠和大肠中帮助人体发酵食用菌多糖等多种膳食纤维,产生的益生代谢产物短链脂肪酸(short-chain fatty acids,SCFA),能够影响人体的代谢、免疫和神经等多个系统,其中丁酸盐被证实是中枢神经系统中重要的神经调节剂[33]。与本文结果相似,Lanza等[34]发现炎症小鼠补充丁酸盐后脊髓组织的NO水平明显降低,并推测是通过抑制核因子κB(nuclear factor kappa-B,NF-κB)信号通路下游促进诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)的表达实现,也有另一项研究表明丁酸盐能够抑制NF-κB信号通路的激活,从而降低肾病小鼠的肾脏氧化损伤[35],基于此,推测柴达木大肥菇多糖同样可能通过结肠发酵产生丁酸盐的方式,影响脑组织中的NF-κB信号通路进而降低NO含量。
3 结论
本文研究结果显示,疲劳和缺氧可以明显加剧小鼠的氧化应激过程,引起小鼠抗氧化能力下降。通过氧化应激损伤动物实验评价发现,25、50、100 mg/kg剂量的柴达木大肥菇胞内多糖均能不同程度提高小鼠的抗氧化能力,缓解小鼠由疲劳和缺氧诱发的氧化损伤,改善小鼠氧化应激程度,从而对小鼠产生保护作用。柴达木大肥菇胞内多糖组小鼠力竭游泳时间和缺氧存活时间均有所延长,且呈剂量依赖性;肝脏抗氧化结果显示,胞内多糖低、中、高剂量组明显降低了肝脏中MDA含量,升高了SOD、CAT和GSH-Px 3种抗氧化酶的活性,说明不同剂量的胞内多糖对肝脏的抗氧化能力均有增强作用。血清指标检测结果显示,胞内多糖低、中、高剂量组能够降低小鼠血清中LDH活性、BUN含量和LAC含量,说明柴达木大肥菇胞内多糖可以降低机体由于运动损伤所引起的代谢产物积累,从而有效缓解过度运动造成的氧化损伤,提高疲劳状态下代偿代谢水平,起到保护机体的作用,具有抗氧化应激活性。
以上结果说明,柴达木大肥菇胞内多糖可以作为天然的抗氧化剂,具有显著的抗氧化应激活性,可以清除机体中多余的活性氧自由基,有效改善机体的氧化和抗氧化体系之间不平衡的状态,逆转抗氧化体系中酶类的活性,维持线粒体内氧化磷酸化的正常进行,提高机体抗疲劳和缺氧耐受性。关于柴达木大肥菇胞内多糖的抗氧化应激活性具体的作用机制、信号通路等需要进一步研究。后期可以借助组学技术对内源性抗氧化信号通路进行研究,从多因子、多信号通路复杂调控机体内在平衡的角度,对深层的机制进行更系统、更全面的分析,阐明柴达木大肥菇多糖发挥作用的深层机制。本实验为柴达木大肥菇多糖在食品、药品领域的应用提供了一定的理论参考。
