鸭胚胎发育过程中肠道菌群的演替规律研究
2022-12-13孙玲利刘一思浦发军郝振芳宁俊平杨小杰
孙玲利,刘一思,浦发军,郝振芳,宁俊平,杨小杰
(1.河南农业职业学院,河南郑州 451450;2.四川农业大学动物科技学院,四川雅安 625014;3.汝州市畜牧局,河南汝州 467599)
肠道微生物在机体中的数量是体细胞数量的数倍,其在维持稳态、调节宿主免疫系统、影响宿主生长发育过程中发挥了积极作用(Wen 等,2019)。同时,肠道微生物群也是重要的内分泌器官,可通过多种途径参与调控宿主能量、血糖和炎症,且部分肠道核心菌群能够参与宿主必需氨基酸、能量、辅因子和维生素等营养物质代谢(Rastelli 等,2019)。由此可见,肠道微生物与畜禽生长发育和生产性能密切相关。
胚胎期早期定植的最初微生物菌群会影响新陈代谢、胃肠道发育与成熟、免疫系统功能等,对畜禽肠道发育及相关器官的发育和健康具有重要意义。作为水禽,鸭具有在胚胎发育中期开始由小肠吸收卵黄的特点,卵黄是鸭胚胎发育的重要营养来源,因此,胚胎时期的肠道发育及肠道功能对禽类具有重要意义。本研究通过对不同胚龄鸭盲肠进行组织学观察,并对胚胎发育不同时期的鸭胚胎的整个肠道进行16s rRNA 测序,探究随着鸭胚胎发育,肠道菌群结构组成及演替规律,旨在为禽类胚胎期的肠道微生物定植研究提供参考,也为微生态制剂在畜牧业生产上的合理开发与应用奠定理论基础。
1 材料和方法
1.1 样品采集 试验选用来自于20月龄农华麻鸭的种蛋,置于孵化机(倍立孵全自动孵化机440型)中孵化,孵化温度为37.2~37.8℃,湿度为55%~65%。种蛋在孵化器中的位置随机分布,且种蛋重量平均为78.3 g,无显著差异。在无菌条件下收集18 份样品,包括孵化至第16(E16)、22 天(E22)的胚胎和出壳第一天(D1)的雏鸭的整个肠道,每个阶段6 个样品,用于肠道微生物的测定。将采集的样品装入EP 管中,立即在-80℃保存。采集孵化至E16、E22 的胚胎和出壳第一天的雏鸭的盲肠样品保存在2%多聚甲醛溶液中,用于制作组织学切片观察。刚孵出的雏鸭被养在无菌室里。胚胎标本采集、微生物基因组DNA 提取、PCR 扩增均采用无菌操作。
1.2 盲肠切片制作及组织学观察 对盲肠进行切片,以观察随卵黄吸收肠道绒毛变化情况。样品用2% 多聚甲醛溶液固定后,用全自动密闭式组织脱水机(Leica TP1020)进行梯度乙醇脱水、二甲苯透明、浸蜡。脱水后的组织用石蜡包埋,切片厚度4µm,经脱蜡后用HE 染色试剂盒(Solarbio)进行HE 染色,经梯度乙醇脱水、二甲苯透明后,用中性树脂封片。用OLYMPUS BX53电子显微镜在低倍镜下观测切片,选择典型视野,在高倍镜下观测视野中所有的完整绒毛,拍照。
1.3 DNA 提取及16S rRNA 测序 通过将16、22 胚龄和出壳第一天鸭胚胎的整个肠道匀浆后,采用常用的SDS 方法提取样本基因组,并采用琼脂糖凝胶电泳的方式检测提取基因组的纯度和浓度。同时,将提取样本基因组使用无菌水进行稀释,使样品DNA 的浓度稀释至1 ng/µL。以稀释浓度为1 ng/µL 样品基因组DNA 为模板,扩增所有微生物16Sr RNA 序列,进行PCR 扩增产物的克隆与筛选,构建16Sr RNA 基因文库,对16Sr RNA 的V3~V4 高变区进行测序和数据分析。样本基因组的建库、测序工作交由北京诺禾致源科技股份有限公司完成。
1.4 数据统计分析 利用Uparse 软件(Uparse v7.0.1001)对所有样品的全部待分析数据(Clean Reads)进行聚类,默认以97% 的一致性将序列聚类成为操作分类单位(OTUs),使用R 软件(Version 2.15.3)绘制稀释曲线,并使用R 软件的vegan 包进行MRPP 分析检验肠道菌群结构差异。LEfSe 分析使用LEfSe 软件,设置LDA Score 的筛选值为2。
2 结果
2.1 鸭胚胎发育过程中肠道形态观察 由图1可知,随着胚胎的发育,肠腔体积不断增加,肠绒毛数量增加,肠绒毛高度和肌层厚度变化不大。
2.2 鸭胚胎发育过程中肠道微生物群落结构分析 根据测序绘制OTUs 数量的稀疏曲线,评价测序量是否足以覆盖所有物种,由表1可知,随着样本数量的增加,曲线趋于平缓,表明测序已达到饱和,测序数量足以反映肠道菌群的物种多样性。MRPP 结果显示,E16 组与D1 组间微生物群落结构差异显著(P<0.05),E16 组与E22 组、E22组与D1 组间微生物群落结构差异不显著(P>0.05)。
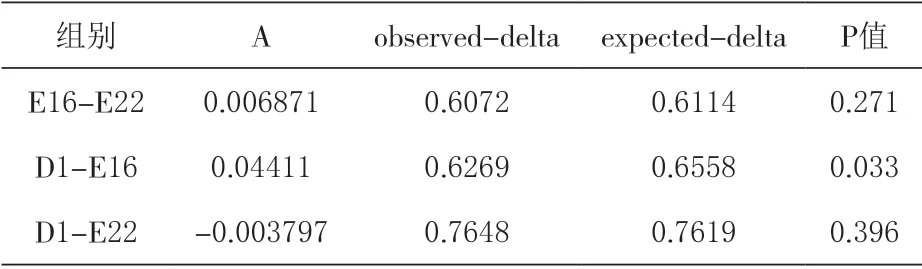
表1 MRPP 组间差异分析
2.3 鸭胚胎发育过程中肠道微生物的差异比较 韦恩图显示胚胎期与出壳后有45 个共有的微生物属(图2A),在胚胎期有沙雷氏菌(Serratia)、霍尔德曼氏菌、另枝菌、小杆菌、毛螺菌等62 个特有的微生物属,出壳后有21 个特有的微生物属,但含量均较少。由Lefse 分析可知(图2B.C),拟杆菌门是胚胎期的标志门,包括科水平上的Muribaculaceae、鞘脂杆菌科以及属水平上的日大生科菌属。厚壁菌门是出壳后的标志门,包括属水平上的罗姆布茨菌。在胚胎期,肠道微生物主要富集了乳酸杆菌、布劳特氏菌、粪杆菌、拟杆菌、无色杆菌5 种菌属;在出壳后,肠道微生物主要富集了罗姆布茨菌、中慢生根瘤菌、藤黄色单胞菌3 种菌属。
3 讨论
近年来,关于哺乳动物与禽类肠道微生物的功能和多样性研究取得了很大进展(Wang 等,2020;Zhu 等,2002)。大多数禽类肠道组织结构发育程度与养分吸收密切相关,在鸡胚发育到18~19 d 时开始由小肠吸收卵黄,卵黄吸收与胚胎发育密切相关(Nangsuay 等,2011)。胚胎期的肠道发育有可能成为禽类终身健康的决定因素,而胚胎期肠道发育与微生物定植之间存在相互作用,肠道菌群可改善肠道发育(Dai 等,2020)。研究表明,在属水平上,布劳特氏菌属、罗氏菌属的丰度与绒毛表面积呈显著正相关(Dai 等,2021)。本研究发现,随着鸭胚胎的发育,肠绒毛数量和肠腔容积逐渐增加,其有可能与胚胎肠道高丰度毛螺菌科及富集布劳特氏菌属相关,进而促进胚胎肠道发育。
为了适应快速变化的发育环境,宿主不同发育阶段的肠道微生物多样性和丰度模式不同(Ding 等,2017)。本研究结果发现,在鸭胚胎期富集乳杆菌属,其可促进胃肠道组织发育,并与饲料转换率和增重密切相关(Beck 等,2019)。在鸭胚胎期富集毛螺菌科,其与饲料转换率和增重密切相关(Gong 等,2007)。在雏鸭肠道中,罗姆布茨菌属的丰度较高,可参与维持肠道内稳态,促进营养物质吸收(Million 等,2017;Zhu 等,2002)。以上研究结果表明,胚胎不同发育阶段肠道微生物的组成和丰度存在差异,说明胚胎中早期定植的微生物菌群在后期发育中受环境及宿主自身遗传的影响,并对肠道发育、营养吸收及宿主生长发育具有重要的调控作用。
4 结论
综上所述,在鸭胚不同发育阶段,鸭肠道已开始有微生物定植。在胚胎期,肠道微生物主要富集乳酸杆菌、布劳特氏菌、粪杆菌、拟杆菌、无色杆菌5 种菌属,而出壳后,肠道微生物主要富集罗姆布茨菌、中慢生根瘤菌、藤黄色单胞菌3 种菌属。说明随着鸭胚胎发育及肠道发育,肠道微生物结构及丰度存在差异,本研究为禽类胚胎期的肠道微生物定植研究提供参考,也为微生态制剂在畜牧业生产上的合理开发与应用奠定理论基础。
