微小RNA-455-3p调控Toll样受体4对哮喘大鼠气道平滑肌细胞的影响
2022-12-11薛梅,廖怡,卢薇
薛 梅, 廖 怡, 卢 薇
(四川省成都市中西医结合医院 儿科, 四川 成都, 610000)
支气管哮喘简称哮喘,是以气道重塑及慢性炎症为主要病理特点的一种常见呼吸系统疾病[1], 其中气道平滑肌细胞(ASMC)的过度增殖及凋亡不足是气管重构的重要原因,可继发难治性哮喘,危害严重[2]。微小RNA(miRNA)是一类非编码小RNA, 可通过转录后调控干扰其靶基因mRNA表达或抑制其转录,广泛参与细胞分化、增殖、凋亡及免疫等多种生物学进程,研究[3-4]显示,多种miRNA在哮喘发生与发展中发挥重要作用。微小RNA-455-3p(miR-455-3p)是一种与糖尿病肾病、乳腺癌等多种癌症以及肺动脉高压等炎症性疾病密切相关的miRNA[5-6]。Toll样受体4(TLR4)是一种高度保守的天然免疫受体家族的成员,其表达水平与哮喘ASMC增殖、凋亡及功能状态密切相关。研究[7]显示, miR-455-3p可靶向TLR4基因调节多种细胞损伤及炎症反应。本研究探讨miR-455-3p与TLR4的靶向关系及其对哮喘大鼠ASMC生物学活性及炎症因子分泌功能的影响,现报告如下。
1 材料与方法
1.1 实验动物
6~8周龄无特定病原体(SPF)级健康雄性SD大鼠12只,体质量190~220 g, 生产许可证号SCXK(粤)2016-0041, 由南方医科大学提供。
1.2 主要试剂及仪器
胎牛血清(FBS,货号10099-145)、DMEM/F-12培养基(货号12634010)购自美国Gibco公司; miR-455-3p NC(阴性对照)、miR-455-3p mimic、pcDNA(空质粒)、pcDNA-TLR4(TLR4过表达质粒)和miR-455-3p、U6、TLR4、GAPDH引物均由吉玛生物科技有限公司合成; 卵清蛋白(OVA,货号A5503)、四甲基偶氮唑蓝(MTT)试剂盒(货号11465007001)购自美国Sigma公司; 原位末端标记法(TUNEL)试剂盒(货号11684795910)购自Roche公司; BCA蛋白定量试剂盒(货号P0010S)购自上海碧云天有限公司; miRNA提取试剂盒(货号AM1561)、Lipofectamine®2000转染试剂盒(货号11668)、兔源一抗anti-TLR4(货号14-9924-82)、anti-GAPDH(货号PA1-16777)、二抗羊抗兔IgG(货号A-11008)均购自美国Invitrogen公司; 大鼠肿瘤坏死因子-α(TNF-α)酶联免疫吸附试验(ELISA)试剂盒(货号ab236712)、白细胞介素-6(IL-6)ELISA试剂盒(货号ab234570)均购自英国Abcam公司; MODEL550型酶标仪购自美国Bio-Rad公司; Forma Steri-Cycle i160 CO2培养箱购自美国Thermo Fisher公司; ix75荧光显微镜购自日本Olympus公司。
1.3 方法
1.3.1 哮喘大鼠模型建立: 参考文献[8]方法,随机选取6只大鼠,于实验第1、8天向大鼠皮下注射含OVA 10 mg和氢氧化铝凝胶200 mg的混合物1 mL, 同时腹腔注射灭活百日咳杆菌5×109个,第15天雾化吸入2% OVA磷酸盐缓冲液50 mL, 30 min/次, 1次/d, 持续1周。其余6只正常大鼠给予等量生理盐水(代替OVA)进行同等处理。哮喘模型建立成功标准为大鼠出现烦躁不安,呼吸加深、加快,弓背,严重者甚至出现伸颈、喘息状、大小便失禁等。
1.3.2 实时荧光定量聚合酶链反应(qRT-PCR)检测大鼠肺组织miR-455-3p表达水平: 分别取6只哮喘大鼠(模型组)和6只正常大鼠(正常对照组),腹腔注射3%戊巴比妥纳麻醉,留取血液置于4 ℃冰箱用于后续ELISA检测,开胸取双肺组织,分别称取0.5 g(其余肺组织置于-80 ℃冰箱用于后续实验),使用RNA提取试剂盒提取肺组织总RNA并检测其浓度,然后使用逆转录试剂盒合成cDNA, 并以cDNA为模板,按照qRT-PCR试剂盒说明书配置聚合酶链反应(PCR)反应体系,反应程序为95 ℃预变性10 min, 95 ℃变性15 s, 60 ℃退火60 s, 72 ℃延伸2 min, 设置45个循环。以U6作为内参,根据2-△△Ct算法进行miR-455-3p表达量的计算与分析。miR-455-3p上游引物序列5′-GCAGUCCAUGGGCAUAUACAC-3′, 下游引物序列5′-GUGUAUAUGCCCAUGGACUGC
UU-3′;U6上游引物序列5′-CTCGCTTCGGCAGC
ACA-3′, 下游引物序列5′-AACGCTTCACGAATT
TGCGT-3′。
1.3.3 ELISA检测大鼠肺组织及血清中炎性因子含量: 取上述置于4 ℃冰箱的2组大鼠血液各2 mL和-80 ℃冰箱的肺组织各0.05 g, 按照TNF-α、IL-6 ELISA试剂盒检测说明书检测哮喘大鼠和正常大鼠血清与肺组织中TNF-α、IL-6含量。
1.3.4 ASMC分离、培养及鉴定: 取上述置于-80 ℃冰箱的肺组织,低温融化后,于解剖显微镜下分离支气管平滑肌,剪碎后置于含胶原酶2 mg/mL、木瓜蛋白酶3 mg/mL、胰蛋白酶2 mg/mL的D-Hank′s液中,置于37 ℃、5%CO2培养箱中消化1 h, 以100目不锈钢筛网过滤后, 800转/min离心10 min, 弃上清,添加于含20%FBS、1%青链霉素的DMEM/F-12培养基中,置于37 ℃、5%CO2培养箱中培养,采用免疫组化染色法鉴定ASMC α-肌动蛋白表达。选取分离成功的ASMC(第4~8代)用于后续试验。
1.3.5 双荧光素酶报告基因实验: 以pmir-GLO质粒为载体,构建与miR-455-3p种子区结合的TLR4基因3′UTR野生型(WT-TLR4)和突变型(MUT-TLR4)双荧光报告重组质粒,之后采用脂质体转染法分别将miRNA(miR-455-3p NC或miR-455-3p mimic)和重组质粒(WT-TLR4或MUT-TLR4)共转染入正常大鼠ASMC, 于CO2培养箱继续培养,分别为miR-455-3p NC+WT-TLR4组、miR-455-3p mimics+MUT-TLR4组、miR-455-3p NC+MUT-TLR4组和miR-455-3p mimics+WT-TLR4组。每组设立6个复孔, 48 h后用PLB裂解细胞,收集细胞裂解液,离心后取上清检测荧火虫荧光素酶信号和海肾荧光素酶信号,计算其相对活性。
1.3.6 细胞炎性诱导、转染及分组: 取对数生长期的哮喘大鼠ASMC接种于96孔细胞板,使用TNF-α刺激哮喘大鼠ASMC(96孔板中加入TNF-α至终浓度为20 ng/mL[9]), 使其产生炎症反应后常规培养。转染当天取出细胞于显微镜下观察细胞密度,达到70%~80%汇合率时即可进行转染。更换无血清培养基后,采用Lip2000转染法转染miR-455-3p NC(50 nmol/L,阴性对照, miR-455-3p NC组)、miR-455-3p mimic(50 nmol/L, miR-455-3p mimic组)和共转染miR-455-3p mimic与pcDNA(miR-455-3p mimic+pcDNA组)、共转染miR-455-3p mimic与pcDNA-TLR4(miR-455-3p mimic+pcDNA-TLR4组)至产生炎症反应的大鼠ASMC中,具体操作严格按照试剂盒说明书进行,孵育4~6 h后更换新鲜培养基。另设正常对照组(正常大鼠ASMC)和模型组(哮喘大鼠炎症ASMC),每组6个重复。
1.3.7 qRT-PCR检测各组ASMC中miR-455-3p、TLR4mRNA表达: 采用RNA抽提试剂盒提取各组ASMC总RNA, 反转录得到cDNA置于-20 ℃冰箱保存待用。采用qRT-PCR法扩增miR-455-3p、TLR4mRNA目的片段。miR-455-3p引物序列及内参U6引物序列见“1.3.2”。TLR4上游引物序列5′-CGCTTTCACCTCTGCCTTCACTA
CAG-3′, 下游引物序列5′-ACACTACCACAATAAC
CTTCGGCTC-3′; 内参GAPDH上游引物序列5′-TGATTCTACCCACGGCAAGTT-3′, 下游引物序列5′-TGATGGGTTTCCCATTCATGA-3′。反应条件为95 ℃预变性15 min, 94 ℃变性15 s, 56 ℃退火30 s, 72 ℃延伸20 s, 共40个循环。采用2-△△Ct法定量分析ASMC中miR-455-3p、TLR4mRNA相对表达水平。
1.3.8 免疫印迹法(WB)检测各组ASMC中TLR4蛋白表达: 采用蛋白抽提试剂盒提取各组ASMC总蛋白,用BCA试剂盒检测蛋白浓度,置于-80 ℃保存备用。取40 μg蛋白样品,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE), 聚偏氟乙烯(PVDF)膜转膜,一抗(anti-TLR4抗体 1∶1 000, anti-GAPDH抗体1∶1 000)4 ℃孵育过夜, TBST缓冲液洗膜,二抗IgG(1∶20 000)室温孵育1.5 h, 洗膜,用免疫印记化学发光试剂(ECL)显色,数字化多功能图像增强化学发光系统曝片,拍照保存,分析蛋白条带灰度值。
1.3.9 MTT检测各组ASMC增殖情况: 将各组大鼠ASMC于消化后计数,以1×106/mL接种于96孔细胞板,培养48 h后,添加MTT溶液(5 g/L)20 μL孵育4 h, 弃培养基后添加二甲基亚砜(DMSO)150 μL, 振荡混匀后使用酶标仪检测正常对照组、模型组、miR-455-3p NC组、miR-455-3p mimic组、miR-455-3p mimic+pcDNA组和miR-455-3p mimic+pcDNA-TLR4组ASMC光密度(OD)值,每组6个重复。
1.3.10 TUNEL法检测各组ASMC凋亡情况: 将正常对照组、模型组、miR-455-3p NC组、miR-455-3p mimic组、miR-455-3p mimic+pcDNA组和miR-455-3p mimic+pcDNA-TLR4组ASMC按1×106/mL密度接种于添加盖玻片的6孔细胞板,待细胞完全汇合后收集盖玻片,以磷酸盐缓冲液(PBS)冲洗,纯丙酮固定。按照TUNEL试剂盒说明书检测各组ASMC凋亡情况,随机选取6个高倍镜下视野,计算阳性细胞百分比(即凋亡率)。
1.3.11 ELISA检测各组ASMC上清液中TNF-α、IL-6水平: 收集正常对照组、模型组、miR-455-3p NC组、miR-455-3p mimic组、miR-455-3p mimic+pcDNA组和miR-455-3p mimic+pcDNA-TLR4组ASMC细胞上清液,每孔取100 μL样品,严格按照ELISA试剂盒说明书操作要求检测TNF-α、IL-6表达水平。
1.4 统计学分析
2 结 果
2.1 哮喘大鼠与正常大鼠肺组织中miR-455-3p表达水平
模型组大鼠肺组织中miR-455-3p表达水平为(0.33±0.04), 低于正常对照组大鼠的(0.64±0.07), 差异有统计学意义(P<0.05)。
2.2 哮喘大鼠与正常大鼠肺组织、血清中炎性因子水平
模型组大鼠肺组织与血清中TNF-α、IL-6表达水平均高于正常对照组,差异有统计学意义(P<0.05), 见表1。
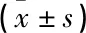
表1 2组大鼠肺组织、血清中炎性因子水平比较 ng/L
2.3 大鼠ASMC鉴定
显微镜下可见,正常大鼠ASMC呈梭形,细胞排列疏密相间,细胞形态正常,有较长突起(图1A)。免疫组化染色法鉴定结果显示, α-肌动蛋白阳性反应细胞为棕黄色(图1B), 提示ASMC分离成功,可用于后续试验。
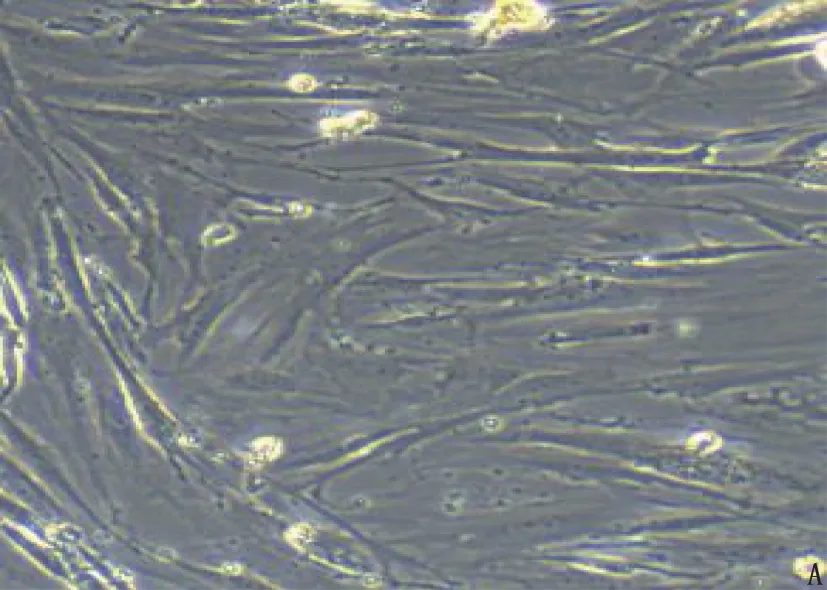
A: 正常大鼠ASMC; B: 免疫组化染色法鉴定显示大鼠ASMC分离成功。
2.4 miR-455-3p与TLR4基因靶向关系验证结果
TargetScan在线生物信息学软件预测TLR4基因3′UTR区可能包含miR-455-3p的互补序列,见图2, 提示TLR4可能是miR-455-3p的作用靶点。双荧光素酶报告基因实验结果显示, miR-455-3p mimics+WT-TLR4组ASMC相对荧光素酶活性低于另3组,差异有统计学意义(P<0.05), 另3组ASMC相对荧光素酶活性比较,差异无统计学意义(P>0.05), 见表2, 提示miR-455-3p可直接靶向抑制TLR4基因表达。

2.5 各组大鼠ASMC中miR-455-3p、TLR4 mRNA及TLR4蛋白表达水平比较
与正常对照组比较,模型组和miR-455-3p NC组miR-455-3p表达水平降低,TLR4mRNA、TLR4蛋白表达水平升高,差异有统计学意义(P<0.05); 与模型组、miR-455-3p NC组比较, miR-455-3p与miR-455-3p mimics+WT-TLR4组比较, *P<0.05。
mimic组和miR-455-3p mimic+pcDNA组miR-455-3p表达水平升高,TLR4mRNA、TLR4蛋白表达水平降低,差异有统计学意义(P<0.05); 与miR-455-3p mimic+pcDNA组比较, miR-455-3p mimic+pcDNA-TLR4组miR-455-3p表达水平降低,TLR4mRNA、TLR4蛋白表达水平升高,差异有统计学意义(P<0.05); 模型组miR-455-3p、TLR4mRNA及TLR4蛋白表达水平与miR-455-3p NC组比较,差异无统计学意义(P>0.05); miR-455-3p mimic组miR-455-3p、TLR4mRNA及TLR4蛋白表达水平与miR-455-3p mimic+pcDNA组比较,差异无统计学意义(P>0.05)。见表3、图3。
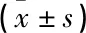
表2 荧光素酶报告基因检测miR-455-3p与TLR4的靶向关系
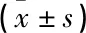
表3 各组大鼠ASMC中miR-455-3p、TLR4 mRNA及TLR4蛋白表达水平比较
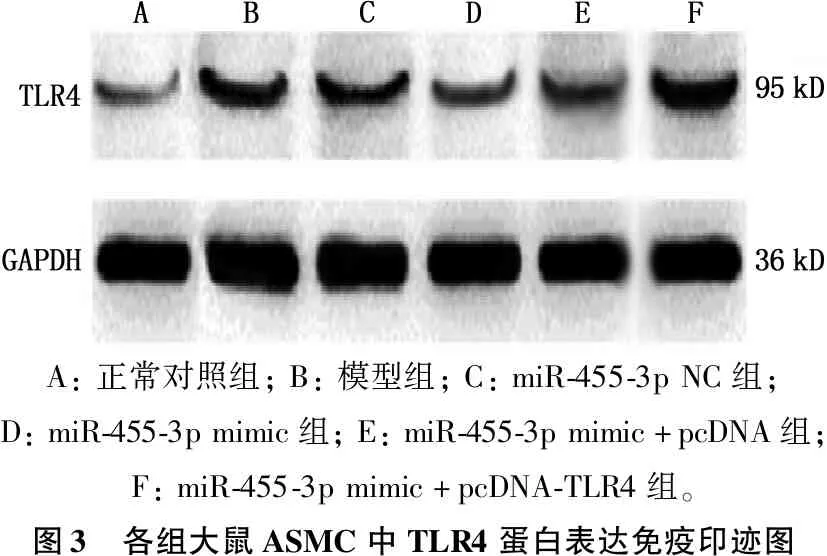
A:正常对照组;B:模型组;C:miR-455-3pNC组;D:miR-455-3pmimic组;E:miR-455-3pmimic+pcDNA组;F:miR-455-3pmimic+pcDNA-TLR4组。图3 各组大鼠ASMC中TLR4蛋白表达免疫印迹图
2.6 各组大鼠ASMC增殖活性和凋亡率比较
与正常对照组比较,模型组和miR-455-3p NC组ASMC增殖活性降低,凋亡率升高,差异有统计学意义(P<0.05); 与模型组、miR-455-3p NC组比较, miR-455-3p mimic组和miR-455-3p mimic+pcDNA组ASMC增殖活性升高,凋亡率降低,差异有统计学意义(P<0.05); 与miR-455-3p mimic+pcDNA组比较, miR-455-3p mimic+pcDNA-TLR4组ASMC增殖活性降低,凋亡率升高,差异有统计学意义(P<0.05); 模型组ASMC增殖活性、凋亡率与miR-455-3p NC组比较,差异无统计学意义(P>0.05); miR-455-3p mimic组ASMC增殖活性、凋亡率与miR-455-3p mimic+pcDNA组比较,差异无统计学意义(P>0.05)。见图4、表4。
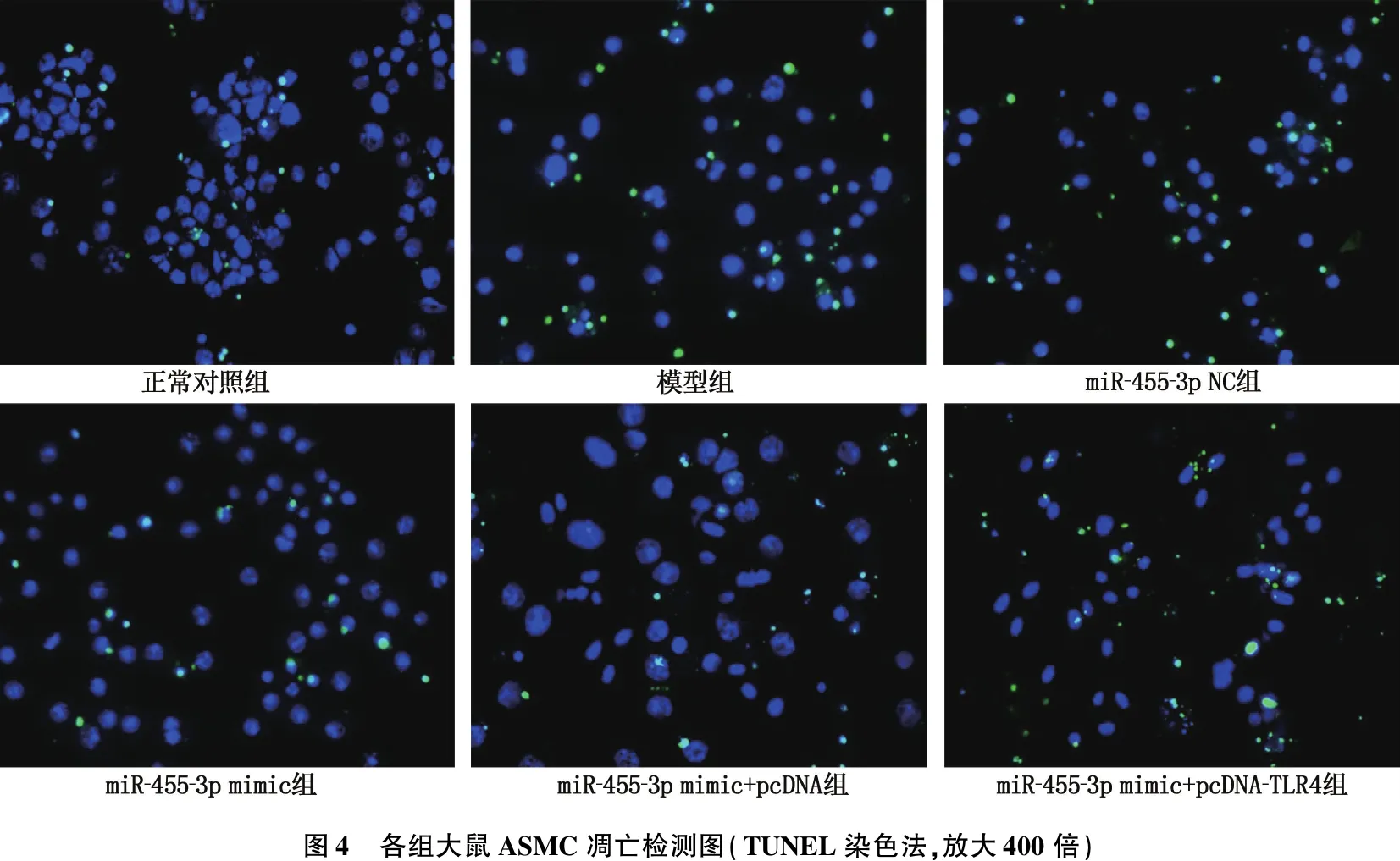
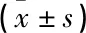
表4 各组大鼠ASMC增殖活性(OD)、凋亡率比较
2.7 各组大鼠ASMC上清液TNF-α、IL-6水平比较
模型组和miR-455-3p NC组ASMC上清液TNF-α、IL-6水平高于正常对照组, miR-455-3p mimic组和miR-455-3p mimic+pcDNA组TNF-α、IL-6水平低于模型组和miR-455-3p NC组,miR-455-3p mimic+pcDNA-TLR4组TNF-α、IL-6水平高于miR-455-3p mimic+pcDNA组,差异均有统计学意义(P<0.05); 模型组TNF-α、IL-6水平与miR-455-3p NC组比较,差异无统计学意义(P>0.05); miR-455-3p mimic组TNF-α、IL-6水平与miR-455-3p mimic+pcDNA组比较,差异无统计学意义(P>0.05)。见表5。
表5 各组大鼠ASMC上清液TNF-α、IL-6水平比较 ng/L
3 讨 论
miR-455-3p是一种与人类多种疾病密切相关的小RNA, 参与多种病理生理过程的调控[10]。CHENG F等[11]报道, miR-455-3p参与骨关节炎中白细胞介素-1(IL-1)诱导的细胞凋亡和炎症反应。SUN Y等[12]研究发现, miR-455-3p在结直肠癌中发挥抑癌作用,通过靶向肿瘤蛋白翻译控制1基因抑制癌细胞增殖。另外, miR-455-3p在免疫系统中具有抗炎作用,与多发性硬化症患者的疾病严重程度高度相关,其表达与炎症预测靶点髓样分化因子88(MyD88)呈负相关[13]。由此提示, miR-455-3p在不同疾病中发挥的作用可能不尽相同。本研究结果显示,与正常大鼠比较,哮喘大鼠肺组织中miR-455-3p显著下调,且肺组织和血清中炎性因子TNF-α、IL-6水平显著升高,提示miR-455-3p可能在哮喘中发挥负调控作用。本研究通过生物学信息预测发现, miR-455-3p与TLR4存在靶向结合位点,进一步开展双荧光素酶报告基因实验进行验证,提示TLR4是miR-455-3p潜在靶基因。XU X等[7]研究发现, miR-455-3p可能通过靶向TLR4基因抑制冠心病进展。然而, miR-455-3p靶向TLR4对哮喘大鼠ASMC生物学行为及炎症因子分泌功能的影响尚需进一步研究。
TLRs是固有免疫中重要的模式识别受体家族,包含TLR1至TLR10共10个成员,其中TLR4信号通路异常激活可导致气道中性粒细胞、单核细胞及Th2淋巴细胞等产生大量炎症因子,引起气道高反应,促进哮喘发生与发展[14]。TLR4/MyD88信号通路参与调控哮喘和小鼠气道炎症的发生与发展[15]。ASMC是气道炎症的效应细胞,其过度增殖或凋亡不足与哮喘进展密切相关。相关研究[16-17]表明, TLR4表达可启动和调节哮喘气道炎症反应,进而激活下游核因子κB(NF-κB)和TNF-α、IL-6等炎性因子,参与调控ASMC增殖与凋亡,促进气道重塑。本研究用TNF-α刺激哮喘大鼠ASMC, 使其产生炎症反应,然后转染miR-455-3p NC、miR-455-3p mimic和共转染miR-455-3p mimic与pcDNA、共转染miR-455-3p mimic与pcDNA-TLR4。本研究结果显示,与正常对照组相比,模型组大鼠ASMC中miR-455-3p表达水平、ASMC增殖活性显著降低,TLR4mRNA及TLR4蛋白表达水平、凋亡率和ASMC上清液TNF-α、IL-6水平显著升高,提示模型组细胞中miR-455-3p下调、TLR4上调,两者可能共同参与ASMC的凋亡和炎症反应; 与转染miR-455-3p NC比较,过表达miR-455-3p可使ASMC中miR-455-3p表达水平、ASMC增殖活性显著升高,TLR4mRNA及TLR4蛋白表达水平、凋亡率和ASMC上清液TNF-α、IL-6水平显著降低,说明过表达miR-455-3p可能通过靶向抑制TLR4减少ASMC凋亡和降低炎症因子水平; 与共转染miR-455-3p mimic与pcDNA比较,共转染miR-455-3p mimic与pcDNA-TLR4可使ASMC中miR-455-3p表达水平、ASMC增殖活性显著降低,TLR4mRNA及TLR4蛋白表达水平、凋亡率和ASMC上清液TNF-α、IL-6水平显著升高,反向验证了上调TLR4可减弱miR-455-3p对ASMC凋亡和炎症反应的抑制作用,提示过表达miR-455-3p可通过靶向抑制TLR4表达,减轻哮喘大鼠ASMC炎症反应,调节其增殖与凋亡平衡,发挥保护作用,同时过表达TLR4可消除miR-455-3p对哮喘大鼠ASMC的保护作用。
综上所述,过表达miR-455-3p可能通过靶向抑制TLR4表达,减轻哮喘大鼠ASMC炎症反应,调节其增殖与凋亡平衡,发挥重要的保护作用。但调控TLR4的miRNA众多,且影响哮喘ASCM增殖、凋亡的机制复杂,其他miRNA及信号通路是否共同参与哮喘大鼠ASMC增殖与凋亡平衡的调节尚不明确,有待进一步深入探究,且后续将继续开展动物体内实验探讨miR-455-3p对哮喘大鼠的影响。
