克雷伯氏菌乙醛脱氢酶基因过表达及产乙醇发酵工艺优化
2022-12-11陈翔宇胡永安
查 凡,周 柱,张 琴*,陈 振,陈翔宇,胡永安
(安徽工程大学 生物与食品工程学院,安徽 芜湖 241000)
进入21世纪,以石油为主的化工炼制方式已不能满足全球经济、社会发展的需求,以可再生资源为基础的生物基化学品炼制日益兴起。乙醇是目前生物炼制领域相对容易实现产业化的重要生物能源产品之一,可作为高辛烷值燃料和燃油增氧剂添加至汽油中使用,不仅能够提供与汽油相当的化学能,还能提高汽油的抗爆性,降低汽车尾气排放,被认为是一种极具潜力的化石能源替代品[1]。随着市场需求的增加,第二代纤维素燃料乙醇在原料成本和政策方面已颇具竞争优势,因而成为生物能源企业竞争的焦点[2]。
近年来,木质纤维素资源作为一种地球上广泛存在且可持续利用的生物质资源,以其为原料生产乙醇已成为燃料乙醇领域的研究热点[3-6]。如何提高过程效率、降低生产成本是关乎纤维素乙醇高效生产的重点,亦是决定其产业化的关键。酿酒酵母(Saccharomyces cerevisiae)或运动发酵单胞菌(Zymomonas mobilis)是用于乙醇发酵的主要微生物菌株,但其不能分解利用纤维素,亦不能有效转化利用木质纤维素水解液中的木糖[7-8],使其在纤维素燃料乙醇生产中不具优势。
乙醛脱氢酶是乙醇代谢途径中的关键酶,在真核生物(如人、酵母菌)中,乙醛脱氢酶是催化乙醇降解的关键酶[9-10]。然而,在原核生物中,乙醛脱氢酶在不同的物种中发挥不同的功能,有研究表明,乙醛脱氢酶可催化芽孢杆菌(Bacillussp.)中乙酸的合成[11];而在具有混合酸发酵途径的兼性厌氧细菌,如大肠杆菌(Escherichia coli)、克雷伯氏菌(Klebsiellasp.)中,乙醛脱氢酶主要催化乙酸和乙醇合成的代谢支路,对乙醇的合成亦起到一定的促进作用[12-15];HONG W K等[16]在多形汉逊酵母(Hansenula polymorpha)中表达了来自运动发酵单胞菌的丙酮酸脱羧酶和乙醛脱氢酶基因,使得乙醇产量较之野生菌株提高3.3倍;MANOW R等[17]在产乙醇大肠杆菌RM10中表达了乙醛脱氢酶基因aldB,使其发酵木糖的乙醇产量明显提高。本研究中的克雷伯氏菌(Klebsiellasp.)WL1316为一株具备混合酸发酵途径的兼性厌氧细菌,已报道能利用木质纤维素水解液中葡萄糖和木糖合成生物氢[18-20],在其发酵产氢过程中,乙醇亦有较高的积累量[19-20]。
为此,本研究基于克雷伯氏菌(Klebsiellasp.)WL1316的全基因组信息[21],拟通过同源过表达其乙醇合成途径中的关键酶—乙醛脱氢酶基因aldh,实现该菌株乙醇合成代谢途径的强化,获得既能有效利用木质纤维素水解糖液又能高效合成乙醇的工程菌株,并通过单因素试验及响应面试验对重组菌株发酵产乙醇的工艺条件进行优化,以期获得高产乙醇的重组菌株及其最优发酵工艺,对纤维素乙醇的高效廉价开发具有重要的理论和实践意义。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株、质粒和引物
克雷伯氏菌(Klebsiellasp.)WL1316、大肠杆菌(Escherichia coli)DH5α、原核表达质粒pET-28a均为本实验室保藏。试验中用于乙醛脱氢酶aldh基因克隆和亚克隆的引物见表1,引物的合成和后续的基因测序均由生工生物工程(上海)股份有限公司完成。
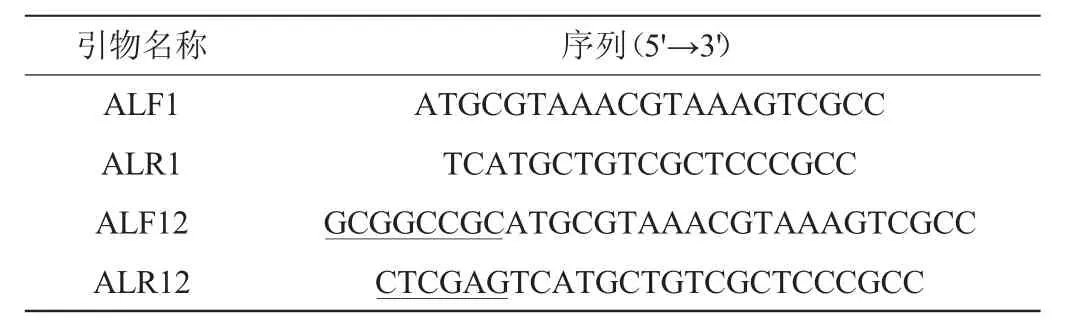
表1 用于aldh基因克隆和亚克隆的引物及序列Table 1 Primers and sequences for aldh gene cloning and subcloning
1.1.2 试剂
NotI、XhoI限制性核酸内切酶、T4脱氧核糖核酸(deoxyribonucleic acid,DNA)连接酶、DL5 000 DNA Marker:宝日医生物技术(北京)有限公司;细菌基因组DNA抽提试剂盒、质粒小量抽提试剂盒、T载体聚合酶链式反应(polymerase chain reaction,PCR)产物克隆试剂盒、TaqPCR Master Mix、PCR产物纯化试剂盒、DNA胶回收试剂盒、TureColor双色预染蛋白Marker、细菌总蛋白提取试剂盒、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)变性丙烯酰胺凝胶快速制备试剂盒:生工生物工程(上海)股份有限公司;K-ETOH乙醇检测试剂盒:爱尔兰Megazyme公司;其他试剂均为国产分析纯。
1.1.3 培养基
LB液体培养基[17]:胰蛋白胨10 g,酵母粉5 g,NaCl 10 g,蒸馏水1 000 mL,121 ℃高压蒸汽灭菌20 min。LB固体培养基中添加琼脂20 g。
活化和种子培养基[19-20]:D-木糖10 g,葡萄糖10 g,牛肉膏5 g,蛋白胨10 g,NaCl 5 g,KH2PO40.5 g,MgSO4·7H2O 1 g,pH7.5,蒸馏水1 000 mL,110 ℃高压蒸汽灭菌30 min。
发酵培养基[16-17]:稻草水解液(初始还原糖质量浓度50 g/L)1 000 mL,牛肉膏5 g,蛋白胨10 g,NaCl 5 g,KH2PO40.5 g,MgSO4·7H2O 0.5 g,异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactoside,IPTG)1 mmol/L,pH值7.5,110 ℃高压蒸汽灭菌30 min。
1.2 仪器与设备
T100梯度PCR仪、SYSTEM GelDoc XR+凝胶成像系统、PowerPac电泳仪:美国Bio-Rad公司;Microfuge 20R高速冷冻离心机:美国贝克曼公司;754PC紫外可见分光光度计:上海菁华仪器有限公司;Scientz IID超声波细胞破碎仪:宁波新芝生物科技股份有限公司;TU-100C恒温金属浴:上海一恒科学仪器有限公司;MultiskanTMFC酶标仪、酶标板:赛默飞世尔科技(中国)有限公司。
1.3 方法
1.3.1Klebsiellasp.WL1316乙醛脱氢酶aldh基因的克隆和亚克隆
作为具有混合酸发酵途径的兼性厌氧细菌,乙醛脱氢酶为调控Klebsiellasp.WL1316合成乙酸和乙醇代谢支路的关键酶[21],该菌株已进行全基因组测序[21],且其基因组数据已提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的SRA(sequence read archive)数据库并获得BioProject登录号PRJNA611005。为此,基于该菌株基因组数据的功能蛋白预测和基因注释,针对乙醛脱氢酶大亚基基因进行引物设计,并命名该基因为乙醛脱氢酶aldh基因。
采用细菌基因组DNA抽提纯化试剂盒提取克雷伯氏菌(Klebsiellasp.)WL1316的基因组DNA,以此作为模板,采用引物对ALF1/ALR1 PCR扩增aldh基因,用PCR产物纯化试剂盒纯化目的基因,连接pUCm-T载体,并转化至大肠杆菌(Escherichia coli)DH5α感受态细胞,再涂布于含20 μg/mL氨苄青霉素的LB平板上,37 ℃条件下培养14 h。获得的转化子进一步进行PCR验证,并进行测序验证,测序正确的即为所需阳性克隆。采用引物对ALF12/ALR12 PCR扩增含NotI、XhoI酶切位点的aldh基因,实现aldh基因的亚克隆,连接pUCm-T载体,按上述方法转化大肠杆菌(Es-cherichia coli)DH5α感受态细胞,筛选阳性克隆,并进行测序验证,获得正确的克隆子aldh-pUCm-T-Escherichia coliDH5α。
1.3.2 重组质粒aldh-pET-28a的构建、转化及验证
从aldh-pUCm-T-Escherichia coliDH5α中提取aldhpUCm-T克隆质粒,采用NotI/XhoI进行双酶切并纯化目的基因,与同样双酶切且纯化的pET-28a载体连接,构建重组质粒aldh-pET-28a,转化至大肠杆菌DH5α感受态细胞,将其涂布于含10 μg/mL卡那霉素的LB平板,37 ℃条件下培养14 h,筛选阳性转化子。通过菌液PCR得到重组表达质粒并进行双酶切,采用1.0%琼脂糖凝胶电泳对双酶切产物进行检测,获得正确的转化子aldh-pET-28a-Escherichia coliDH5α。
1.3.3 过表达aldh基因重组菌株的构建
从构建成功的aldh-pET-28a-Escherichia coliDH5α中提取重组质粒aldh-pET-28a,采用CaCl2法将该重组质粒转化至Klebsiellasp.WL1316感受态细胞,涂布含10 μg/mL卡那霉素的LB平板,37 ℃条件下培养14 h,获得转化子,并抽提质粒,再进行双酶切和测序验证,验证正确的菌株即为研究所得的重组菌株aldh-pET-28a-Klebsiellasp.WL1316。
1.3.4 目的蛋白诱导表达和SDS-PAGE电泳检测
将过表达aldh基因的重组菌aldh-pET-28a-Klebsiellasp.WL1316和野生菌Klebsiellasp.WL1316分别接种于LB固体培养基(重组菌的培养基中加10μg/mL卡那霉素),37℃条件下活化16 h;挑单菌落接种于10 mL LB液体培养基(重组菌的培养基中加10 μg/mL卡那霉素)中,37 ℃、180 r/min条件下培养过夜;取培养好的菌液5mL接种于新鲜的100 mL LB液体培养基(重组菌的培养基中加10 μg/mL卡那霉素)中,野生菌在37 ℃、180 r/min条件下培养8 h;重组菌在37 ℃、180 r/min条件下培养2 h时,在重组菌发酵液中加入无菌的IPTG至终浓度为1 mmol/L,37 ℃、180 r/min条件下继续诱导培养6 h。取20 mL菌液8 000 r/min条件下离心5 min,收集菌体,采用细菌总蛋白提取试剂盒提取菌体中的总蛋白;采用SDS-PAGE变性丙烯酰胺凝胶快速制备试剂盒对蛋白质进行检测。
1.3.5 过表达aldh基因重组菌株发酵稻草水解液产乙醇过程的研究
挑取活化好的野生菌Klebsiellasp.WL1316和过表达aldh基因重组菌株aldh-pET-28a-Klebsiellasp.WL1316的单菌落,分别接种于3 mL种子培养基(重组菌的培养基中加10 μg/mL卡那霉素)中,37 ℃、180 r/min条件下培养12~14 h作为一级种子液;按10%(V/V)的接种量将一级种子液接种于30 mL种子培养基(重组菌的培养基中加10 μg/mL卡那霉素)中,野生菌在37 ℃、180 r/min条件下培养8 h,作为二级种子液;重组菌在37 ℃、180 r/min条件下培养2 h时,加入无菌的IPTG至终浓度为1 mmol/L,37 ℃、180 r/min条件下继续诱导培养6 h,作为二级种子液。将二级种子液按10%(V/V)的接种量接入发酵培养基,37 ℃、180 r/min条件下培养12 h,之后转入第二段厌氧发酵,37 ℃静置发酵至72 h。每12 h取发酵液,8 000 r/min条件下离心5 min,收集上清液,采用K-ETOH乙醇检测试剂盒检测乙醇含量,采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法[22]检测葡萄糖含量,采用地衣酚比色法[23]检测木糖含量,并计算葡萄糖和木糖利用率,其计算公式如下:

1.3.6 过表达aldh基因重组菌株发酵稻草水解液产乙醇工艺优化
单因素试验:按照1.3.5的方法依次考察IPTG浓度(0、0.5 mmol/L、1.0 mmol/L、1.5 mmol/L、2.0 mmol/L)、发酵培养基初始pH值(6.5、7.0、7.5、8.0、8.5)和初始还原糖含量(25 g/L、50 g/L、75 g/L、100 g/L)对乙醇产量的影响。
响应面试验:在单因素试验的基础上,以乙醇产量(Y)为响应值,以IPTG浓度(A)、初始pH值(B)及初始还原糖含量(C)为考察因素,采用Design-Expert 12.0软件设计3因素3水平的响应面试验,试验因素与水平见表2。

表2 过表达aldh基因重组菌株发酵稻草水解液产乙醇工艺优化响应面试验因素与水平Table 2 Factors and levels of response surface tests for process optimization of ethanol production from rice straw hydrolysate by gene recombinant strain of overexpressing aldh gene
2 结果与分析
2.1 Klebsiella sp.WL1316乙醛脱氢酶基因aldh的克隆和亚克隆
采用1.0%琼脂糖凝胶电泳对aldh基因克隆和亚克隆的PCR扩增产物进行检测,结果见图1。由图1可知,PCR扩增产物碱基长度均约为1 000 bp,与预期目标条带大小相符,表明获得了这个基因的克隆和亚克隆产物。克隆和亚克隆PCR扩增产物与pUCm-T载体连接,并转化至大肠杆菌DH5α感受态细胞,进一步筛选获得的阳性克隆,进行测序验证,结果表明,该aldh基因序列与肺炎克雷伯菌(Kleb siella pneumoniae)(GenBank登录号:WP_117070081.8)的乙醛脱氢酶基因序列的一致性达100%,并与Klebsiellasp.WL1316的基因组解析结果完全一致,说明克隆获得了序列正确的aldh基因。
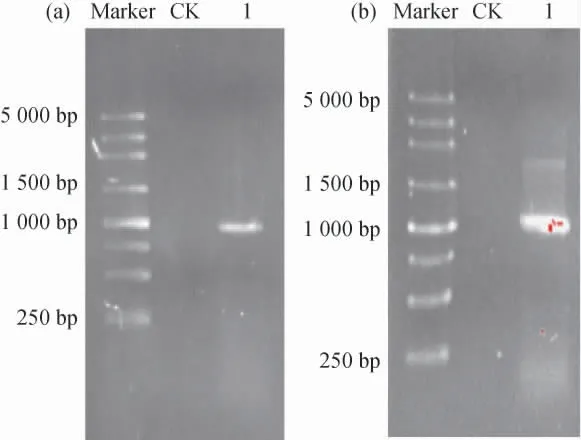
图1 aldh基因克隆(a)和亚克隆(b)PCR扩增产物琼脂糖凝胶电泳结果Fig.1 Results of agarose gel electrophoresis of PCR amplification products of aldh gene clones (a) and subclones (b)
2.2 过表达aldh基因重组菌株的构建
提取阳性克隆的aldh-pUCm-T质粒,双酶切并纯化目的基因,与同样双酶切的pET-28a载体连接、转化、筛选,获得重组菌株aldh-pET-28a-Klebsiellasp.WL1316。提取重组表达质粒aldh-pET-28a,采用NotI/XhoI进行双酶切,用1.0%琼脂糖凝胶电泳对双酶切产物进行检测,结果见图2。
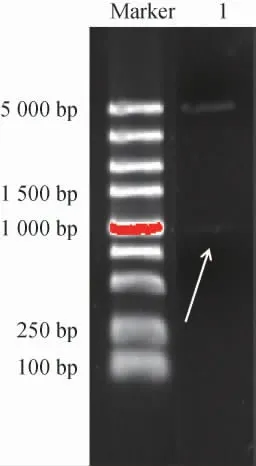
图2 重组表达质粒aldh-pET-28a双酶切产物琼脂糖凝胶电泳检测结果Fig.2 Determination results of agarose gel electrophoresis of double digestion products of recombinant expression plasmid aldh-pET-28a
由图2可知,获得了碱基长度正确的目的条带,表明得到正确的重组菌株aldh-pET-28a-Klebsiellasp.WL1316。
2.3 aldh基因的同源过表达
重组菌株通过IPTG诱导表达,采用SDS-PAGE检测目的蛋白,结果见图3。
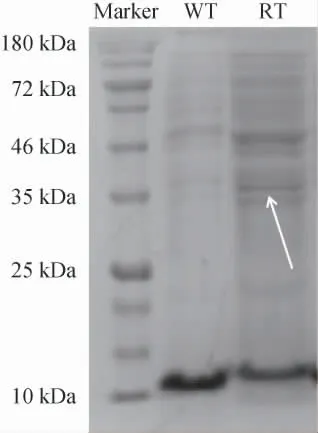
图3 目的蛋白SDS-PAGE电泳图Fig.3 SDS-PAGE electrophoretic diagram of target protein
理论上,aldh基因序列翻译后的目的蛋白分子质量应该为32.8 kDa,由图3可知,在分子质量接近35 kDa处出现了条带,并较之野生菌有一定加深,初步表明该乙醛脱氢酶基因在Klebsiellasp.WL1316中实现了同源过表达。
2.4 重组菌株aldh-pET-28a-Klebsiella sp.WL1316发酵稻草水解液产乙醇过程的研究
有研究表明,乙醛脱氢酶表达量越高,乙醇产量越高[17]。为研究aldh基因表达对菌株乙醇合成及稻草水解液中葡萄糖和木糖的利用动态,本研究对重组菌aldh-pET-28a-Klebsiellasp.WL1316和野生菌Klebsiellasp.WL1316发酵72 h内的乙醇产量及葡萄糖和木糖利用率的动态变化进行监测,结果见图4。由图4A可知,在菌株发酵过程中,乙醇呈动态积累的趋势,可能是由于菌株中存在不同功能乙醛脱氢酶,使得菌株乙醇产量在一定发酵阶段达到峰值。当重组菌aldh-pET-28a-Klebsiellasp.WL1316发酵至60 h时,乙醇产量达到最高,为(4.92±0.03)g/L,较野生菌Klebsiellasp.WL1316提高18.3%,可推测菌株中过表达aldh基因有利于乙醇在60 h的积累,为此,选择60 h为适宜的发酵时间。由图4B亦可知,重组菌aldh-pET-28a-Klebsiellasp.WL1316的葡萄糖和木糖利用率和野生菌Klebsiellasp.WL1316的无显著差异(P<0.05),由此可认为,重组菌aldh-pET-28a-Klebsiellasp.WL1316保持了野生菌Klebsiellasp.WL1316利用木质纤维素水解液中葡萄糖和木糖的能力,aldh基因的表达并未降低其糖利用效率。
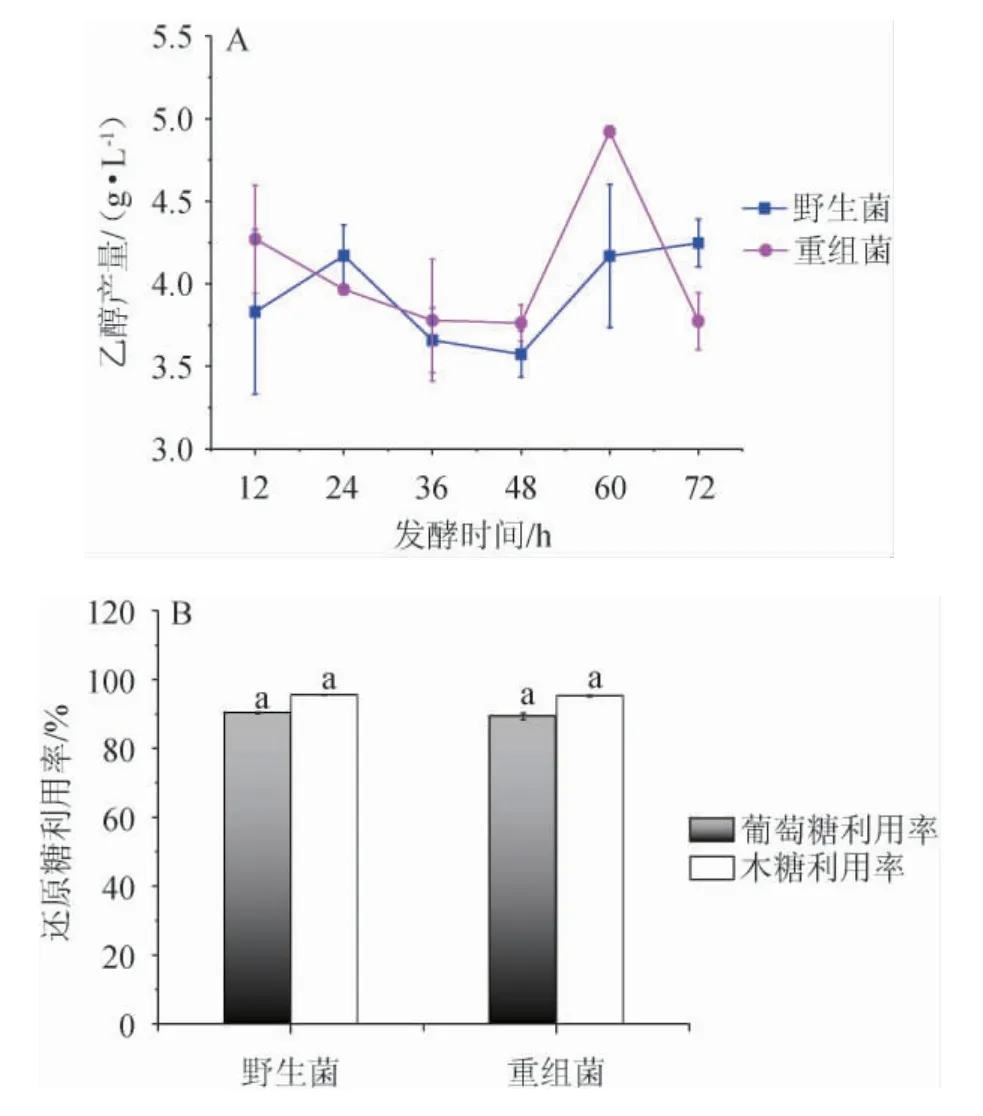
图4 重组菌和野生菌的乙醇产量(A)和还原糖利用率(B)Fig.4 Ethanol production (A) and reducing sugar utilization rate (B)of recombinant strain and wild strain
2.5 过表达aldh基因重组菌株发酵稻草水解液产乙醇工艺优化
2.5.1 单因素试验
IPTG浓度、发酵培养基初始pH值和初始还原糖含量对重组菌aldh-pET-28a-Klebsiellasp.WL1316发酵稻草水解液生产乙醇的影响见图5。

图5 IPTG浓度(A)、初始pH值(B)及初始还原糖含量(C)对重组菌株发酵稻草水解液产乙醇的影响Fig.5 Effects of IPTG concentration (A),initial pH (B) and initial reducing sugar content (C) on ethanol production from rice straw hydrolysate fermented by recombinant strain
在原核基因表达过程中,诱导剂能够提高重组蛋白的整体表达量[17]。由图5A可知,IPTG诱导浓度在0.5~2.0 mmol/L范围内,乙醇产量较未诱导菌株的均显著提高(P<0.05),尤以1.0 mmol/L的诱导菌株效果最好,其乙醇产量可达(4.90±0.05)g/L,较未诱导的提高35.00%。因此,选择IPTG最佳诱导浓度为1.0 mmol/L。
由图5B可知,在1.0 mmol/L IPTG诱导下,重组菌株aldh-pET-28a-Klebsiellasp.WL1316在初始pH6.5~8.5的范围内均能有效地合成乙醇,乙醇产量呈先升高后下降的趋势,当初始pH值为7.5时,乙醇产量最高,为(4.92±0.03)g/L。因此,选择pH7.5为最适宜的发酵初始pH值。
由图5C可知,在IPTG诱导浓度和发酵初始pH值固定为1.0 mmol/L和7.50条件下,重组菌株aldh-pET-28a-Klebsiellasp.WL1316在初始还原糖含量为25~100 g/L范围内,乙醇产量呈先升高后下降的趋势,分析原因可能是初始还原糖含量较低可能引起碳源不足,但初始还原糖含量过高又会对乙醇的积累起到一定的抑制作用。当初始还原糖含量为50 g/L时,乙醇产量最高,为(4.99±0.59)g/L。因此,选择50 g/L为最佳的初始还原糖含量。
2.5.2 响应面试验
响应面试验设计及结果见表3,方差分析结果见表4。
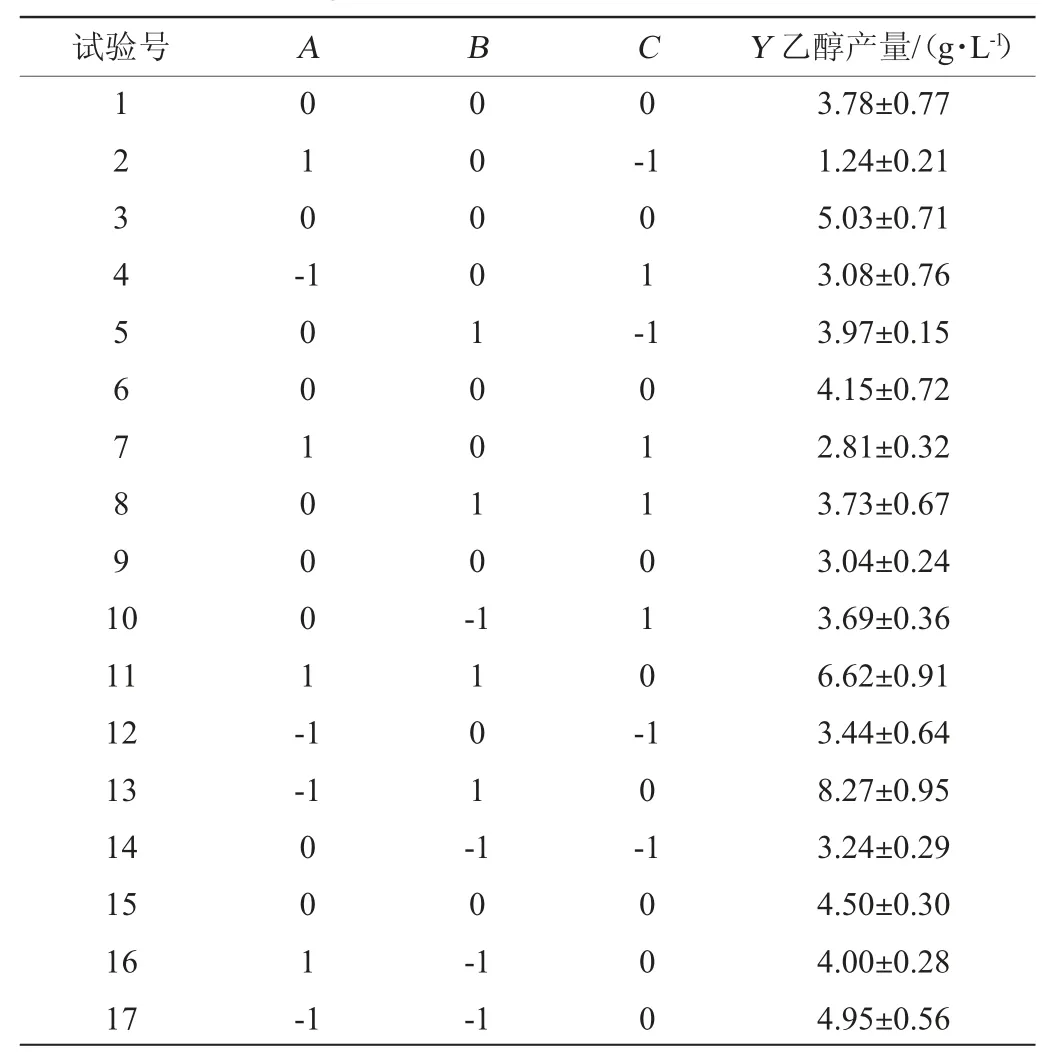
表3 响应面试验设计及结果Table 3 Design and results of response surface tests

表4 回归模型方差分析Table 4 Variance analysis of regression model
采用Design-Expert 12.0软件对表3结果进行二次回归分析,得重组菌株aldh-pET-28a-Klebsiellasp.WL1316乙醇含量的二次多元回归方程如下:

由表4可知,模型显著(P<0.05),而失拟项不显著(P>0.05),表明建立的模型拟合程度良好。决定系数R2可对模型的精确性和变异性进行评估[24-25],本模型的R2为0.853 7,表明实测值和预测值之间呈较显著的相关关系,响应值的大多数变化都能通过模型进行预测。由表4亦可知,二次项C2对结果影响极显著(P<0.01),一次项B和二次项B2对结果影响显著(P<0.05),其他项对结果影响不显著(P>0.05)。
采用Design-Expert 12.0软件对回归方程进行求解,得到重组菌株aldh-pET-28a-Klebsiellasp.WL1316发酵稻草水解液产乙醇的最佳工艺条件为:IPTG诱导浓度1.45 mmol/L,初始pH值7.29,初始还原糖含量59.10 g/L,乙醇产量理论值为5.11 g/L。为便于实际操作,将最优发酵工艺修正为IPTG浓度1.5 mmol/L,初始pH值7.3,初始还原糖含量59 g/L,采用最优发酵工艺得到重组菌株aldh-pET-28a-Klebsiellasp.WL1316的乙醇产量实际值为(5.39±0.51)g/L,与理论值接近,是同等发酵条件下野生菌Klebsiellasp.WL1316乙醇产量[(3.67±0.32)g/L]的1.47倍,可见aldh基因的过表达促进了乙醇产量的提高,这与OH B R等[26]报道的在肺炎克雷伯氏菌中过表达乙醛/乙醇脱氢酶AdhE基因的促乙醇合成效果类似,由此也证明了本研究基因操作策略的可行性。
3 结论
本研究成功构建了同源过表达aldh基因的重组菌株aldh-pET-28a-Klebsiellasp.WL1316,其发酵稻草水解液60 h时的乙醇含量较野生菌株提高18.3%,并保持了野生菌株利用木质纤维素水解液中葡萄糖和木糖的特性,这对于纤维素乙醇的生产至关重要。通过单因素和响应面试验得到重组菌aldh-pET-28a-Klebsiellasp.WL1316发酵稻草水解液产乙醇的最优发酵工艺条件为:发酵时间60 h,IPTG浓度1.5 mmol/L,发酵培养基初始pH值7.3,初始还原糖含量59 g/L,在此最优工艺条件下,乙醇产量为(5.39±0.51)g/L,较同等发酵条件下野生菌株Klebsiellasp.WL1316的乙醇产量[(3.67±0.32)g/L]提高47%。可见,本研究对纤维素乙醇发酵生产基因重组菌株的研发及乙醇燃料的高效廉价开发具有重要的理论和实践意义。
