黄芩-连翘配伍对脂多糖诱导小鼠急性肺炎模型的保护作用
2022-12-10武振帅纪鹏魏彦明徐誉彰张晓松武凡琳任建明李琛琛华永丽姚万玲袁子文
武振帅,纪鹏,魏彦明,徐誉彰,张晓松,武凡琳,任建明,李琛琛,华永丽,姚万玲,袁子文
(甘肃农业大学动物医学院,兰州 730070)
畜禽肺炎发病率高、发病急且病死率高,严重危害养殖效益。如多杀性巴氏杆菌、溶血性巴氏杆菌、肺炎链球菌、结核杆菌等常可引起犊牛肺炎[1];链球菌、肺炎球菌、葡萄球菌等都可引起羊肺炎,对羊只剖检发现其肺部有发炎及质变的迹象[2]。脂多糖(LPS),又名内毒素,是革兰氏阴性菌细胞壁外膜中的主要成分,当浓度升高时会引发强烈炎症反应,其在动物体内可以诱发炎性细胞浸润,TNF-α、IL-1β、IL-6 等炎症因子的释放[3],引起的炎症机理与革兰氏阴性菌感染相似,故采用LPS 建立急性肺炎动物模型属于经典方法之一[4]。可通过建立小鼠急性肺炎模型来筛选防治药物。急性肺炎所致急性肺损伤(acute lung injury,ALI)是心肺功能衰竭、氧化应激、急性炎症性疾病等多种因素引起的一种严重的呼吸系统疾病,可引起严重临床并发症和高死亡率,并可导致呼吸窘迫综合征[5-7]。肺表面活性物质 (pulmonary surfactant,PS)是由Ⅱ型肺泡上皮细胞(alveolar epithelium cell Ⅱ,AECⅡ)分泌的一种脂蛋白,主要含有4 种蛋白,但只有表面活性物质相关蛋白C(surfactant-associated protein C,SFTPC)是Ⅱ型肺泡上皮细胞表达的活性蛋白[8]。阮玲瑛等[9]研究表明Ⅱ型肺泡上皮细胞与许多肺部疾病的发生及病理过程有关。中药黄芩,是唇形科植物黄芩的干燥根[10],具有清热燥湿、泻火解毒、止血安胎等功效,常用于治疗肺热咳嗽、黄疸等[11],其主要活性成分为黄芩苷、汉黄芩苷、黄芩素、汉黄芩素等。连翘为木犀科植物,具有清热解毒、散结消肿、疏散风热功效,常用于治疗肺炎、痢疾和疮疡等[12-13],其主要活性成分为连翘苷、连翘脂素、木犀草素与牛蒡子苷元等。黄芩和连翘配伍,遵循了中药药对相须为用的原则,是中(兽)医临床上防治温热病的常用药对之一[14]。因此,本研究主要分析了黄芩-连翘不同配伍比例对小鼠急性肺炎的保护效果差异,旨在筛选出防治急性肺炎效果确切的最佳配伍比例,为后期开发畜禽肺炎防治药物奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验动物
144 只4 周龄SPF 级雄性KM 小鼠,体重18~22 g,购自兰州兽医研究所实验动物中心【SCXK(甘)2020-0002】,饲养场地为甘肃省动物疾病防治药物创制工程研究中心实验动物房【SYXK(甘)2019-0002】,12 h 光照,12 h 黑暗周期循环,自由饮食饮水,适应性喂养3 d 后开始实验。动物实验获得甘肃农业大学伦理委员会批准(GSAU-Eth-VMC-2021-013)。在小鼠饲养和实验过程中已做到按实验动物使用的3R 原则给予人道主义的关怀。
1.1.2 主要试剂与仪器
黄芩、连翘饮片购自甘肃省兰州市黄河药材市场,经甘肃农业大学动物医学院中兽医教研室魏彦明教授鉴定;地塞米松(广东华南药业集团有限公司,国药准字H44024469);LPS(索莱宝);TNF-α 试剂盒(上海酶联,货号:ml002095)、IL-1β 试剂盒(上海酶联,货号:ml063132)和IL-6 试剂盒(上海酶联,货号:ml002293)、Rabbit Anti-SFTPC Polyclonal Antibody (bs-10067R)购自北京博奥森生物技术有限公司、SFTPC Polyclonal Antibody 购自武汉三鹰生物技术有限公司等。
YP502N 电子天平(上海天美天平仪器有限公司);血常规分析仪(Boule Medical AB 公司);Olympus DP-71 显微照相系统(日本Olympus 公司);石蜡切片机(德国Leica 公司,型号:RM2245);KD-BM 组织包埋机(上海艾牧生物科技有限公司);DZ5-WS 多管架自动平衡离心机(长沙湘仪离心机仪器有限公司);BSA224S-CW 分析天平(赛多利斯科学仪器有限公司);Spectra Max Plus384酶标仪(美谷分子仪器有限公司)等。
1.2 方法
1.2.1 实验药物的制备
取黄芩、连翘饮片,粉碎后过60 目筛,备用。分别按照9 个黄芩-连翘不同比例(3∶2,3∶0,3∶1,2∶1,1∶1,2∶3,1∶2,1∶3,0∶3)制备不同混合物,各取6.00 g 于500 mL 圆底烧瓶中,加入120 mL蒸馏水,加热回流1 h,3500 r/min 离心5 min,取上清液。余下药渣再加入120 mL 蒸馏水,加热回流30 min,3500 r/min 离心5 min,合并2 次取上清液,真空浓缩至48 mL。
1.2.2 动物实验与采样
将144 只健康KM 小鼠随机分为正常对照组(K)、模型组(M)、9 个黄芩-连翘不同比例(3∶2,3∶0,3∶1,2∶1,1∶1,2∶3,1∶2,1∶3,0∶3)配伍干预组、地塞米松阳性药物组(Y)组,每组12 只。地塞米松阳性药物组给予地塞米松2 mg/kg,9 个黄芩-连翘不同比例(3∶2,3∶0,3∶1,2∶1,1∶1,2∶3,1∶2,1∶3,0∶3)配伍干预组依次给予相应药物的提取液0.1 mL/10 g(相当于生药量1.2 mg/10 g),灌服,1 次/日,连续7 d,正常对照组和模型组给予等量生理盐水。参考Ye 等[15]的方法,在实验第8 天,灌药1 h 后,除正常对照组外,其他组均采用LPS(10 mg/kg 体重)滴鼻造模,造模前12 h 禁食不禁水。将小鼠腹腔注射3%戊巴比妥钠溶液麻醉;然后用移液器精确吸取浓度为10 mg/mL 的LPS溶液,左手控制住小鼠的头部,右手轻轻推移液器,枪头可见吸取的小液滴,轻轻靠向小鼠右鼻孔,左手立刻快速有力度的向上提35 cm 左右,再缓慢轻轻回到左手起始位置,进行来回10 次,然后同样的操作向小鼠左鼻孔滴加小液滴,左右鼻孔依次滴加,直至液体滴注完成,最后松开小鼠,将小鼠置于鼠板,腹部朝上、头部朝上倾斜的体位保持30 min以上,待小鼠复苏,放回原笼饲养观察。实验过程中记录小鼠采食量与体重。观察各组小鼠精神状态、活动状态等,并记录。小鼠造模6 h 后,采取血液样本后,用3%戊巴比妥钠溶液麻醉,然后将小鼠固定在手术板上,采取心、肝、脾、肺、肾、胸腺。计算心、肝、脾、肺、肾、胸腺的器官指数。计算公式如下:脏器指数=器官质量/动物体质量。
1.2.3 血常规检测与血清制备
各组小鼠采集全血首先进行血常规检测,然后将余下全血置于1.5 mL 离心管中,静置后经3500 r/min 离心15 min,取血清置于-80℃冰箱保存。
1.2.4 肺病理组织学观察
将肺以4%的甲醛固定14 d 后,通过常规石蜡包埋、切片、HE 及IHC 染色并观察。
1.2.5 小鼠血清炎性因子测定按照ELISA 试剂盒说明书进行操作,测定各组小鼠血清中TNF-α、IL-1β、IL-6 含量。
1.3 统计学分析
采用SPSS 26.0 统计学软件进行统计学处理,符合正态分布的定量资料以平均值 ± 标准差()来表示,多组资料之间比较采用单因素方差分析,事后比较采用LSD 法;非正态分布的定量资料采用非参数检验。P<0.05 表示差异具有显著性,P<0.01 表示差异极具显著性。
2 结果
2.1 一般情况
正常对照组小鼠表现正常,毛发顺滑、比较活泼、呼吸均匀、反应灵敏;模型组小鼠精神状态差,反应迟钝,毛发杂乱,蜷缩扎堆,听诊发现肺部有啰音等。不同给药组较模型组比,整体情况较好,尤其黄芩-连翘配伍组(1∶1,2∶3,1∶2)活动较频繁,反应较灵敏。
2.2 小鼠体重与采食量分析
如图1 所示,各组小鼠的日均体重增长量及日均采食量差异均无统计学意义(P>0.05)。

图1 小鼠日均体重增长量及采食量变化(,n=12)Figure 1 Changes in average daily weight gain and food intake of mice(,n=12)
2.3 脏器指数变化
如表1 所示,各组小鼠肾指数、肝指数、脾指数和胸腺指数差异均不显著(P>0.05);与正常对照组相比,模型组的心脏指数差异不显著(P>0.05);与模型组比,黄芩-连翘配伍组(3∶2)小鼠心脏指数显著降低(P<0.05),黄芩-连翘药对组(3∶1,2∶1,1∶3,3∶0,0∶3)的心脏指数极显著降低(P<0.01);与正常对照组相比,模型组小鼠肺指数极显著升高(P<0.01),表明急性肺炎造模成功,与模型组相比,黄芩-连翘配伍组(1∶2)的肺指数显著降低(P<0.05),说明黄芩-连翘配伍组(1∶2)对LPS 诱导小鼠急性肺炎保护作用较好。
表1 小鼠脏器指数的变化(,n=12)Table 1 Changes of viscera index of mice(,n=12)

表1 小鼠脏器指数的变化(,n=12)Table 1 Changes of viscera index of mice(,n=12)
注:与对照组比较,##P <0.01;与模型组比较,※P <0.05,※※P <0.01。(下图/表同)Note.Compared with normal control group,##P <0.01.Compared with model group,※P <0.05,※※P <0.01.(The same in the following figures and tables)
2.4 小鼠血常规指标变化分析
如表2 所示,造模6 h 后,与正常对照组比较,模型组血液中白细胞总数和中性粒细胞总数显著增加(P<0.01);与模型组比较,黄芩-连翘配伍组(3∶2,1∶1,2∶3,1∶2)能显著降低白细胞总数和中性粒细胞总数(P<0.01),结果与地塞米松组一致;黄芩-连翘配伍组(2∶1,1∶3,3∶0)也能显著降低白细胞总数(P<0.05);血液中血红蛋白总数无统计学意义(P>0.05);比较血液中平均红细胞血红蛋白浓度,与正常对照组比较,模型组血液中平均红细胞血红蛋白浓度显著升高(P<0.01);与模型组比较,黄芩-连翘配伍组都能显著降低血液中平均红细胞血红蛋白浓度(P<0.01);比较血液中红细胞总数,与正常对照组比较,模型组血液中红细胞总数显著升高(P<0.01);与模型组比较,黄芩-连翘配伍组(2∶3)能显著降低红细胞总数(P<0.01),结果与地塞米松组一致;比较血液中血小板总数,与对照组比较,模型组血液中血小板总数显著降低(P<0.01);与模型组比较,黄芩-连翘配伍组(1∶1,2∶3,1∶2)血液中血小板总数显著升高(P<0.05),结果与地塞米松组一致;结果表明,黄芩-连翘配伍组(3∶2,1∶1,2∶3,1∶2)对LPS 诱导的小鼠急性肺炎有明显减轻作用。
表2 黄芩-连翘配伍对小鼠血常规指标的影响(,n=12)Table 2 Effect of compatibility of Scutellariae Radix-Forsythiae fructus on blood routine index of mice(,n=12)

表2 黄芩-连翘配伍对小鼠血常规指标的影响(,n=12)Table 2 Effect of compatibility of Scutellariae Radix-Forsythiae fructus on blood routine index of mice(,n=12)
2.5 各组小鼠肺组织切片病理学观察
用同一显微镜观察并拍照,对切片的肺损伤程度进行评分。每个切片随机选择6 个视野。将炎性细胞浸润、肺泡壁厚度变化、肺泡充血损伤程度作为肺组织损伤评分依据[16],具体见表3。
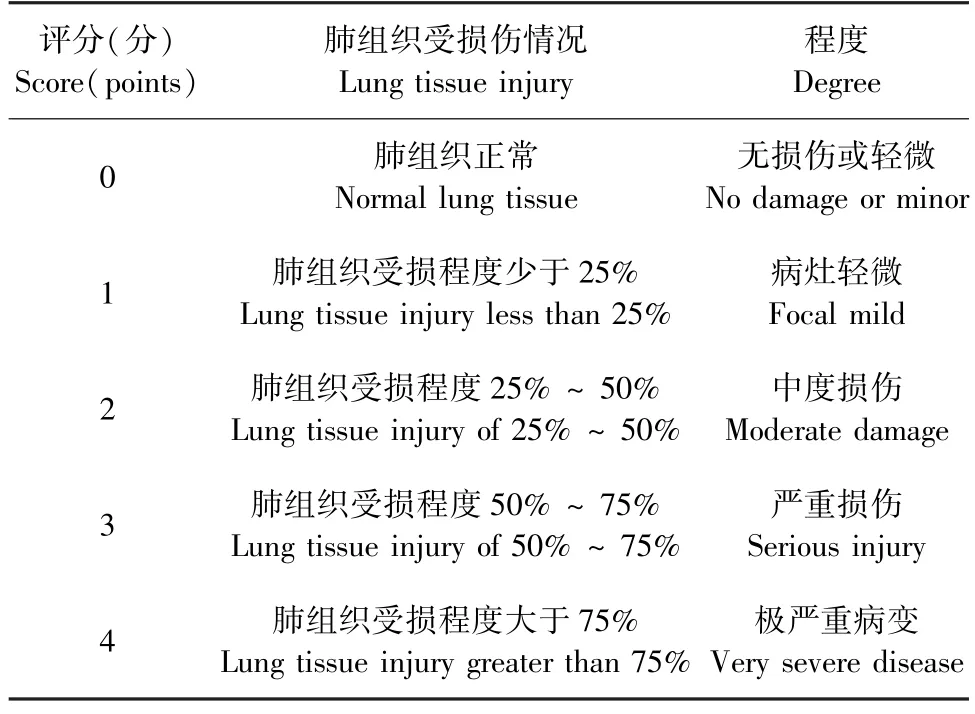
表3 小鼠肺病理组织学评分标准Table 3 Scoring standard of lung histopathology in mice
如图2,图3 所示,通过HE 染色后组织形态学观察结果显示黄芩-连翘药对LPS 诱导的小鼠急性肺炎的保护作用。正常对照组小鼠肺部结构正常,无渗出液,且没有炎性细胞浸润等病理现象;与正常对照组比较,模型组肺组织结构松散,有大量炎性细胞浸润,可观察到肺泡壁间质明显增厚及出血等病理现象,并且其肺组织损伤评分均升高;与模型组比较,黄芩-连翘配伍组(3∶2,1∶1,2∶3,1∶2)的肺组织有一定程度好转,肺组织充血减轻,出血减少、炎性细胞浸润减少、肺泡壁间质增厚减轻,黄芩-连翘配伍组(1∶3)也有一定的好转,并且黄芩-连翘配伍组(3∶2,1∶1,2∶3,1∶2,1∶3)与地塞米松组肺组织损伤评分均降低。

图2 小鼠肺组织损伤评分(,n=6)Figure 2 Lung tissue injury score of mice(,n=6)

图3 各组小鼠肺组织病理形态变化Figure 3 Pathological changes of lung tissues in mice of each group
如图4,图5 所示,免疫组织化学实验研究发现,滴加过Rabbit Anti-SFTPC Polyclonal Antibody(bs-10067R)工作液的小鼠肺组织切片均出现褐色区域,而阴性对照组未出现,认为褐色区域为阳性表达。表明SFTPC 蛋白在肺组织中均有表达。与正常对照组比较,模型组SFTPC 蛋白在肺组织肺泡与肺泡间隔区域表达量显著增加,大量阳性细胞表达SFTPC 蛋白;与模型组比较,黄芩-连翘配伍组(3∶2,1∶1,2∶3,1∶2)SFTPC 蛋白在肺组织肺泡与肺泡间隔区域表达量显著减少,阳性细胞的表达量较少。结果表明,黄芩-连翘配伍组(3∶2,1∶1,2∶3,1∶2)对LPS 诱导的小鼠急性肺炎有明显减轻作用。

图4 SFTPC 蛋白在小鼠肺组织中的分布(IHC)Figure 4 Distribution of SFTPC protein in lung tissue of mice(IHC)

图5 SFTPC 蛋白在小鼠肺组织中的分布(阴性对照,IHC)Figure 5 Distribution of SFTPC protein in lung tissue of mice (Negative control,IHC)
2.6 小鼠血清中TNF-α、IL-1β 和IL-6 的含量测定的结果分析
如表4 所示,与对照组比,模型组小鼠血清中TNF-α、IL-1β 和IL-6 的含量显著升高(P<0.01);与模型组相比,黄芩-连翘配伍组(1∶1,2∶3,1∶2)小鼠血清中TNF-α、IL-1β 和IL-6 的含量显著降低(P<0.01),黄芩-连翘配伍组(3∶2)小鼠血清中TNF-α 和IL-1β 的含量显著降低(P<0.05);与模型组相比,黄芩-连翘配伍组(3∶2,1∶1,2∶3,1∶2) 小鼠血清中IL-6 的含量显著降低(P<0.01),黄芩-连翘配伍组(2∶1)小鼠血清中IL-6的含量显著降低(P<0.05),说明黄芩-连翘配伍组(1∶1,2∶3,1∶2)在一定程度上抑制TNF-α、IL-1β 和IL-6 的分泌。
表4 小鼠血清中TNF-α、IL-1β 和IL-6 的含量(,n=6)Table 4 The contents of TNF-α,IL-1β and IL-6 in serum of mice (,n=6)

表4 小鼠血清中TNF-α、IL-1β 和IL-6 的含量(,n=6)Table 4 The contents of TNF-α,IL-1β and IL-6 in serum of mice (,n=6)
3 讨论
近年来,国内外的肺炎动物模型建立方法很多,根据肺炎病原学可分为细菌性、真菌性、病毒性、支原体、脂多糖(LPS)诱导性、化学诱导性等多种类型[17]。其中脂多糖诱导的肺炎动物模型较为常用,此模型常用的建立方法包括全身给药法、气管内给药法、吸入法以及雾化法等。全身给药法由于诱发全身免疫反应较重,故用于建立急性呼吸窘迫呼吸综合征模型;气管内给药法由于小鼠操作较难及操作不当会导致实验失败;雾化法由于需要专用的暴露塔,使用该方法的研究较少;本研究根据各种给药方法优缺点及实验室的条件综合考虑选择吸入法中的滴鼻法,此方法操作简单,能很好反映出小鼠肺部的炎症状况,具体操作步骤是将小鼠麻醉后,将配置好的一定浓度的LPS 溶液滴入小鼠鼻孔中使其全部吸入即可。
脂多糖诱导的小鼠急性肺炎模型,影响小鼠心、肺组织,血液中的炎性细胞以及血清中TNF-α、IL-1β、IL-6 的水平,提前摄入一定剂量的黄芩-连翘配伍组合物对脂多糖诱导的小鼠急性肺炎有较好的保护作用,主要从改善心脏功能、肺部炎症反应等方面促进炎症恢复。
急性肺炎所致急性肺损伤是由一些不可控制的炎症反应引起的肺部功能障碍综合征,导致大量炎症因子和效应细胞相互激活和相互作用[18]。脂多糖称为内毒素(LPS),是比较常见的炎症激发因素[19],可使小鼠肺出现炎性细胞浸润,产生大量炎症因子,如TNF-α、IL-1β、IL-6 等[3],继而从外周血中招募大量中性粒细胞等炎性细胞进入肺中,诱导炎性细胞在肺泡和肺间质内聚集,进一步释放炎症因子,造成炎症级联式反应,引起细胞因子风暴产生[20]。全血中的白细胞(中性粒细胞为主)是诱导小鼠急性肺炎的重要细胞,在炎症反应早期可发现其显著性升高。LPS 进入小鼠肺部,诱发肺间质发生水肿进而导致急性肺损伤,出现低氧血症、呼吸困难等症状。本研究利用LPS 诱导小鼠急性肺炎模型,分析黄芩-连翘不同配伍的抗炎作用差异。通过给小鼠鼻腔滴入LPS 建立急性肺炎模型,同时使用生理盐水作为对照,不同比例黄芩-连翘配伍作为给药组,地塞米松作为阳性对照组,以模拟治疗急性肺炎的过程。模型组小鼠精神状态差、反应迟钝、活动减少、呼吸急促、听诊肺部有湿罗音等,正常对照组小鼠表现正常、活泼、呼吸均匀、反应灵敏,初步判断LPS 诱导的小鼠急性肺炎模型复制成功;与模型组相比,各给药组小鼠活动基本正常,整体情况较好。与正常对照组相比,模型组小鼠肺指数极显著升高(P<0.01),与模型组相比,黄芩-连翘配伍组(1∶2)的肺指数显著降低(P<0.05),说明黄芩-连翘配伍能预防小鼠急性肺炎的发生。与正常对照组比较,模型组血液中白细胞总数和中性粒细胞总数明显升高(P<0.01),说明急性肺炎造模成功;与模型组比较,黄芩-连翘不同配伍组(3∶2,1∶1,2∶3,1∶2)能明显降低白细胞总数和中性粒细胞总数(P<0.01),说明黄芩-连翘不同配伍组(3∶2,1∶1,2∶3,1∶2)能降低炎性细胞浸润。小鼠血清中TNF-α、IL-1β 和IL-6 是常见炎症因子,通过不同炎症通路诱导产生,进而介导急性肺炎的发生。研究结果显示,模型组小鼠血清中的炎症因子TNF-α、IL-1β 和IL-6 的含量明显高于正常对照组,说明急性肺炎造模成功,LPS 引起了小鼠肺部的炎症;黄芩-连翘不同配伍组(1∶1,2∶3,1∶2)可明显降低小鼠血清中TNF-α、IL-1β 和IL-6 的含量(P<0.01),说明黄芩-连翘配伍组(1∶1,2∶3,1∶2)具有很好的抗炎作用。
在组织学方面,肺是动物体非常重要的器官之一。为研究肺组织的病理变化,本研究使用组织学染色与肺组织病理评分方法。肺上皮细胞包括肺泡I 型和肺泡II 型细胞。发生急性肺炎后,肺泡I型细胞可转为肺泡II 型细胞,促进肺泡的再生,并协调肺的稳态[21];肺泡上皮完整性恢复对肺内环境的恢复至关重要[22]。为研究肺泡上皮细胞的恢复情况,可以用典型标志物SFTPC 来识别肺泡II 型细胞,通过免疫组织化学判断肺泡II 型细胞在SFTPC蛋白上的表达量[23]。病理组织学结果显示,LPS 诱导的小鼠急性肺炎模型肺组织的病理表现为肺泡充血、炎性细胞浸润、肺泡壁增厚等急性肺炎特征,说明通过鼻腔滴入LPS 成功建立了急性肺炎模型。而黄芩-连翘配伍组(3∶2,1∶1,2∶3,1∶2)小鼠肺组织肺泡充血、炎性细胞浸润、肺泡壁增厚症状均较模型组减轻。与正常对照组相比较,模型组病理组织学评分均升高;与模型组相比,黄芩-连翘配伍组(1∶1,2∶3,1∶2)和阳性给药组评分均降低。免疫组化结果显示,与正常对照组相比较,模型组SFTPC 蛋白在肺组织肺泡与肺泡间隔区域表达量明显增加,有大量肺泡II 型细胞表达SFTPC 蛋白,而阴性对照组未加SFTPC 抗体,根据阴性对照组的结果来看其未出现SFTPC 蛋白阳性表达,进一步说明了结果的可靠性;与模型组相比较,黄芩-连翘配伍组(3∶2,1∶1,2∶3,1∶2),SFTPC 蛋白在肺组织肺泡与肺泡间隔区域表达量明显减少,推测肺泡II 型细胞数量下降,说明黄芩-连翘不同配伍组(3∶2,1∶1,2∶3,1∶2)可改善LPS 诱导的急性肺炎的发生,为初步阐明黄芩-连翘配伍干预急性肺炎模型机制的研究奠定基础,后续将围绕TNF-α、IL-1β 与IL-6 相关的上下游关键信号通路做进一步的实验验证。
综上所述,通过分析小鼠急性肺炎模型临床症状、脏器指数、血清炎症因子TNF-α、IL-1β 和IL-6含量、血常规、HE 及IHC 染色肺组织形态学观察及肺组织损伤病理组织学评分等指标变化的结果,将LPS 经过鼻腔进入小鼠肺部能成功建立小鼠急性肺炎模型。且综合研究发现黄芩-连翘不同配伍组(1∶1,2∶3,1∶2)可显著预防LPS 诱导的急性肺炎,为临床畜禽急性肺炎的防治提供依据。
