自发矮小症突变大鼠家系的建立及其主要生物学特性测定
2022-12-10包峰云龙红秦廷洋霍春茂唐克桐张仕斌
包峰云,龙红,秦廷洋,霍春茂,唐克桐,张仕斌
(贵州遵义医科大学实验动物中心,贵州 遵义 563006)
矮小症(short stature,SS)是影响人口素质的重要因素之一,我国儿童矮小症患病率约3%[1],即约有800 万矮小症患儿,并且以16.1 万的年增速递增。因此,开展矮小症病因诊断、干预、预后、预防研究对于提高人口素质具有非常重要的现实意义和社会意义。矮小症常见的病因包括:骨骼系统疾病如软骨发育不良[2];先天性酶的代谢缺陷如粘多糖病和肝糖原累积症[3];内分泌激素分泌不足[4],甲状腺功能减退[5](克汀病)等等。矮小症的病因仅通过临床评估能发现的不超过40%[6],大部分的病因都与遗传有关,需要通过基因检测明确和诊断。
动物模型是开展人类矮小症研究必不可少的工具。有4 种比较著名和常用的自发常染色体隐性突变矮小症啮齿类模型:Snell 小鼠(dw)、Ames 小鼠(df)、spontaneous dwarf 大鼠(SDR)和Little 小鼠(lt)。dw 小鼠是由编码脑垂体转录因子Pit-1 基因发生点突变引起的,突变后导致3 种脑垂体细胞系发育障碍[7];df 小鼠则是由于转录因子Prop-1 基因发生突变,通过Pit-1 基因的激活因子发生作用的[8];SDR 大鼠主要是生长激素(GH)调控的基因发生了突变[9];lt 小鼠则是由于编码生长激素释放激素受体的基因发生了错义突变,导致生长激素释放激素受体失去了与生长素释放激素特定结合的能力[10]。矮小症动物模型除主要用于生长发育相关研究外,也在睡眠[11-12]、认知[13]、应激[14]、能量代谢[15]、抗肿瘤[16-18]等方面开展了相关性及机制的应用研究,凸显出越来越广泛的新的应用价值。矮小症动物模型更多的应用特性及其机理则需要开展更广泛深入的研究。
国内陈芷沅教授[19]最早于1982 年在津白3(TA3)小鼠群体中发现矮小症小鼠,经过十多年的繁殖与选种培育成近交系。姚菊芳等[20]于2016 年在Wistar 大鼠繁育群中意外发现矮小突变个体,经过22~23 代全同胞兄妹交配培育成近交系,但未鉴定到致病基因。Cui 等[21]于2015 年利用锌指核酸酶技术(ZFNs)制备了生长激素受体(GHR)基因突变的矮小症小型猪模型。Yu 等[22]又于2018 年利用dual-sgRNAs/Cas9system 制备了GHR 基因修饰的矮小症小型猪。尽管如此,国内矮小症动物模型资源仍显稀少。
遵义医科大学实验动物中心在封闭群SD 大鼠的繁育过程中偶然发现2 只自发矮小症的雄性个体,本研究通过将突变个体与野生型个体配种进行扩群繁殖建立家系,初步对家系个体进行了表型特征及遗传模式的鉴定。
1 材料与方法
1.1 材料
1.1.1 实验动物
用于创建家系的2 只SPF 级雄性矮小症突变SD 大鼠和6 只雌性野生型SD 大鼠,体重分别为160~190 g 和270~290 g,均12 周龄,遗传背景为封闭群,来源于遵义医科大学实验动物中心【SCXK(黔)2021-0002】,饲养于本中心SPF 级大鼠饲养室【SYXK(黔)2021-0004】。实验大鼠饲养期间自由饮水,饲喂由江苏省协同医药生物工程责任有限公司【苏饲证(2019)01008】提供的生长繁殖饲料,饲养环境:昼夜各半循环照明,温度控制在20~26℃,相对湿度控制在40%~70%。动物实验符合遵义医科大学实验动物福利伦理管理相关要求(ZMU22-2203-530)。
1.1.2 主要试剂与仪器
孕马血清促性腺激素(PMSG),人绒毛膜促性腺激素(hCG)(宁波第二激素厂)。
FA2204 电子天平(上海浦春计量仪器有限公司);不锈钢直尺;HF-400B 型宠物DR(江苏康派医疗科技有限公司);斯玛特SMT-120VP 生化分析仪(成都斯马特科技有限公司);迈瑞BC-2800Vet 动物专用血细胞分析仪(深圳迈瑞生物医疗电子股份有限公司)。
1.2 方法
1.2.1 矮小症突变大鼠扩群繁殖建立家系及其遗传模式鉴定
将2 只12 周龄矮小症雄性SD 大鼠按1∶3 与野生型雌鼠合笼配种,在出生的F1 代个体中,将体重小于群体均值2 倍标准差者判定为矮小症突变个体,计算突变型与野生型分离比例,作遗传性卡方检验以判定其遗传模式。对建立的矮小症SD 大鼠家系按照国际标准命名法则进行命名。
1.2.2 生长曲线及成年大鼠体重、体尺测量以及骨发育情况检测
使用电子秤直接测定3 周龄(离乳)至12 周龄(成年)各周龄大鼠体重,按性别及性状分组作生长曲线,并以12 周龄体重数据作差异显著性检验;使用不锈钢直尺测定12 周龄大鼠体长、尾长;使用HF-400B 型宠物DR 对成年大鼠进行X 光拍摄,着重观察长骨(胫骨及股骨)软骨发育情况及其之间关节腔间隙大小,测量胫骨长及股骨长,同时分别计算胫骨长指数及股骨长指数,按不同性别及不同性状作差异显著性检验。胫骨长指数和股骨长指数可分别反映这2 种长骨的发育情况,计算方法为:胫骨长指数=胫骨长/体长 × 100%,股骨长指数=股骨长/体长 × 100%,数值偏小表明发育不良。
1.2.3 成年脏器重量及指数
使用电子天平测定12 周龄矮小症大鼠和野生型大鼠主要脏器重量,计数脏器指数并进行差异显著性检验。
1.2.4 成年血液生理生化指标
采用眼眶静脉丛采血方法采集12 周龄大鼠全血用于测定18 项血液生理指标及20 项血液生化指标。18 项血液生理指标例如白细胞总数(WBC)、淋巴细胞数目(Lymph)、单核细胞数目(Mon)等分别按不同性别及不同性状作差异显著性检验;20 项血液生化指标例如白蛋白(ALB)、总蛋白(TP)、球蛋白(GLOB)等各项指标分别按不同性别及不同性状作差异显著性检验。
1.2.5 成年雌性矮小症大鼠发情周期及排卵检测
选择6 只成年矮小症雌性大鼠,采用阴道涂片方法连续5 d 检测其发情情况。采用超数排卵方法检测成年矮小症雌性大鼠是否排卵:对6 只成年矮小症雌性大鼠于16:00 开始每只注射10 IU PMSG,间隔48 h 后每只注射10 IU hCG,注射hCG 后按1∶1 与野生型雄鼠合笼,合笼后第2 天9:00 采用麻醉呼吸机麻醉大鼠,然后采用颈椎脱位法处死大鼠,接着解剖大鼠剪取输卵管,在体视显微镜下划开输卵管膨大部采集受精卵并计数。
1.3 统计学分析
测定数值以平均值 ± 标准差()表示,采用独立t检验作差异显著性分析,P<0.05 为差异有统计学意义。
2 结果
2.1 矮小症大鼠命名及遗传模式鉴定
参照国际命名法则,暂时将矮小症大鼠命名为SSR(short stature rat,SSR)。将2 只SSR 雄鼠与野生型雌鼠交配后,获得的82 只F1 代个体中突变型个体39 只(18♂21♀),野生型个体43 只(20♂23♀),性状分离比例符合1 ︰1 的分配比例,性状在不同性别间无差异分布,卡方适合性检验(表1)表明矮小症性状遗传模式符合常染色体单基因显性遗传的孟德尔定律。
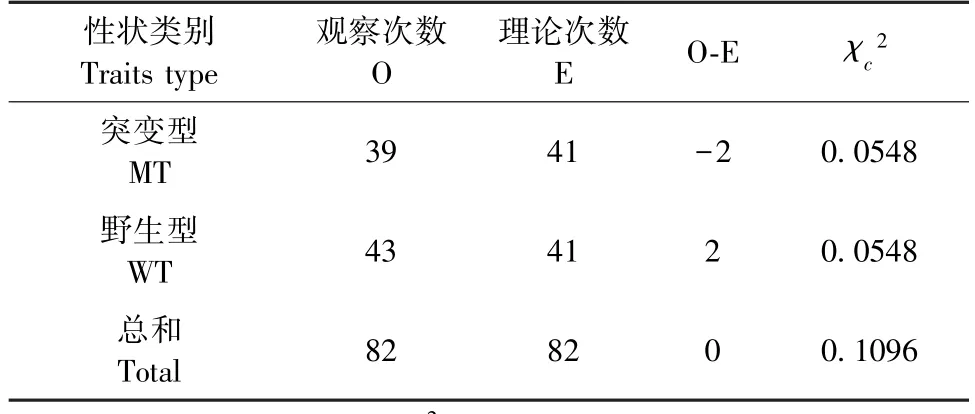
表1 矮小症SD 大鼠家系F1 代性状统计及卡方检验Table 1 Trait statistics and chi square test of F1 generation of short stature SD rats
2.2 SSR 生长曲线及成年体重、体尺数据以及骨发育情况
生长曲线(图1A)显示,SSR 从3 周龄至12 周龄各周龄体重均明显小于同年龄、同性别野生型大鼠。两种性别成年SSR 体重分别为野生型的57%(♂)和65%(♀),差异极具显著性(P<0.01,图1A)。成年SSR 大鼠与野生型个体外观比较见图1B,成年SSR体长(图1C)、尾长(图1D)均低于同年龄、同性别野生型大鼠,差异极具显著性(P<0.01)。

图1 SSR 生长曲线、成年体重及体尺比较Note.Compared with females WT,∗∗∗P <0.01.Compared with males WT,###P <0.01.(The same in the following figures)Figure 1 Growth curves of SSR and macroscopic findings regarding body weight,body length and tail length
成年SSR 长骨关节间隙未见增大(图2A),表明长骨软骨发育未见异常,股骨长(图2B)、胫骨长(图2C)均低于同年龄、同性别野生型大鼠,差异极具显著性(P<0.01),而胫骨长及股骨长占体长比例在不同性别及性状间差异不显著(表2,P>0.05),表明SSR 长骨发育相对正常,为匀称型身材矮小症。

表2 成年SSR 与野生型大鼠体尺(胫骨长、股骨长)指数比较(n=10)Table 2 Body size (tibia lengths and femur lengths)indexs of adult SSR and widetype rats(n=10)

图2 X 光显示SSR 骨发育情况及胫骨、股骨长度比较Figure 2 Radio graphic findings regarding the lengths of the femur and tibia
2.3 成年SSR 脏器重量及指数
成年SSR 与野生型大鼠主要脏器重量比较见表3,除卵巢外,SSR 的心、肝、脾、肺、肾及睾丸重量均显著低于野生型大鼠(P<0.01)。

表3 成年SSR 与野生型大鼠主要脏器重量比较Table 3 Main organ weights of adult SSR and wide type rats
脏器指数中(见表4),成年雄性及雌性SSR 的肝指数均显著低于野生型大鼠,而成年雄性SSR 睾丸指数显著高于野生型大鼠。

表4 成年SSR 与野生型大鼠主要脏器指数比较Table 4 Organ indexs of adult SSR and wide type rats
2.4 成年SSR 与野生型大鼠血液生理生化指标比较
18 项血液生理指标测定结果中雄性SSR 淋巴细胞百分比、单核细胞百分比、中性粒细胞百分比,较野生型差异极显著(P<0.01),雌性SSR 白细胞总数、淋巴细胞数目,较野生型相比显著性差异(P<0.05)。20 项血液生化指标测定结果中雌雄SSR 较野生型各项指标无显著性差异(P>0.05)(见表5,表6)。

表5 成年SSR 与野生型大鼠血液生理指标比较Table 5 Blood physiological indexes of adult SSR and wide type rats

表6 成年SSR 与野生型大鼠血液生化指标比较Table 6 Blood biochemical indices of adult SSR and wide type rats
2.5 成年雌性SSR 繁殖能力检测
阴道涂片检测见图3,未发现成年雌性SSR 发情周期异常;超数排卵实验表明,成年雌性SSR 未发生排卵,但对卵巢组织进行病理切片HE 染色,观察到卵泡发育(见图4)。导致雌性SSR 不孕的病理原因还需进一步检测。

图3 成年SSR 阴道涂片Figure 3 Adult SSR vaginal smear

图4 成年雌性SSR 与野生型大鼠卵巢病理切片Figure 4 Adult female SSR ovarian pathology section
3 讨论
本实验对遵义医科大学实验动物中心封闭群SD 大鼠生产群中自发突变的矮小症个体进行扩群繁殖建立了家系,家系暂时命名为SSR。SSR 的遗传学及生物学特性明显不同于已报道的几种矮小症或侏儒症小鼠/大鼠模型。已报道的Snell 小鼠[7]、Ames 小鼠[8]、SDR 大鼠[9]、Little 小鼠[10]、CCI大鼠[2]均为常染色体隐性遗传,其中CCI 大鼠隐性纯合突变个体表现出完全不育的性状。姚菊芳等[20]报道的SWDR 大鼠的雌性突变个体具有繁殖能力,只是繁殖性能低于野生型大鼠,但突变性状的遗传机制尚不明确。本实验创建的SSR 家系其遗传模式为常染色体显性遗传,性状表现为明显的匀称型身材缩小,软骨发育未见异常,但雌性突变个体伴发排卵障碍性不孕,因此无法通过自然交配得到隐性纯合突变个体,家系的创建只能利用杂合子进行保种和传代。SSR 可作为生长发育及生殖功能研究的新的动物模型,但其确切的致病基因及分子病理机制还需要进一步深入的研究。同时,SSR雌性突变个体的生殖功能表型特征也需要进一步系统准确的鉴定。
矮小症通常可根据不同类型骨骼发育异常归类为短肢型、短躯干型和匀称型3 类[23]。软骨发育不全、假性软骨发育不全、软骨外胚层发育不良以及多发性骨骺发育不良均导致长骨发育不良,呈现为短肢型矮小症;粘多糖病Ⅳ型为严重的短躯干型矮小症;而许多病因不明的特发性矮小症则属于匀称型。这种分类方法有助于矮小症的病因诊断。由于大小鼠本身个体体尺很小,不易直观判定其矮小症类型。本研究借鉴大型经济类动物牛的体长指数(体长/体高 × 100)和肢长指数(胸肢长/体高 × 100)来鉴定SSR 体型的匀称性和长骨发育情况。由于大鼠体高无法准确界定和测量,因此我们以“胫骨长/体长 × 100%”定义为胫骨长指数,将“股骨长/体长 × 100%”定义为股骨长指数分别来判定胫骨及股骨的发育情况,结果表明,同年龄段SSR 与野生型大鼠相比,胫骨长指数与股骨长指数无显著性差异,由此将SSR 判定为匀称型矮小症。是否能将胫骨长指数与股骨长指数作为大小鼠矮小症表型分类的一个通用的科学指标,可能还需要在更多类型矮小症动物模型中进行验证和进一步探讨。
