耐碳青霉烯铜绿假单胞菌血流感染患者的细菌耐药性、感染风险因素及预后分析
2022-12-10荆楠贾爱华马冰袁有华闫文娟张琦张江峰马琼楚亚菲许俊红王山梅李轶
荆楠,贾爱华,马冰,袁有华,闫文娟,张琦,张江峰,马琼,楚亚菲,许俊红,王山梅,李轶*
1河南省人民医院检验科,郑州大学人民医院检验科,河南大学人民医院检验科,郑州 450003;2桐柏县人民医院检验科,南阳 474750
铜绿假单胞菌为医院内感染的重要条件致病菌,因其易定植,对多种抗菌药物存在固有耐药性,且具有强大的获得性耐药能力,因此铜绿假单胞菌引起的感染通常很难治疗和根除。铜绿假单胞菌是血流感染的常见病原菌[1],其感染可延长患者住院时间,增加住院费用,并引发患者多器官功能衰竭,预后较差。碳青霉烯类药物主要用于治疗严重感染,且临床应用广泛。2021年中国细菌耐药监测网(China Antimicrobial Surveillance Network,CHINET)结果显示铜绿假单胞菌对碳青霉烯类药物亚胺培南的耐药率超过20%[2],2017年世界卫生组织(WHO)就已将耐碳青霉烯类铜绿假单胞菌(carbapenem-resistant Pseudomonas aeruginosa,CRPA)危险级别确定为“紧要优先”(critical-priority)[3]。CRPA血流感染对患者危害巨大,且临床治疗极具挑战性,寻求一种有效的治疗策略迫在眉睫。本研究通过检测本院铜绿假单胞菌血流感染患者的细菌耐药性,分析CRPA血流感染的风险因素及影响患者预后的因素,以期为临床治疗和感染防控提供依据。现报道如下。
1 资料与方法
1.1 一般资料
回顾性选取2018年1月~2021年12月期间本院收治的215例铜绿假单胞菌血流感染患者为研究对象,并记录患者的各项临床资料,包括:①患者的性别、年龄。②基础疾病,包括高血压、糖尿病、实体肿瘤、心血管疾病、血液系统疾病、贫血、低蛋白血症、慢性肾脏疾病、脓毒症休克、重症肺炎。③是否入住重症加强护理病房(intensive care unit,ICU)并进行相关侵入性操作(包括留置胃管、留置尿管、中心静脉置管、机械通气、其他部位引流管)、手术史、转院转科史、抗菌药物使用史。④患铜绿假单胞菌血流感染前患者的住院时长、28天生存情况。
纳入标准:①血培养1次或多次检出铜绿假单胞菌者。②符合《医院感染诊断标准(试行)》[4],确定为感染致病菌者。③年龄≥18岁者。④多次血培养阳性者,取首次检测阳性时的病例资料。排除标准:①门诊患者。②病例资料不完整者。③混合其他病原体感染者。
1.2 细菌鉴定及药敏试验方法
依照《全国临床检验操作规程》(第4版)[5]进行菌株培养及分离。无菌采集疑似血流感染患者的血液标本,采用BACTECTMFX和BacT/Alert 3D全自动血培养仪对标本进行培养。阳性标本转种至血琼脂平板、巧克力琼脂平板或麦康凯琼脂平板进行菌株分离。
药敏试验采用Phoenix-100全自动细菌鉴定药敏系统(美国BD公司)进行,并与纸片扩散法(英国Oxoid公司)检测结果进行比对。药敏试验结果参照2021美国临床与实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)的 M100 文件判读[6]。将亚胺培南、美罗培南中的一种或两种不敏感的铜绿假单胞菌归为CRPA组(n=59)[7],否则归为非耐碳青霉烯类铜绿假单胞菌(non-carbapenem-resistant Pseudomonas aeruginosa, NCRPA)组(n=156)。质控菌株为铜绿假单胞菌ATCC27853、大肠埃希菌ATCC25922,均来自原卫生部临床检验中心。
1.3 统计学方法
采用SPSS 20.0软件对数据进行统计分析。计量资料以±s表示,行t检验;计数资料以n(%)表示,行χ2检验;感染危险因素及死亡因素分析使用Logistic回归分析。P<0.05为具有统计学差异。
2 结果
2.1 患者科室分布
215例铜绿假单胞菌血流感染患者主要来源于血 液 科(71例,33.0%)、ICU(69例,32.1%)、肝胆胰腺外科(18例,8.4%)、肾内科(15例,7.0%)和感染科(12例,5.6%)。其中,CRPA组共59例(27.4%),患者主要分布在ICU(35例,50.7%)、呼吸科(1例,33.3%)和肝胆胰腺外科(5例,27.8%)。见图1。
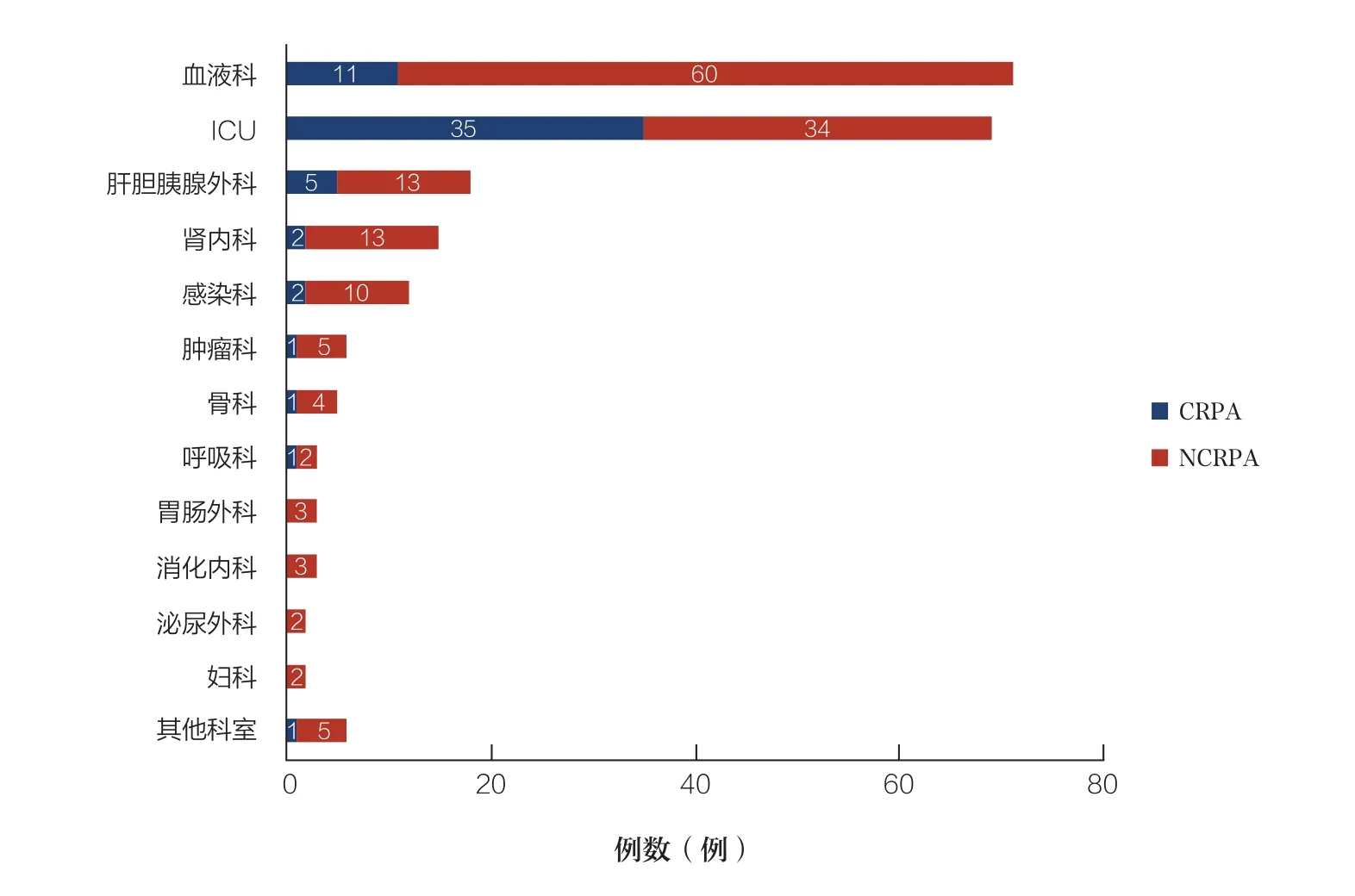
图1 铜绿假单胞菌血流感染患者的科室分布情况
2.2 铜绿假单胞菌对常用抗菌药物耐药情况分析
本研究中,铜绿假单胞菌对多黏菌素B、阿米卡星及庆大霉素的耐药率均较低,分别为0.0%、4.7%和9.3%,而对亚胺培南耐药率最高(26.5%)。CRPA组菌株对β内酰胺类药物(哌拉西林、哌拉西林/他唑巴坦、头孢他啶、头孢吡肟、氨曲南)和喹诺酮类药物(环丙沙星、左氧氟沙星)的耐药率均明显高于NCRPA组。此外,CRPA组菌株对氨基糖苷类药物阿米卡星、庆大霉素的耐药率从2019年的36.4%、45.5%下降至2021年的5.3%、15.8%,对哌拉西林、头孢哌酮/舒巴坦、哌拉西林/他唑巴坦的耐药率也从2018年的70.6%、64.7%、64.7%下降至2021年的26.3%、26.3%、21.1%。见表1。
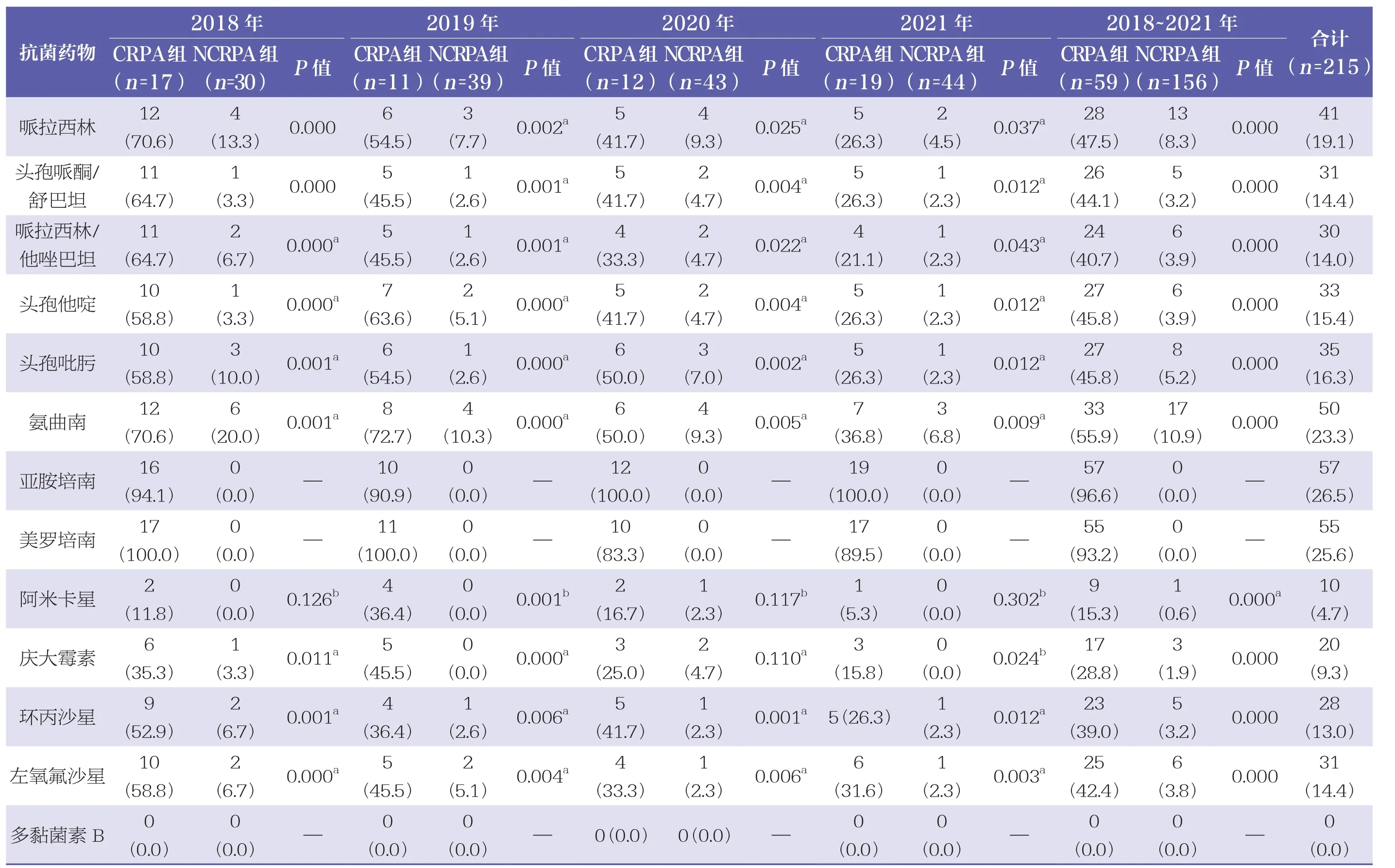
表1 2018~2021年铜绿假单胞菌对常用抗菌药物耐药情况分析n(%)
2.3 两组患者临床特征比较
单因素分析结果显示,CRPA组的男性患者、低蛋白血症、转院转科史、入住ICU、留置胃管、中心静脉置管、机械通气、联用2种抗菌药物、应用碳青霉烯类抗菌药物及感染前住院时长等的患者比例均高于NCRPA组(P<0.05),且CRPA组死亡率也高于NCRPA组(P=0.002)。见表2。
表2 两组患者临床特征比较 ±s,n(%)
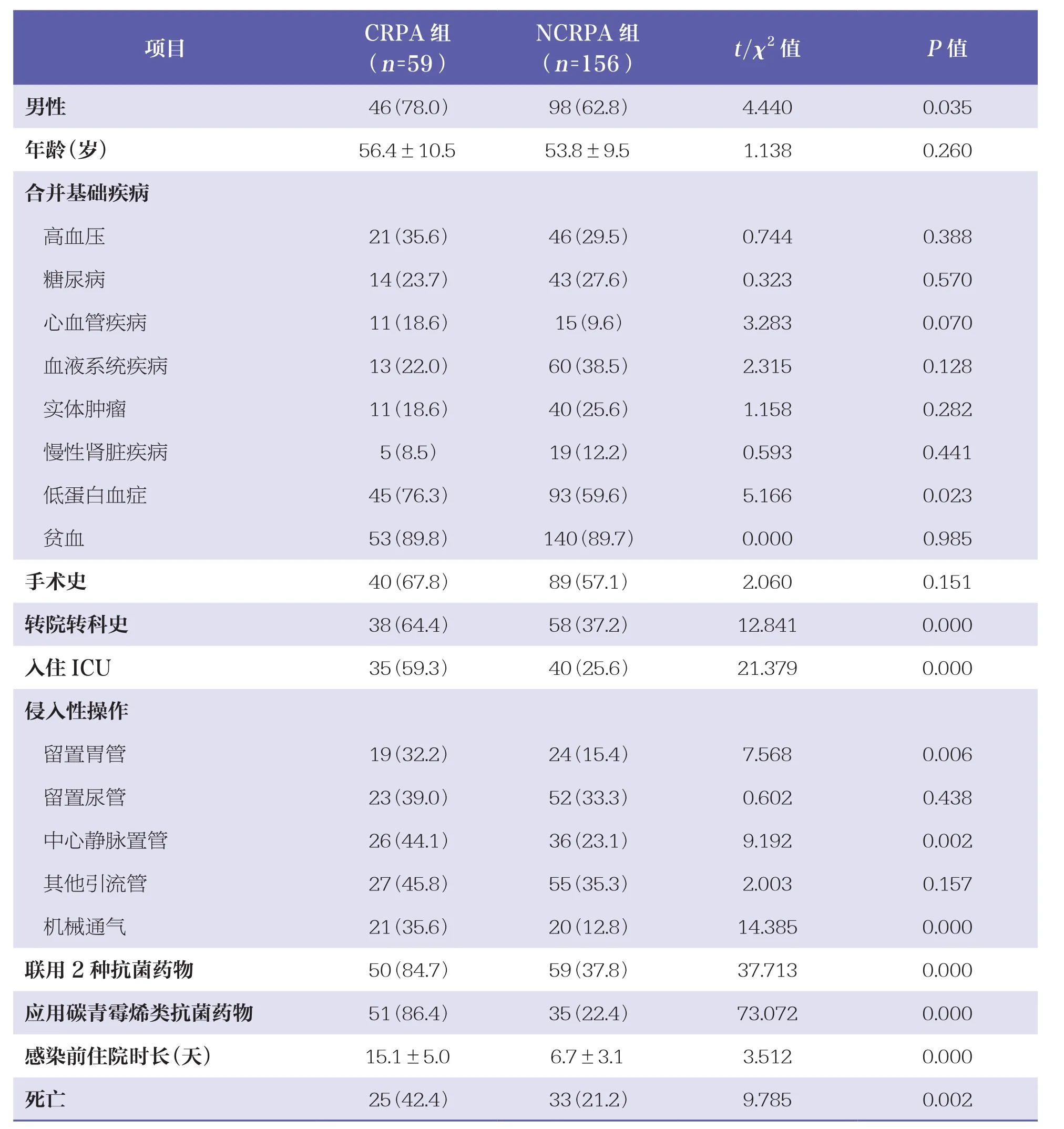
表2 两组患者临床特征比较 ±s,n(%)
项目 C R P A组(n=5 9)N C R P A组(n=1 5 6) t/χ 2值 P值男性 4 6(7 8.0) 9 8(6 2.8) 4.4 4 0 0.0 3 5年龄(岁) 5 6.4±1 0.5 5 3.8±9.5 1.1 3 8 0.2 6 0合并基础疾病高血压 2 1(3 5.6) 4 6(2 9.5) 0.7 4 4 0.3 8 8糖尿病 1 4(2 3.7) 4 3(2 7.6) 0.3 2 3 0.5 7 0心血管疾病 1 1(1 8.6) 1 5(9.6) 3.2 8 3 0.0 7 0血液系统疾病 1 3(2 2.0) 6 0(3 8.5) 2.3 1 5 0.1 2 8实体肿瘤 1 1(1 8.6) 4 0(2 5.6) 1.1 5 8 0.2 8 2慢性肾脏疾病 5(8.5) 1 9(1 2.2) 0.5 9 3 0.4 4 1低蛋白血症 4 5(7 6.3) 9 3(5 9.6) 5.1 6 6 0.0 2 3贫血 5 3(8 9.8) 1 4 0(8 9.7) 0.0 0 0 0.9 8 5手术史 4 0(6 7.8) 8 9(5 7.1) 2.0 6 0 0.1 5 1转院转科史 3 8(6 4.4) 5 8(3 7.2) 1 2.8 4 1 0.0 0 0入住I C U 3 5(5 9.3) 4 0(2 5.6) 2 1.3 7 9 0.0 0 0侵入性操作留置胃管 1 9(3 2.2) 2 4(1 5.4) 7.5 6 8 0.0 0 6留置尿管 2 3(3 9.0) 5 2(3 3.3) 0.6 0 2 0.4 3 8中心静脉置管 2 6(4 4.1) 3 6(2 3.1) 9.1 9 2 0.0 0 2其他引流管 2 7(4 5.8) 5 5(3 5.3) 2.0 0 3 0.1 5 7机械通气 2 1(3 5.6) 2 0(1 2.8) 1 4.3 8 5 0.0 0 0联用2种抗菌药物 5 0(8 4.7) 5 9(3 7.8) 3 7.7 1 3 0.0 0 0应用碳青霉烯类抗菌药物 5 1(8 6.4) 3 5(2 2.4) 7 3.0 7 2 0.0 0 0感染前住院时长(天) 1 5.1±5.0 6.7±3.1 3.5 1 2 0.0 0 0死亡 2 5(4 2.4) 3 3(2 1.2) 9.7 8 5 0.0 0 2
2.4 CRPA血流感染患者风险因素Logistic回归分析
将单因素分析结果中有意义的指标纳入Logistic回归分析。结果提示,应用碳青霉烯类抗菌药物、联用2种抗菌药物及感染前住院时长是CRPA血流感染的独立风险因素(P<0.05)。见表3。
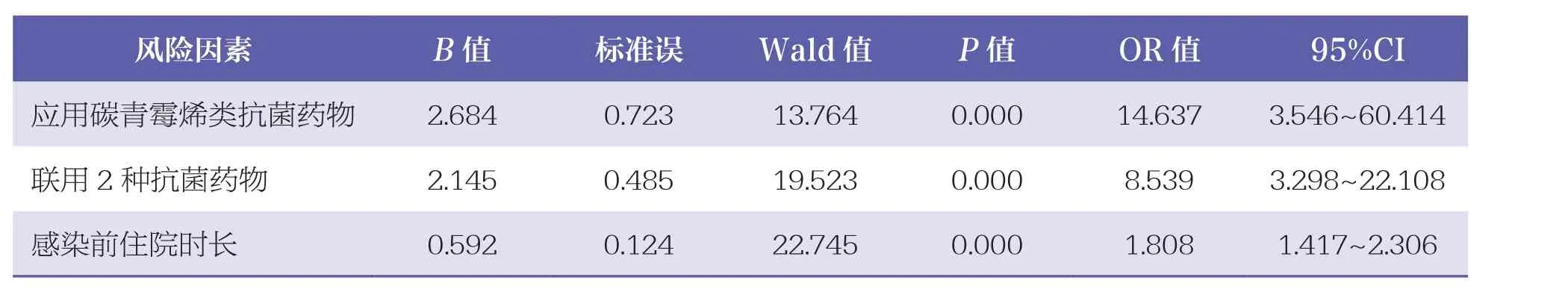
表3 CRPA血流感染风险因素的Logistic回归分析结果
2.5 CRPA血流感染患者临床特征分析
59例CRPA血流感染患者中,根据患者28天预后分为死亡组(n=25)和存活组(n=34)。单因素分析结果显示,低蛋白血症、脓毒症休克、重症肺炎、入住ICU、转院转科史、中心静脉置管、机械通气等因素与患者预后不良有关(P<0.05)。见表4。
表4 CRPA血流感染患者临床特征分析 ±s,n(%)

表4 CRPA血流感染患者临床特征分析 ±s,n(%)
项目 死亡组(n=25) 存活组(n=34) t/χ2值 P值男性 19(76.0) 24(70.6) 0.098 0.755年龄(岁) 57.9±12.0 54.9±8.9 1.037 0.305合并基础疾病高血压 8(32.0) 10(29.4) 0.367 0.544糖尿病 5(20.0) 9(26.5) 0.333 0.564心血管疾病 4(16.0) 4(11.8) 0.322 0.570血液系统疾病 6(24.0) 2(5.9) 2.508 0.113实体肿瘤 7(28.0) 7(20.6) 0.000 1.000低蛋白血症 22(88.0) 18(52.9) 5.930 0.015贫血 22(88.0) 30(88.2) 0.001 0.971脓毒症休克 18(72.0) 2(5.9) 28.107 0.000重症肺炎 19(76.0) 13(38.2) 8.278 0.004手术史 15(60.0) 20(58.8) 0.351 0.554转院转科史 16(64.0) 13(38.2) 4.601 0.032入住ICU 13(52.0) 7(20.6) 10.949 0.001侵入性操作留置胃管 7(28.0) 6(17.6) 1.208 0.272留置尿管 8(32.0) 8(23.5) 1.483 0.223中心静脉置管 15(60.0) 11(32.4) 4.958 0.026其他引流管 7(28.0) 14(41.2) 0.054 0.816机械通气 10(40.0) 3(8.8) 7.881 0.005联用2种抗菌药物 23(92.0) 27(79.4) 0.926 0.336应用碳青霉烯类抗菌药物 22(88.0) 29(85.3) 0.000 1.000
2.6 CRPA血流感染患者死亡风险因素的Logistic回归分析
多因素Logistic回归分析结果显示,脓毒症休克(P=0.001)和机械通气(P=0.021)是CRPA血流感染患者死亡的独立风险因素。见表5。
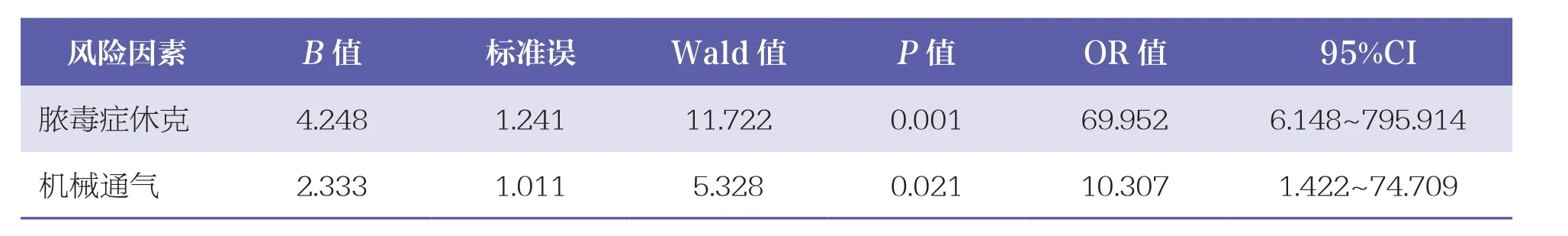
表5 CRPA血流感染患者死亡风险因素的Logistic回归分析
3 讨论
2020年CHINET细菌耐药监测数据表明,铜绿假单胞菌是引起血流感染的第7位病原菌,居革兰阴性菌感染的第3位[8]。随着碳青霉烯类抗菌药物在临床上的广泛应用,CRPA菌株的出现对全球构成了威胁,其患病率与地区差异、标本类型、患者所处环境及抗菌药物选择压力等因素有关[9]。CRPA感染患者的临床结局较差,其死亡率为20.0%~30.8%[10],临床医生给予CRPA血流感染患者恰当的抗感染治疗可降低死亡率,并降低获得性耐药菌株的发生率。
本研究中,铜绿假单胞菌血流感染患者主要来源于血液科、ICU和肝胆胰腺外科,与既往报道结果相似[11-12]。铜绿假单胞菌是ICU环境中最常见的病原体[13-14],59例CRPA血流感染患者主要分布在ICU,提示入住ICU是CRPA感染的风险因素[13]。ICU患者常合并多种严重的基础疾病,长期使用抗菌药物及高频率的侵入性操作,极大地增加了CRPA血流感染的风险。本研究连续4年对血流感染的铜绿假单胞菌进行耐药性监测发现,铜绿假单胞菌对亚胺培南、美罗培南的总体耐药率分别为26.5%和25.6%,与CHINET公布的数据(23.2%、19.3%)相似[8]。此外,CRPA对β内酰胺类药物(哌拉西林、哌拉西林/他唑巴坦、头孢他啶、头孢吡肟、氨曲南)、喹诺酮类药物(环丙沙星、左氧氟沙星)和氨基糖苷类药物(阿米卡星、庆大霉素)的耐药率均高于NCRPA;除多黏菌素、阿米卡星、庆大霉素和环丙沙星外,CRPA对其他常用抗菌药物的耐药率也均超过40.0%。该结果提示,临床治疗CRPA血流感染可选择的抗菌药物有限,仍具有极大的挑战性。CRPA对β内酰胺类药物的耐药率逐年下降,表现为对哌拉西林的耐药率从2018年的70.6%下降至2021年的26.3%;对头孢哌酮/舒巴坦、头孢他啶、头孢吡肟、氨曲南的耐药率也呈明显下降趋势。这可能与我国近年来执行抗菌药物的合理应用管理及更规范的医院感染管理有关。
本研究单因素分析结果显示,男性患者占比、低蛋白血症、转院转科史、留置胃管、中心静脉置管、机械通气、入住ICU、感染前住院时长、应用碳青霉烯类抗菌药物及联用2种抗菌药物等因素与CRPA血流感染有关,与文献结果基本一致[15-16]。Logistic回归分析结果显示,感染前住院时长、应用碳青霉烯类抗菌药物及联用2种抗菌药物是CRPA血流感染的独立风险因素。入院时间越长、侵入性操作越多,与医院环境菌接触概率也随之增大,而抗菌药物的长时间或不规范应用可导致铜绿假单胞菌发生基因突变或产生新的耐药基因。碳青霉烯类抗菌药物及三、四代头孢菌素的应用是CRPA感染的独立风险因素[17-18],临床须对这2类抗菌药物的应用管理给予更多关注,以减少耐药菌株的出现。另有研究表明,联合应用2种及以上抗菌药物治疗铜绿假单胞菌血流感染的死亡率(35.6%)高于单药治疗方案(19.8%,P<0.05)[7],提示联合用药并未对临床结局产生有利影响,这也与Babich等[19]的研究结果相一致。因此,临床治疗CRPA血流感染时应根据药敏试验结果合理选用抗菌药物。
CRPA与铜绿假单胞菌菌血症患者的5天死亡率显著相关[7],且CRPA患者伴有更高的30天死亡风险[20]。本研究中,CRPA组的死亡率(42.4%)高 于 NCRPA 组(21.2%,P<0.05), 且 Logistic回归分析结果显示脓毒症休克、机械通气是CRPA血流感染患者死亡的独立风险因素,这与国内报道基本一致[21-23]。
综上所述,CRPA血流感染死亡率高,且菌株对常用药物呈现出一定程度的耐药性。应用碳青霉烯类药物、联用2种抗菌药物及感染前住院时长是导致CRPA血流感染的主要风险因素,机械通气及脓毒症休克与CRPA血流患者预后较差相关。临床医生应规范诊疗操作、加强病原学的检测、重视碳青霉烯类药物的合理使用并给予适当的用药管理,同时医疗机构应进一步强化防控措施,尽可能减少院内CRPA血流感染。
