超声辅助提取茄皮酚工艺优化及其降血糖功效研究
2022-12-10关玉婷陈瑞瑞蔡如玉张紫阳常世敏
关玉婷,陈瑞瑞, ,蔡如玉,范 蓓,孙 晶,张 瑞,张紫阳,常世敏,
(1.河北工程大学生命科学与食品工程学院,河北邯郸 056038;2.邯郸市天然产物与功能食品开发重点实验室,河北邯郸 056038;3.中国农业科学院农产品加工研究所,北京 100193)
茄(Solanum melongenaL.)为茄科,茄属植物,在我国广泛种植,是一种高产作物,茄子的不同部位,如皮、肉和叶子,都含有丰富的生物活性物质,如类黄酮和酚类化合物。然而茄皮通常被当做垃圾进行处理,造成严重的环境问题和经济浪费[1]。茄皮作为一种副产品,含有丰富的酚类化合物,具有显著的抗氧化[2]、降血糖[3]和抑菌[4]等作用。将茄皮中的多酚进行提取,可提升茄子的附加值并降低环境压力。
Ⅱ型糖尿病是常见的代谢性疾病,对全球人民健康造成了巨大的威胁。国际糖尿病联合会公布2019年有4.63亿人(占全球人口的9.3%)患有糖尿病[5]。Ⅱ型糖尿病是由多种因素引起的代谢紊乱性疾病,例如遗传、生活习惯和环境等,其特征是缺乏胰岛素或胰岛素水平较低,导致血糖水平异常升高[6]。临床治疗Ⅱ型糖尿病常选用阿卡波糖或二甲双胍等药物,但患者会出现呕吐、腹泻等症状[7],因此选用天然产物调控血糖水平具有重要意义。赵艳威等[8]研究表明苹果多酚可通过抑制α-葡糖苷酶活性降低糖尿病大鼠的血糖。厉成玲等[9]研究发现黑米多酚可有效刺激小鼠胰岛素分泌,改善Ⅱ型糖尿病小鼠恢复趋于正常血糖水平。
本研究采用超声辅助提取技术制备茄皮酚(EPP),以得率为指标对提取工艺进行优化,测定EPP对α-葡萄糖苷酶活性的抑制率,评价其体外的降血糖作用,通过建立糖尿病小鼠模型,对EPP体内降血糖活性进行研究,既提升了茄皮的综合利用率,又为治疗Ⅱ型糖尿病提供了新的原料和思路。
1 材料与方法
1.1 材料与仪器
雄性昆明小鼠 实验动物饲养于北京市实验动物研究中心,4周龄(18~20 g),动物许可证号为SYXK(京)2020-0038,实验期间充分保证了实验动物的各项福利;紫黑色茄子 表皮颜色均匀无虫害,购于邯郸市丛台区美食林超市;硝基苯基-α-D-吡喃葡萄糖、阿卡波糖、α-葡萄糖苷酶(10 U/mg) 上海源叶生物科技有限公司;四氧嘧啶 美国Sigma公司;磷酸钾、碳酸钠 分析纯,国药集团化学试剂有限公司。
SB25-12DTD超声波清洗器、SCIENTZ-18N冷冻干燥机 宁波新芝生物科技股份有限公司;BPG-9100BH高热鼓风干燥箱 上海一恒科技有限公司;AL204型精密电子天平 梅特勒-托利多公司;SIGMA3K15台式冷冻离心机 曦瑪离心机(扬州)有限公司;UV-80005紫外分光光度计 上海方析仪器有限公司;ACCU-CHEK血糖测定仪 罗氏血糖健康医护公司。
1.2 实验方法
1.2.1 EPP提取 将新鲜无虫害茄子进行清洗,取茄皮置于45 ℃鼓风干燥箱中干燥5 h,干燥后的茄皮进行粉碎并过100目筛。在装有100 mL蒸馏水的锥形瓶中加入2.00 g干燥茄皮粉末,进行超声辅助提取,超声功率为420 W,提取30 min,结束后,8500 r/min离心15 min,收集上清液,冷冻干燥,得到EPP,称重并计算得率。
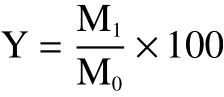
式中:Y为EPP得率,%;M1为EPP的质量,g;M0为茄皮粉末的质量,g。
1.2.2 单因素实验 以EPP的得率为指标,提取时间为50 min,提取温度为45 ℃,料液比为1:50 g/mL,探究最优超声功率(360、420、480、540、600 W);以EPP的得率为指标,提取时间为50 min,超声功率为480 W,提取温度为45 ℃,探究最优料液比(1:40、1:45、1:50、1:55、1:60 g/mL);以EPP的得率为指标,提取时间为50 min,超声功率为480 W,料液比为1:50 g/mL,探究最优提取温度(35、40、45、50、55 ℃);以EPP的得率为指标,超声功率为480 W,提取温度为45 ℃,料液比为1:50 g/mL,探究最优提取时间(30、40、50、60、70 min)。
1.2.3 正交试验 在单因素实验基础上,以料液比、提取时间、超声功率和提取温度为因素,EPP得率为指标,采用正交试验L9(34)设计,对影响EPP得率的因素进行优化,见表1。
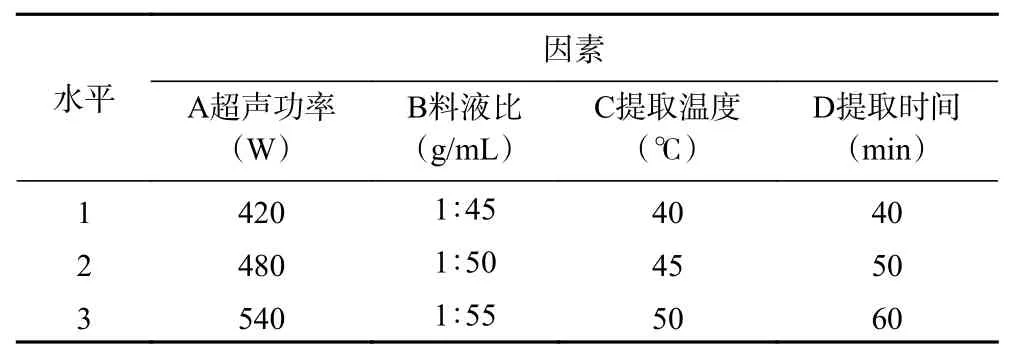
表1 正交试验因素和水平设计Table 1 Factors and levels of orthogonal experiment
1.2.4 EPP对α-葡萄糖苷酶活性的抑制率测定 根据黄春跃等[10]的方法进行调整,测定EPP对α-葡萄糖苷酶活性的抑制率。用pH6.9,0.1 mmol/L磷酸盐缓冲溶液分别配制2 mg/mL阿卡波糖溶液、0.2 U/mL的α-葡萄糖苷酶溶液和0.2 mol/L的碳酸钠溶液;配制0.2、0.4、0.6、0.8、1.0 mg/mL的浓度EPP溶液备用。37 ℃孵育10 min后加入2.0 mL碳酸钠溶液,反应终止后在405 nm处测定吸光值,α-葡萄糖苷酶溶液+EPP溶液吸光值记为OD1,EPP溶液吸光值记为OD2,α-葡萄糖苷酶溶液吸光值记为OD3,磷酸盐缓冲溶液吸光值记为OD4,2 mg/mL阿卡波糖溶液为阳性对照。
α-葡萄糖苷酶抑制率计算公式为:
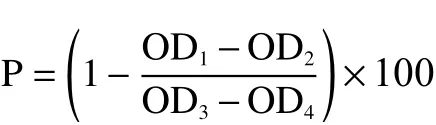
1.2.5 建立糖尿病小鼠模型 所有实验动物均饲养在北京市实验动物研究中心SPF级动物房中,充分保证了实验动物的福利,严格遵守了有关动物使用的道德规定。
随机选120只健康4周龄雄性昆明小鼠,禁食16 h,注射四氧嘧啶180 mg/kg·bw,注射体积为0.01 mL/g,建立Ⅱ型糖尿病模型小鼠;同时给予普通饲料自由采食,禁食8 h,采尾血,测定空腹血糖值。糖尿病小鼠建模成功标准:空腹血糖值大于10 mmol/L(参照《保健食品功能检验与评价方法(2020年版)》)。
1.2.6 降血糖试验 随机选取10只健康小鼠作为空白组,选取50只建模成功的小鼠,分为5组(n=10):空白组(等体积无菌水),阳性对照组(1 mg/kg·bw的阿卡波糖溶液),模型组(等体积无菌水),高剂量组(1.5 g/kg·bw的EPP溶液),中剂量组(0.5 g/kg·bw的EPP溶液),低剂量组(0.25 g/kg·bw的EPP溶液),灌胃体积为10 mL/kg,同时给予普通饲料自由采食,连续灌胃4周,禁食4 h,采尾血,测定空腹血糖值[11]。
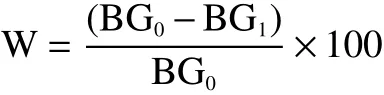
式中:W表示血糖下降率,%;BG0表示EPP干预前血糖值,mmol/L;BG1表示EPP干预后血糖值,
mmol/L。
1.2.7 糖耐量试验 小鼠试验4周禁食4 h后进行灌胃,20 min后每只小鼠灌胃葡萄糖溶液,剂量为2.0 g/kg·bw,分别测定灌胃后0、0.5、2 h的血糖值并记录血糖曲线下面积[12]。
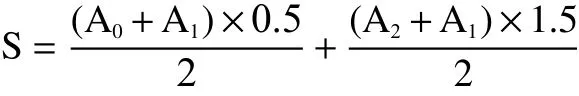
式中:S表示血糖曲线下的面积;A0表示0 h血糖值;A1表示0.5 h血糖值;A2表示2 h血糖值。
1.3 数据处理
采用SPSS 20.0进行数据处理,显著性差异采用ANOVA,P<0.05为具有显著性差异,P<0.01为具有极显著差异,数据表示均采用均值±标准误。
2 结果与分析
2.1 单因素实验结果
各因素对EPP得率的影响如图1所示,超声功率对EPP得率的影响呈先上升后下降的趋势,在480 W时,EPP得率最高达到39.21%,因过高的超声功率会造成EPP中黄酮、多酚类物质结构被氧化分解[13],且过高的超声会产生热效应[14],改变原料结构,降低了酚类物质的溶出,降低了EPP的得率。
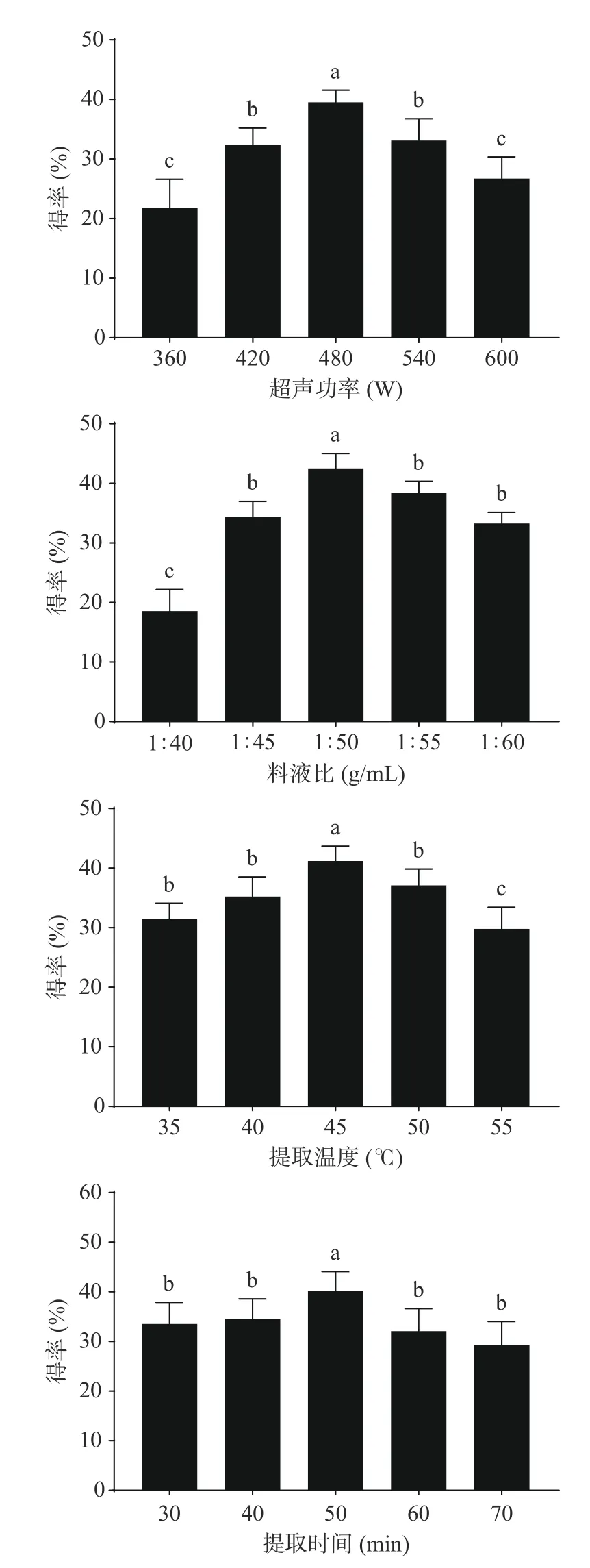
图1 超声功率、料液比、提取温度和提取时间对EPP得率的影响Fig.1 Effects of ultrasonic power, solid-liquid ratio, extraction temperature and extraction time on the yield of EPP
EPP的得率随着料液比的变化呈先上升后下降的趋势,在料液比为1:50 g/mL时得率达到最大,为42.51%。表明料液比为1:50 g/mL时已基本完成对EPP的提取,增加溶剂已无法提升得率,甚至可能会增加冷冻干燥的负荷[15]。故1:50 g/mL为提取EPP的最佳料液比。
EPP的得率随着温度的变化呈先上升后下降的趋势,温度在35~45 ℃时,EPP得率随着温度增加而增加,且提取温度为45 ℃时,EPP得率高达41.2%;当温度高于45 ℃,EPP得率呈下降趋势;过高的提取温度导致EPP中的生物活性物质被分解,且溶剂挥发导致样液溶解度降低,从而降低了EPP的得率[16],与胡栋宝等[17]的结果一致,利用适宜的提取温度可加快酚类物质溶出,同时需防止过高的提取温度破坏已经提取的多酚类物质。
EPP的得率随着提取时间的变化呈先上升后下降的趋势,当提取时间小于50 min时EPP的得率随提取时间的增加而升高;当提取时间大于50 min时,EPP的得率随提取时间的增加而降低,最优提取时间50 min为,得率为40.11%,与刘静等[18]研究结果一致,过长的提取时间会造成已溶出的EPP被氧化,导致EPP得率会随着提取时间的增加呈现出下降的趋势[19]。故提取EPP最佳超声时间为50 min。
2.2 正交试验结果
由表2、表3可知,影响EPP得率的顺序依次为:提取温度(C)>提取时间(D)>料液比(B)>超声功率(A),且提取EPP的最佳工艺是A3B2C3D2,即提取温度50 ℃,提取时间50 min,料液比1:50 g/mL,超声功率540 W。
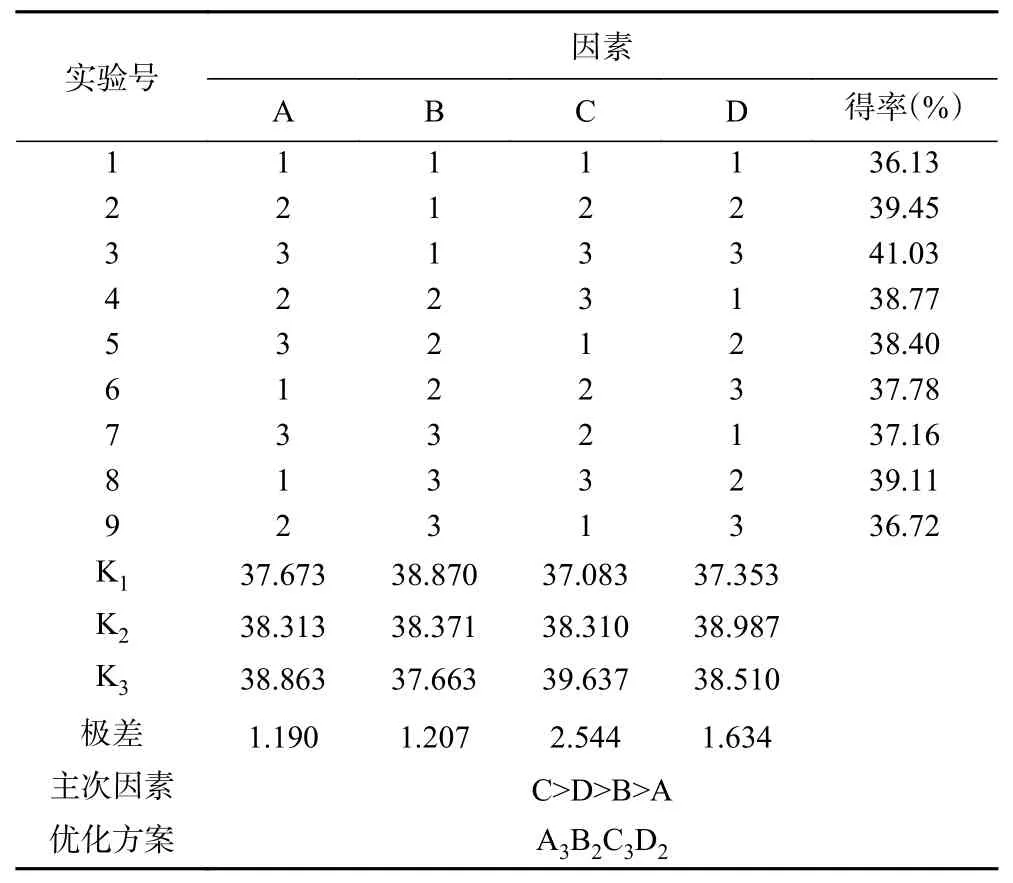
表2 正交试验结果Table 2 Results of orthogonal experiment
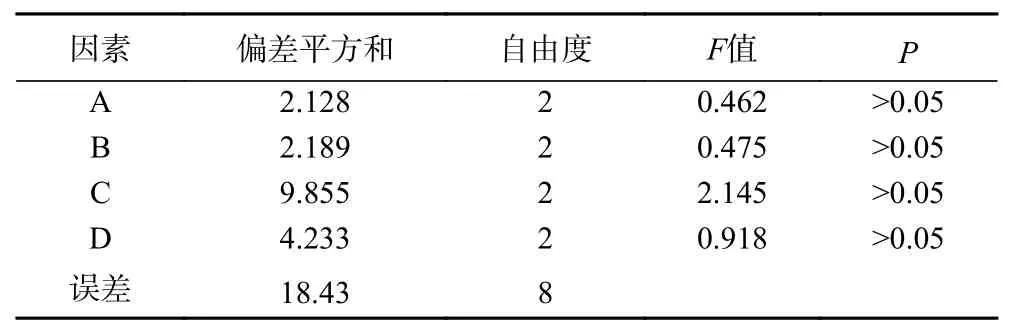
表3 方差分析Table 3 Variance analysis
进行了3次正交试验结果验证试验,测的EPP得率为43.21%,确认提取工艺最优参数为A3B2C3D2。
2.3 EPP对α-葡萄糖苷酶活性的影响
α-葡萄糖苷酶是关键的消化酶,抑制α-葡萄糖苷酶可降低消化率从而缓解餐后血糖。对于Ⅱ型糖尿病的治疗,可以利用抑制α-葡萄糖苷酶的活性从而抑制血糖水平的异常升高[20-22]。如图2所示,不同浓度的EPP对α-葡萄糖苷酶均有抑制作用,EPP浓度在0.2~1 mg/mL时,抑制率与EPP浓度呈正相关,1 mg/mL EPP抑制率为45.46%。而常国立等[23]研究发现1 mg/mL杨梅核多酚对α-葡萄糖苷酶的抑制率高于90%且效果优于同浓度阿卡波糖的抑制率,可能是由于提取的EPP未进行纯化,导致相同浓度时,EPP的抑制效果较差。
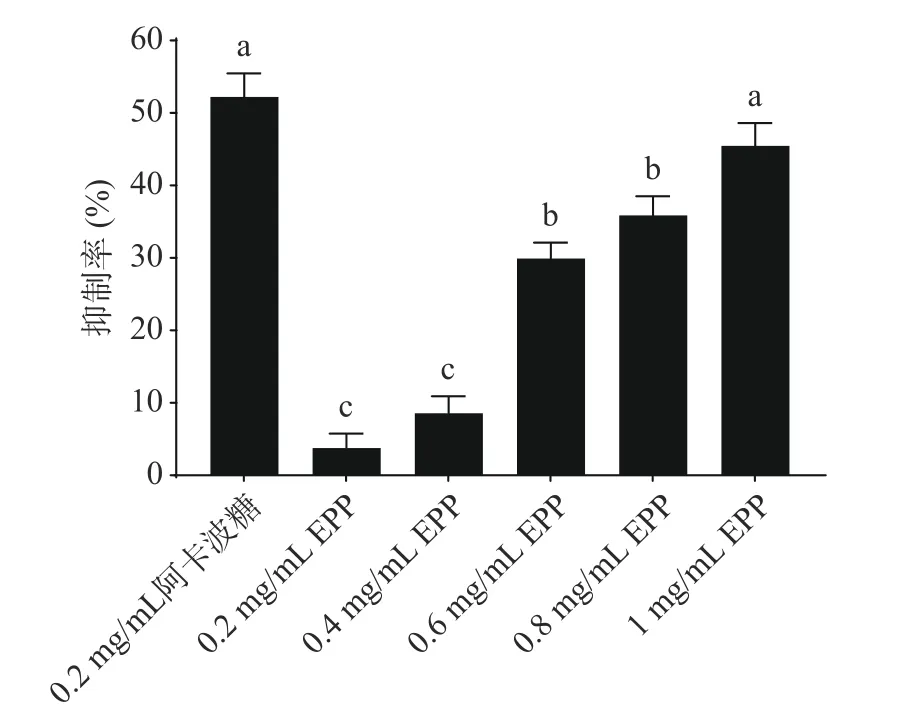
图2 EPP对α-葡萄糖苷酶的抑制率Fig.2 Inhibition rate of α-glucosidase by EPP
2.4 EPP对糖尿病小鼠体重的影响
糖尿病小鼠体重通常会出现缓慢增长甚至降低的状态。由表4可知,试验前后,空白组小鼠的体重与其他试验组均存在极显著差异(P<0.01),表明建立糖尿病小鼠模型成功;阳性对照组、低剂量组、中剂量组、高剂量组给药后体重均有所上升,但与模型组相比,均无统计学差异(P>0.05);EPP三个剂量组之间及与阳性对照组也均无显著差异(P>0.05)。
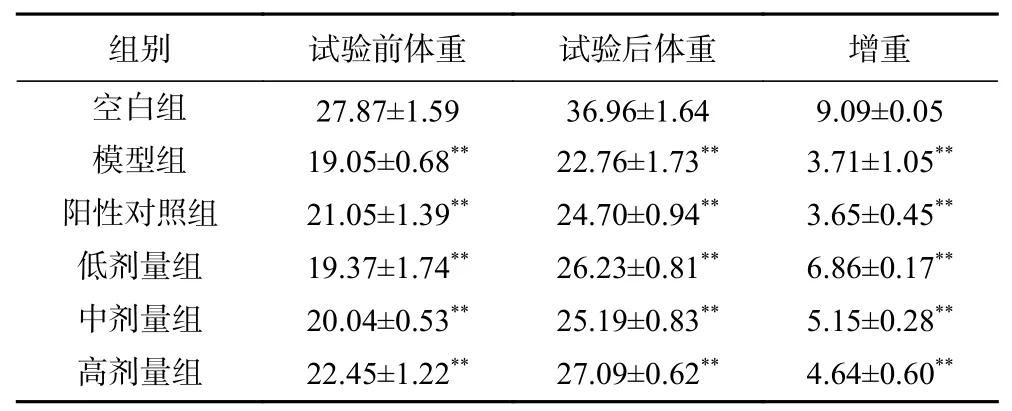
表4 EPP对糖尿病小鼠体重的影响(g)Table 4 Effects of EPP on body weight of hyperglycemic mice (g)
2.5 EPP对糖尿病小鼠空腹血糖的影响
空腹血糖值可以反映出机体血糖代谢的状况[24]。由图3可知,试验前,与空白组相比,糖尿病小鼠空腹血糖值均升高,具有极显著差异(P<0.01),且注射四氧嘧啶的小鼠各组间空腹血糖值无显著差异(P>0.05),表明糖尿病小鼠建模成功。经4周灌胃后,与空白组相比,模型组和低、中、高剂量组血糖值均升高,存在极显著差异(P<0.01);虽然低剂量组血糖值降低,但与模型组无显著性差异(P>0.05),中剂量组存在显著差异(P<0.05),阳性药组及高剂量组血糖值明显下降,存在极显著差异(P<0.01);与阳性药组相比,EPP干预的剂量组均存在极显著的差异(P<0.01),但血糖值均高于阳性药组,表明EPP对降低空腹血糖水平有积极作用,但效果不及阿卡波糖治疗效果,这可能是由于注射四氧嘧啶对小鼠胰岛细胞造成了不可逆的损伤,EPP的干预仅能改善空腹血糖水平,而不能使其恢复至正常状态[25]。
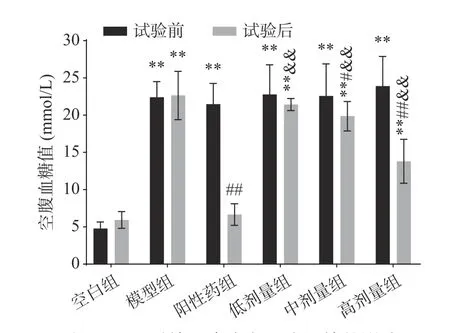
图3 EPP对糖尿病小鼠空腹血糖的影响Fig.3 Effects of EPP on fasting blood glucose in hyperglycemic mice
由血糖下降率可知,模型组、阳性药组和EPP干预的三个剂量组血糖下降率均高于空白组,且存在极显著差异(P<0.01);阳性药和EPP干预均使之呈现出较高的血糖下降率,与模型组比,低剂量组存在显著差异(P<0.05),阳性药组和中、高剂量组存在极显著差异(P<0.01);EPP干预的三个剂量组血糖下降率均低于阳性药物组,存在极显著的差异(P<0.01),结论与空腹血糖值相同,且高剂量的EPP干对糖尿病小鼠的空腹血糖值预有更好的治疗效果。
2.6 EPP对小鼠糖耐量的影响
糖耐量可反映出机体对葡萄糖代谢的调节能力。由图4可知,给药0.5 h时,除空白组外,所有小鼠的血糖值均达到最高水平;与阳性药组相比,高剂量组0.5 h血糖值明显降低,具有显著差异(P<0.05)。给药2 h后,灌胃葡萄糖溶液引起的血糖值波动基本消失;除空白组外其他实验组血糖值仍较高,且与空白组相比存在极显著差异(P<0.01);经低、中剂量EPP灌胃小鼠的血糖值与模型组相比无显著差异(P>0.05),但经高剂量EPP灌胃小鼠的血糖值与模型组相比存在显著差异(P<0.05);与阳性药物组相比,低、中、高剂量组血糖值降低效果较差,低剂量组存在极显著差异(P<0.01),中剂量组存在显著差异(P<0.05),且经过EPP干预(如图5),血糖曲线下面积极显著降低(P<0.01)。上述结论表明EPP的降血糖作用具有剂量依赖性,EPP能有效提升糖尿病小鼠的糖耐量,EPP可以改善糖尿病小鼠,降低小鼠机体葡萄糖的负荷,促进代谢,有效降低血糖值,与赵艳威等[8]研究结果一致。
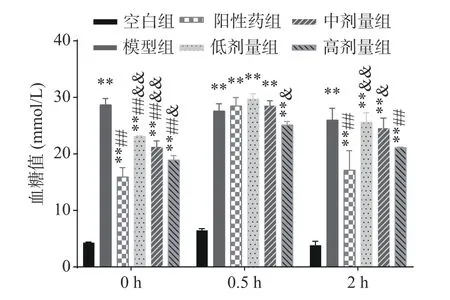
图4 EPP对糖尿病小鼠糖耐量的影响Fig.4 Effects of EPP on glucose tolerance in hyperglycemic mice
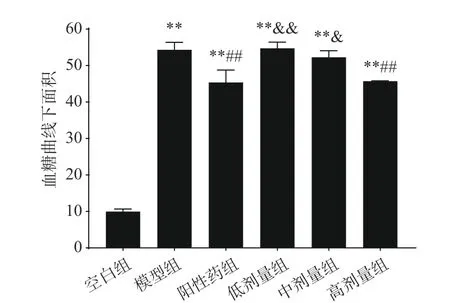
图5 EPP对糖尿病小鼠血糖曲线下面积的影响Fig.5 Effects of EPP on area under the blood glucose curve in hyperglycemic mice
3 结论
本研究对紫黑色茄皮以蒸馏水为提取剂进行超声辅助提取,研究优化了EPP的提取工艺:最优超声功率为540 W,料液比为1:50 g/mL、提取温度为50 ℃、提取时间为50 min,此条件下EPP的得率为43.21%。通过对α-葡萄糖苷酶活性的抑制率确定EPP具有体外降血糖功效,1 mg/mL的EPP在体外对α-葡萄糖苷酶抑制率为45.46%。利用EPP对糖尿病小鼠进行干预治疗,通过测定小鼠的体重、空腹血糖值及糖耐量,确定了EPP不会使正常小鼠的血糖代谢异常;对糖尿病小鼠具有明显的降血糖作用,且高剂量EPP具有更优的降血糖效果。这表明EPP具有治疗Ⅱ型糖尿病的潜力,且不会对正常的胰腺组织产生负面影响。但EPP的具体成分需进行进一步研究。本研究可提升茄皮的综合利用价值,为降血糖相关产品的开发提供新的研究思路。

表5 EPP对糖尿病小鼠血糖下降率的影响Table 5 Effect of EPP on hypoglycemic rate in diabetic mice
