固态发酵对藜麦营养成分、酚类物质含量及抗氧化活性的影响
2022-12-10王璐瑶张笃芹
王璐瑶,张笃芹 ,牛 猛,谭 斌
(1.华中农业大学食品科技学院,湖北武汉 430070;2.国家粮食与物资储备局科学研究院,北京 100037)
藜麦(Chenopodium quinoaWilld.)是苋科藜属双子叶假谷物,籽粒结构由种皮、胚乳、胚组成,含量分别为8.2%、30.1%、58.8%(以全谷物的质量比计)[1]。藜麦除富含优质蛋白质、不饱和脂肪酸、矿物质、维生素等基本营养元素,还含有多种生物活性物质,如酚类物质、甜菜红素、皂苷、植物甾醇、植物蜕化类固醇、甘氨酸甜菜碱等。藜麦的高营养价值、富含生物活性物质、不含谷醇溶蛋白等特性,使得藜麦适合儿童、老人、乳糖不耐症人群、易患骨质疏松的女性,贫血、糖尿病、血脂异常、肥胖、乳糜腹泻等高风险人群食用,被联合国粮食及农业组织(FAO)评价为“唯一一种单体植物即可满足人体基本营养需求的食物”。
藜麦全谷物中不溶性膳食纤维含量较高,对其食用品质产生不利影响。因此,为进一步提高藜麦的营养价值和加工品质,国内外常采用物理(包括碾磨、蒸煮、超微粉碎、焙烤、挤压膨化等)和生物(发芽等)方式对藜麦进行加工。然而,由于藜麦的酚类物质主要位于外层,部分处理方式使其外层结构损失明显,导致酚类物质含量及抗氧化活性下降。例如,当藜麦碾磨抛光度为30%时,其游离酚和结合酚含量分别下降了21.5%和32.5%[2]。挤压膨化藜麦粉与未处理的相比,总酚和总黄酮含量分别下降了37.82%和60.35%,DPPH和ABTS+自由基清除能力也明显下降[3]。相比于物理加工方式,藜麦发芽可使酚类物质及其抗氧化活性增强,例如,藜麦发芽48 h后,总酚、总黄酮含量分别增加了63.2%和23.6%[4]。
固态发酵是目前用于提升谷物综合品质的关键生物加工技术之一[5-6]。国内外已有利用酵母菌、米根霉、少孢根霉等菌种对小麦、糙米、青稞和荞麦等进行固态发酵处理的研究,结果发现固态发酵可显著提高这些谷物中酚类物质含量及其抗氧化活性[6-9]。藜麦在使用少孢根霉固态发酵后,植酸含量降低了43%;使用双胞蘑菇AS2796菌株对藜麦发酵时,蛋白质的含量变为原来的2.34倍;使用动物型双歧杆菌固态发酵时,酚酸类物质的含量上升超过100%,抗高血压和抗氧化活性显著增强[10-12]。总体而言,使用不同菌种固态发酵对藜麦营养成分、酚类物质含量及抗氧化活性影响的研究还较为缺乏。
因此,本研究利用植物乳杆菌、酿酒酵母、米根霉、米曲霉和好食脉胞菌单独或混合对藜麦进行固态发酵处理,分析测定不同菌种固态发酵对藜麦基本营养成分、酚类物质含量及其抗氧化活性的影响,获得营养价值及抗氧化能力显著提高的固态发酵加工藜麦,以期为藜麦产品的开发提供新的思路和方案。
1 材料与方法
1.1 材料与仪器
藜麦全谷物籽粒 品种为灰藜麦一号,于2021年11月购自甘肃市场;好食脉孢菌Neurospora sitophila(CICC 40204)、植物乳杆菌Lactobacillus plantarum(CICC 22696)、酿酒酵母Saccharomyces cerevisiae(CICC 1223)、米根霉Rhizopus oryzae(CICC 40282)、米曲霉Aspergillus oryzae(CICC 41737)均来自中国工业微生物菌种保藏管理中心;马铃薯葡萄糖肉汤(PDB)、酵母浸出粉胨葡萄糖肉汤(YPD)培养基、月桂基硫酸盐胰蛋白胨肉汤(MRS)培养基
北京奥博星生物技术有限责任公司;察氏肉汤干粉(CDB)培养基 北京酷来搏科技有限公司;硝酸铝、水溶性维生素E(Trolox)、2,2-联苯基-1-苦基肼基自由基(2,2-Diphenyl-1-picrylhydrazyl radiacal,DPPH)、芦丁(Rutin,RU)、没食子酸(Gallic acid,GA) 上海麦克林生化科技有限公司;福林酚 北京博奥拓达科技有限公司;所有试剂 均为分析纯。
DH 420电热恒温培养箱 北京科伟永兴仪器有限公司;电子分析天平、UV5Bio紫外可见光分光光度计 瑞士梅特勒托利多公司;Synergy H1MF多功能酶标仪 美国博腾仪器有限公司;FOSS 2050脂肪测定仪、FOSS 1023膳食纤维测定仪 丹麦福斯分析仪器公司。
1.2 实验方法
1.2.1 固态发酵
1.2.1.1 原料预处理 挑选颗粒饱满的藜麦并清洗烘干,121 ℃高压灭菌20 min后冷却至室温备用。
1.2.1.2 菌种活化 参考郑子懿等[13]的方法稍作改动,将植物乳杆菌、酿酒酵母、米根霉、米曲霉和好食脉胞菌活性粉分别接种至液态培养基中30 ℃环境下进行活化,培养传代并传代后在3000×g下离心10 min,沉淀用生理盐水清洗2次后悬浮于50 mL无菌蒸馏水中备用。
取1 mL菌的悬浮液利用生理盐水对该混合溶液进行稀释并计数,为保证酿酒酵母和植物乳杆菌接种浓度的一致性,植物乳杆菌和酿酒酵母悬浮液最终稀释至107CFU/mL,米曲霉、米根霉和好食脉孢菌的孢子悬浮液为107孢子/mL。
1.2.1.3 接种与发酵 对照组和实验组分别进行如表1处理。
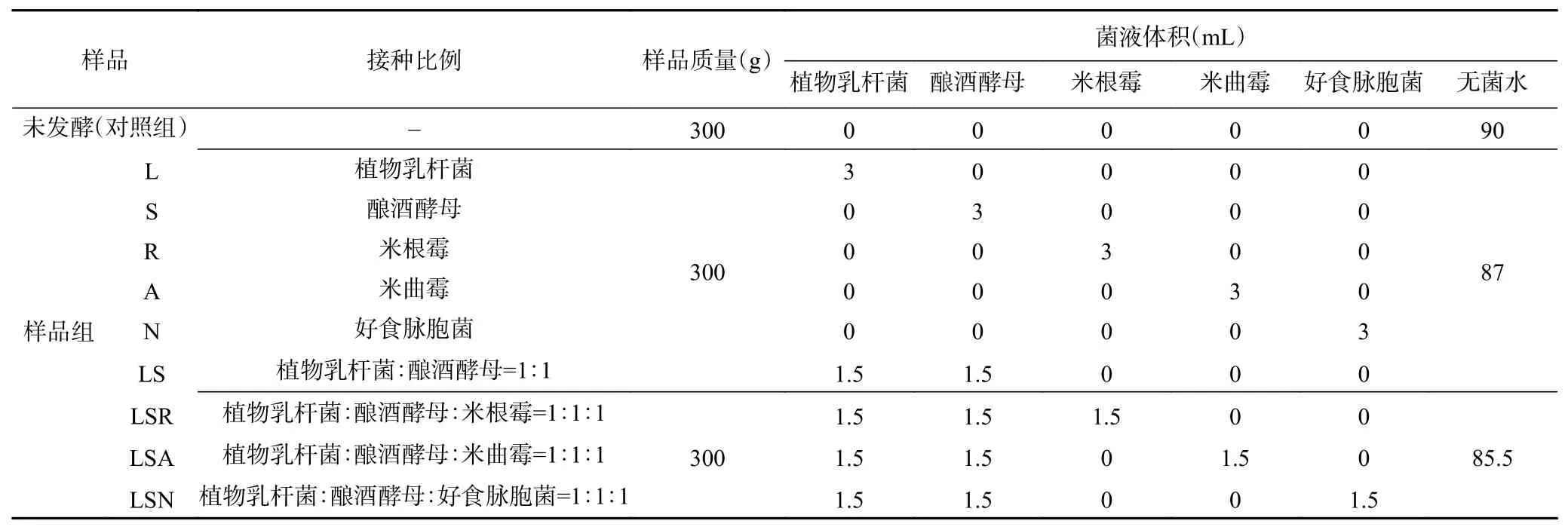
表1 接种比例实验设计Table 1 Experiment design of inoculation proportion
根据预实验结果,发酵时间小于30 h时,各种营养成分变化不明显,而当样品发酵时间超过48 h时,会产生异味。因此,样品分别在无菌发酵袋中30 ℃静态培养30和48 h后高压灭菌。对发酵后样品进行真空冷冻干燥,粉碎后过60目筛,得到固态发酵藜麦冻干粉备用。
1.2.2 基本营养成分测定 水分参照国家标准GB 5009.3-2016《食品安全国家标准食品中水分的测定》。脂肪参照国家标准GB 5009.6-2016《食品安全国家标准食品中脂肪的测定》。灰分参照国家标准GB 5009.4-2016《食品安全国家标准食品中灰分的测定》。蛋白质参照国家标准GB 5009.5-2016《食品安全国家标准食品中蛋白质的测定》。淀粉参照AOAC标准996.11《AOAC Official Method 996.11 Starch(Total)in Cereal Products》。膳食纤维参照国家标准GB 5009.88-2014《食品安全国家标准食品中膳食纤维的测定》。
1.2.3 酚类物质的提取及测定
1.2.3.1 游离态酚类物质的提取 参考Wang等[14]的方法,准确称取2.00 g样品放入到50 mL的塑料离心试管中,加入40 mL甲醇,超声提取30 min(温度40 ℃,功率100%),离心(3500×g,离心10 min)取上清液,重复操作1次,合并上清液,40 ℃旋转蒸干后甲醇定容至2 mL,得到样品的游离酚粗提液。
1.2.3.2 结合态酚类物质的提取 自由酚提取后的沉淀加入2 mol/L NaOH溶液室温避光涡旋1 min,在氮气保护下调pH至中性终止反应。3500×g离心10 min,重复操作3次,合并上清液。 45 ℃旋转蒸干后甲醇定容至2 mL,得到样品的结合酚粗提液[15-16]。
1.2.3.3 多酚含量测定 采用Folin-Ciocalteu法[17]测定试样的酚含量,250 μL样品稀释液与250 μL福林酚试剂混合反应6 min,加入2.5 mL Na2CO3(7 g/100 mL)溶液和2 mL蒸馏水室温下避光反应90 min,765 nm波长处测定吸光度。以没食子酸为标样制定标准曲线y=5.2915x+0.0194,R²=0.9961,根据式(1)计算样品多酚含量,样品多酚含量以100 g干基中所含没食子酸的毫克数表示(简写为mg GAE/100 g DW)。

式中:A为反应液调零后在765 nm波长处的吸光度;m为提取时称取的样品质量;w为样品水分含量;D为样品稀释倍数;c为样品中的没食子酸浓度(mg GAE/100 g DW)。
1.2.3.4 黄酮含量测定 采用NaNO2-Al(NO3)3方法测定试样的黄酮含量。取适量样品粗提液加入200 μL NaNO2(5 g/100 mL)溶液混合均匀后避光反应6 min,加入200 μL Al(NO3)3(10 g/100 mL)溶液反应6 min,再加入2 mL的NaOH(4 g/100 mL)溶液和2.5 mL 蒸馏水混匀后室温下避光反应15 min,510 nm波长处测定吸光度。以芦丁为标样制作标准曲线y=0.2308x+0.0016,R²=0.9993,根据式(2)计算样品黄酮含量,结果以100 g干基中所含芦丁当量的毫克数表示(简写为 mg RE/100 g DW)。

式中:A为反应液调零后在510 nm波长处的吸光度;m为提取时称取的样品质量;w为样品水分含量;D为样品稀释倍数;c为样品中所含的芦丁当量浓度(mg RE/100 g DW)。
1.2.4 抗氧化活性的测定
1.2.4.1 总抗氧化能力 按照南京建成生物工程研究所提供的总抗氧化能力检测试剂盒的要求操作,于520 nm波长处测定吸光度,根据式(3)计算样品的总抗氧化活性,结果以“单位/g DW”表示(在37 ℃时,每分钟每单位体积或质量样品使反应体系的吸光度(OD)值每增加0.01时,为一个总抗氧化能力单位)。

式中:A测定为反应液在510 nm波长处的吸光度;A对照为对照液在510 nm波长处的吸光度;m为提取时称取的样品质量;w为样品水分含量;D为样品稀释倍数;V1为反应液总量;V2为取样量。
1.2.4.2 DPPH自由基清除能力 参考Thaipong等[18]的方法稍作改动,将等份的样品粗提稀释液与0.1 mmol/L的DPPH甲醇溶液混匀后避光反应20 min,于517 nm波长处测定吸光度,以Trolox(水溶性维生素E)为标样制作甲醇溶液标准曲线y=0.2308x+0.0016,R²=0.9997,根据式(4)计算样品DPPH自由基清除能力,结果以100 g干基中所含Trolox的当量微摩尔数表示(μmol Trolox/100 g DW)。
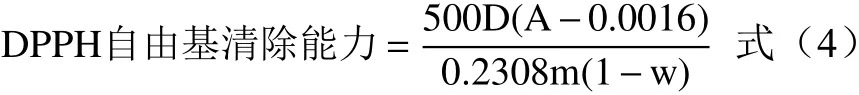
式中:A为反应液调零后在517 nm波长处的吸光度;m为提取时称取的样品质量;w为样品水分含量;D为样品稀释倍数。
1.2.4.3 ABTS+自由基清除能力 将20 mL的ABTS(5 mmol/L)溶液中加入1 g MnO2,室温避光反应30 min后形成ABTS+·储备液,测定前用pH7.4的磷酸缓冲溶液稀释至734 nm波长处吸光度为0.70±0.02的ABTS+·工作液。200 μL样品稀释液与3 mL ABTS+·工作液混匀室温下避光反应6 min后在734 nm波长处测定吸光度,根据式(5)计算样品ABTS+·清除能力,以Trolox作为标样制作标准曲线y=0.7691x+0.0619,R²=0.9999,结果以100 g干基中所含Trolox的当量微摩尔数表示(μmol Trolox/100 g DW)[19]。
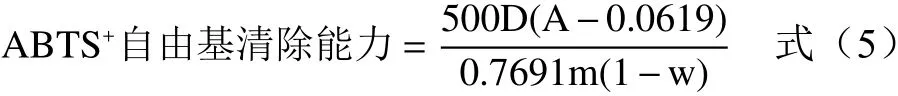
式中:A为反应液调零后在734 nm波长处的吸光度;m为提取时称取的样品质量;w为样品水分含量;D为样品稀释倍数。
1.3 数据处理
数据统计采用Excel 2016,数据以“平均值±标准偏差”表示,平行n=3,使用SPSS 22.0对数据进行分析,采用Ducan's多重检验(P<0.05)进行显著性分析;使用Origin 2018进行绘图。
2 结果与分析
2.1 固体发酵对藜麦基本营养成分的影响
固态发酵处理对藜麦基本营养成分的影响见表2。藜麦中含有多种人体所需的基本营养物质,未发酵藜麦中水分、脂肪和淀粉含量分别为9.33%、5.04%和54.61%。经过固态发酵处理后,藜麦样品的淀粉含量都有所下降,其中米根霉发酵48 h的藜麦样品中,淀粉含量为39.32%,下降最为明显。淀粉含量的下降主要是因为,发酵前期,基质中的营养物质用于菌种的生长和繁殖,特别是用于合成细菌和真菌细胞壁[5,20],此外,各个菌种在生长过程中能够产生大量的淀粉酶和糖化酶,使得淀粉含量减少[21-22]。例如,酵母内酶系丰富,含有蛋白酶、蔗糖酶、β-葡聚糖酶、淀粉酶、脂肪酶等,植物乳杆菌中含有大量与碳水化合物有关酶类,如淀粉酶、葡萄糖淀粉酶、β-葡萄糖苷酶等。对于丝状真菌,米根霉可产生大量的葡萄糖淀粉酶、液化酶等;米曲霉主要产出蛋白酶、淀粉酶、β-葡萄糖苷酶、纤维素酶等;好食脉胞菌生长迅速,可以产出纤维素酶和植酸酶,同时也含有蛋白酶、淀粉酶和果胶酶等[23-25]。

表2 不同菌种发酵对藜麦样品基本营养组分的影响(%)Table 2 Effects of solid-state fermentation with different strains on the proximate composition of quinoa (%)
米曲霉发酵30 h和米根霉发酵48 h的藜麦中,脂肪含量分别为7.47%和6.95%,明显高于其他样品;酿酒酵母发酵48 h的样品脂肪含量(4.41%)明显低于其他样品。藜麦的脂肪主要分布在藜麦胚乳中,外部包裹了外部果皮和种皮[26],菌种发酵产生的淀粉酶、纤维酶等将外部包裹的种皮等分解,使内部结合的脂肪酸释放出来,从而使脂肪含量升高[27]。对于酵母而言,其生长和繁殖过程中可利用脂质合成几丁质,造成游离脂肪含量的降低。
未发酵藜麦中不可溶和可溶性膳食纤维含量分别为2.32%和2.58%。总体而言,固态发酵使藜麦中不可溶性膳食纤维含量降低,可溶性膳食纤维含量升高。其中,好食脉孢菌发酵30 h(0.26%)和48 h(0.39%)的藜麦样品中,不可溶性膳食纤维含量下降明显;植物乳杆菌(4.30%)、米根霉(4.38%)、好食脉孢菌(4.00%)发酵30 h的藜麦样品中,可溶性膳食纤维含量显著高于其他组别(P<0.05)。
微生物发酵产生大量的纤维素水解酶,可以切断膳食纤维的糖苷键,分解不溶性膳食纤维而释放出可溶性膳食纤维[28-29]。由研究结果可见,单菌发酵与混菌发酵相比,植物乳杆菌、米根霉和好食脉孢菌单菌发酵30 h后可溶性膳食纤维含量的增加更为明显,这可能是因为单菌发酵过程中,不存在其他菌种的干扰作用,生长速度较快而产生的纤维素酶和木聚糖酶更多,更加利于可溶性膳食纤维的形成[28,30];对于混菌发酵而言,发酵过程中不同作物菌株产生相互作用,一方面菌种间的竞争生长使酶类的分泌产量减少,另一方面,菌种代谢的关键酶(包括膳食纤维水解酶,如纤维素酶、半纤维素酶等),在酶活力上也存在着一定的相互作用(促进或抑制),从而导致膳食纤维含量变化各异[9,31]。
2.2 固体发酵对藜麦酚类物质含量的影响
2.2.1 固态发酵对藜麦多酚含量的影响 固态发酵对多酚含量的影响见表3。未发酵藜麦中游离酚和结合酚粗提液中多酚含量分别为53.46 和21.33 mg GAE/100 g DW。游离酚粗提液中的多酚和黄酮分别简称为游离态多酚和游离态黄酮;结合酚粗提液中多酚和黄酮分别简称为结合态多酚和结合态黄酮。经固态发酵处理以后,米根霉、植物乳杆菌/酿酒酵母/好食脉孢菌发酵48 h的藜麦中游离态多酚含量上升最为显著,分别为92.06、85.08 mg GAE/100 g DW。虽然部分组别固态发酵藜麦中游离态多酚含量有所下降,但随发酵时间由30 h延长至48 h,这些组别游离态多酚含量均显著增加,该趋势与Dordevic等的研究结果一致[32]。
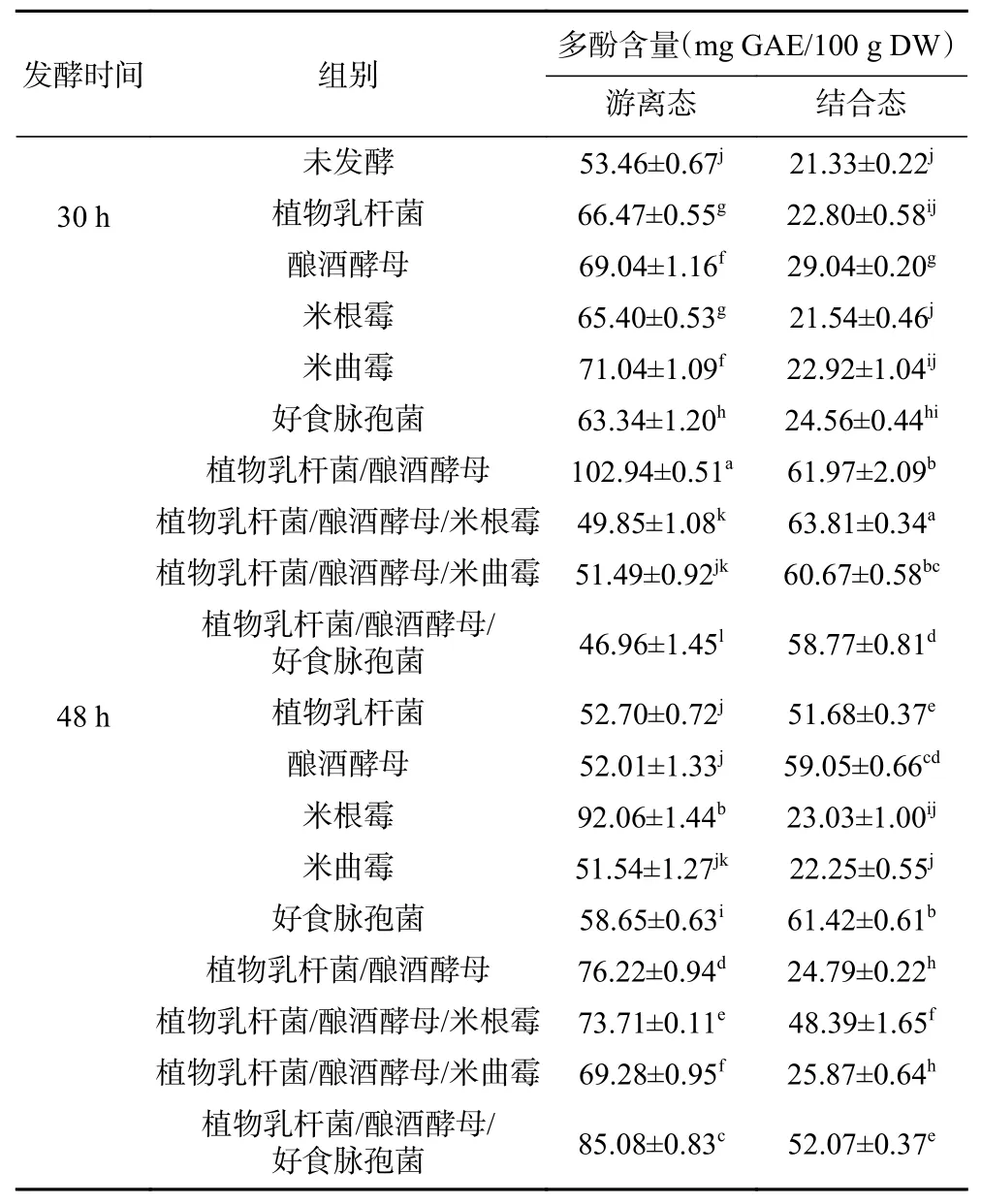
表3 固态发酵对藜麦多酚含量的影响Table 3 Effects of solid-state fermentation on polyphenol content of quinoa
固态发酵处理后藜麦中结合态多酚含量明显上升,其中,植物乳杆菌/酿酒酵母(61.97 mg GAE/100 g DW)、植物乳杆菌/酿酒酵母/米根霉(63.81 mg GAE/100 g DW)发酵30 h,以及好食脉孢菌(61.42 mg GAE/100 g DW)发酵48 h的藜麦样品中结合态多酚含量较高。
2.2.2 固态发酵对藜麦黄酮含量的影响 固态发酵对藜麦黄酮含量的影响如表4。未发酵藜麦中,游离态和结合态黄酮的含量分别为362.71和336.42 mg RE/100 g DW。部分发酵30 h的黄酮含量下降,其中,植酸乳杆菌/酿酒酵母发酵30 h后游离态黄酮含量最低(337.00 mg RE /100 g DW),米根霉发酵30 h后结合态黄酮含量最低(322.46 mg RE/100 g DW)。随发酵时间由30 h延长至48 h,游离态和结合态黄酮含量均显著升高(P<0.05),好食脉孢菌发酵48 h后游离态黄酮升高至624.65 mg RE/100 g DW,植酸乳杆菌/酿酒酵母发酵48 h后结合态黄酮升高至617.83 mg RE/100 g DW,分别变为未发酵藜麦样品的1.72和1.84倍。
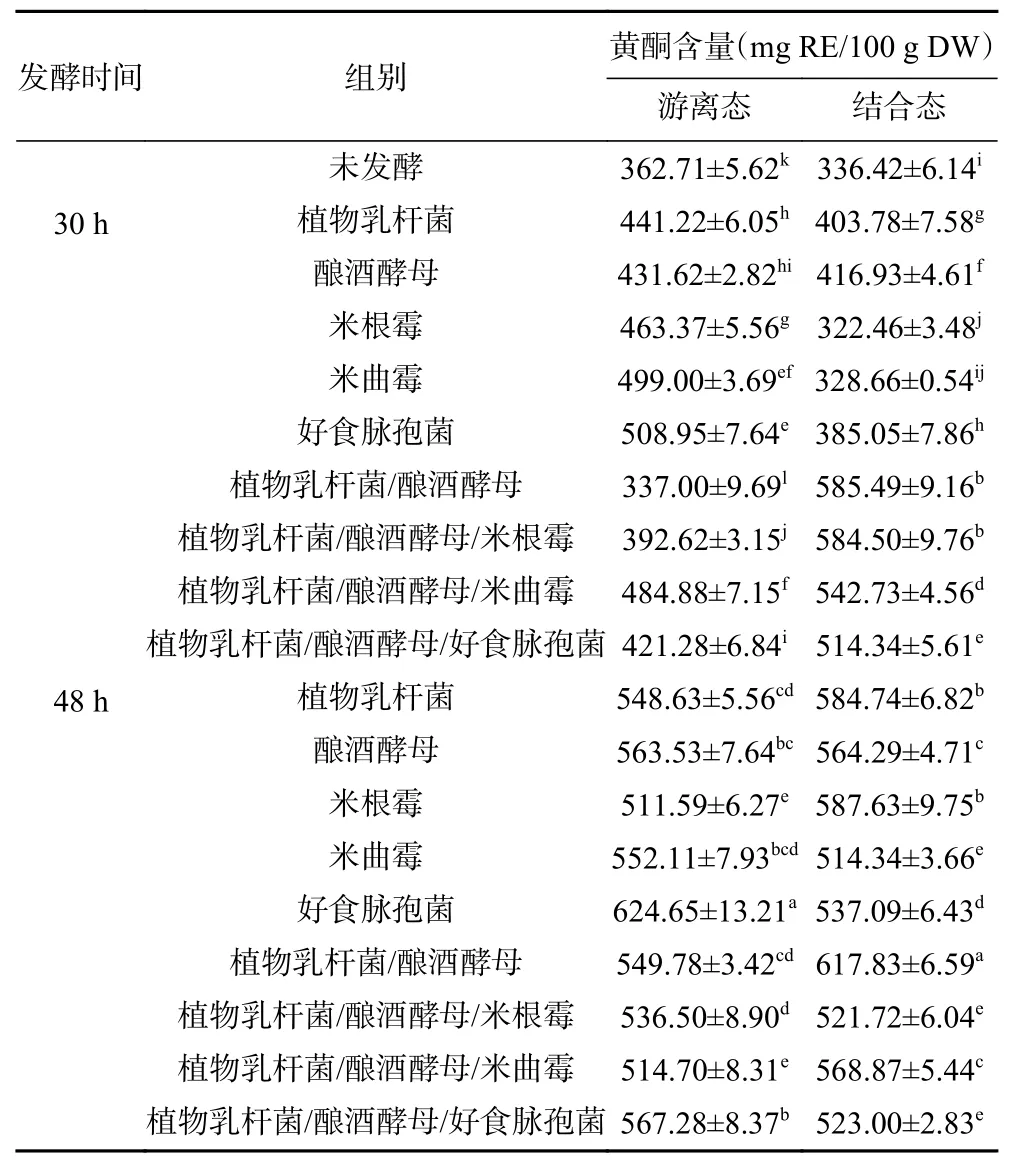
表4 固态发酵对藜麦黄酮含量的影响Table 4 Effects of solid-state fermentation on flavonoids content in quinoa
谷物中的酚类物质(多酚和黄酮)主要有两种存在形态,一部分游离存在,另一部分与细胞壁成分(主要和阿拉伯木聚糖和木质素的阿拉伯糖侧链上的酯结合)连接而以结合态存在。有研究表明,游离态酚类物质在摄入人体后,主要在人体上消化道(口腔至十二指肠)产生有益活性(如抗氧化活性等),而结合态酚类物质因牢固的共价连接,在人体下消化道(十二指肠以下)分解产生效果,抑或无分解作用[33-34]。固态发酵48 h后藜麦中酚类物质含量的升高,主要是因为微生物在发酵时产生多种酶类,使藜麦细胞壁发生降解,释放出酚类物质并使其含量增加。此外,固态发酵处理过程中,微生物的生长代谢可以切断结合态时连接的酯键或醚键,使游离态酚含量增加[35-37]。
2.3 固体发酵对藜麦抗氧化性的影响
2.3.1 固态发酵对藜麦总抗氧化能力的影响 固态发酵对藜麦中酚类物质总抗氧化能力的影响如图1。对于未发酵的藜麦样品,游离酚和结合酚粗提液的抗氧化能力分别为211.61和55.53单位/g DW,总抗氧化能力为267.14单位/g DW。固态发酵后,藜麦中游离酚粗提液的抗氧化能力下降,而结合酚类粗提液的总抗氧化能力明显提高。其中植物乳杆菌/酿酒酵母/好食脉孢菌发酵48 h的藜麦样品中游离酚粗提液的总抗氧化能力仅为103.71单位/g DW,下降最为明显;植物乳杆菌/酿酒酵母发酵30 h和酿酒酵母、植物乳杆菌/酿酒酵母/好食脉孢菌发酵48 h的藜麦样品中,结合酚粗提液的总抗氧化能力上升最为明显,均超过了180单位/g DW。
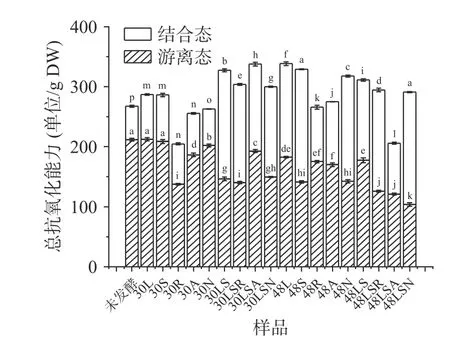
图1 固态发酵对藜麦酚类物质粗提液的总抗氧化能力的影响Fig.1 Effects of solid-state fermentation on the total antioxidant capacity of the crude extract of quinoa phenolics
2.3.2 固态发酵对藜麦DPPH自由基清除能力的影响 固态发酵对藜麦中酚类物质DPPH自由基清除能力的影响见图2。未发酵的藜麦样品中,游离酚和结合酚粗提液的DPPH自由基清除能力分别为23.10和2.10 μmol Trolox/100 g DW,总DPPH自由基清除能力为25.20 μmol Trolox/100 g DW。固态发酵后,游离酚粗提液的DPPH自由基清除能力变化不一,其中,米根霉发酵48 h后,其游离酚粗提液的DPPH自由基清除能力最大,为25.67 μmol Trolox/100 g。固态发酵后结合酚粗提液的DPPH自由基清除能力都显著上升(P<0.05):发酵30 h后,植物乳杆菌/酿酒酵母(15.05 μmol Trolox/100 g DW)、植物乳杆菌/酿酒酵母/米曲霉(15.15 μmol Trolox/100 g DW)、植物乳杆菌/酿酒酵母/好食脉孢菌(13.05 μmol Trolox/100 g DW)接种的藜麦中,结合酚粗提液的DPPH自由基清除能力显著增大(P<0.05);发酵48 h后,酿酒酵母(13.60 μmol Trolox/100 g DW)、好食脉胞菌(14.81 μmol Trolox/100 g DW)、植物乳杆菌/酿酒酵母/米根霉(13.39 μmol Trolox/100 g DW)、植物乳杆菌/酿酒酵母/好食脉孢菌(13.45 μmol Trolox/100 g DW)接种的藜麦中,结合酚粗提液的DPPH自由基清除能力最高。总体而言,植物乳杆菌/酿酒酵母/好食脉孢菌发酵48 h的藜麦样品中,其酚类物质总体的DPPH自由基清除能力最高,为36.23 μmol Trolox/100 g DW。

图2 固态发酵对藜麦酚类物质粗提液的DPPH自由基清除能力的影响Fig.2 Effects of solid-state fermentation on DPPH radical scavenging ability of the crude extract of quinoa phenolics
2.3.3 固态发酵对藜麦ABTS+自由基清除能力的影响 固态发酵对藜麦中酚类物质的ABTS+自由基清除能力的影响见图3。未发酵藜麦样品中,游离酚和结合酚类粗提液的ABTS+自由基清除能力分别为12.34和11.86 μmol Trolox/100 g,总ABTS+自由基清除能力为124.20 μmol Trolox/100 g DW。固态发酵后,植物乳杆菌、米根霉发酵30 h的藜麦中,游离酚粗提液的ABTS+自由基清除能力最强,均超过25 μmol Trolox/100 g DW;植物乳杆菌、酿酒酵母发酵48 h和植物乳杆菌/酿酒酵母/好食脉胞菌发酵48 h的藜麦样品中,结合酚类粗提液的ABTS+自由基清除能力最高,均超过130 μmol Trolox/100 g DW。
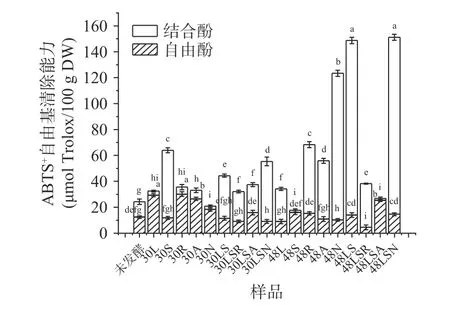
图3 固态发酵对藜麦酚类物质粗提液的ABTS+自由基清除能力的影响Fig.3 Effects of solid-state fermentation on ABTS+ free radical scavenging ability of the crude extract of quinoa phenolics
谷物的生物活性化合物,特别是酚类和多肽,能够提供或接收电子来中和自由基,减少人体的患病几率[38]。固态发酵处理后,藜麦酚类物质粗提液中多酚和黄酮含量与抗氧化活性(总抗化能力、DPPH自由基清除能力和ABTS+自由基清除能力)的相关性分析结果如表5。游离酚粗提液的多酚和黄酮含量与各种抗氧化能力间相关性不显著,而结合酚粗提液的多酚和黄酮含量与各种抗氧化能力间的相关性较为显著,其中,结合酚粗提液的多酚含量与DPPH自由基清除能力的相关系数r=0.9623(P<0.0001),相关性最高,多酚含量与总抗氧化能力相关性也较强(P<0.05);黄酮含量与总抗氧化能力和DPPH自由基清除能力之间的相关性也较为显著(P<0.05)。将游离酚和结合酚粗提液混合后,其中总多酚和总黄酮含量与DPPH自由基清除能力具有显著的相关性(r=0.7320、0.6145,P<0.05)。

表5 各抗氧化活性指标与酚类及黄酮类物质的相关性分析Table 5 Correlation analysis between antioxidant activity indexes and phenols and flavonoids
不同抗氧化能力与酚类物质含量之间的关系不完全表现出线性相关性的原因可能是,藜麦发酵过程中,除酚类物质的变化外,微生物代谢释放出的蛋白质水解产物和其他具有抗氧化活性的非酚类化合物对各种抗氧化活性影响各不相同[36]。除丰富的酚类物质外,藜麦中蛋白质含量较高,且其富含多种氨基酸,例如,Rizzello等[38]通过研究发现,植物乳杆菌发酵24 h的藜麦中的抗氧化活性显著升高,其主要归因于发酵过程中,藜麦蛋白质水解产生多种多样的短链多肽,使其自由基清除能力有不同程度的提高。
综合三种抗氧化活性测定结果,采用多个菌种混合固态发酵时,藜麦的抗氧化活性比单菌发酵更高,这可能是因为多菌种混合发酵所产生的酶、有机酸等代谢产物种类更加丰富,使抗氧化活性的提高更加显著。总体而言,所有固态发酵的藜麦样品中,植酸乳杆菌/酵母菌/好食脉孢菌混合发酵48 h后,藜麦的抗氧化活性最高。
3 结论
本文利用植物乳杆菌、酿酒酵母、米根霉、米曲霉和好食脉胞菌对藜麦进行了30和48 h的单菌和混菌固态发酵,分析测定了不同菌种固态发酵对藜麦基本营养成分、酚类物质组成及抗氧化活性的影响。研究发现,固态发酵后,藜麦中淀粉、不可溶性膳食纤维含量明显下降,而可溶性膳食纤维、游离态多酚、结合态多酚、游离态黄酮和结合态黄酮含量明显升高;此外,固态发酵还显著增强了藜麦中酚类物质的总抗氧化能力、DPPH和ABTS+自由基清除能力(P<0.05)。混菌发酵时,不同菌株相互作用会一定程度抑制酶活,使营养物质的改善作用不如单菌发酵;但混合发酵所产生酶以及代谢产物的种类更加丰富,所以在改善抗氧化作用方面优于单菌发酵。
尽管本文明确了固态发酵对藜麦营养成分、酚类物质含量及抗氧化活性具有显著的提升效果,其对藜麦其他品质,包括生物活性、抗营养因子活性、物化特性和功能特性等的影响仍不明确。未来的研究将更加系统而全面地分析固态发酵对藜麦品质的影响,通过更加科学的数据分析手段分析获得可明显改良藜麦品质的固态发酵菌种及工艺条件,拓展生物发酵技术在藜麦食品加工中的应用范围,为藜麦新产品的研发提供数据支撑和理论依据。
