干燥方式对蛋清蛋白理化性质和功能特性的影响
2022-12-10孙乐常林端权刘光明曹敏杰
孙乐常,曾 添,林端权,翁 凌,刘光明,缪 松,3,4,曹敏杰,
(1.集美大学海洋食品与生物工程学院,福建厦门 361021;2.海洋食品精深加工关键技术省部共建协同创新中心,大连工业大学,辽宁大连 116034;3.水产品深加工技术国家地方联合工程研究中心,福建厦门 361021;4.爱尔兰农业部农业与食品发展局Teagasc食品研究中心,芒斯特科克 999014)
鸡蛋是人类日常饮食中最常见且不受宗教和种族影响的食物之一,同时也是人们日常饮食中价格低廉但营养价值极高的食物。蛋清蛋白具有良好的凝胶性、起泡性和乳化性等多种功能特性,常被用作添加剂广泛应用于食品加工领域[1]。目前,蛋清蛋白主要以粉状与液态形式进行商品化销售。相较于蛋清液,蛋清蛋白粉具有运输方便、货架期长、均一性高和微生物安全等特点,具有更大的市场应用价值[1]。
目前,工业上蛋清粉的制备方法以喷雾干燥和真空冷冻干燥为主,并辅以一定的前处理或改性。喷雾干燥生产效率高且成本较低,但热处理会导致敏感的蛋清成分,如卵类粘蛋白[2]等变性,从而可能影响蛋清蛋白整体的功能特性。Katekhong等[3]与代晓凝等[4]研究发现采用喷雾干燥的高温会使蛋清蛋白的构象部分展开,暴露的巯基增加,有助于蛋白质的聚集,从而有利于蛋清粉的凝胶性。另一方面,冉乐童等[5]将蛋清液巴氏杀菌后进行喷雾和冷冻干燥,发现冷冻干燥蛋清粉的起泡性、起泡稳定性和乳化性优于喷雾干燥,但热稳定性较喷雾干燥低。Kudre等[6]将蛋清蛋白进行磷酸化预处理后再进行干燥,则发现冷冻干燥磷酸化蛋清蛋白具有更高的乳化性、持油力与凝胶性,而起泡性能力则低于喷雾干燥[7]。由此可见,蛋清蛋白的冷冻干燥与喷雾干燥相比各具优势,且一定的前处理会对干燥蛋清蛋白的性质产生显著影响[5,8]。系统揭示干燥过程中蛋白的理化性质及其功能特性的变化规律对蛋清蛋白在不同食品生产加工中的科学应用具有重要意义。目前,国内外对干燥蛋清蛋白的研究大多围绕干燥的条件[9-11]或一定的改性处理[1,6]对凝胶性及其储藏稳定性[7,12-13]等方面,而对天然蛋清蛋白的直接干燥及其理化性质与功能特性的变化机理却缺乏系统性研究。
基于此,本文以鸡蛋清蛋白为对象,通过测定内源性荧光、表面疏水性、游离巯基含量、二级结构组成、溶解度、接触角以及表面张力等指标,表征蛋清蛋白经过喷雾干燥或真空冷冻干燥处理后的构象变化,同时分析蛋清蛋白的乳化性和起泡能力等功能特性,以探究不同干燥方式对蛋清蛋白功能特性的影响机理,旨在为蛋清粉在食品加工领域中的应用提供理论依据。
1 材料与方法
1.1 材料与仪器
鸡蛋、玉米油 福建省厦门市集美区大润发超市,鸡蛋放置于4 ℃冰箱中备用,玉米油放置于室温阴凉处;苯胺基-1-萘磺酸铵盐(8-anilino-1-naphthalenesulfonic acid ammonium salt,ANS) 美国Sigma公司;标准蛋白 美国Thermal公司;十二烷基硫酸钠(SDS,电泳纯)和丙烯酰胺 Bio-Rad公司;三羟甲基氨基甲烷(Tris)、氢氧化钠、盐酸、磷酸二氢钠、磷酸氢二钠等其他试剂 均为国产分析纯。
WSC-S色差计 中国上海仪电物理光学仪器有限公司;G:BOX凝胶成像仪 英国Syngene公司;BZY-1全自动表面张力仪 中国上海Sunny衡平科学仪器有限公司;CA-100接触角测量仪 上海盈诺精密仪器有限公司;Avanti JA-10高速冷冻离心机、pH计 美国Beckman公司;Vector-22傅里叶变换红外光谱仪 瑞士Bruker公司;FP-8200荧光分光光度计 日本Jasco公司;TCS SP8激光扫描共聚焦显微镜 德国Leica公司;Alpha 1-4 LDplus冷冻干燥机 德国Christ公司;Echo Revolve 荧光倒置显微镜 美国Tousimis公司;DHR-2流变仪 美国TA仪器公司;Phenom Pro扫描电子显微镜 荷兰Phenom-World Pr公司。
1.2 实验方法
1.2.1 蛋清液的制备及干燥 参照Chang等[14]的方法并做适当修改。将蛋清和蛋黄分离,取蛋清用1 mol/L HCl调pH至6.0,搅拌15 min后再次调pH至6.0,于4 ℃搅拌30 min,8000 g离心10 min后除去不溶性蛋白,取上清液得到蛋清液(EWP-C)存放于4 ℃冷库中备用,分别按下述条件制备相应的干燥蛋白粉。
干热喷雾干燥蛋清粉(EWP-P):进风温度170 ℃,出风温度 70 ℃;蠕动泵12 r/min。
真空冷冻干燥蛋清粉(EWP-D):-70 ℃预冻过夜;真空度0.63 Pa,冷冻干燥温度-48 ℃、时间2 d;溶液厚度5~8 mm。
1.2.2 SDS-PAGE分析 将蛋清液和蛋清粉溶液的蛋白浓度调整为10 mg/mL。添加约7%的β-巯基乙醇作还原处理进行对比。分离胶的浓度为12%,浓缩胶的浓度为5%,蛋白上样量为40 mg,电流为12 mA。电泳结束后,将胶取出用考马斯亮蓝染色液在室温下染色1 h,然后用脱色液脱色,最后利用凝胶成像仪分析蛋白质条带。
1.2.3 白度的测量 用色差仪直接测定蛋清粉的亮度值(L*)、红(a*)、黄(b*)。测定5次取平均值。L*为正值表示偏亮,反之偏暗;a*为正值偏红,反之偏绿;b*为正值偏黄,反之偏蓝。白度的计算公式如下:
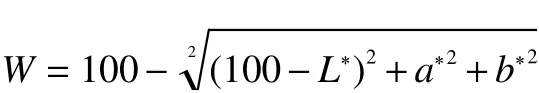
式中:L*、a*、b*值分别为经不同干燥处理蛋清粉的亮度、红度和黄度。
1.2.4 内源性荧光测定 参考Yu等[15]的方法测定了各样品的内源性荧光强度。将EWP样品稀释至0.1 mg/mL。采用荧光分光光度计记录激发波长为258、275和295 nm的时的荧光光谱,发射光谱范围为300~500 nm,狭缝宽度为5 nm。
1.2.5 表面疏水性测定 根据荧光探针剂ANS法测定样品的表面疏水性。将样品稀释至0.025~0.1 mg/mL,取2 mL样品与8 μL ANS(20 mmol/L)混匀,涡旋振荡3 s,避光20 min测定荧光强度,测试所用的激发波长为390和470 nm,狭缝宽度为10 nm。
1.2.6 总游离巯基和表面游离巯基测定 用Ellman's法[16]分析了蛋清液和不同干燥方式蛋清粉之间蛋白质中总游离巯基和表面游离巯基的区别,摩尔消光系数为13600 M-1cm-1。
1.2.7 傅里叶变换红外光谱(Fourier Transform Infrared Spectroscopy,FTIR)分析 用玛瑙研钵将蛋清粉样品磨细,将样品与溴化钾混合,压成片状后测量。25 ℃下,在4000~500 cm-1的波数范围内对每个样品进行分析。每个样品以空气为背景、KBr为空白对照进行扫描。每次测量都是32次扫描的叠加。用Omnic软件基线校正和傅里叶自取卷积后使用PeakFit软件对1600~1700 cm-1区域进行归一化。利用高斯峰和曲线拟合模型对二级结构组分进行定量估计。
1.2.8 溶解度测定 参照Latorres等[17]的方法测定蛋清粉的溶解度并做适当修改。称取0.2 g蛋清粉溶解于20 mL DDW,用1 mol/L HCl 或1 mol/L NaOH将溶液的pH调节至2.0,4.0,6.0,8.0和10.0,混合溶液在30 ℃下以100 r/min的转速搅拌30 min,然后7500×g,离心10 min,取上清,用Lowry法测定上清液蛋白质含量。全蛋白含量用蛋白溶解液(20 mmol/L PBS,2% SDS,8 mol/L Urea,pH8.0)充分溶解蛋白样品后的蛋白含量表示。

1.2.9 接触角测定 接触角是三相(液、固、气)接触点的切角,是测定粉体润湿性的常用参数。由于润湿行为是一个动态过程,因此可以通过监测接触角的变化率来量化润湿过程。参照Li等[18]的方法,用接触角测量仪测量粉体的水接触角变化。设置的参数为5 μL水滴体积和介质滴定速率。记录0~60 s的接触角。每个样品的测量至少重复5次。
1.2.10 表面张力测定 采用全自动表面张力仪,以及铂金板法测定不同pH下浓度为1%(w/v)的蛋清溶液表面张力。
1.2.11 乳化性和乳化稳定性测定 蛋清蛋白的乳化活性指数(emulsifying ability index,EAI)和乳化稳定性(emulsifying stability index,ESI)参考Dabbour等[19]的方法并作适当修改。制备不同pH(2.0、4.0、6.0、8.0、10.0)含1%(w/v)蛋清蛋白的溶液,取15 mL溶液与5 mL玉米油混合,在10000 r/min条件下高速均质1 min。分别在0、30 min时从离心管底部取50 μL溶液,加入到4950 μL 0.1% SDS溶液中,涡旋5 s混匀,立即在500 nm波长处测定吸光度。
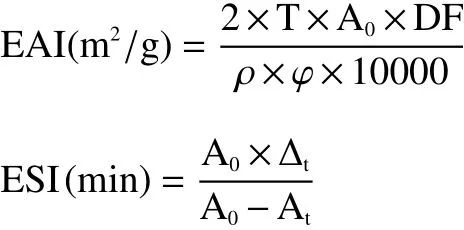
式中:T为浊度(2.303);A0为0 min时吸光度;DF为稀释倍数(100);ρ为蛋白质浓度(g/mL);φ为油相与水相的比例(0.25);Δt为时间差/min;At为放置30 min后吸光度。
1.2.12 起泡性和泡沫稳定性 参考Dabbour等[19]的方法测定蛋清蛋白的起泡性(foaming capacity,FC)和泡沫稳定性(foaming stability,FS),将蛋清蛋白溶液稀释至1%(w/v),调节pH至2.0,4.0,6.0,8.0,10.0,用高速分散器以10000 r/min的速度均质1 min,记录均质前后体积。将样品静置30 min后,再次记录样品体积。
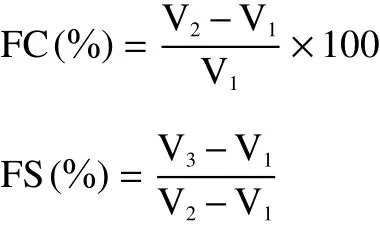
式中:V1为均质前体积(mL);V2为均质后体积(mL);V3为均质30 min后体积(mL)。
1.2.13 乳液的微观结构分析
1.2.13.1 乳液的制备 蛋清蛋白乳液的制备参考Xu等[20]的方法并略作修改。90 mL含1%(w/v)蛋清蛋白溶液的超纯水作为乳液的水相,10 mL玉米油为油相,10000 r/min条件下高速均质2 min,分别50 MPa高压均质0、1、2次(分别用EWP-P0、EWPP1、EWP-P2和EWP-D0、EWP-D1、EWP-D2表示)。加入0.02% NaN3作为防腐剂,抑制细菌增长。
1.2.13.2 荧光倒置显微镜 用荧光倒置显微镜观察蛋清液及不同干燥方式蛋清粉均质不同次数后乳液的微观结构。取20 μL乳液置于载玻片上,并用盖玻片小心的盖住。平衡2 min后,拍摄放大率为400倍下的蛋清蛋白乳液的微观结构照片。
1.2.13.3 激光扫描共聚焦显微镜 参考Xu等[20]的方法并作适当修改。将样品用0.1%(w/v)的尼罗红和FITC试剂染色,并在黑暗中孵育10 min。在室温下避光环境中由Leica TCS SP8系统在激发波长为488 nm下(放大倍数为400倍)进行分析。
1.3 数据处理
所有的试验均至少重复三次取平均值加减标准差,利用IBM SPSS Statistics 21软件和Duncan多重检验方法对实验数据进行方差分析和显著性分析,并采用Origin 9.0软件处理实验数据及画图。
2 结果与分析
2.1 不同干燥方式蛋清蛋白的SDS-PAGE分析
如图1所示,蛋清中主要含有三种蛋白:卵清蛋白(45 kDa)、卵转铁蛋白(76 kDa)和卵粘蛋白。卵粘蛋白主要有α-和β-两个亚基,α-卵粘蛋白又分为两种类型:α1-和α2-,分子量分别为150和220 kDa;β-卵粘蛋白的分子量为400~720 kDa[21]。非还原条件下SDS-PAGE上方出现许多高聚物条带,添加β-巯基乙醇后,高聚物条带消失,表明该高聚物由蛋白通过二硫键聚合而成。蛋清蛋白中原有的卵类粘蛋白与溶菌酶在本实验室并未被检测到,可能是由于卵类粘蛋白在蛋清前处理将稀释、调节pH和搅拌时会发生絮凝,形成白色絮状物,从而被离心除去[2,22]。溶菌酶的不可逆变性临界点是77 ℃,因此喷雾干燥(温度高达180 ℃)过程中溶菌酶可能会变性从而造成损失[23]。此外,冷冻干燥也会造成溶菌酶的损失,如Kudre等[6]在比较日本鹌鹑(Coturnix japonica)和白来航鸡(White Leghorn)冷冻干燥蛋清粉的SDS-PAGE时也发现了冷冻干燥过程中溶菌酶损失的现象。蛋清蛋白各组分在还原条件(图1A)下的分子量略大于非还原条件(图1B),这是因为SDS与蛋白质结合会引起蛋白质构象改变,使蛋白质形成一种长椭圆棒状结构,加入足够量的SDS和β-巯基乙醇可使蛋白质的迁移速率仅与蛋白质分子大小有关[24-25]。未加入β-巯基乙醇(非还原状态)时蛋白质迁移速度更快可能是因为蛋白质中的二硫键未打开,蛋白质与SDS结合形成长椭圆棒状物的长轴较短,迁移速度更快,因此蛋白质条带的分子量较小。EWP-C、EWP-P和EWP-D蛋白条带几乎没有区别,表明本实验的干燥条件未对蛋清蛋白组分造成明显影响。
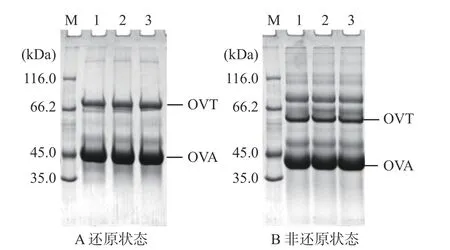
图1 蛋清液和不同干燥方式蛋清粉蛋白质模式图Fig.1 Protein pattern of egg white proteins by different drying methods
2.2 不同干燥方式蛋清蛋白的外观和色泽分析
如图2所示,EWP-P为细腻的鹅黄色颗粒粉末,EWP-D为松散的黄色片状物。EWP-P的L*、a*和b*值分别为53.90±0.23、-2.06±0.70和6.04±0.21。EWP-D的L*、a*和b*值分别为49.89±0.36、-1.65±0.26和3.84±0.50(表1)。EWP-P的b*值较大是因为蛋清蛋白中的葡萄糖在喷雾干燥过程中与蛋白发生了美拉德反应[3]。此外,真空冷冻干燥需将样品进行冷冻预处理,冷冻过程中,蛋清蛋白会发生褐变反应,故EWP-D最终呈现出的颜色较EWP-P黄(图2)。EWP-P的颜色较EWP-D白(图2),可能是因为干热喷雾干燥的干燥速度快,蛋清中的蛋白质受热时间短。因此在本实验干燥条件下,干热喷雾干燥所得的蛋清蛋白粉更亮、更白,易被消费者接受。

图2 不同干燥方式EWP的宏观图Fig.2 Macrograph of EWP for different drying methods
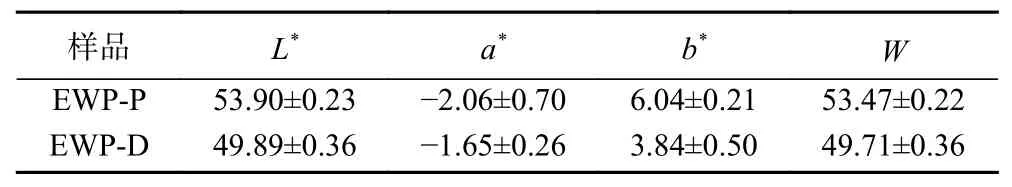
表1 干热喷雾干燥蛋清粉和真空冷冻干燥蛋清粉的色差Table 1 Color difference of dry heat spray drying and vacuum freeze-drying egg white powder
2.3 不同干燥方式蛋清蛋白的内源性荧光分析
蛋白质的固有荧光来自于内部的芳香族氨基残基(酪氨酸 Tyr、色氨酸 Trp、苯丙氨酸 Phe),其荧光最大值(λmax)、强度对其微环境的极性极其敏感,因此可用来表征蛋白质的三级结构变化,其中Trp、Tyr和Phe的特有荧光激发波长分别为295、275和258 nm[15]。如图3所示,与EWP-C相比,不同干燥方式制备的蛋清粉的固有荧光强度降低但荧光峰的位置未有明显的迁移。EWP-P的荧光强度低于EWP-D于EWP-C,可能是因为喷雾干燥的干燥温度高,蛋清蛋白变性程度大,芳香族氨基酸残基暴露于更极性环境中,进而发生了荧光猝灭现象。此外,EWP-P的荧光强度较低还可能是由于蛋清蛋白中含有葡萄糖,在高温下会与蛋白质发生美拉德反应,屏蔽了芳香族氨基残基[4]。
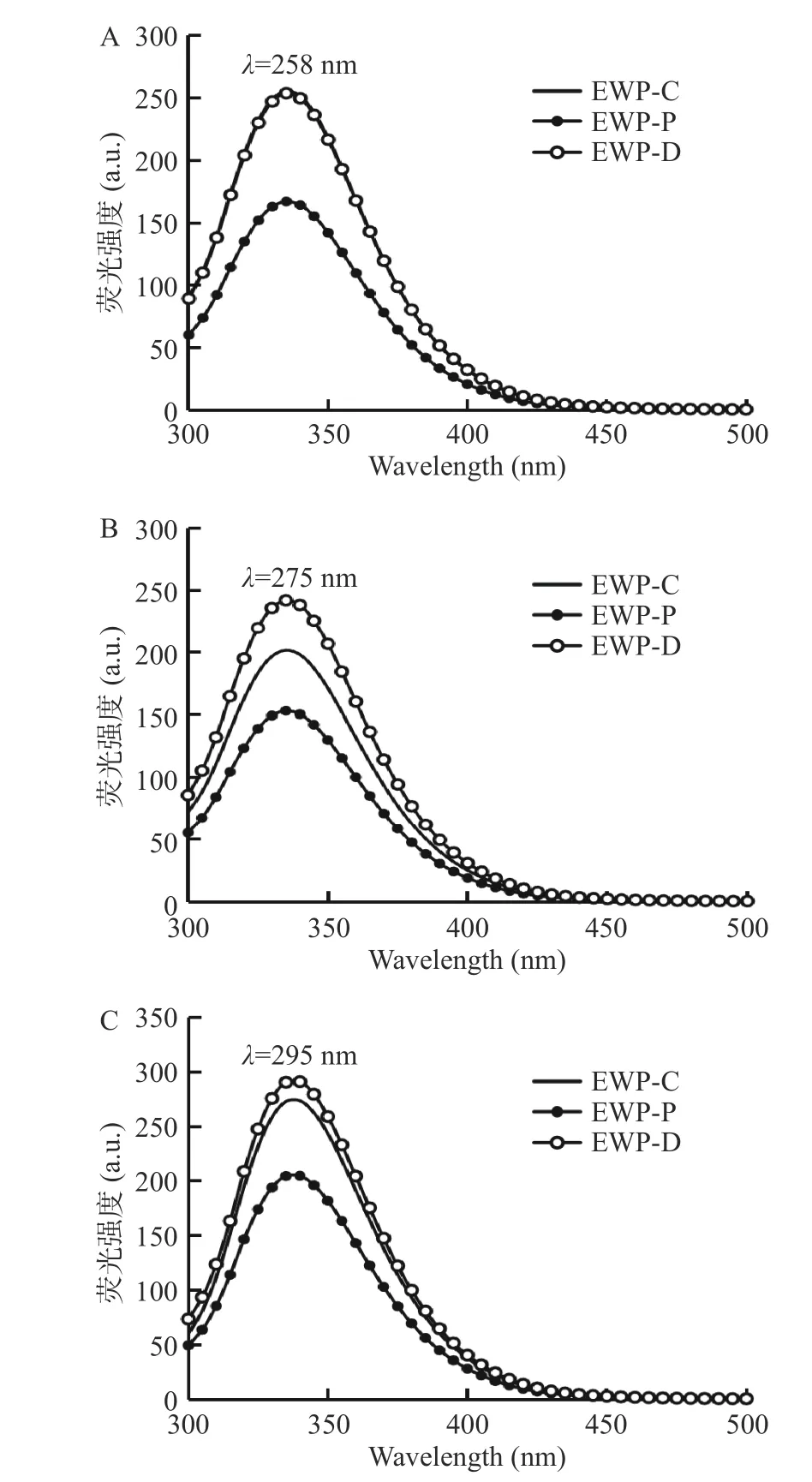
图3 蛋清液及不同干燥方式EWP的内源性荧光Fig.3 Endogenous fluorescence of EWP in egg white liquid and different drying methods
2.4 游离巯基和表面疏水性分析
总游离巯基包含蛋白质分子内部和表面的游离巯基。巯基的变化会影响蛋白质的结构和功能,如溶解度、乳化性和胶凝性能等[26]。如图4所示,EWPC、EWP-P和EWP-D的总游离巯基分别是103.81±2.10、93.40±5.93和113.61±7.63 μmol/L,其游离巯基分别是41.96±8.31、56.18±2.88和45.39±1.97。与EWP-C相比,EWP-P表面游离巯基含量显著升高(P<0.05)、总游离巯基含量显著降低(P<0.05)。而EWP-D与EWP-C相比总巯基和表面游离巯基含量差异不显著(P>0.05)。这可能与喷雾干燥过程中卵清蛋白的变性有关,天然状态的卵清蛋白中含有埋藏于球状分子内部的游离巯基,而高温破坏了卵清蛋白的空间结构使内部巯基暴露在蛋白表面[27]。三种蛋清蛋白的表面疏水性与表面游离巯基含量变化趋势一致, EWP-C和EWP-D的表面疏水性差异不显著(P>0.05),但其表面疏水性显著低于EWP-P组(P<0.05),这可能也与喷雾干燥的高温环境有关,该环境下蛋清蛋白部分展开,导致内部疏水基团暴露,从而表面疏水性增高。代晓凝等[4]将自然发酵后的蛋清液分别进行冷冻、热风和喷雾干燥处理,比较三种蛋清粉与溴酚蓝的结合率从而判断其表面疏水性大小为:冷冻干燥>喷雾干燥>热风干燥,推测是喷雾干燥发生美拉德反应引入亲属基团所致。这与本文研究不一致,可能是因为蛋清前处理不同,自然发酵时微生物可能会改变蛋清蛋白的结构。
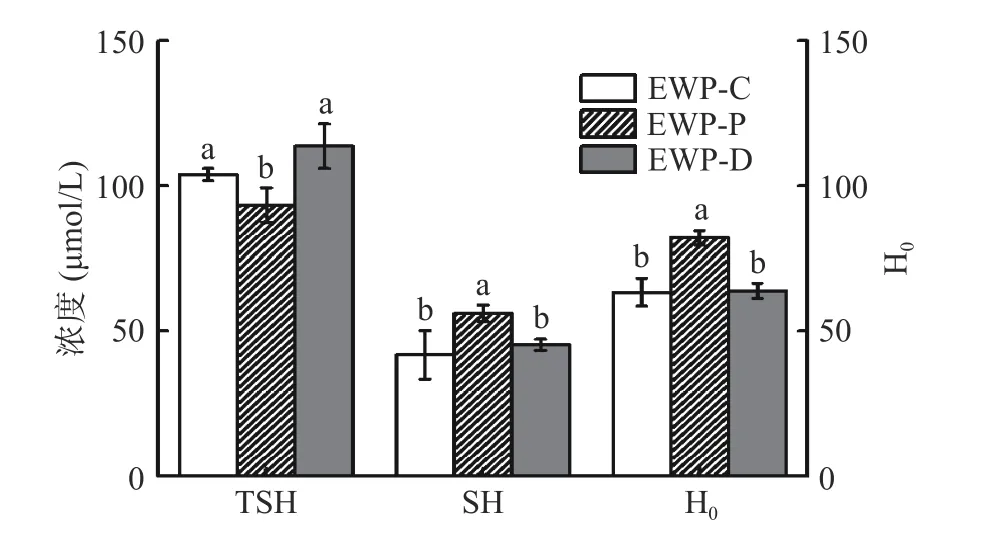
图4 不同干燥方式蛋清粉的总游离巯基(TSH)、表面游离巯基(SH)和表面疏水性(H0)Fig.4 Total free sulfhydryl group (TSH), surface free sulfhydryl group (SH) and surface hydrophobicity (H0) of egg white powder by different drying methods
2.5 傅里叶变换红外光谱分析
不同干燥方式蛋清蛋白的红外光谱如图5所示。EWP-P和EWP-D在酰胺A带(3700~3200 cm-1)处有强吸收峰,EWP-P的峰强大于EWP-D,表明干燥方式会影响蛋清蛋白的水合能力,这可能与蛋白质分子中N-H键舒展并与氢键形成了缔合体,或蛋白质分子与葡萄糖以共价键结合有关[4]。酰胺B带(2961.64 cm-1)的弱吸收峰主要由C-N键产生。酰胺I带 (1600~1700 cm-1)信号主要由C-O键伸缩振动引起,与蛋白质的二级结构有关,涉及β-折叠(1600~1640 cm-1)、无规则卷曲(1640~1650 cm-1)、α-螺旋(1650~1660 cm-1)和β-转角(1660~1700 cm-1)[28]。采用Peak fit软件对不同干燥方式蛋清蛋白的酰胺I带峰强进行高斯曲线拟合分析,根据峰面积计算其二级结构的相对百分含量,结果如表2。EWP-P和EWP-D的二级结构以β-折叠和β-转角为主,EWPP的β-折叠含量增加主要与卵转铁蛋白热变性有关[29],同时分子间的β-折叠结构也易转变为β-转角
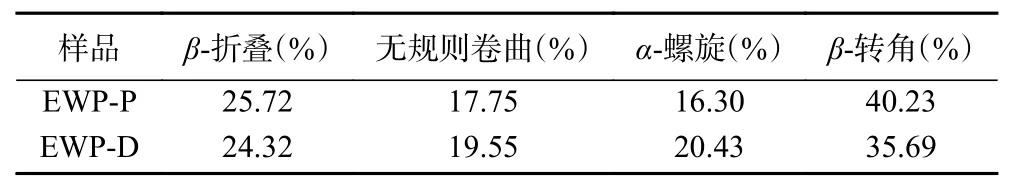
表2 不同干燥方式蛋清粉的二级结构含量Table 2 Secondary structure content of egg white powder by different drying methods
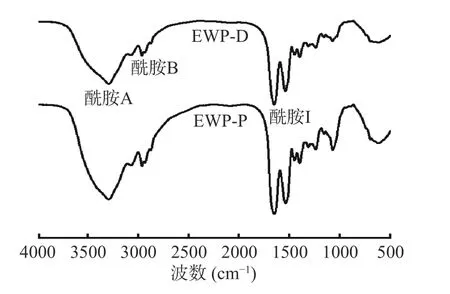
图5 不同干燥方式蛋清蛋白傅里叶变换红外光谱图Fig.5 FTIR of egg white proteins in different drying modes
结构[29]。而α-螺旋下降可能是因为热变性导致α-螺旋中的氢键断裂,进而发生了解螺旋现象[30]。EWPP无规则卷曲增加,表明其部分有序结构向无规则卷曲转化,蛋白变性明显,结构的随机性增强。
2.6 不同干燥方式蛋清蛋白的溶解度分析
溶解性是蛋白重要的功能特性之一,与接触角、表面张力、乳化性等密切相关。如图6A,不同pH下不同干燥方式的蛋清粉溶解度的测量。EWP-P的溶解度随着pH的升高先减小后增大,这可能是因为在酸性和碱性环境中球状蛋白质会发生部分展开,形成熔融球状构象,变得更加灵活,更容易与水分子作用[31]。pH为6.0时蛋清蛋白的溶解度最低,可能是因为该pH与蛋清蛋白中大部分蛋白的等电点相近,蛋白带电荷量较少,因此容易发生沉淀。与EWPP相比,EWP-D在pH6.0时溶解度的下降程度较小,这可能与真空冷冻干燥后蛋清蛋白的微观结构呈片状,具有较大的比表面积有关,也可能是因为冷冻干燥蛋白质在脱水过程中蛋白质变性低,促进了可溶性聚集物生成[5,19]。EWP-D的溶解度远大于EWP-P,这是因为喷雾干燥是直接将蛋清液雾化后再干燥,其蛋清粉表面会形成一个光滑、抗湿性的薄膜,最终导致蛋白的溶解性降低,复水性差且易结块[32]。而真空冷冻干燥经过冷冻升华,可保持食品原有的形状故具有很好的速溶性和复水性[33]。Shaviklo等[34]也发现喷雾干燥的含添加剂(花粉)蛋白的蛋白质溶解度明显低于冻干蛋白。
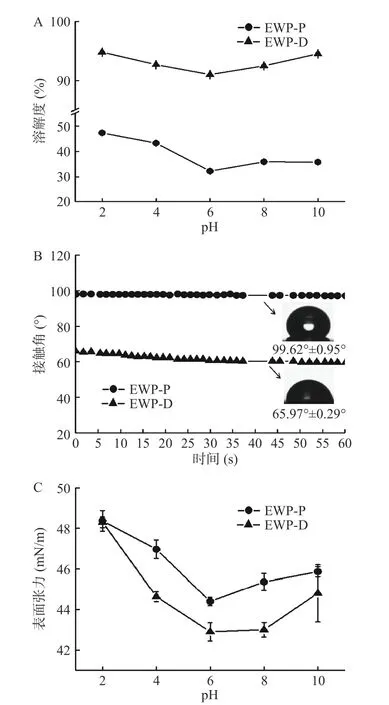
图6 不同干燥方式蛋清粉的功能性质Fig.6 Functional properties of egg white powder by different drying methods
2.7 不同干燥方式蛋清蛋白的接触角分析
接触角值作为时间函数的变化,表征了润湿行为,是评价粉体润湿性的常用指标。当样品的接触角大于90°时,表明其疏水性较强,反之则亲水性较强[35]。不同干燥方式制备的蛋清蛋白粉与水相的接触角如图6B所示,EWP-P在0 s时的接触角为99.62°,表现出疏水性特征;EWP-D的接触角为65.97°,表明其具有较好的亲水性。样品与水滴接触60 s后,由于水进入到了粉末内部,两种样品的接触角不断减小,EWP-P的接触角下降到97.07°,EWPD的接触角下降到59.59°,EWP-D在60 s内接触角的下降速率更大,表明其具有更好的润湿性,这可能与干燥后粉末的微观结构有关。冉乐童等[5]利用扫描电镜观察了冷冻干燥与喷雾干燥蛋清蛋白粉的微观结构,发现EWP-P粉末是球状带孔的结构,且粒径较小,而EWP-D则呈现出较大、松散的片状结构。相较于EWP-P的球状结构,EWP-D的松散片状结构可能更有利于水分在其内部的自由流动,因此具有更好的润湿性[18]。
2.8 不同干燥方式蛋清蛋白的表面张力分析
表面张力是液体自由表面或两种不相溶液体之间界面上的一种拉力,与蛋白质的乳化性和起泡性息息相关。从图6C可知,在2.0~10.0的pH范围内EWP-P的表面张力均大于EWP-D,这可能是EWPD较高的溶解度影响了蛋白质在界面的扩散速度所导致[36]。在pH2.0时,EWP-P和EWP-D的表面张力最大,分别为48.36±0.50和48.30±0.26 mN/m。随着pH的增大EWP-P和EWP-D的表面张力均先减小后增大,与溶解度(图6A)的趋势相似,这可能是因为在酸性条件下,卵清蛋白表面的疏水基团会增加,从而降低了蛋白质分子在界面上吸附的动力学障碍,所以EWP-P和EWP-D的表面张力在酸性环境下更大[37]。
2.9 乳化能力和起泡能力分析
蛋白质的溶解度和表面张力等特性在决定其乳化能力等方面起着重要作用。如图7A,EWP-P和EWP-D的乳化性随着pH的增高先减小后增大,与溶解度(图6A)和表面张力(图6C)的趋势一样。pH为2.0时,两者的乳化能力最好,其乳化性分别为5.98±0.04和6.25±0.02 m2/g,乳化稳定性分别为151.48和277.85 min。酸性环境下卵清蛋白表面暴露了更多的疏水氨基酸和带电基团,可以有效地帮助乳状液体系的形成和物理稳定,因此在酸性环境下EWP-P和EWP-D的乳化性和乳化稳定性均更高[37]。EWP-D的乳化性优于EWP-P,这是因为蛋白质的乳化性与其溶解度密切相关,溶解度较大,乳化性也相对较高[38]。此外,卵清蛋白是一种典型的含糖链的球蛋白,其糖链具有较强的界面吸附作用,有利于油水界面的乳化[39-40]。EWP-P在喷雾干燥时的美拉德反应消耗了蛋清蛋白中的糖,故其乳化性较小。
泡沫的形成依赖于由蛋白质形成的界面膜及其在悬浮液中保持气泡和减缓聚结速率的能力,其中蛋白质的发泡能力和稳定性与蛋白与水相在界面上的相互作用有关,受蛋白分子柔性、净电荷、构象和疏水性的影响[39-40]。蛋清蛋白在pH2.0~10.0条件下的起泡性如图7C所示,EWP-D的起泡性优于EWPP,这可能是由于EWP-D的溶解度较高,在起泡过程中蛋白能迅速展开,形成能同时连接水相溶剂与空气界面的两性介质,而自身的带电性又可产生一定的静电排斥,使蛋白分子在空气-水界面上呈现规律性排列,而不会发生聚集[19,41]。相比之下,EWP-P在高温发生的美拉德反应会使蛋白形成更大的空间位阻,进而延缓了蛋白质在空气/液体界面的吸附[1]。pH为6.0时,EWP-P和EWP-D的起泡性较低,分别是10.19%±1.01%和11.7%±0.66%,这是由于该pH下蛋白的溶解度和表面张力较低,蛋白易发生聚集,故不易形成泡沫。Dabbour等[19]研究向日葵蛋白时也发现所有的蛋白样品在pH6.0时的起泡性最低,且冷冻干燥样品的起泡性优于对流烘箱干燥样品。另一方面,泡沫稳定性与蛋白膜的强度有关,蛋白质在搅打时,蛋白质分子被吸附在空气-水界面,蛋白质分子重新排列,使其疏水部分朝向气相方向,这种变化容易引起巯基的氧化,在空气-水界面与相邻的蛋白质分子中的巯基形成二硫键,从而增强界面膜的强度,有利于泡沫稳定性[1]。EWP-P的泡沫稳定性大于EWP-D,可能是因为喷雾干燥可能导致更多的蛋白质展开,表面游离巯基含量较多。另一方面可能是因为EWP-P发生了美拉德反应,在空气-水界面上可以形成的厚的粘弹性美拉德产物层,有利于泡沫稳定性的增加[42]。Zeng等[43]研究不同干燥方式对鸡皮胶原蛋白多肽时也发现喷雾干燥使其蛋白样品的泡沫稳定性优于冷冻干燥样品。
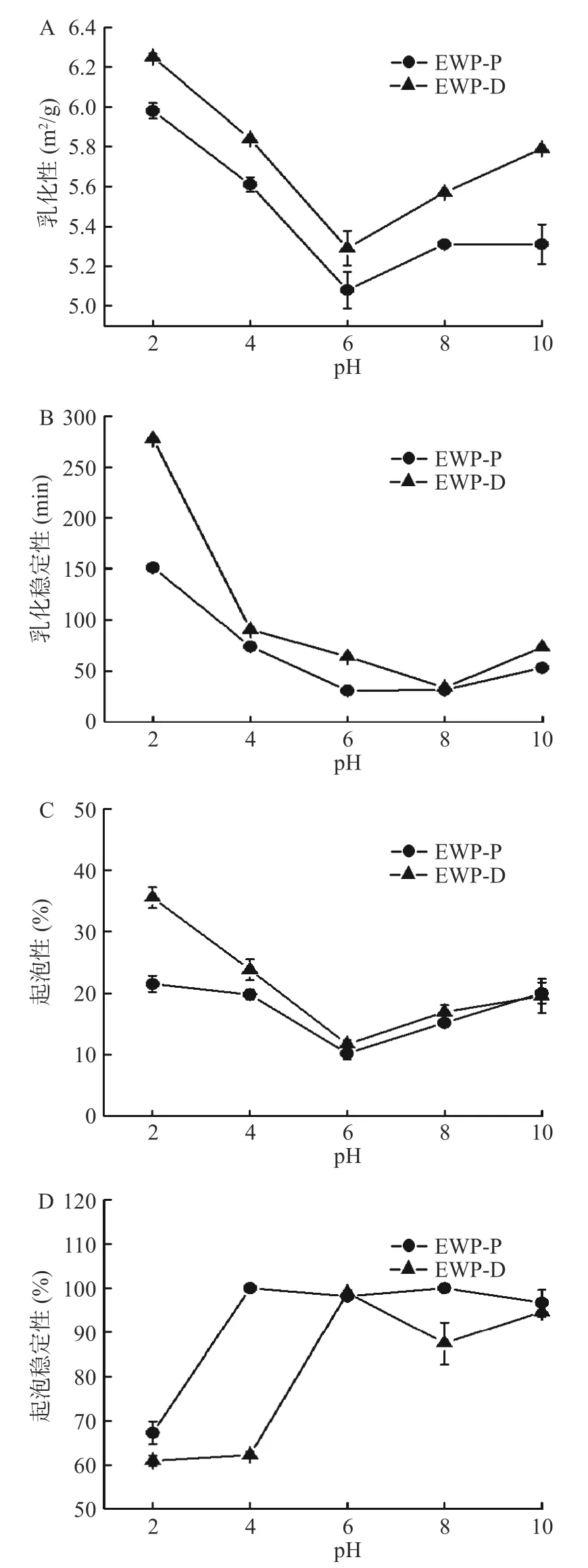
图7 不同干燥方式蛋清粉的乳化能力和起泡能力Fig.7 Emulsifying ability and foaming ability of egg white powder by different drying methods
2.10 不同干燥方式蛋清蛋白的乳液微观结构分析
EWP-P和EWP-D经高压均质机均质0、1、2次后所得乳液的微观结构如图8所示。未高压均质的蛋清蛋白乳液油滴大,且不均一,蛋白质容易从油水界面解离出来,使小油滴聚集形成大油滴。均质1次后蛋清蛋白乳液的油滴尺寸减小,分散性提高,且未发生团聚现象,其原因可能是高压均质后,蛋清蛋白乳液被高压剪切力切割形成小分子,使蛋清蛋白粒径减小,更多的蛋白质吸附至油-水界面,为液滴间提供足够的排斥力,从而阻止乳析的发生,使蛋清蛋白乳液的稳定性增强[44]。均质2次后,两者均出现了小程度的团聚现象,形成了较大的油滴,这可能是因为均质次数增多,体系出现了“过处理”效应,高压使蛋清蛋白乳液的油滴变小,油滴之间的运动速率加快,增加了相互碰撞的次数,从而破坏界面膜,导致油滴聚集[45]。刘竞男等[44]研究高压对大豆分离蛋白的影响时也发现随着均质次数的增多,大豆分离蛋白的乳液体系出现了“过处理”效应,这被归因为部分解离的大豆蛋白分子重新通过新的二硫键形成了聚集体。EWP-P的团聚现象比EWP-D的更明显,可能是因为EWP-P的溶解度较低且表面巯基含量较高,故更易于聚集。以上结果表明,EWP-D乳液的稳定性高于EWP-P,说明真空冷冻干燥更有利于蛋清蛋白的乳液稳定。

图8 不同干燥方式蛋清粉乳液的微观结构(400×)Fig.8 Microstructure of egg white powder emulsion by different drying methods (400×)
3 结论
蛋清蛋白经过不同干燥方式干燥后,其结构会发生变化,从而导致理化和功能特性不同。喷雾干燥会使蛋清蛋白内部疏水基团和巯基暴露,同时还会与蛋清中的糖发生美拉德反应,最终使蛋白的溶解度、乳化性以及起泡能力下降,但其较高的表面疏水性有利于维持泡沫的稳定。冷冻干燥蛋清蛋白干燥前后的结构变化较小,蛋白基本保持原有的空间构象。相较于喷雾干燥蛋清蛋白,冷冻干燥蛋清蛋白具有较大的比表面积与溶解度,表面张力更小,因此蛋白的乳化能力和起泡性更优。随着冷冻干燥技术与装备的日益成熟,本研究的结果可为冷冻干燥蛋清蛋白在新食品开发与加工中的应用提供理论参考。
