罗氏沼虾Dmc1基因的克隆及表达分析
2022-12-10杨彦豪杨慧赞黄光华邱高峰
杨彦豪, 黎 铭, 王 瑞, 黄 姻, 杨慧赞, 黄光华, 邱高峰, 曾 兰
(1.上海海洋大学/农业农村部淡水水产种质资源重点实验室/水产科学国家级实验教学示范中心/上海水产养殖工程技术研究中心,上海 201306;2.广西壮族自治区水产科学研究院/广西水产遗传育种与健康养殖重点实验室,广西南宁 530021)
Dmc1(disrupted meiotic cDNA)基因是DNA重组酶RecA/Rad51家族成员之一,在同源染色体配对、联会、重组和分离过程中具有重要作用[1]。Dmc1基因最早在酵母中发现,被鉴定为减数分裂过程中的特异性基因[2],具有催化DNA双链交换的能力[3],还可以通过抑制解旋酶Srs2的活性来协助减数分裂过程中交叉的形成,从而保证减数分裂的完整性[4]。已有的研究表明,在减数分裂过程中,Dmc1基因可在睾丸和卵巢特异表达,其突变可能导致减数分裂停滞[5-7]。迄今为止,已在多个物种中发现Dmc1基因,一些水生动物的Dmc1基因也得到了克隆和鉴定[11-16]。
罗氏沼虾(Macrobrachiumrosenbergii)是淡水养殖虾类主要品种之一。近年来,由于引种混乱、育苗技术不规范、近亲繁殖等,造成罗氏沼虾种质资源退化问题日趋严重,影响了罗氏沼虾产业的可持续发展。随着分子生物学技术的快速发展,探索研究罗氏沼虾生长发育相关的分子调控机制成为解决这些问题的可行途径。目前,有关罗氏沼虾的研究主要集中在生物形态学[17-18]、种群生态学[19-20]、遗传学[21-24]方面,有关罗氏沼虾Dmc1基因的研究尚未见报道。本研究利用RACE技术对罗氏沼虾Dmc1(MrDmc1)基因进行全长cDNA克隆,利用生物信息学方法分析MrDmc1基因编码区特征、理化性质及系统进化关系,并利用荧光定量PCR对其在不同组织、卵巢发育不同时期的表达情况进行分析,以期为进一步研究MrDmc1基因在卵巢发育过程中的作用,探究罗氏沼虾卵巢发育分子调控机制,建立罗氏沼虾卵巢发育人工调控新技术,推进罗氏沼虾遗传改良及分子辅助育种奠定理论基础。
1 材料与方法
1.1 试验材料
试验材料来自广西南宁国家级罗氏沼虾良种场,选择健康的4月龄罗氏沼虾,采集卵巢置于液氮中速冻,-80 ℃冰箱中保存备用,用于Dmc1基因克隆。
1.2 引物设计与合成
根据GenBank中斑节对虾Dmc1基因序列(EU440762),利用Primer 5.0软件设计接头引物、5′RACE特异性引物、3′RACE特异性引物和实时荧光定量PCR引物,引物序列见表1。引物均由生工生物工程(上海)股份有限公司合成。

表1 引物信息
1.3 罗氏沼虾总RNA提取及cDNA合成
冻存的卵巢组织按Trizol提取试剂盒说明书的步骤提取总RNA,经1.5%琼脂糖凝胶电泳验证RNA。去除基因组DNA后,进行cDNA第1链合成,合成cDNA置于-20 ℃保存备用。
1.4 MrDmc1基因克隆
1.4.1 5′-RACE 以特异性引物RC779-RT1/RC779-RT2反转录,得到cDNA,经RNase H 和末端转移酶TdT处理后,进行巢氏PCR(操作步骤见英杰公司5′-RACE系统手册)。PCR反应条件见表2。PCR产物经1.0%琼脂糖凝胶电泳检测回收纯化后连接pMD18-T载体,转化感受态细胞(SK2301),以pMD18-T载体的通用引物做菌落PCR,将PCR产物送至生工生物工程(上海)股份有限公司测序。
1.4.2 3′-RACE 以3′接头引物做反转录,获得的cDNA为模版进行巢式PCR,PCR反应条件见表3。PCR产物经1.0%琼脂糖凝胶电泳检测,经过胶回收、纯化后,送至生工生物工程(上海)股份有限公司测序。根据5′RACE和3′RACE测序得到的序列,利用DNAMAN软件拼接获得MrDmc1基因的全长序列。
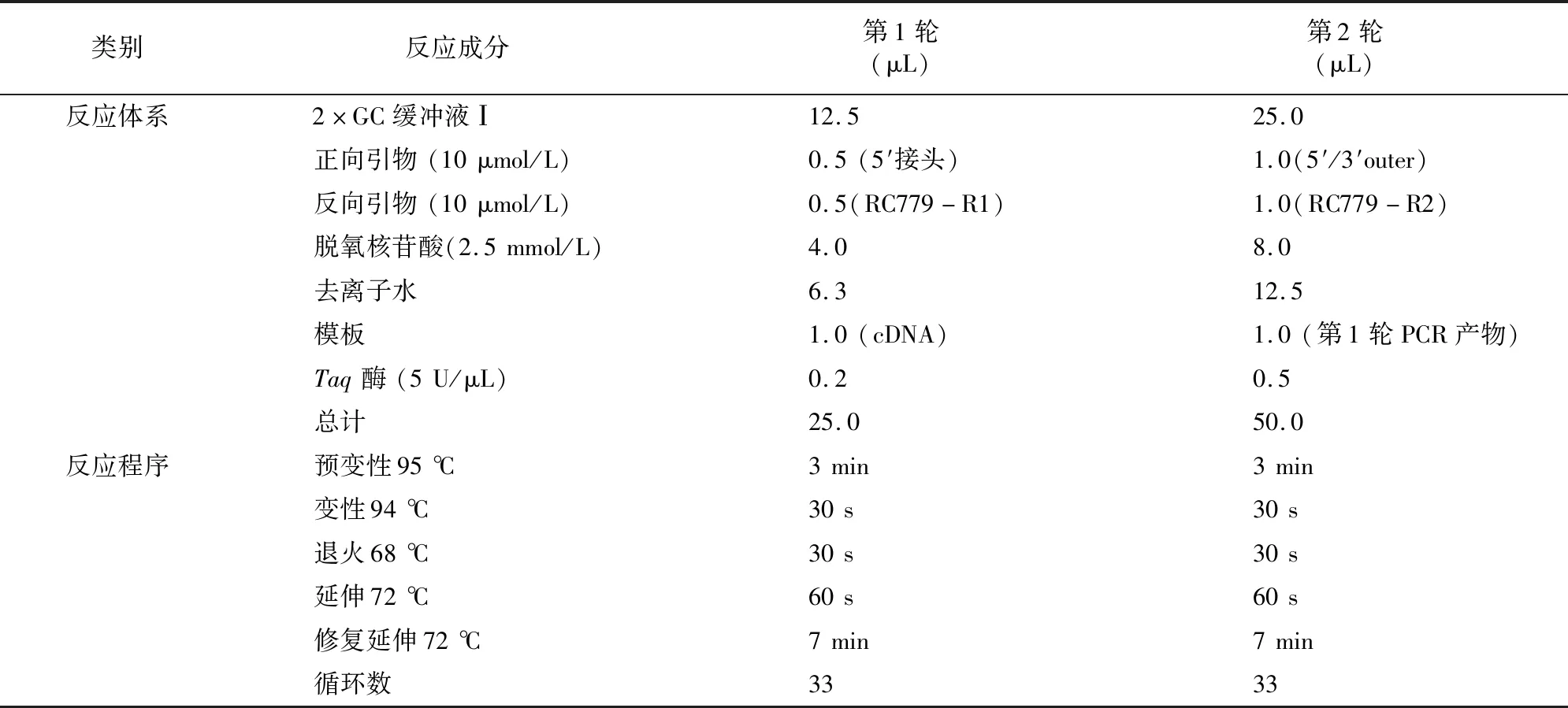
表2 5′-RACE反应条件
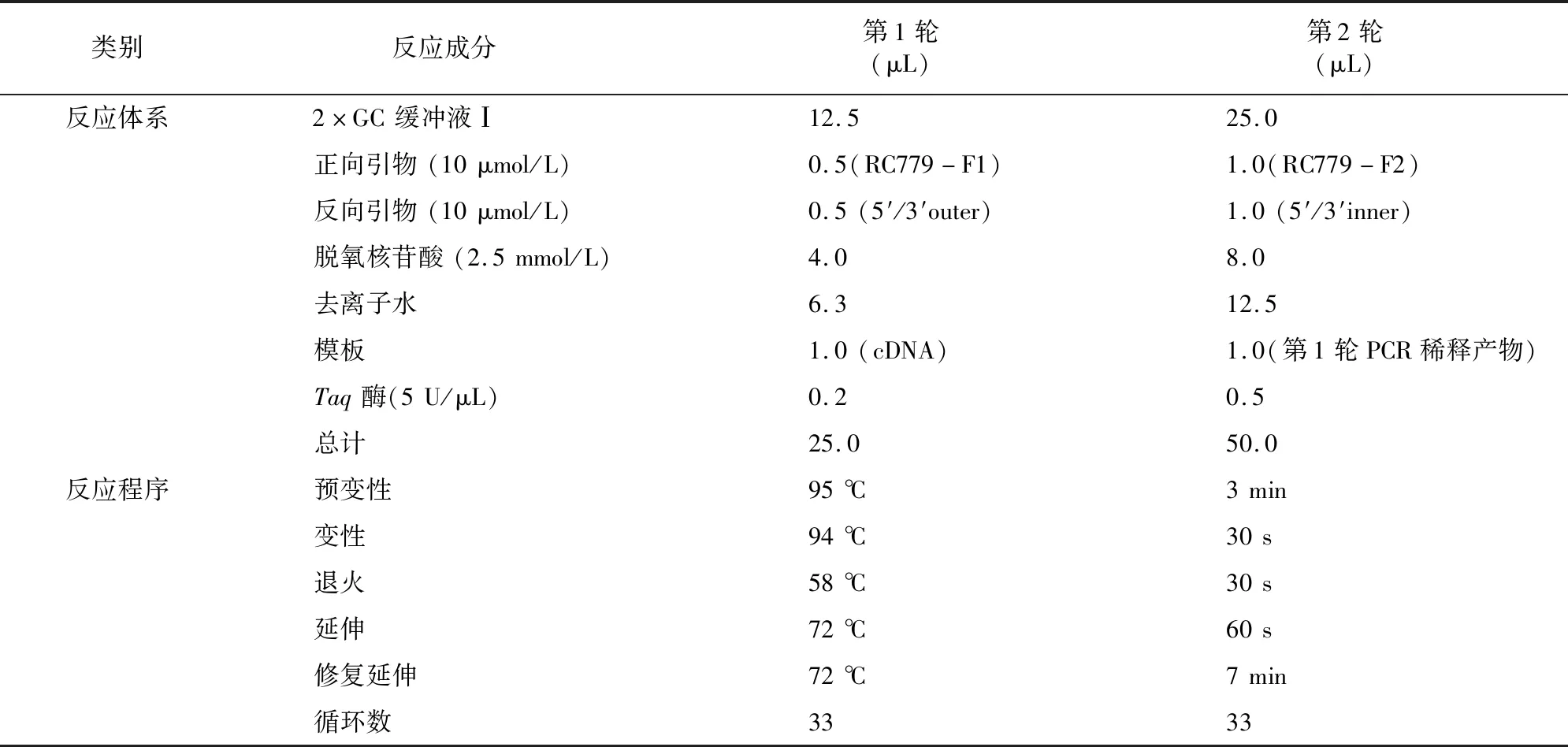
表3 3′-RACE反应条件
1.5 生物信息学分析
通过NCBI ORF finder(https://www.ncbi.nlm.nih.gov/orffinder/)网站在线分析基因的开放阅读框(ORF)和其编码的氨基酸序列;MrDMC1蛋白的保守结构域由NCBI conserved domain(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)和Pfam(http://pfam.xfam.org/)在线预测获得;利用 Expasy ProtParam(http://web.expasy.org/protparam/)分析MrDMC1蛋白质氨基酸组成、分子量、理论等电点等;利用RARE CODON CALTOR在线软件(http://https://people.mbi.ucla.edu/sumchan/caltor.html)计算基因序列的稀有密码子;利用ProtScale、SignalP 6.0 Sever和TMHMM Sever v.2.0在线分析蛋白质的亲疏水性、信号肽。利用NetNGlyc 1.0 server和NetPhos 3.1 server预测蛋白糖基化和磷酸化位点;利用PSORTⅡ Prediction 在线软件(http://psort.hgc.jp/form2.html)进行亚细胞定位;通过SOPMA和SWISS-MODEL在线预测工具分析MrDMC1蛋白的二级和三级结构;用DNAStar软件中的MegAlign程序对MrDmc1基因序列与其他物种的Dmc1基因序列进行比对,并利用MEGA 5.1软件中邻接法(Neighbor Joining)构建系统进化树。
1.6 实时荧光定量PCR分析MrDmc1基因的表达
根据克隆获得的MrDmc1基因序列设计引物,以β-action基因作为内参,进行实时荧光定量PCR反应。反应体系如下:Premix ExTaqTMⅡ 10 μL,上、下游引物各0.5 μL,cDNA 5 μL,ddH2O 4μL;扩增程序:95 ℃预变性30 s;95 ℃变性15 s,60 ℃延伸30 s,40个循环。利用2-ΔΔCT法计算MrDmc1基因的相对表达量。利用IBM SPSS Statistics软件对MrDmc1基因表达差异性进行单因素方差分析,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 罗氏沼虾总RNA提取及检测
使用Trizol法提取罗氏沼虾卵巢的总RNA,1.0%琼脂糖凝胶电泳检测RNA的完整性,NanoDrop 2000分光光度计检测其纯度和浓度,选取D260 nm/D280 nm的值在1.90~2.0范围的样品用于后面的试验研究(图1-A)。
2.2 MrDmc1基因全长序列克隆及序列分析
利用特异性引物RC779-RT1/RC779-RT2反转录,得到cDNA,经RNase H 和TdT处理后,进行5′-RACE巢氏PCR(图1-B);利用3′接头为反转引物的cDNA为模版进行3′-RACE巢式PCR(图1-C);通过DNAMAN拼接获得MrDmc1基因全长序列,对基因序列分析表明MrDmc1基因序列全长为 1 627 bp,ORF为1 026 bp,包含542个密码子,编码蛋白包含341个氨基酸(图2)。
2.3 生物信息学分析
对MrDmc1基因进行生物信息学分析,结果表明,MrDMC1蛋白分子式为C1648H2644N460O514S10,理论分子量为37.4 ku,为亲水性稳定蛋白(图3);该蛋白具有Rad51结构域和helix-hairpin-helix(HhH)结构域(图4),没有跨膜区域和信号肽切割位点(图5),含有1个N-糖基化位点和25个磷酸化位点(图6);该蛋白主要存在于细胞质(60.9%)、细胞核(17.4%)和细胞骨架中(17.4%);该蛋白二级结构中α-螺旋、延伸链、β-转角、无规卷曲分别占48.39%、13.78%、7.04%、30.79%,三级结构与人减数分裂重组蛋白DMC1(SWTL ID:7c99.1)的相似度为78.11%(图7)。
2.4 系统进化树
在NCBI数据库中下载凡纳滨对虾(Penaeus vannamei,ADM45305.1)等31个物种DMC1蛋白的氨基酸序列,利用MEGA 5.1软件构建系统进化树(图8),结果表明罗氏沼虾与甲壳纲动物的进化关系最为接近,与鱼类的亲缘关系较远。
2.5 MrDmc1基因的mRNA表达分析
MrDmc1基因的组织表达谱表明,在雌虾7个不同组织中MrDmc1基因均有表达,其中,在心脏中的表达量最高,其次是肝胰腺、鳃,在眼中的表达量最低。单因素方差分析发现,除在卵巢与肌肉、肝胰腺与鳃中的表达量差异为不显著外,其他各组织之间的表达量差异均为极显著(P<0.01)(图9)。
以4个不同发育时期的罗氏沼虾卵巢组织为试验材料,进一步研究MrDmc1基因在卵巢中的表达规律,结果表明,在卵巢发育过程中,MrDmc1基因呈先上升再下降的趋势,在卵巢发育Ⅱ期表达量达到最高,从卵巢发育Ⅱ期开始表达量逐步降低。单因素方差分析表明,MrDmc1基因在不同发育时期卵巢中的表达差异为极显著(P<0.01)(图10、图11)。
3 讨论
利用现代分子生物学技术,探究罗氏沼虾生长发育相关的分子调控机制,是推动罗氏沼虾产业可持续发展的重要途径。因此,深入开展罗氏沼虾生殖发育相关的分子研究,揭示罗氏沼虾卵巢发育的分子调控机制尤为关键。Dmc1基因已被证明是具有DNA重组酶活性的RecA/Rad51超家族的成员之一[25]。对同源染色体之间DNA链的交换和减数分裂过程中断链双键的修复是必不可少的[26]。本研究利用RACE技术对罗氏沼虾Dmc1基因进行克隆,获得了MrDmc1基因的全长cDNA序列,为MrDmc1基因功能等方面研究奠定基础。
一些水生动物Dmc1基因已有报道,且不同动物的Dmc1基因长度不同[11-17]。本研究首次克隆了罗氏沼虾MrDmc1基因的核苷酸序列,并对其进行了生物信息学分析,发现该基因全长为1 627 bp,ORF为1 026 bp,编码341个氨基酸,与斑节对虾、中华绒螯蟹、 克氏原螯虾的基因编码区一致。基因相似性分析表明,罗氏沼虾MrDmc1与中华绒螯蟹、克氏原螯虾、凡纳滨对虾和美洲龙虾的基因相似性较高;氨基酸序列同源性比较表明,罗氏沼虾MrDMC1与克氏原螯虾同源性最高,为92.96%,其次是美洲龙虾(90.91%)和凡纳滨对虾(90.32%),与文昌鱼同源性最低,为77.35%;系统进化树表明,罗氏沼虾MrDmc1基因与克氏原螯虾、凡纳滨对虾等甲壳类动物进化关系较近,与鱼类的亲缘关系较远,说明该基因在不同物种间的保守型存在差异。生物信息学分析表明,罗氏沼虾MrDMC1蛋白的分子量为37.4 ku,为稳定亲水性蛋白,该蛋白中无信号肽和跨膜区域,不是跨膜蛋白或分泌蛋白,MrDMC1蛋白存在1个N-糖基化位点和25个磷酸化位点,主要定位于细胞质中。预测结果可为后期体外构建罗氏沼虾MrDmc1基因原核表达载体及蛋白的表达优化提供重要的科学数据。
组织表达分析显示,MrDmc1基因在罗氏沼虾卵巢等7个组织中均有表达,且在不同组织中存在差异,在心脏中的表达量最高,其次是肝胰腺、鳃,在眼中的表达量最低。已有的研究表明,Dmc1基因在多个物种的性腺中高表达,在不同倍性鲤鱼[12]、红腹蝾螈[27]、达氏鲟[28]和南方鲇[29]的研究中,Dmc1基因只在性腺中表达。在斑节对虾的研究中,Dmc1基因在性腺、心脏和血细胞中均有表达[14];在日本鳗鲡的研究表明Dmc1基因主要在性腺中表达,在大脑中也有表达[11]。在本研究中,MrDmc1基因在卵巢中的表达水平不高,与所用卵巢样品处于的卵巢发育Ⅲ期有关;MrDmc1基因在卵巢等7个不同组织中均有表达,表明Dmc1基因在脊椎动物和无脊椎动物中的生物功能可能存在差别。
MrDmc1基因在不同发育时期卵巢中的表达结果显示,MrDmc1基因在卵巢发育Ⅰ期到Ⅱ期表达量逐步增高,在卵巢发育Ⅱ期达到最高,从卵巢发育Ⅱ期开始MrDmc1基因表达量逐步降低。达氏鲟Dmc1基因在0~Ⅰ期精巢中不表达,在Ⅱ、Ⅲ、Ⅳ期精巢中表达量逐步升高,并在Ⅳ期精巢中达到最高,在Ⅴ期精巢中,表达量显著下降[29];小鼠dmc1基因仅在减数分裂Ⅰ细线期到偶线期的精母细胞中特异表达[10];蝾螈dmc1基因在减数分裂Ⅰ细线期开始表达,一直持续到精子生成阶段[27]。日本鳗鲡dmc1基因只在减数分裂Ⅰ的早期表达,并且持续到粗线期,但是表达量却逐渐降低[11]。本研究发现MrDmc1基因在卵巢发育早期表达量较高,随着卵巢的逐渐成熟,MrDmc1随之降低,在卵巢发育Ⅱ期表达量最高,随后逐渐降低,说明MrDmc1基因参与了罗氏沼虾卵巢发育,推测其在卵巢发育早期发挥关键的调控作用。
4 结论
本试验通过RACE技术获得罗氏沼虾MrDmc1基因,基因全长为1 627 bp,ORF为1 026 bp,存在542个密码子,编码341个氨基酸;系统进化树发现罗氏沼虾MrDmc1基因与克氏原螯虾、凡纳滨对虾等甲壳类动物进化关系较近。生物信息学分析表明,MrDMC1蛋白分子量为37.4 ku,没有跨膜区域和信号肽切割位点,含有1个N-糖基化位点和25个磷酸化位点,是亲水性蛋白,主要存在细胞质中。荧光定量PCR检测结果显示,MrDmc1基因在卵巢等7个组织中均有表达,且在不同组织中存在差异;MrDmc1基因在卵巢发育Ⅱ期表达量达到最高,推测其在卵巢发育早期发挥关键的调控作用。试验结果可为进一步研究罗氏沼虾Dmc1基因的生物学功能,探究罗氏沼虾卵巢发育分子调控机制提供重要依据。
