枇杷植株对木霉P3.9菌株及枇杷根腐病病菌的激素响应
2022-12-10鲁海菊朱海燕熊欣燕张晓永
鲁海菊, 朱海燕, 熊欣燕, 张晓永, 谢 昆
(1.红河学院生物科学与农学学院,云南蒙自 661199; 2.南宁汉和生物科技股份有限公司,广西南宁 530000)
枇杷(Eriobotryajaponica)为云南省蒙自市特色经济水果之一,已成为当地农民脱贫致富的重要途径。近年来,土传真菌性病害枇杷根腐病在云南省蒙自市普遍严重发生[1],每年带来近千万元的经济损失。在农业防治和化学药剂对当地枇杷根腐病害控制效果均不理想的情况下,生物防治有望成为一种绿色有效的控制方法。鲁海菊等从枇杷主干韧皮部分离获得1株内生木霉(Trichodermaatroviride)P3.9,已被证实能成功抑制枇杷根腐病病菌[2],对枇杷根腐病有良好的盆栽防效,并对枇杷植株无不良影响,此外,它还兼具抗菌谱广[3],发酵工艺简单[4-5],能成功定殖于枇杷根际[6]及其植株内[7],能抑制枇杷根际土壤真菌[8]、细菌[9]及枇杷内生真菌[10]等特点,具有重要的开发利用价值。研究已发现,内生木霉P3.9菌株对枇杷植株具有诱导抗性(待发表),然而,对其诱导枇杷植株产生抗病性的信号转导途径尚未明确。
水杨酸(salicylic acid,简称SA)和茉莉酸(jasmonic acid,简称JA)是与植物防御体系相关的内源信号物质,是诱导植物产生抗病性的重要信号分子[11]。两者均能启动植物体内抗病防御基因的表达,从而调控植物抗病反应。水杨酸信号转导途径在植物系统获得性抗病过程中起关键作用,病程相关蛋白积累与植物系统获得性抗性密切相关,水杨酸可以诱导植物体内病程相关蛋白基因的表达[12],从而增强植物的系统抗性。水杨酸参与植物抗病原真菌[13]、病毒[14]和细菌[15]获得系统抗性,具有广谱性。研究发现,烟草花叶病毒(TMV)侵染黄瓜植株后,其体内水杨酸浓度大幅增加,系统获得性抗性达到最大值[16]。水杨酸合成还与苹果轮纹病[17]、紫楠炭疽病[18]、葡萄霜霉病[19]、芒果采后病害[20]等抗性有关。茉莉酸信号转导途径参与激发植物的诱导系统抗性[21]。研究发现,茉莉酸不同调控通路与香蕉叶斑病[22]、小麦白粉病[23]、稻瘟病[24]、棉花黄萎病[25]、苜蓿黑茎病[26]、油菜菌核病[27]、马铃薯晚疫病[28]等植物抗病性有关。茉莉酸合成还与植物丛枝菌根的形成[29]有关。因此,为揭示内生木霉P3.9菌株诱导枇杷植株抗根腐病病菌的信号转导途径,本研究从水杨酸和茉莉酸视角,采用高效液相色谱法研究枇杷根系接种木霉生防菌P3.9菌株及枇杷根腐病病菌后,枇杷体内与植物病害防御相关激素含量的变化规律,以期为今后枇杷抗性基因的挖掘及内生木霉P3.9菌剂的系统开发利用提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 供试枇杷及菌株 枇杷苗为大五星品种,由蒙自市十里铺枇杷育苗基地提供。内生木霉P3.9菌株(T.atroviride)、枇杷根腐病病菌(Pestalotiopsismicrospora)P3.1、P3.5和P3.6菌株保存于红河学院植物病理学标本室。
1.1.2 供试培养基 PDA培养基:200 g马铃薯、17 g葡萄糖、18 g琼脂、1 000 mL蒸馏水,pH值为7.0。
1.2 试验方法
1.2.1 试验时间与地点 于2019年4月9日至6月25日在红河学院生物科学与农学学院植物病理学实验室和苏州科铭生物科技有限公司完成木霉菌剂发酵及激素含量测定;于2019年4月16日前往云南蒙自枇杷育苗基地购买大五星枇杷嫁接苗并移栽至营养袋,置于红河学院生物科学与农学学院实验基地。
1.2.2 菌种的扩繁 将木霉P3.9、枇杷根腐病病菌P3.1、P3.5及P3.6菌株接种到PDA培养基上,置于28 ℃培养箱中培养观察,等到平板上长出孢子后即可取出备用。
1.2.3 木霉菌剂的制备 分别称量10.0 g米糠、0.2 g果糖、7.0 mL自来水,混匀放入同一个组培瓶,并以同样的方法准备组培瓶60个。上述称量好的组培瓶以及250 mL自来水,2个小烧杯(量程为 100 mL)和几只量程为1、5 mL的注射器采用高压蒸汽灭菌法,灭完菌冷却备用。将培养基上的木霉孢子用蒸馏水洗到小烧杯中,稀释调节孢子浓度为107个/mL,取1 mL接种到上述组培瓶中,置于 28 ℃ 的培养箱中培养5~7 d,视木霉生长情况而定。木霉孢子浓度达106个/g备用。
1.2.4 枇杷苗种植及菌剂接种方法 枇杷嫁接苗种植于营养袋(23 cm×18 cm)中,枇杷基地自然土壤未经消毒,陆地盆栽,苗龄为1年时做接种试验。用上述木霉菌剂拌土施入根部20 g/株,病原菌菌株用5 mm打孔器打成圆片,用等直径的打孔器打去枇杷苗根茎韧皮部,将菌片正面贴合木质部接种,保鲜膜缠绕保湿,每株接种3个菌片。处理组1:接种枇杷根腐病病菌P3.1+内生木霉P3.9菌剂,处理组2:接种枇杷根腐病菌P3.5+内生木霉P3.9菌剂,处理组3:接种枇杷根腐病病菌P3.6+内生木霉P3.9菌剂,处理组5:接种内生木霉P3.9菌剂,以施入等量米糠和接PDA圆片为处理组4(对照),设10次重复,常规肥水管理。接种6 d后分别取对照组和处理组的枇杷根、茎和叶,取3个生物学重复,采用液氮冷冻处理后,在-20 ℃的冰箱中保存,干冰送检。
1.2.5 激素含量检测 将上述45个样品用干冰寄送至苏州科铭生物科技有限公司,用高效液相色谱法分别检测茉莉酸、游离水杨酸、结合水杨酸含量。
1.2.6 数据统计 用SPSS 19.0软件,采用Duncan’s多重比较法处理试验数据。
2 结果与分析
2.1 木霉P3.9菌株及其与枇杷根腐病病菌互作对枇杷根系JA和SA含量的影响
木霉P3.9菌株及其与枇杷根腐病病菌互作对枇杷根系JA和SA含量的影响情况如表1所示。经Duncan’s多重比较,发现处理组1、2、5 JA含量与对照组4差异极显著,处理组3与对照组4差异不显著。处理组1、2、5和对照组4的JA含量分别为 0.239 4、0.211 7、0.483 2、0.331 5 μg/g FW,处理组3的JA含量为0.329 9 μg/g FW。说明木霉P3.9菌株可以促使枇杷根系JA含量增加,其分别与病原菌P3.1、P3.5和P3.6互作,前两者导致枇杷根系JA含量下降,后者不受影响。处理组1、2、3、5的游离SA含量和对照组4差异极显著,且均高于对照组4,分别为154.06、128.20、337.67、74.26 ng/g FW。说明木霉P3.9菌株可以促使枇杷根系游离SA含量增加,分别与病原菌P3.1、P3.5和P3.6互作能起到增效作用,其中,与病原菌P3.6互作增效作用最强,与病原菌P3.5互作增效作用最弱,与病原菌P3.1互作增效作用居中。处理组1、2、3、5结合SA含量和对照组4差异极显著,分别为235.00、1 145.60、780.63、1 236.44 ng/g FW。说明木霉P3.9菌株可以促使枇杷根系结合SA含量增加,其分别与病原菌P3.1、P3.5和P3.6互作增幅消弱,其中,与病原菌P3.5互作降幅最低,与病原菌P3.1互作降幅最高,与病原菌P3.6互作降幅居中。综上,木霉P3.9菌株通过增加枇杷根系JA和SA含量,提前调度寄主防御系统,抵抗病原菌的攻击。
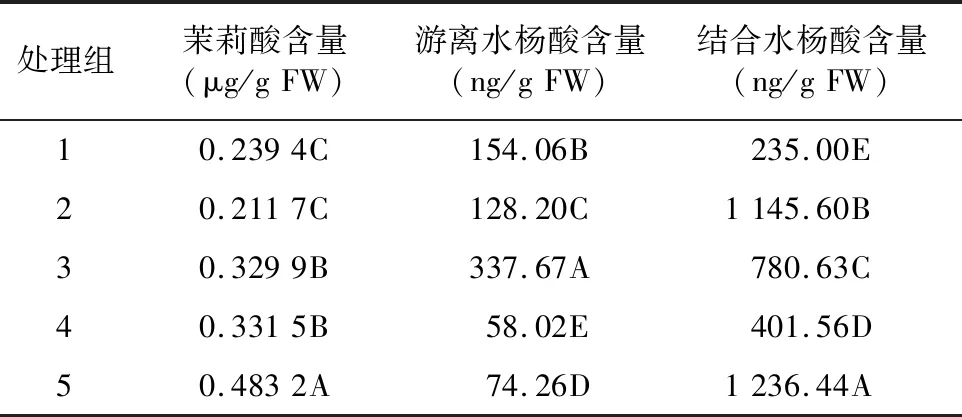
表1 木霉P3.9菌株及其与枇杷根腐病病菌互作对枇杷根系JA和SA含量的影响
2.2 木霉P3.9菌株及其与枇杷根腐病病菌互作对枇杷茎部JA和SA含量的影响
木霉P3.9菌株及其与枇杷根腐病病菌互作对枇杷茎部JA和SA含量的影响情况如表2所示。经Duncan’s多重比较,发现处理组1、2、3、5 JA含量和对照组4差异极显著,且含量明显增加,分别为0.683 1、1.591 6、1.032 2、1.199 2 μg/g FW。说明木霉P3.9菌株可以促使枇杷茎部JA含量增加,其分别与病原菌P3.1、P3.5和P3.6互作导致JA含量增幅发生变化。其中,与病原菌P3.5互作的增幅大于与病原菌P3.1互作,与病原菌P3.6互作差异不显著。处理组1、2、3、5 游离SA含量和对照组4差异极显著,且含量极显著增加,分别为873.56、273.25、534.23、122.91 ng/g FW。说明木霉P3.9菌株可以促使枇杷茎部游离SA含量增加。其分别与病原菌P3.1、P3.5和P3.6互作能起到协同增效作用,其中,与病原菌P3.1互作增效作用最强,与病原菌P3.5互作增效作用最弱,与病原菌P3.6互作增效作用居中。处理组1、2、3、5结合SA含量与对照组4差异极显著,且含量增加,分别为614.20、1 272.41、1 535.76、831.28 ng/g FW。说明木霉P3.9菌株可以促进枇杷茎部结合SA含量增加,其分别与病原菌P3.1、P3.5和P3.6互作能起到协同增效作用,其中,与病原菌P3.6互作增幅最大,与病原菌P3.1互作增效作用最弱,与病原菌P3.5互作增效作用居中。综上,木霉P3.9菌株可以通过增加枇杷茎部JA和SA含量,提前调度寄主防御系统,抵抗病原菌的攻击。
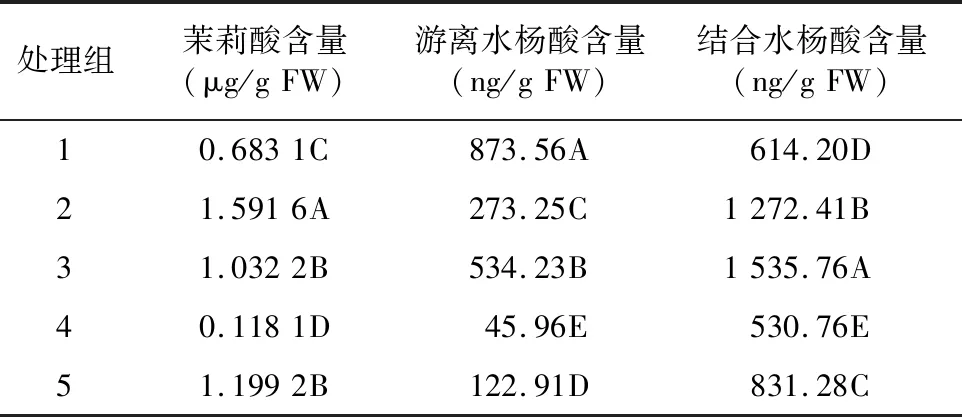
表2 木霉P3.9菌株及其与枇杷根腐病病菌互作对枇杷茎部JA和SA含量的影响
2.3 木霉P3.9菌株及其与枇杷根腐病病菌互作对枇杷叶部JA和SA含量的影响
木霉P3.9菌株及其与枇杷根腐病病菌互作对枇杷叶部JA和SA含量的影响情况如表3所示。经Duncan’s多重比较,发现处理组1、3 JA含量与对照组4差异极显著,且含量增加,处理组2、5与对照组4差异不显著。处理组1、3、4叶部茉莉酸含量分别为0.267 1、0.164 9、0.129 1 μg/g FW,处理组2、5叶部茉莉酸含量分别为0.120 5、0.113 7 μg/g FW。说明木霉P3.9菌株分别与枇杷根腐病菌P3.1、P3.6及P3.5互作,前两者可以促使叶部JA含量增加,后者不产生影响。处理组1、3、5游离SA含量与对照组4差异极显著,且含量增加,处理组2与对照组4差异不显著。处理组1、3、5、4的游离SA含量分别为396.75、508.61、117.16、177.18 ng/g FW,处理组2为184.71 ng/g FW。说明木霉P3.9菌株可以促使枇杷叶部游离SA含量降低,其与病原菌P3.1、P3.6和P3.5互作后游离SA含量变化不一致,前两者增加,后者不变。处理组1、2、3、5结合SA含量和对照组4差异极显著,分别为 1 214.31、828.88、2 541.27、1 206.62 ng/g FW。说明木霉P3.9菌株与枇杷根腐病病菌P3.1、P3.6及P3.5互作,结合SA含量变化不一致,前两者增加,后者降低。综上,木霉P3.9菌株对枇杷叶部JA和SA含量影响较复杂,其中,游离SA含量降低,结合SA含量升高,JA含量不变。其分别与病原菌P3.1、P3.6和P3.5互作,前两者JA和SA含量均增加,抵抗病原菌攻击;后者结合SA含量降低,JA和游离SA含量不变,导致严重落叶。
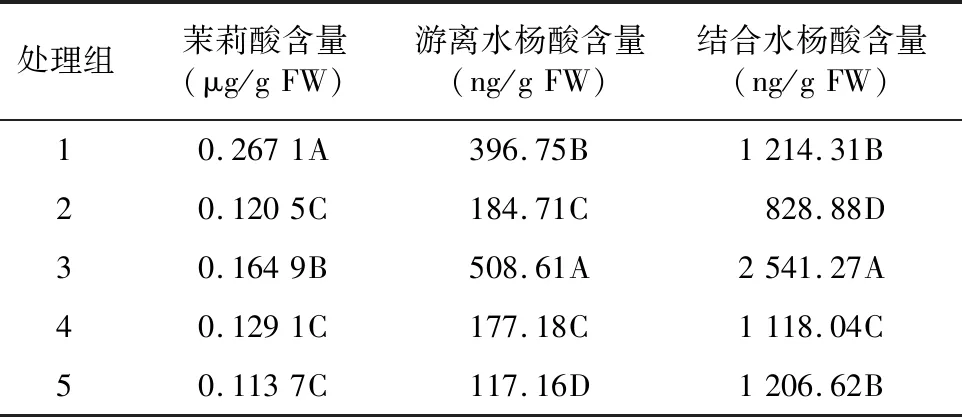
表3 木霉P3.9菌株及其与枇杷根腐病病菌互作对枇杷叶部JA和SA含量的影响
3 讨论
木霉P3.9菌株与枇杷互作,枇杷根茎JA、游离SA和结合SA含量均增加。说明木霉P3.9菌株促使枇杷根茎SA和JA含量增加,提前激活枇杷植株防御系统,抵御病原菌的攻击,对枇杷根茎有诱导抗性作用。此结论与木霉对水稻[30]、黄瓜[31-32]和大豆[33]具有诱导抗性的研究结果一致。据报道,青霉素灭活菌丝体能使烟草SA和JA信号转导标志基因表达量上调,获得抗TMV病毒的系统获得性抗性[34],木霉P3.9菌株促使枇杷根部过氧化物酶(POD)活性增加(待发表),由此推测木霉P3.9菌株诱导的枇杷根部SA的积累与POD基因的表达呈正相关。外施SA可以防治冬瓜枯萎病[35],枇杷根系可通过添加木霉P3.9菌剂诱导SA含量增加,最终达到防治枇杷根腐病的目的,与植物诱抗剂达到异曲同工之效。植物自身具有免疫系统,木霉菌作为植物免疫诱导菌[36]之一,具有重要的开发应用前景。
木霉P3.9菌株与枇杷根腐病病菌互作,枇杷根部游离SA含量增加,茎部JA、游离SA和结合SA含量同时增加。说明枇杷植株被枇杷根腐病病菌攻击时,木霉P3.9菌株诱导的枇杷根茎部抗根腐病病菌信号转导通路存在差异,根部主要通过增加游离SA含量来启动枇杷防御系统,茎部由JA和SA共同启动其防御系统。SA和JA分别参与活体营养和死体营养病原菌诱导的抗病过程[37],而枇杷根部主要通过SA信号转导途径实现获得性抗性功能,由此推测枇杷根腐病病菌为活体营养型。木霉P3.9菌株与病原菌P3.5互作,叶部游离SA和JA含量均不受影响。木霉P3.9菌株分别与病原菌P3.1和P3.6互作,叶部游离SA和JA含量均增加,其中,游离SA增幅前者小于后者。叶部结合SA含量与游离SA含量变化一致。木霉P3.9菌株分别与枇杷根腐病病菌P3.1、P3.6和P3.5互作,枇杷根系中游离SA含量增幅不一致,其中,与P3.6互作增幅最大,与P3.5互作增幅最小,与P3.1互作增幅居中。游离SA含量增幅越大致病性越强,说明3株枇杷根腐病病菌致病性存在差异。由此推测枇杷根腐病病菌P3.6菌株的致病性最强,P3.5菌株的致病性最弱,P3.1菌株居中。木霉P3.9菌株分别与枇杷根腐病病菌P3.1和P3.5互作,枇杷根部游离SA含量增加,JA含量降低。此结果可能与JA和SA介导的信号转导途径经常发生拮抗[38]有关。木霉P3.9菌株与枇杷根腐病病菌互作,同样促使枇杷根部POD和苯丙氨酸解氨酶(PAL)活性增加(待发表),由此推断以上2种防御酶活性增加与枇杷根部游离SA含量增加相关。此结果与菊花抗白锈病调控机制相似[39]。
SA生物合成途径及其受体和转录因子因不同植物各异[40-41]。WRKY转录因子参与调控各种激素信号转导。然而SA转导最关键的因子是NPR1[37]。JAZ蛋白是JA信号负调控因子,其基因家族成员对病原真菌响应模式各不相同[42]。据文献报道,木豆中存在激素响应基因家族JAZ[21],其中,木豆叶片被真菌侵染后,CcJAZ19基因表达量显著增加。病原真菌侵染诱导植物抗性的分子调控机制研究不断深入,已明确草莓抗白粉菌[43]、大麦抗赤霉菌[13]等分子调控机制。枇杷抗根腐病病菌分子调控机制也值得我们去深入研究。
