水稻纹枯病离体接种鉴定技术因子量化试验
2022-12-10马军韬张国民邓凌韦王永力高洪儒王南博肖明纲赵北平宫秀杰
马军韬, 张国民, 邓凌韦, 王永力, 高洪儒, 王南博, 肖明纲, 赵北平, 任 洋, 宫秀杰
(1.黑龙江省农业科学院生物技术研究所,黑龙江哈尔滨 150028; 2.黑龙江省农业科学院耕作栽培研究所,黑龙江哈尔滨 150028)
黑龙江省是北方水稻生产大省,是国家粮食安全的“压舱石”和口粮基地,国计民生意义重大。水稻纹枯病是由立枯丝核菌(RhizoctoniasolaniKühn)引起的一种世界性水稻病害,也是黑龙江省水稻生产中的主要病害之一,每年必发,常年减产5.00%~10.00%,严重时可达50.00%[1-2]。水稻纹枯病属于典型的土传病害[3-4],在东北主要以菌核为初侵染源,侵染水稻后也主要危害植株的中下部。喷洒化学药剂是生产中的主要防治措施,由于药剂较难到达靶标,防控效果经常不佳,反而污染环境、增加成本[5]。秋季深翻和灌水、春季打捞菌核等农业措施也对病害防控有一定的作用,但受人力缺乏、限时给水等条件限制,经常难以完成[6]。选用抗性品种可以在一定程度上减轻病害的威胁,且操作轻简,关注度越来越高。虽然水稻对纹枯病的抗性属于数量性状,缺乏免疫或高抗的品种[7],但中抗水平的品种还是占有一定比例,只需要通过科学的方式将其筛选出来,也可在生产中发挥重要作用。因此,通过何种方式对水稻品种的纹枯病抗性进行准确、快捷的鉴定便成为一项重要工作。
关于水稻品种的纹枯病抗性鉴定方法很多,常用的是通过田间自然感病的方式进行鉴定,如王道泽等均进行过相关研究[8-10]。这种方式虽操作轻简,但耗时过长,结果易受当地菌群、气候条件的影响,可重复性较差。相对而言,通过接种方式进行品种抗性鉴定,其结果的科学性、准确性均要好一些,可重复性也较好。接种鉴定的方法也很多,主要分为两大类,第1类为田间条件下的接种鉴定,如撒施法[11]、捆扎法[12]、注射法[13]、嵌入法[14]、外贴法[15]等,以成株期鉴定为主。王子斌等应用牙签嵌入法,以纹枯病RH-9为接种体,对Lemont、武育粳3号、特青、Jasmine 85和YSBR1等5份水稻品种的纹枯病抗性进行了分析,结果显示,其病级均值分别为6.96、6.54、5.59、4.96、2.42,均彼此差异极显著[16]。王爱民等应用牙签嵌入法,对江苏省101份水稻品种的纹枯病抗性进行了分析,结果显示,供试水稻抗性总体偏差,抗病品种3份,占比2.97%;中抗品种6份,占比5.94%,其他均为中感以上品种[17]。罗霄凤等应用撒施法,以纹枯病PJ-10为接种体,对四川省187份水稻品种的纹枯病抗性进行分析,结果表明,12.30%的品种平均病级介于5.1~6.0,72.70%的品种平均病级介于6.1~7.0,发病较重[18]。田间条件下的各类接种鉴定,嵌入法应用较为广泛,其结果的认可度也较高。第2类为受控条件下的接种鉴定,依据接种环境的不同主要分为温室法鉴定[19]、微室法鉴定[20]、雾室法鉴定[21]等,以苗期鉴定[22]为主。依据接种植株的不同,又可分为活体鉴定[23]、离体鉴定[24]等。Nelson等利用“雾室接种法”与“微室接种法”接种鉴定197个DH系,通过111个SSR标记检测,发现4个抗性QTLs来自抗病亲本MCR10277,总共可解释47%遗传变异;最大效应的QTL命名为qsbr_9.1[25]。郭田等利用“雾室接种法”接种纹枯病菌株GD-118,在此基础上完成PS04菌株对水稻纹枯病的防效分析,发现PS04菌株发酵液对水稻苗期纹枯病兼具保护性和治疗性,其防效分别达93.65%、92.02%[26]。关于离体叶片接种鉴定技术,研究和应用的学者相对偏少[27-29],对各技术因子进行量化分析和比较的更少。马晨燕等对水稻纹枯病离体叶片接种方法进行了改进,对接种条件进行了更精确的控制,量化了病情调查方法,结果显示抗病品种和感病品种相对病斑面积差异显著,与大田接种及苗期“微室”接种结果一致[30]。
上述各类鉴定技术互有优势,也各有局限性。本研究力图通过相关技术因子的量化分析,改进离体叶片接种鉴定技术,在发挥其轻简、快捷、适宜规模化鉴定等优势的同时,提高其鉴定的准确性。同时,本研究还应用认可度较高的田间嵌入接种鉴定方式对离体叶片接种鉴定结果进行复评,以确保技术真实可信。
1 材料与方法
1.1 试验材料
供试水稻3份,分别为五优稻4号、龙稻18、松粳22,均为黑龙江省第一积温带推广品种。
供试纹枯病菌株1份,编号为19-62,为黑龙江省第一积温带代表性菌株,致病力中等强度,由黑龙江省农业科学院生物技术研究所提供。
试验时间为2019年5—9月;试验地点为哈尔滨市道外区民主镇,黑龙江省农业科学院试验基地。
1.2 试验方法
1.2.1 离体叶片接种鉴定技术 在前期定性试验的基础之上,完成相关试验因子的定量分析。本试验中应用的离体接种鉴定技术的框架方法为铁盘内平铺浸湿的双层面巾纸,选取充分展开的心叶(叶龄为6叶)剪成30 cm叶段,正面朝上放置于面巾纸上,将直径6 mm的纹枯病菌丝块接种在叶片正面的中间部位,喷水保持微环境相对湿度85%左右,封口膜密封,于28 ℃,光照14 h/黑暗10 h条件下共培养,分别于接种后24、48、72、96、120 h进行数据调查。每个处理接种5个叶段,3次重复。
叶片黄化抑制试验,仅接种无菌水,不接种纹枯病菌,在叶段两端切口处分别加入0.5 mL供试溶液,共设置0.005 g/mL氯化钠、0.000 1 g/mL苯并咪唑和清水3个处理;接种体类型筛选试验,共设置菌核、菌悬液、菌丝块3个处理;叶片长度筛选试验,共设置5、10、20、30 cm 等4个处理;叶片层面筛选试验,共设置叶片正面和叶片背面2个处理;接种最佳温度筛选试验,共设置22、25、28、30 ℃等4个处理;接种相对湿度筛选试验,共设置相对湿度65%、75%、85%、95%等4个处理;接种光照时间筛选试验,共设置光照时间8、10、12、14、16 h等5个处理。上述所有试验,除自身设置的处理外,其他具体操作同框架方法。
1.2.2 田间嵌入接种鉴定技术 将木质牙签剪成0.8~1.0 cm小段,均匀铺在玻璃培养皿底部,加入PDB液体培养基浸没牙签,灭菌后接种新鲜纹枯病菌块,28 ℃暗培养3~5 d,待牙签表面密布菌丝即可用于接种。在水稻分蘖末期,用镊子将带菌牙签嵌入水稻倒3叶叶鞘内侧,接种后叶鞘抱茎状态基本不变。每个品种接种10个主分蘖,3次重复,接种后田间保持2~5 cm浅水层[31]。
1.2.3 鉴定标准 离体叶片接种鉴定标准[32],接种后24、48、72、96、120 h进行发病调查,将5个接种叶段作为1个整体调查病斑面积占比,具体分级标准如下:0级,叶片无病斑;1级,0<病斑面积≤12.50%叶片面积;2级,12.50%叶片面积<病斑面积≤25.00%叶片面积;3级,25.00%叶片面积<病斑面积≤50.00%叶片面积;4级,50.00%叶片面积<病斑面积≤75.00%叶片面积;5级,病斑面积>75.00%叶片面积。
田间嵌入接种鉴定标准[33],水稻黄熟期植株发病完全后开始调查,每个接种的主分蘖均需进行调查,具体分级标准如下:0级,全株无病;1级,基部叶片叶鞘发病;2级,第3叶片以下各叶鞘或叶片发病(自顶叶算起,下同);3级,第2叶片以下各叶鞘或叶片发病;4级,顶叶叶鞘或顶叶发病;5级,全株枯死。
1.2.4 数据分析 应用Excel 2010软件进行统计分析。应用DPSv14.10分析软件,以SNK法进行样本差异显著性分析。
2 结果与分析
2.1 叶片黄化抑制试验
由表1可知,接种后24、48、72 h调查,氯化钠、苯并咪唑和清水处理无差别,叶片均未黄化。接种后96 h调查,清水处理下五优稻4号叶片略有黄化,黄化面积约占接种叶片总面积的0.87%,其他处理叶片均未黄化。接种后120 h调查,清水处理下五优稻4号、龙稻18和松粳22叶片黄化均较明显,黄化面积占比分别为3.66%、2.52%、2.29%;氯化钠处理下五优稻4号、龙稻18和松粳22叶片均略有黄化,黄化面积占比分别为1.25%、0.93%、1.04%;苯并咪唑处理下五优稻4号、龙稻18和松粳22叶片均略有黄化,黄化面积占比分别为1.43%、1.22%、1.10%。此外,差异显著性分析表明,在0.05水平上,接种后120 h清水处理与氯化钠处理、苯并咪唑处理均差异显著,氯化钠处理与苯并咪唑处理差异不显著,3个水稻品种结果一致。综合对比,氯化钠对叶片黄化抑制效果最好。
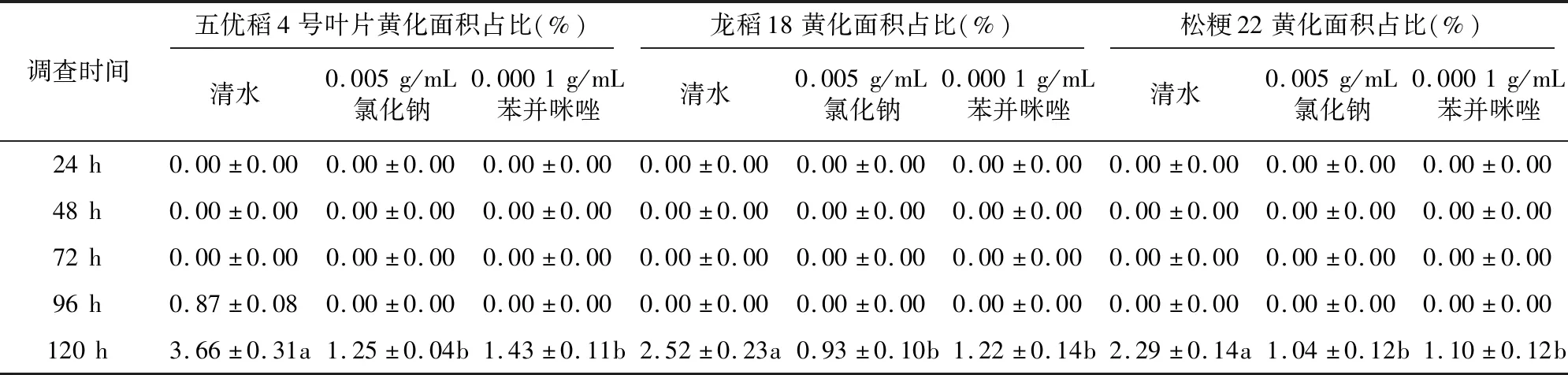
表1 不同处理下水稻品种叶片黄化情况
2.2 最佳调查时间试验
由表2可知,接种后24、48 h各水稻品种纹枯病发病均不够完全,五优稻4号接种后24、48 h的病斑面积占比分别为4.43%、10.35%,只相当于接种后72 h病斑面积占比的19.35%、45.22%;龙稻18接种后24、48 h的病斑面积占比分别为3.85%、9.30%,只相当于接种后72 h病斑面积占比的21.97%、53.08%;松粳22接种后24、48 h的病斑面积占比分别为3.40%、6.69%,只相当于接种后72 h病斑面积占比的24.55%、48.30%;调查结果误差较大,在0.05水平上与接种后72 h均差异显著,均不是最佳调查时间。而接种后72 h各水稻品种纹枯病发病基本完全,其调查结果与接种后96、120 h 调查结果差别很小,病斑持续扩展趋势不明显,在0.05水平上均差异不显著,且3个水稻品种结果一致。综合对比,初步认为接种后72 h调查即可。
2.3 接种体类型筛选试验
由表3可知,以菌核为接种体,3个水稻品种发病速度均偏慢,接种后72 h逐步发病且病斑面积占比很低,分别为3.53%、3.06%、2.73%;接种后 120 h 发病接近完全,病斑面积占比为22.57%、17.57%、14.02%。以菌悬液为接种体,3个水稻品种发病均过重,接种后72 h病斑面积占比分别为55.68%、53.91%、52.84%,品种间几乎无差别,在0.05水平上差异均不显著,不利于品种的抗性鉴定。以菌丝块为接种体,3个水稻品种发病速度适中,接种后72 h病斑面积占比分别为22.97%、17.79%、13.95%,品种间抗感性差别明显,在0.05水平上五优稻4号与龙稻18、松粳22均差异显著,适宜抗性鉴定。
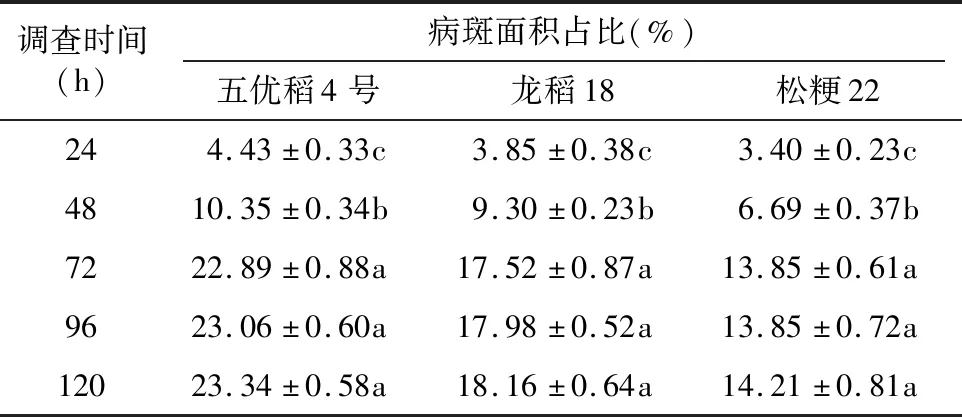
表2 不同调查时间下水稻品种病斑扩展情况
2.4 叶片长度筛选试验
由表4可知,接种后72 h,3个水稻品种叶片长度5 cm的处理中,其病斑面积占比介于82.71%~97.35%,占比均很高,病斑极有可能受到叶片长度的限制而没有扩展完全,造成严重误差甚至错误,不建议应用;叶片长度10 cm的处理中,其病斑面积占比介于41.89%~69.34%,结果稍好,但占比依然偏高,也不建议应用;叶片长度20 cm的处理中,其病斑面积占比介于21.03%~34.26%,基本可以满足病斑扩展的空间需求,但鉴于试验选用菌株致病力强度中等这一前提,也不是最佳选择;叶片长度30 cm的处理中,其病斑面积占比介于13.78%~22.56%,可以满足病斑扩展的空间需求,初步确定为最佳选择。此外,接种后72 h,不同叶片长度各处理在0.05水平上均彼此差异显著,3个水稻品种结果一致。
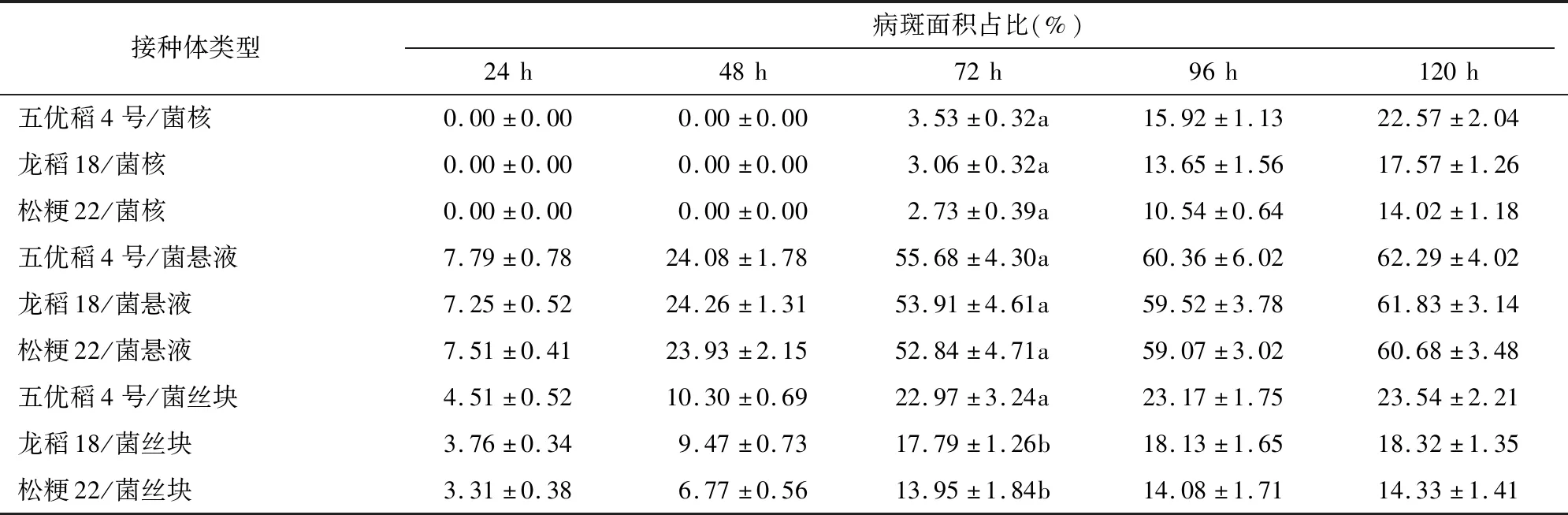
表3 不同接种体接种后水稻品种病斑扩展情况
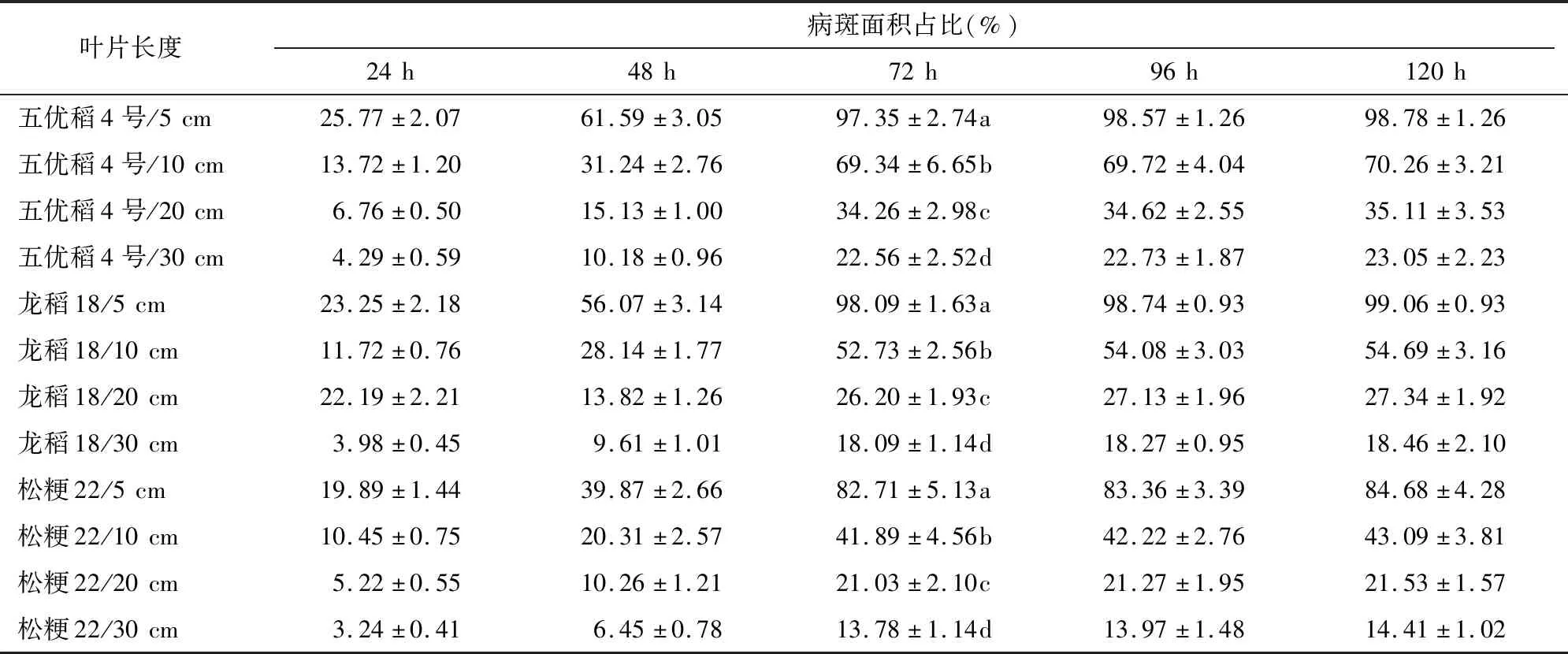
表4 不同叶片长度下水稻品种病斑扩展情况
2.5 叶片层面筛选试验
由表5可知,3个水稻品种叶片背面接种的处理中,发病明显偏慢,接种后48 h内均不发病;接种后72 h逐步发病且病斑面积占比很低,分别为7.32%、4.33%、3.59%,仅为同期正面接种各处理病斑面积的24.28%~32.09%;接种后120 h病斑扩展近完全,其病斑面积占比分别为22.14%、16.69%、14.03%,仅与正面接种72 h各处理的病斑面积占比持平或略低。综合对比,叶片正面接种试验效果较好。
2.6 接种温度筛选试验
由表6可知,五优稻4号接种后72 h,接种温度22、25、28、30 ℃各处理病斑面积占比分别为14.76%、18.67%、22.08%、22.55%,接种温度 30 ℃ 处理病斑面积占比最高,接种温度28 ℃处理次之,但二者差别很小;接种温度22 ℃处理病斑面积占比最低,仅为接种温度30 ℃处理的65.45%,在0.05水平上与其他3个温度处理均差异显著。龙稻18接种后72 h,接种温度22、25、28、30 ℃各处理病斑面积占比分别为12.74%、14.97%、16.92%、17.04%, 接种温度30 ℃处理病斑面积占比最高,接种温度28 ℃处理次之;接种温度22 ℃处理病斑面积占比最低,仅为接种温度30 ℃处理的74.77%,在0.05水平上分别与接种温度28、30 ℃处理差异显著,与接种温度25 ℃处理差异不显著。松粳22接种后72 h,接种温度22、25、28、30 ℃各处理病斑面积占比分别为9.63%、12.13%、13.87%、13.98%,接种温度30 ℃处理病斑面积占比最高,接种温度28 ℃处理次之;接种温度22 ℃处理病斑面积占比最低,仅为接种温度30 ℃处理的68.88%,在0.05水平上与接种温度28、30 ℃处理差异显著,与接种温度25 ℃处理差异不显著。综合对比,接种温度30、28 ℃试验效果均较好。
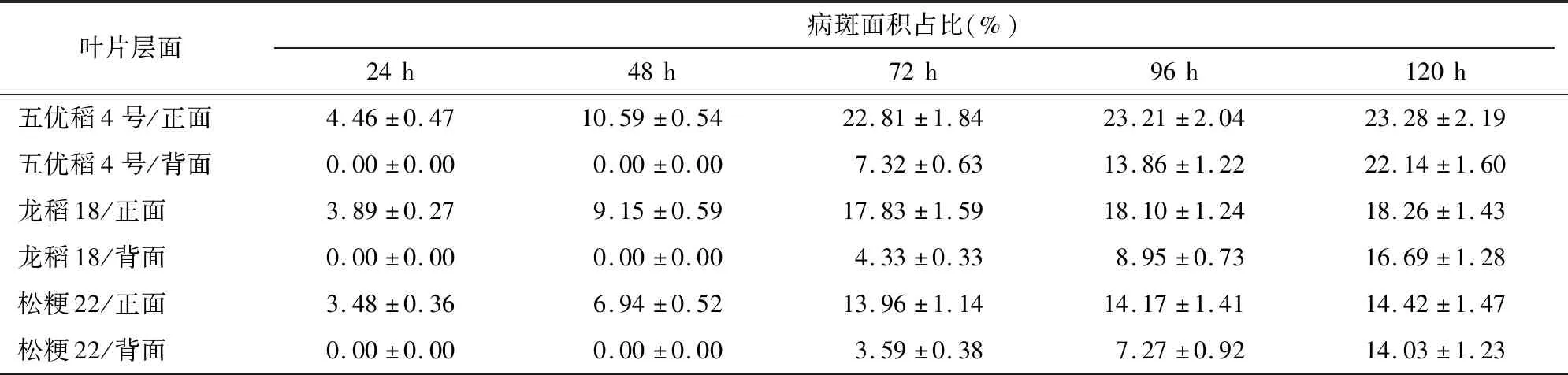
表5 不同叶片层面下水稻品种病斑扩展情况
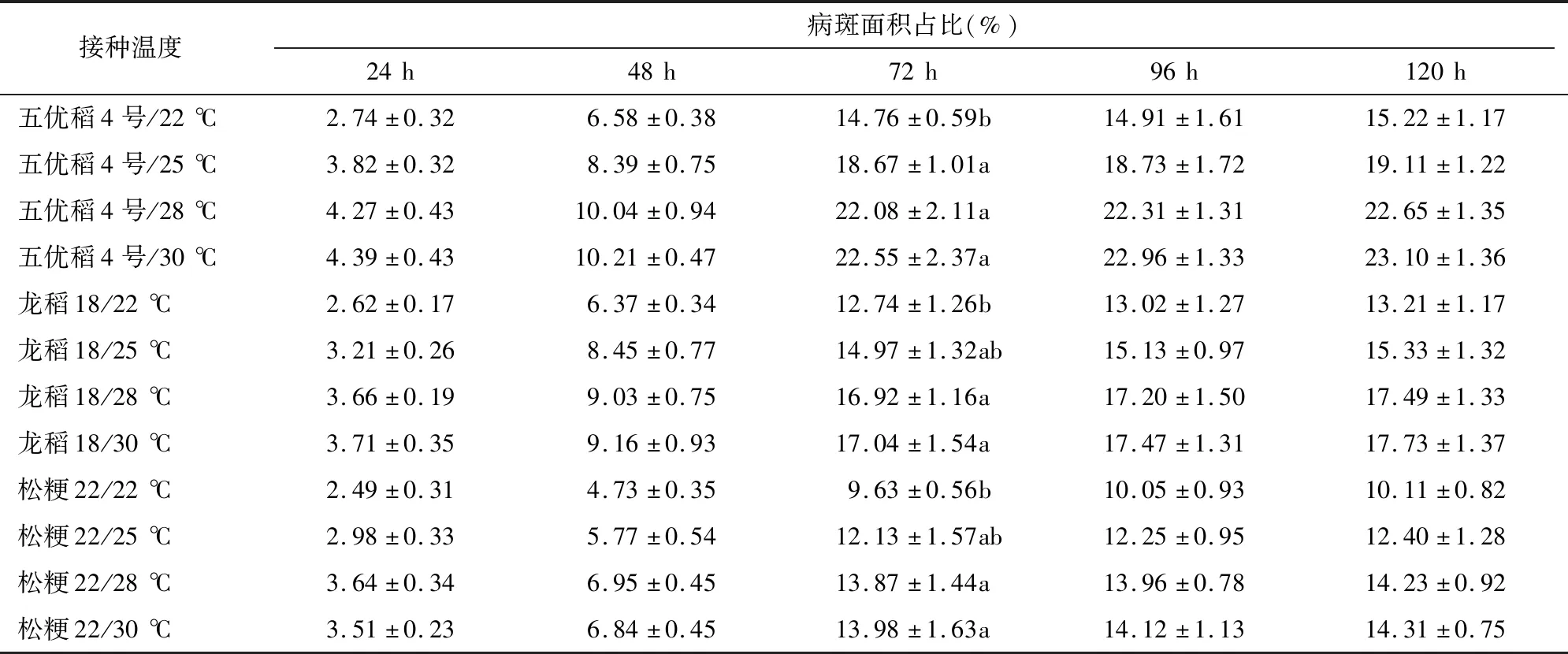
表6 不同接种温度下水稻品种病斑扩展情况
2.7 接种相对湿度筛选试验
由表7可知,五优稻4号接种后72 h,接种相对湿度65%、75%、85%、95%各处理病斑面积占比分别为3.66%、7.26%、23.07%、14.43%,接种相对湿度85%处理病斑面积占比最高,接种相对湿度95%处理次之;接种相对湿度65%处理病斑面积占比最低,仅为接种相对湿度85%处理的15.86%,在0.05水平上与其他3个处理均差异显著。龙稻18接种后72 h,接种相对湿度65%、75%、85%、95%各处理病斑面积占比分别为2.67%、7.13%、17.86%、12.60%,接种相对湿度85%处理病斑面积占比最高,接种相对湿度95%处理次之;接种相对湿度65%处理病斑面积占比最低,仅为接种相对湿度85%处理的14.95%,在0.05水平上与其他3个处理均差异显著。松粳22接种后72 h,接种相对湿度65%、75%、85%、95%各处理病斑面积占比分别为2.71%、5.57%、13.91%、9.76%,接种相对湿度85%处理病斑面积占比最高,接种相对湿度95%处理次之;接种相对湿度65%处理病斑面积占比最低,仅为接种相对湿度85%处理的19.48%,在0.05水平上与其他3个处理均差异显著。综合对比,接种相对湿度85%试验效果最好。
2.8 接种光照时间筛选试验
由表8可知,五优稻4号接种后72 h,接种光照时间8、10、12、14、16 h各处理病斑面积占比分别为21.50%、21.78%、22.66%、22.97%、22.84%,接种光照时间14 h处理病斑面积占比最高,接种光照时间16 h处理次之;接种光照时间8 h处理病斑面积占比最低,为接种光照时间14 h处理的93.60%,在0.05水平上与其他4个处理差异均不显著。龙稻18接种后72 h,接种光照时间8、10、12、14、16 h各处理病斑面积占比分别为17.19%、17.31%、17.59%、17.83%、17.91%,接种光照时间16 h处理病斑面积占比最高,接种光照时间14 h处理次之;接种光照时间8 h处理病斑面积占比最低,为接种光照时间16 h处理的95.98%,在0.05水平上与其他4个处理均差异不显著。松粳22接种后72 h,接种光照时间8、10、12、14、16 h各处理病斑面积占比分别为12.85%、13.10%、13.24%、13.52%、13.44%,接种光照时间14 h处理病斑面积占比最高,接种光照时间16 h处理次之;接种光照时间8 h处理病斑面积占比最低,为接种光照时间14 h处理的95.04%,在0.05水平上与其他4个处理差异均不显著。综合对比,接种光照时间对试验效果影响偏小,接种光照时间14 h试验效果最好。
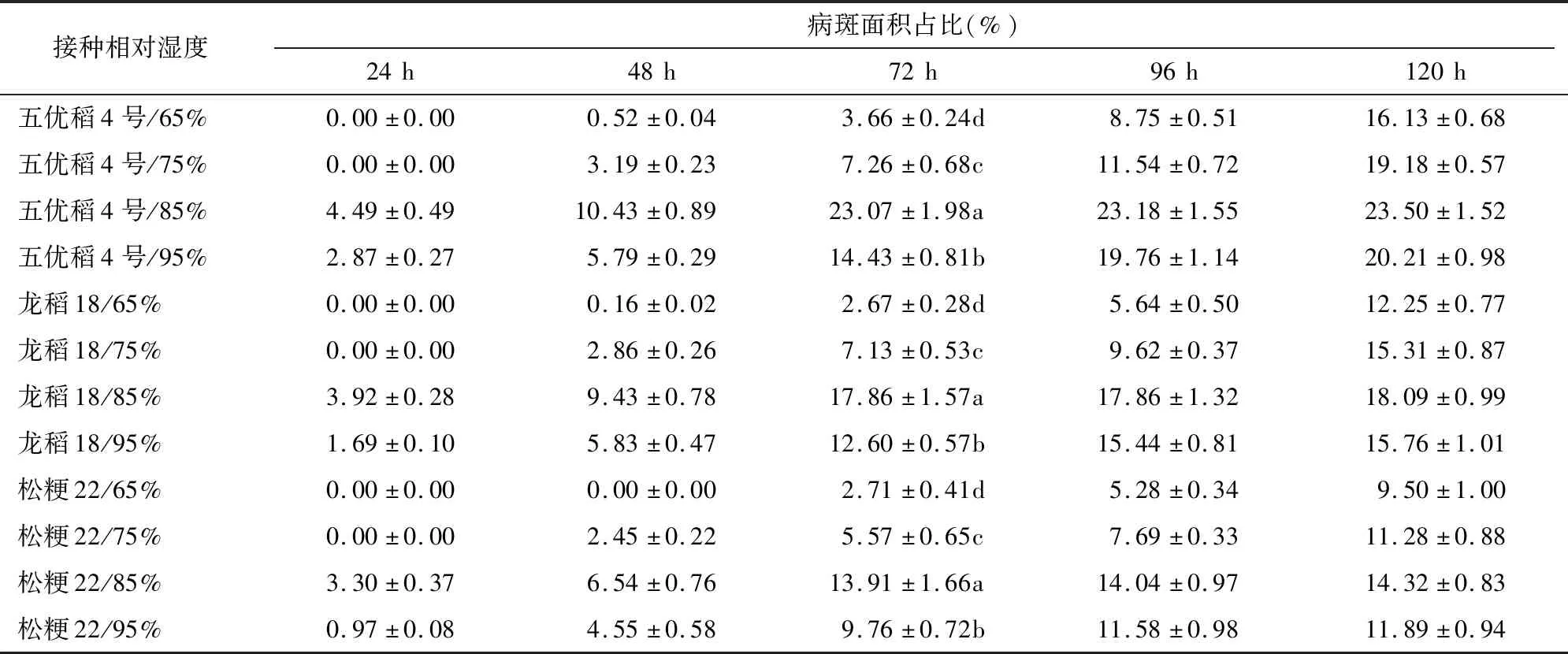
表7 不同接种相对湿度下水稻品种病斑扩展情况
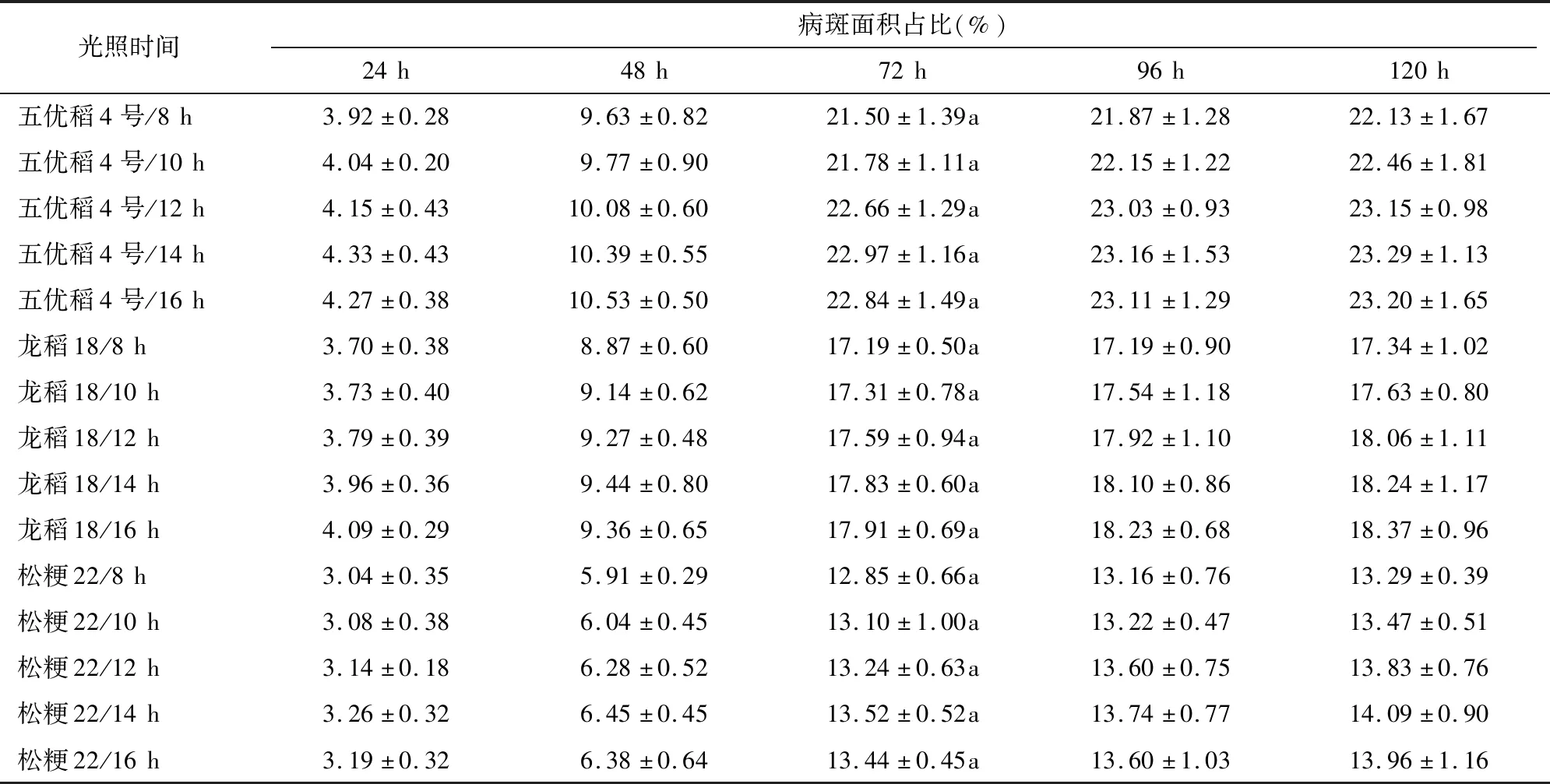
表8 不同接种光照下水稻品种病斑扩展情况
2.9 2种鉴定技术对比试验
综合前述各技术因子定量分析结果,初步认为纹枯病离体叶片接种技术流程如下,选取6叶期充分展开的心叶,长度为30 cm,正面朝上放置于面巾纸上,将直径6 mm的纹枯病菌丝块接种在叶片正面的中间部位,不需加入黄化抑制剂,喷水保持微环境相对湿度85%左右,封口膜密封,于28 ℃,光照14 h/黑暗10 h条件下共培养,72 h后进行数据调查。由表9可知,每个处理接种5个叶段,3次重复。在此条件下,五优稻4号、龙稻18和松粳22的病斑面积占比平均值分别为22.89%、17.52%、13.85%,在0.05水平上彼此差异显著。其中,松粳22抗性最好,五优稻4号抗性最差。从发病级别来看,3个品种都是2级。
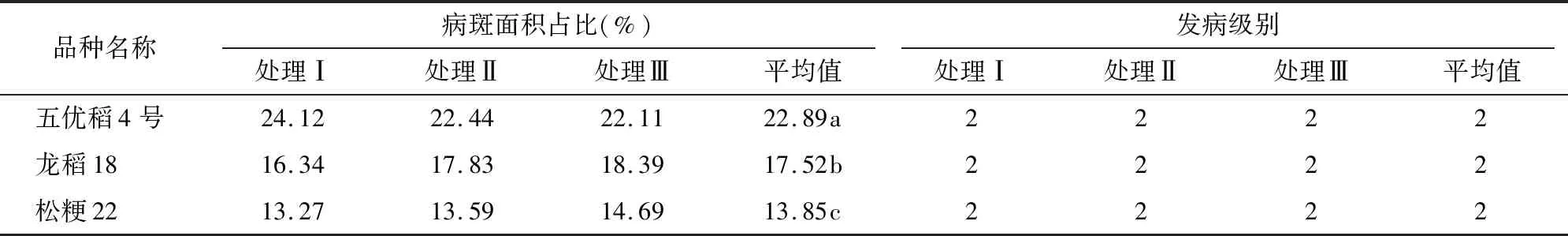
表9 接种后72 h离体叶片接种下水稻品种发病情况
田间嵌入接种鉴定结果显示,五优稻4号、龙稻18和松粳22的平均发病级别分别为2.60、2.20、1.90级,在0.05水平上,五优稻4号的平均发病级别与龙稻18、松粳22均差异显著。其中,松粳22抗性最好,五优稻4号抗性最差(表10)。
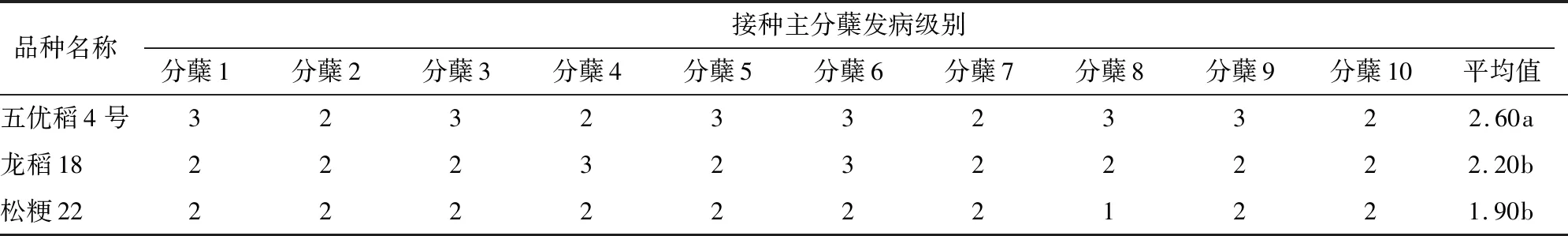
表10 田间嵌入接种下水稻品种发病情况
3 讨论与结论
从叶片黄化角度分析,水稻品种间虽有一定差别,但整体趋势一致,是否添加黄化抑制剂主要取决于设定的调查时间,如果在接种后72 h内完成数据调查,则不需添加;如果在接种后120 h以上进行调查,建议添加一定的氯化钠。此外,本试验是在接种体为无菌水的前提下获得的结果,如果接种体变为纹枯病菌,受病菌侵染影响,叶片黄化可能会更严重一些。
从病斑相对扩展速度角度分析,在认为接种后72 h即发病完全的前提下,虽然松粳22整体抗性最强,但在侵染前期(接种后24 h以内)病斑相对扩展速度却最快,即接种后24 h病斑面积占比与接种后72 h病斑面积占比的比值最高,本研究所有试验中最佳处理下的数据均表现出这一趋势;依此原则,在侵染中期(接种后24~48 h)病斑相对扩展速度最快的是龙稻18;在侵染后期(接种后48 h以上)病斑相对扩展速度最快的是五优稻4号。上述情况的出现,可能与品种自身的抗性机制有一定的关系,尚需通过各类组学研究方可得出进一步结论。
从接种体类型角度分析,菌悬液不能有效分辨品种间的抗感性差别,明显不适用;菌核虽能分辨品种间的抗感性差别,但发病偏慢,影响试验效率,后期可能出现的叶片黄化也会对调查结果造成一定干扰,易产生误差,也不是最佳的接种体;菌丝块接种后发病速度和发病效果均较适中,是较为理想的接种体。
从接种叶片层面角度分析,无论叶片正面接种,还是背面接种,均可使纹枯病发病完全,理论上均可行。但在实际操作中,叶片背面接种发病偏慢,试验效率偏低,后期可能出现的叶片黄化也会对调查结果造成一定干扰,易产生误差,不是最佳选择。因此,建议叶片正面接种。
从接种温度角度分析,接种温度30、28 ℃处理较适宜发病且二者差别很小,接种温度22 ℃处理发病较差,不建议应用。此外,依据病斑面积占比的相对变化,在认为接种温度30 ℃处理发病完全的前提下,接种温度22 ℃处理下五优稻4号仅发病65.45%,是3个水稻品种中最低的,也侧面说明五优稻4号对接种温度的变化可能最为敏感,在一定的温度范围内,更适宜的接种温度会更明显地加速发病;同理,龙稻18对接种温度的变化最不敏感,松粳22居中。
从接种相对湿度角度分析,相对湿度85%各处理发病更快、发病效果最好;相对湿度65%各处理发病最慢,接种后48 h才开始发病,接种后120 h病斑仍在扩展;相对湿度75%各处理发病情况与之类似,但发病速度偏快;相对湿度95%各处理菌丝生长速度最快,发病速度也较快,在接种后96 h发病趋近完全。接种后72 h调查,相对湿度85%的平均病斑面积占比分别是相对湿度65%、75%、95%各处理平均病斑面积占比的6.04、2.73、1.48倍。这一结论与王子斌等的研究结论[23]一致。此外,依据病斑面积占比的相对变化,侧面说明龙稻18对接种相对湿度的变化可能最为敏感,松粳22对接种相对湿度的变化最不敏感,五优稻4号居中。
从接种光照时间角度分析,光照时间各处理差别均较小。接种后72 h调查,五优稻4号和松粳22在光照时间14 h处理下病斑面积占比最高,3个水稻品种的平均病斑占比也最高,为18.11%;龙稻18在光照时间16 h处理下病斑面积占比最高,3个水稻品种的平均病斑面积占比较高,为18.06%;在光照时间8 h处理下,3个水稻品种病斑面积占比均最低,平均病斑面积占比为17.18%,差别同样较小。
从鉴定技术角度分析,离体叶片接种鉴定技术和田间嵌入接种鉴定技术可以相互印证,试验结论整体趋势一致,说明技术本身没有太大问题,这一结论与马晨燕等的研究结论[30]一致。但离体叶片鉴定结果必须结合病斑面积占比进行具体分析,因为病情分级标准划分不够精细,品种间抗性的微小差别难以体现,这就需要在后续试验中进一步细化分级标准,以使抗性评价更加科学、准确。
