串晶结构纤维调控成纤维细胞行为
2022-12-09李晓婧焦勇杰李超婧王富军
李晓婧, 焦勇杰, 李超婧, 王富军, 王 璐
(东华大学 a.纺织面料技术教育部重点实验室,b.产业用纺织品教育部工程研究中心,c.纺织学院, 上海 201620)
伤口快速有效愈合是整个医学界关注的问题。成纤维细胞是负责生产、重塑和维持细胞外基质(extracellular matrix,ECM)的细胞[1]。在伤口愈合早期,成纤维细胞通过向肌成纤维细胞分化并分泌ECM获得收缩力以闭合伤口[2-4]。伤口上皮化完成后,若肌成纤维细胞未及时凋亡,会产生过量的ECM从而形成瘢痕组织[2-6]。因此,探究成纤维细胞-肌成纤维细胞分化对于损伤后结缔组织的生理重建和纤维化病变研究具有重要意义[7-9]。文献报道[2,10-11]指出,成纤维细胞-肌成纤维细胞的分化受到生化和物理因素的影响。而生物体内细胞所在的动态微环境中存在很多会影响细胞行为,如基因/蛋白质表达的物理和生化因素[12-13]。其中,物理因素如施加的外力或ECM的结构和力学性能,特别是ECM纳米和微米级表面拓扑结构,对于调控细胞行为而言最为有效、简便与稳定[14]。
串晶结构是由中间纤维状晶体与垂直于纤维轴方向的片晶构成的结晶结构[15],其中由溶液孵育法诱导的串晶结构因操作简单、可用材料广泛、片晶尺寸和密度可控,可便捷地调控材料的表面结构、力学和热学性能,影响细胞的黏附、增殖等行为,被广泛应用于组织工程[16-17]。Guo等[16]发现,静电纺聚己内酯(PCL)串晶结构纤维支架可为内皮细胞提供适宜的生长微环境,促进内皮细胞迁移和增殖,有效改善血管内皮化。Liu等[18]制备了负载BMP-2的电纺PCL串晶结构纤维支架,研究表明除化学因素外,粗糙度较大的串晶结构纤维也会影响干细胞的募集、迁移和分化。针对串晶结构对各类细胞行为影响的文献研究较多,但鲜有关于串晶结构片晶密度对成纤维细胞行为的影响及其机制的研究报道。
静电纺丝是一种简单而有效的纳米纤维成型技术,调节静电纺丝参数可以制备具有不同直径和结构的纤维支架[2,19]。本研究采用静电纺丝技术结合溶液孵育结晶法制备表面光滑和不同片晶密度的微/纳复合串晶结构纤维支架,根据纤维支架理化性能表征结果及体外细胞试验结果,分析拓扑结构对成纤维细胞增殖、表型以及成纤维细胞分化和基质合成基因表达的影响,以期了解串晶结构纤维支架在成纤维细胞分化中的作用及其作为伤口修复和基质再生支架的潜力。
1 材料与方法
1.1 试验材料
PCL(Mw=8 000 g/mol),三氯甲烷(CF)、N-N二甲基甲酰胺(DMF)、乙酸戊酯,Sigma试剂有限公司;六孔板,Flexcell公司;人皮肤成纤维细胞(HFF-1),中国科学院上海细胞库;高糖培养基(不含谷氨酰胺)、胎牛血清(FBS)、Trizol细胞裂解液,赛默飞世尔科技(中国)有限公司;活/死染料,上海凯基生物技术股份有限公司;细胞计数试剂盒(CCK-8试剂盒),上海翊圣生物科技有限公司;EasyScript®One-Step gDNA Removal and cDNA Synthesis SuperMix,北京全式金生物公司。
1.2 不同拓扑结构纤维膜的制备
将质量分数为12%的PCL溶入CF和DMF的混合溶剂(VCF∶VDMF=9∶1)中,磁力搅拌至少16 h形成均一稳定的纺丝液进行静电纺丝。静电纺丝参数:针头23 G,正电压20 kV,负电压1.5 kV,接收距离18 cm,推注速率1 mL/h,温度23~27 ℃,相对湿度40%~50%。纺丝完成后将纤维膜放在37 ℃的真空烘箱中干燥24 h,记PCL质量分数为12%的光滑纤维膜为P12。在此基础上采用溶液孵育结晶方法获得具有不同片晶密度的串晶结构纤维膜。具体步骤:称取不同质量的PCL溶于乙酸戊酯中,制得质量分数为0.5%和1.0%的PCL结晶稀溶液,在60 ℃下加热3 h使PCL完全溶解,冷却至室温后将5 cm×5 cm的纤维膜分别浸泡在0.5%和1.0%稀溶液中15 min,分别记成型的串晶结构纤维膜为P12-SK1和P12-SK2。
1.3 理化性能测试与表征
1.3.1 微观形貌
通过场发射扫描电镜(FE-SEM,Hitachi SU8010型,日本)观察不同拓扑结构纤维膜的微观形貌,并采用Image J软件测试纤维直径,每种纤维膜样品选取100根纤维。
1.3.2 表面粗糙度
研究[14]表明纳米级表面粗糙度会对细胞的黏附产生影响,而黏附是贴壁细胞在基质上存活、生长和增殖的前提,因此纳米级粗糙度对细胞增殖和分化等活动有着重要影响。采用原子力显微镜(Keysight 5500 AFM-SPM型,美国)分析样品的表面粗糙度,扫描面积为25 μm×25 μm。
1.3.3 水接触角和结晶度
采用OCA15EC型接触角仪(Dataphysics型,德国)测量样品的水接触角(WCA)以评估纤维膜的表面亲水性。滴加2 μL PBS液滴接触纤维膜10 s后拍照,每个样品测量5次,结果取平均值。采用X射线衍射仪(XRD,D/Max-2550 PC Rigaku型,日本)测试并计算纤维膜的结晶度。
1.3.4 力学性能
纤维支架的力学性能受单丝力学性能和纤维堆积密度的综合影响[20],而支架的力学性能和结构特性在控制细胞增殖和迁移方面起着重要作用[21]。为探究支架的力学性能在调控细胞行为方面的作用,采用动态机械分析仪(TA Q800型,美国)测定样品的力学性能。样品在37 ℃下平衡3 min后以1 N/min速率拉伸至样品断裂。按照式(1)计算断裂强度,选取应力-应变曲线的线性部分按照式(2)计算弹性模量。
σ=F/S
(1)
式中:σ为断裂强度,MPa;F为断裂强力,N;S为试样横截面积,mm2。
E=σ/ε
(2)
式中:E为弹性模量,MPa;ε为试样应变。
1.4 体外细胞行为表征
1.4.1 细胞毒性
HFF-1细胞用于探索不同纤维膜的细胞活力。将HFF-1细胞(4×104mL-1)种植在灭菌后的纤维膜样品上培养1 d,无样品组作为空白对照,对活/死细胞进行染色,采用Nikon Ti-s型生物倒置荧光显微镜拍照。
1.4.2 细胞增殖
将灭菌后的样品和细胞(12×104mL-1)在6孔板中预培养72 h,随后再培养1和3 d进行细胞增殖测试,每48 h更换培养基,采用CCK-8法进行细胞增殖测定,读取450 nm处的吸光度。
1.4.3 细胞形态
细胞表型作为细胞-材料相互作用的指标之一,基质的拓扑结构可以对细胞的铺展产生显着影响。将灭菌后的样品和细胞在6孔板中预培养72 h,再继续培养3 d,固定细胞后,配制12个梯度(10%,20%,30%,40%,50%,60%,70%,75%,80%,90%,95%,100%)的乙醇溶液对细胞进行脱水处理。干燥后镀金处理,采用场发射扫描电镜观测细胞形态。
1.4.4 基因表达
转化生长因子(TGF-β1)/Smad信号通路是调节成纤维细胞向肌成纤维细胞分化以及胶原形成的经典通路,是诱导成纤维细胞分化最有效的细胞因子[22-23]。成纤维细胞具有力学敏感性和收缩性,在力学刺激下,成纤维细胞分泌TGF-β1到ECM中诱导胶原合成和成熟并参与α-平滑肌肌动蛋白(α-SMA)的合成,α-SMA具有强大收缩力,可以促进伤口收缩和组织再生[24-25]。但在伤口愈合后期,过量的基质蛋白会导致组织变硬,产生瘢痕。瘢痕组织分为两种:增生性瘢痕组织主要是Ⅲ型胶原蛋白(COL Ⅲ)升高,瘢痕疙瘩则是I型胶原蛋白(COL I)和COL Ⅲ过度紊乱[26]。研究[2,27]表明,ECM的拓扑结构在成纤维细胞的表型、分化,以及胶原蛋白和TGF-β1的合成和分泌等方面有着重要作用。因此,为探究串晶结构对成纤维细胞行为的影响,使用qPCR(quantitative polymerase chain reaction)检测诱导成纤维细胞分化和参与基质合成胶原的基因表达。
使用Trizol试剂分离总RNA。采用EasyScript®One-Step gDNA Removal and cDNA Synthesis SuperMix合成第一链cDNA(反转录)。所测基因及其相应合成引物的详细信息见表1。再采用QuantStudioTM3型Real-Time PCR仪进行扩增,最后对所得qPCR数据中的Ct值进行统计学分析。采用2-ΔΔCt相对定量分析方法进行处理:将各试验组基因的Ct值与相应β-肌动蛋白(β-actin)的Ct值相减,记所得相对值为ΔCt,再将此ΔCt值与所选对照(P12)的ΔCt相对值相减,所得相对值记为ΔΔCt,最后求得2-ΔΔCt即为相对RNA水平。

表1 qPCR引物序列Table 1 Primer sequences used for quantitative polymerase chain reaction
1.5 统计分析
定量数据以平均值±标准差形式表示,组间统计分析采用单因素方差分析(ANOVA)。统计结果的显著性水平:***表示p<0.001;**表示p<0.01;*表示p<0.05。
2 结果与讨论
2.1 形貌分析
不同表面拓扑结构纤维支架SEM图如图1所示。由图1(a)可知,成功制备了直径均匀且无串珠的光滑纤维,且随着稀溶液中PCL质量分数的增加,串晶结构纤维直径逐渐增大,分别为P12 (1.33±0.15) μm、P12-SK1 (1.82±0.17) μm、P12-SK2 (2.30±0.26) μm。PCL分子从溶液中析出并附着在纤维表面,在原有纤维上外延生成纳米结晶结构,随着PCL质量分数的增加,稀溶液中的PCL分子与纤维接触位点增多,导致纤维表面结构结晶密度增大,但由于几何尺寸限制,片晶取向随着纤维直径的增大而降低[28-31]。

图1 不同表面拓扑结构纤维支架SEM图Fig.1 SEM images of fiber scaffolds with different surface topologies
2.2 粗糙度
图2为不同表面拓扑结构纤维支架的原子力图。纤维支架表面粗糙度随稀溶液中PCL质量分数增加从(0.71±0.13) μm增加到(0.85±0.10) μm和(1.04±0.15) μm。这是因为随着PCL质量分数的增加,溶液中有更多准备结晶的PCL链聚集在纤维周围,使得PCL链接触到纤维的可能性增加,致使纤维支架表面粗糙度增大[16]。

图2 不同表面拓扑结构纤维支架的AFM 3D视图Fig.2 AFM 3D views of fiber scaffolds with different surface topologies
2.3 结晶度和接触角
通过XRD测试了不同表面拓扑结构纤维支架的结晶度,试验结果显示,随着稀溶液中PCL质量分数的增加,结晶度从(30.82±16.10)%增加到(38.43±3.73)%和(45.97±2.90)%。这是由于稀溶液中PCL链含量增加导致纤维支架的结晶度随聚合物中己内酯含量的增加而增加[28]。
聚合物支架的表面特性是控制细胞反应的关键因素,接触角决定支架的表面润湿性,进而影响养分扩散、蛋白质渗透以及细胞和基质之间的黏附[21,28,32],因此采用接触角探究支架的表面润湿性。随着稀溶液中PCL质量分数的增加,P12-SK1和P12-SK2接触角分别从P12(132.18±1.68)°降低为(128.25±2.49)°和(126.54±0.93)°,这可能是因为串晶结构使纤维间距增加导致水滴更容易渗透,从而显示出较小的水接触角[30]。但由于所有支架都是疏水的,且变化较小,因此更有意义的是探究表面拓扑结构对细胞行为的影响。
2.4 力学性能
不同表面拓扑结构纤维支架的力学性能如图3所示。由图3可知,与光滑纤维相比,串晶结构纤维可以提高材料的弹性模量和断裂强度,弹性模量从(2.66±0.13) MPa增加到(4.38±0.53)和(9.24±1.20) MPa,断裂强度从(1.23±0.12) MPa增加到(1.43±0.09)和(2.17±0.22) MPa。P12-SK2弹性模量和断裂强度增加显著,这是因为片晶尺寸过大,造成纤维之间机械互锁,导致强力过度增加。研究[33]证明串晶结构可提高纤维膜整体的力学性能。与P12相比,P12-SK1和P12-SK2断裂伸长率虽然有所下降,但不存在显著性差异。
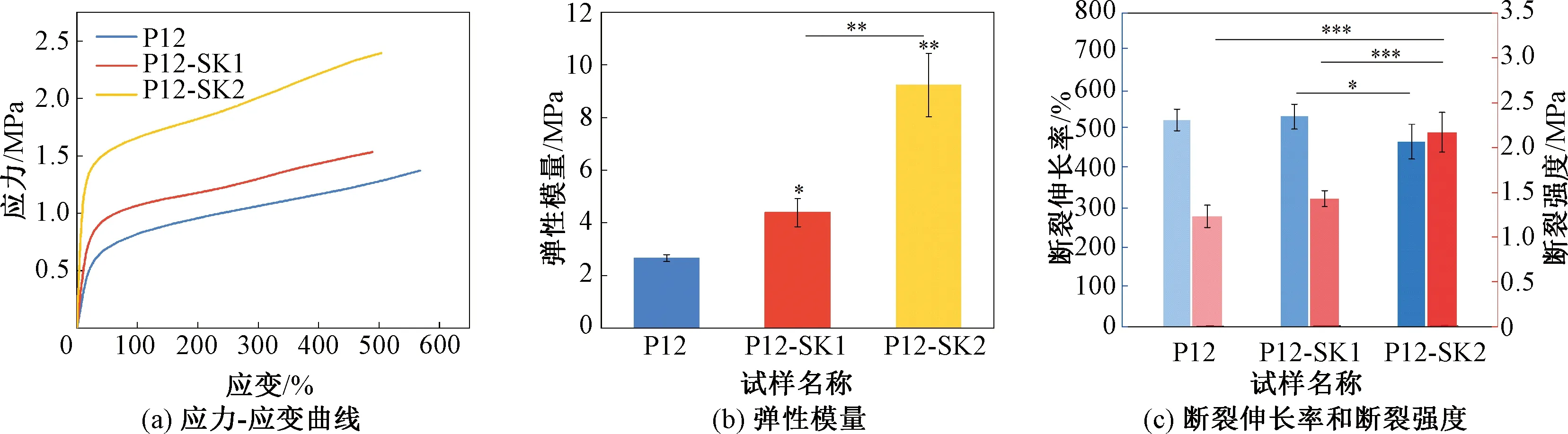
图3 不同表面拓扑结构纤维支架的力学性能Fig.3 Mechanical properties of fiber scaffolds with different surface topologies
2.5 细胞毒性
对支架进行活/死细胞染色,结果如图4所示,其中活细胞显示绿色荧光。培养1 d后,3个试验组支架上的细胞与图4(d)空白对照组无差异,细胞生长状态良好,表明PCL光滑纤维以及串晶结构纤维支架的生物相容性好,为细胞提供了良好的生存环境。
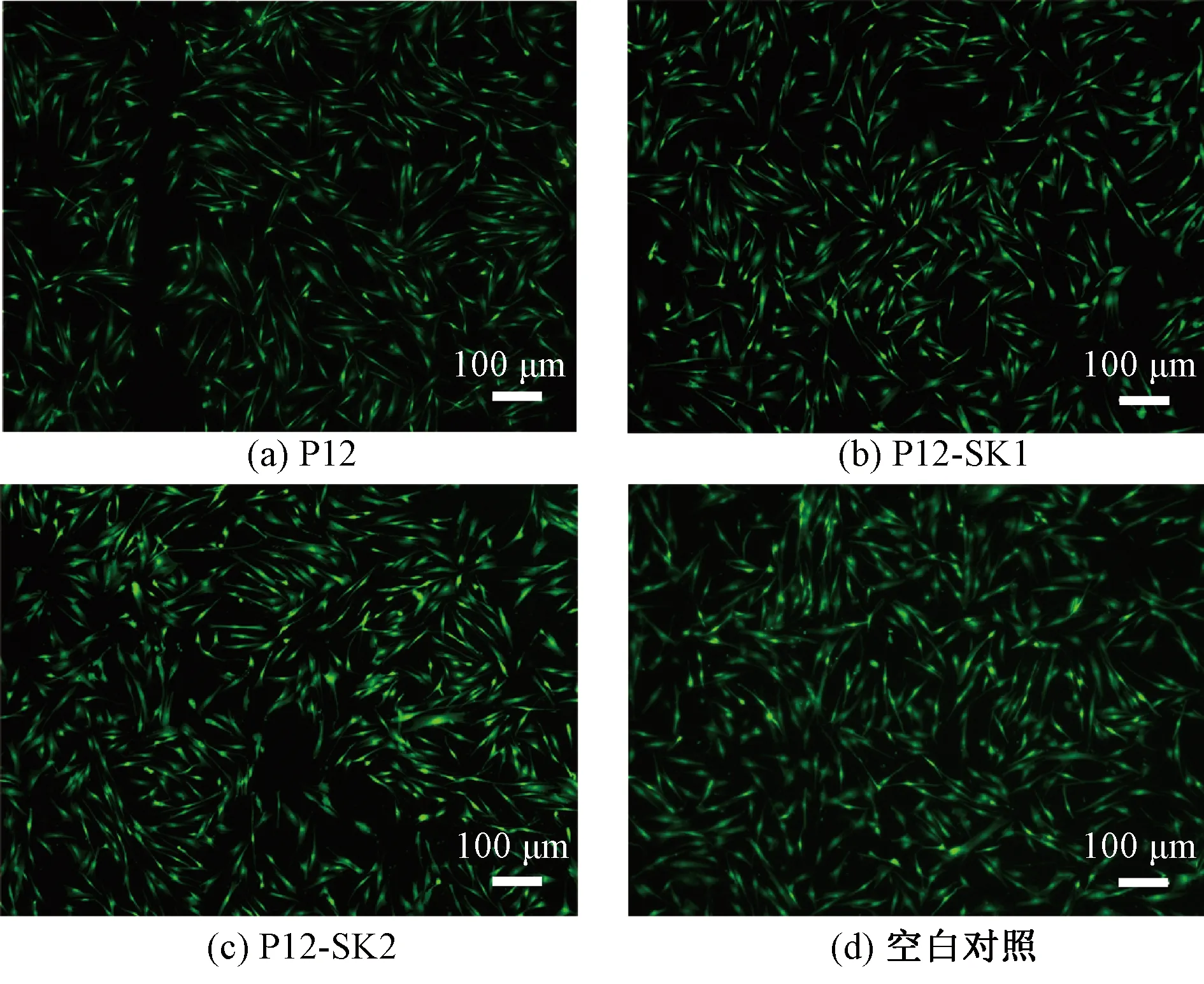
图4 在不同表面拓扑结构纤维支架上培养的HFF-1 细胞活/死染色荧光图Fig.4 Fluorescence images of HFF-1 live/dead cells cultured on fiber scaffolds with different surface topologies
2.6 细胞增殖
在不同表面拓扑结构纤维膜上预培养72 h后再培养1、3 d的HFF-1细胞增殖情况如图5所示。由图5可知:所有支架的吸光度均随时间增加而增加,表明光滑和串晶结构纤维具有良好的生物相容性,均支持HFF-1细胞生长。但P12上的成纤维细胞呈现过度增殖趋势,其1、3 d的吸光度分别是空白对照组的1.63和1.54倍。研究[25]表明成纤维细胞的持续激活会增强细胞增殖,促使ECM过度沉积,导致组织纤维化和瘢痕形成。因此,串晶结构对成纤维细胞的过度增殖有抑制作用,在抑制纤维化领域有潜在的应用。

图5 不同表面拓扑结构纤维支架上的HFF-1细胞增殖情况Fig.5 Proliferation of HFF-1 cells on fiber scaffolds with different surface topologies
2.7 细胞形态
改变ECM表面拓扑结构是一种成熟的控制细胞表型的方法。图6为HFF-1细胞在不同表面拓扑结构上的表面形态。由图6可知,细胞在纤维基质上铺展面积大且分泌较多的ECM,尤其是微/纳复合的P12-SK1,细胞铺展良好。而P12-SK2上的细胞收缩,铺展面积小,可能是因为纤维膜片晶密度过大,类似2 D致密的表面结构抑制了整合素的表达,从而抑制了细胞的铺展[25]。

图6 不同表面拓扑结构纤维支架的HFF-1细胞形态Fig.6 Morphology of HFF-1 cells on fiber scaffolds with different surface topologies
2.8 基因表达
图7为HFF-1细胞在不同表面拓扑结构上的纤维化基因和基质重塑基因表达。由图7可知,随着培养时间的增加,基质中的基因表达均有所增加,表明拓扑结构可以触发细胞内信号转化,将物理信号转化为影响细胞基因/蛋白表达的生化信号。细胞可以通过整合素传导ECM物理信号,进而调节细胞行为。研究[34-35]表明,ECM拓扑结构和刚度变化可以改变ECM与整合素的结合,进而影响潜在TGF-β1的激活。相比P12-SK1和P12-SK2,P12具有较高的TGF-β1、α-SMA和COL Ⅲ表达,其α-SMA的表达量是P12-SK1和P12-SK2的2倍、COL Ⅲ分别是P12-SK1和P12-SK2的3.76和6.14倍,增加了成纤维细胞向肌成纤维细胞的分化和增生性瘢痕组织形成的可能。虽然微/纳复合的P12-SK1和P12-SK2较P12具有较低的TGF-β1、α-SMA表达,可以减少成纤维细胞的分化和瘢痕组织形成,但P12-SK2因细胞铺展面积小且所有基因的表达量均低,具有延迟的伤口愈合效果,尤其是作为ECM主要成分的COL I表达较少,约为P12-SK1的20%,无法满足结缔组织的承重要求[25]。而具有适当纳米片晶密度的P12-SK1可以产生类似于新生儿伤口的愈合过程,在早期产生较多的COL Ⅲ,在后期具有适当的COL I/COL Ⅲ比例(3∶1),可有效促进伤口愈合,加强结缔组织承重能力,减少瘢痕组织[36-37]。以上结果均表明纤维拓扑结构可以影响成纤维细胞的基因表达和表型变化。

图7 不同表面拓扑结构纤维支架上的HFF-1基因表达Fig.7 HFF-1 gene expression on fiber scaffolds with different surface topologies
3 结 语
采用静电纺丝和溶液孵育结晶法制备具有不同纳米纤维密度的串晶结构纤维膜。通过对纤维膜进行理化性能和体外细胞试验表征发现,与P12相比,微/纳复合的P12-SK1和P12-SK2纤维,可以增加纤维膜的力学性能和粗糙度,影响细胞外基质与细胞的接触位点,可调节细胞形态、基质合成(COL I、COL Ⅲ)和肌成纤维细胞激活标志基因(TGF-β1、α-SMA)的表达,对伤口愈合和减少瘢痕具有较好的效果。但P12-SK2较P12-SK1具有更大的片晶密度、更小的细胞铺展面积和更少的COL I、COL Ⅲ表达,最终会导致修复效果不良。综上,低密度微/纳复合纤维膜P12-SK1不仅具有优异的理化和生物相容性,还可以加快组织修复,减少瘢痕,在组织愈合中具有一定的应用潜力。
