MnO2纳米片在生物传感和生物医学中的应用研究进展
2022-12-09卢玉君田雪莹何贤会彭黔荣
卢玉君, 田雪莹, 何贤会,杨 敏*,彭黔荣
(1. 贵州大学 药学院,贵州 贵阳550025; 2. 贵州中烟工业有限责任公司技术中心,贵州 贵阳 550009)
随着纳米材料在生物医学领域的应用越来越广泛,越来越多的研究者们开始探寻性能优越的生物纳米材料。二维(2D)过渡金属氧化物纳米片如二氧化锰(MnO2)、二硫化钼(MoS2)等纳米片作为一类新兴的纳米材料,具有平面形貌特征,比表面积(SSA)较高,物理化学性质优越,可降解且易于修饰,可作为生物医学应用纳米平台[1-4]。
MnO2纳米片是具有氧化还原活性的二维纳米材料,其厚度及横向尺寸都较小[5-6]。MnO2纳米片具有三个原子层,两个O层夹有一个Mn层,Mn原子占据八面体的中心且与6个最近的O原子配位,而每个O原子又和3个最近的Mn原子配位,由此形成共享边缘的[MnO6]八面体。MnO2纳米片因为Mn空位的存在而带负电荷[7]。 MnO2纳米片由于Mn离子的d-d跃迁而具有宽吸收光谱(200~600 nm),在380 nm处具有较大的摩尔消光系数(εmax= 9.6×103L·mol-1·cm-1)。MnO2纳米片因其结构独特而表现出出色的性质:1)层状MnO2的比表面积较大,因此可作为一种环保材料来吸附并降解不同种类的重金属离子、有机污染物和有机染料[8-10];2)MnO2纳米片吸收光谱较宽,可以猝灭大多数荧光物质的荧光[11-14];3)MnO2纳米片因为+4价Mn的存在而表现出很强的氧化还原能力,因此可被用于检测生物样品中的还原性物质[15-16];4)MnO2纳米片比表面积大,载药量高,并且能够与肿瘤微环境中过表达的谷胱甘肽(GSH)和过氧化氢(H2O2)发生反应而降解为Mn2+(如式1、式2所示),且反应所得的O2可以改善肿瘤缺氧的缺陷,因此MnO2纳米片可以作为构建抗癌药物递送系统(Drug Delivery System, DDS)的纳米载体材料,降解所得的Mn2+可作为T1加权的磁共振成像(Magnetic Resonance Imaging, MRI)对比增强试剂。MnO2纳米材料本身具有优异的光热转换性质,因此也可用于肿瘤的光热治疗。通过用MnO2纳米片负载不同类型的抗癌药物(光敏剂、化疗药物等),并复合其他抗癌性能好的材料,可以构建不同的抗癌协同诊疗纳米体系,对癌症的治疗有很高的指导意义。
MnO2+ H2O2+ H+→ Mn2++ H2O + 1/2O2
(1)
MnO2+ 2GSH + 2H+→ Mn2++ GSSH + 2H2O
(2)
1 基于MnO2纳米片的生物传感
基于MnO2的强大氧化能力和催化活性,MnO2纳米片已被广泛用于构建生物传感器。目前MnO2纳米片在生物传感器中的应用主要可分为三类:荧光生物传感器、电化学生物传感器和比色生物传感器。
1.1 基于MnO2纳米片的荧光生物传感
MnO2纳米片由于其强大的光学吸收和快速的电子转移性质,通常用作荧光测定中的荧光猝灭剂。当存在还原性目标物质时,MnO2纳米片与目标物质发生氧化还原反应,被还原为Mn2+离子,随之荧光标记被释放,荧光恢复,其强度与目标物的浓度直接相关。通过与不同种类的荧光纳米材料偶联,基于这一原理可以检测出许多还原物质。
Qu等[17]基于MnO2纳米片,开发了一种通过调节硫胺素(TH)的光致发光测定丁酰胆碱酯酶(BChE)活性的新策略(如图1a)。MnO2纳米片的类氧化酶活性使它们能够催化非荧光底物TH的氧化,从而产生强荧光硫色素(TC)。当在S-丁酰硫代碘化物(BTCh)存在下引入靶BChE形成硫代胆碱时,MnO2纳米片被硫胆碱还原为Mn2+,导致其类氧化酶活性的丧失于是TC荧光的降低。基于此,利用TH的发光行为变化和MnO2纳米片的类氧化酶活性,构建了BChE活性荧光生物传感器。荧光生物传感器对BChE表现出灵敏的反应,检测限达到0.036 U·L-1。
1.2 基于MnO2纳米片的比色生物传感
比色生物传感器具有独立可视读数,近年来也引起很多研究者的关注。它具有许多优点,例如操作简单、成本低和不需要任何复杂的仪器,因此对于实时现场检测特别有意义[18]。在各种比色系统中,由于其无标记性质和快速响应,现在应用于比色生物传感中最典型的显色反应是酶催化氧化成色底物如3,3′,5,5′-四甲基联苯胺(TMB)。近年来,人工酶具有酶样反应和底物特异性,与天然酶相比,它们更稳定可调。MnO2纳米材料由于存在晶格氧缺陷而具有较高的过氧化物酶、氧化酶和过氧化氢酶样活性,因此能够在没有H2O2的情况下催化有机底物[TMB、邻苯二胺(OPD)和重氮氨基苯(DAB)]的反应以产生不同颜色[19]。基于这种氧化酶样催化性质,研究者们报道了利用MnO2纳米材料类氧化酶活性,通过比色法检测各种分析物,包括离子、小分子等。
Liu等[20]报道,MnO2纳米片具有类氧化酶活性,可以催化TMB的氧化。同时,GSH的存在会导致氧化TMB的减少,从而产生颜色变化。因此,作者开发了一种用于检测人血清中的GSH的新型比色方法,检测限为300 nmol·L-1(如图1b)。它的便利性和可见性在生物医学领域中的应用非常重要。除此之外,MnO2纳米片-TMB反应系统被开发为尿酸[21]、抗坏血酸[22]、半胱氨酸等其他抗氧化剂的便携检测平台。然而,这些传感器只能确定一种抗氧化剂,由于目标物质化学性质相似,因此无法进行高通量检测。Gan等[23]基于3,3′,5,5′-四甲基联苯胺-二氧化锰(TMB-MnO2)纳米片,开发了一种快速灵敏的草酸盐检测方法。浅黄色TMB可被 MnO2纳米片催化氧化成蓝色氧化物TMB,草酸盐通过消耗MnO2纳米片,选择性地抑制该反应,从而实现草酸盐的定量检测。此外,还开发了一种自制的仿生电子眼(E-eye)系统,作为便携式原位检测平台,可以直接拍摄在10 s内有效地测得的草酸盐浓度。该方法显示出草酸盐检测的宽线性范围(7.8至250 μmol·L-1)和低检测限(0.91 μmol·L-1)。此外,即使存在80倍的干扰化学物质,该方法也表现出高选择性。通过测试人工尿液样本验证了该方法的性能,表明其在临床应用中监测和诊断尿石症具有巨大潜力。
1.3 基于MnO2纳米片的电化学生物传感
MnO2纳米片因其具有高催化活性、高化学稳定性、低成本等优点,而被用作电化学传感器。然而,因为MnO2的固有电导率(10-5~10-6S·cm-1)低,研究人员将MnO2与氧化石墨烯[24]、碳纳米管(CNTs)[25]、碳泡沫[26]、金属纳米颗粒或金属氧化物等相结合。因此,通过将石墨烯显著的导电性和优异的生物相容性等优点与MnO2的高电催化活性相结合,可以制备出在离子、小分子、免疫分析等各种分析物检测的传感器。
Lyu等[27]设计了一种光电化学(PEC)免疫测定法,基于H2O2对氧/磷共掺杂石墨C3N4/AgBr/MnO2纳米片(OP-g-C3N4/AgBr/MnO2)的蚀刻反应,用于前列腺特异性抗原(PSA)的灵敏监测(如图1c)。最初,在PSA存在下,将葡萄糖氧化酶(GOX)标记的检测抗体引入具有三明治型免疫反应的捕获抗体包被的微孔板中,于是GOX分解葡萄糖产生的H2O2将MnO2纳米片蚀刻成锰离子(Mn2+),从而导致底层OP-g-C3N4/AgBr的暴露,同时H2O2还可以用作电子清除剂,抑制OP-g-C3N4/AgBr的电子-空穴对的重组。H2O2的这两个特性协同增强了光电流。在最佳条件下,PEC免疫测定在0.05~50 μg·L-1的动态工作范围内对靶标PSA表现出高灵敏度,检测限为17 ng·L-1。该系统具有高特异性,良好的选择性和良好的稳定性,并且相对于商业化的PSA ELISA试剂盒,该方法具有可靠的准确性。更重要的是,该系统可以扩展到通过控制相应的抗体来筛选其他生物标志物。
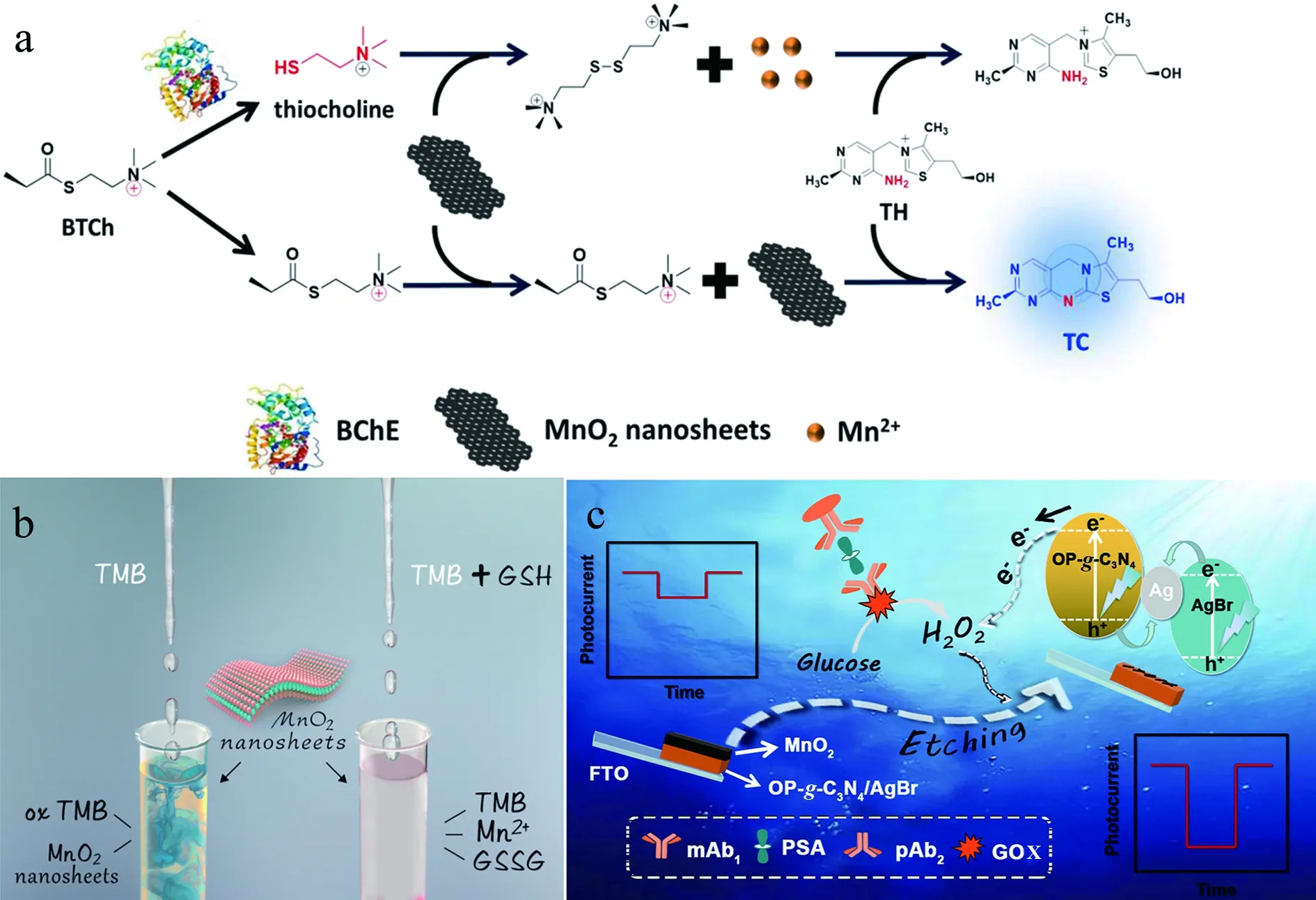
图1 (a) MnO2纳米片对BChE的荧光生物传感[17];(b) MnO2纳米片对GSH的比色传感检测[20];(c) OP-g-C3N4/AgBr/MnO2纳米片对PSA的光电化学生物传感[27]
2 基于MnO2纳米片的生物成像
与其他成像方式相比,磁共振成像(MRI)的空间分辨率高,但灵敏度有限。自20世纪80年代末以来,钆(Gd3+)[28]和锰(Mn2+)[29]作为顺磁性配合物,可以减少纵向弛豫时间T1,从而成功应用于MRI。锰基氧化物因其生物相容性较好且细胞毒性低,已取代临床上广泛使用的钆基对比成像试剂。虽然MnO2纳米片并不具备MRI性质,但经分解成为Mn2+后,展现出了优越的T1-MRI性能。MnO2纳米片肿瘤微环境中分解的Mn2+可用于肿瘤细胞MRI。
Yu等[30]构建了智能TME/NIR响应和O2自补充锰基杂化纳米平台(MnO2/Ce6@UPOMs)。MnO2纳米片在TME刺激下产生O2以缓解肿瘤缺氧并恢复PDT的猝灭上转换荧光(UCL)。MnO2纳米片发生降解产生的Mn2+可用于T1加权MRI。Mn2+具有优异的芬顿样活性,使其能够同时将内源性H2O2转化为剧毒·OH,促进癌细胞杀伤作用。因此,该纳米系统在实现CDT/PDT联合癌症治疗的同时,能够进行实时MRI监测。Zhang等[31]制备了一种纳米颗粒,由MnO2纳米片包覆的金纳米棒(GNRs)核心(装载化疗药物阿霉素(DOX))和癌细胞膜壳组成(CM-DOX-GMNP)(如图2)。细胞膜的修饰赋予纳米颗粒极高的胶体稳定性和癌细胞靶向能力。一旦纳米颗粒进入肿瘤细胞,MnO2纳米片可以通过与肿瘤微环境中的GSH和H2O2反应生成Mn2+,从而释放DOX。同时,Mn2+可以作为肿瘤诊断的MRI造影剂。当用近红外光(NIR)照射时,GNRs的光热转换效应可用于癌症的协同治疗。
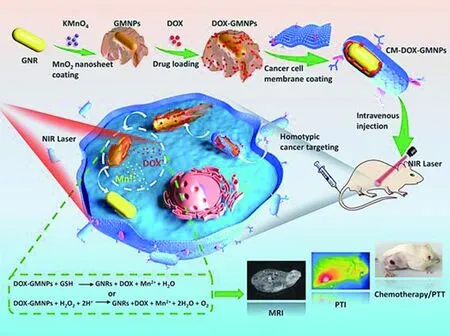
图2 CM-DOX-GMNP纳米粒子在肿瘤诊疗中的应用示意图[31]
3 基于MnO2纳米片的癌症治疗
MnO2纳米片具有一系列优异的性质,使其可以作为构建抗癌药物递送系统的纳米材料:1)MnO2纳米片比表面积大,对抗癌药物的装载效果好;2)MnO2纳米片的细胞毒性较低,其降解所得的Mn2+可以经由肝肾代谢和排泄,且Mn是人体微量元素之一,所以生物相容性良好;3)MnO2可以和肿瘤微环境中的特征性物质(GSH、H2O2等)发生反应后降解,随之药物释放,可以达到药物靶释和控释的目的,从而降低药物体系对非肿瘤组织的毒副作用;4)MnO2纳米片与H2O2反应后产生的O2有利于改善肿瘤缺氧,从而增强O2依赖的光动力治疗疗效,同时其引发的类芬顿可以用于癌症的化学动力学治疗;5)MnO2降解后所得的Mn2+可以用作MRI的对比增强试剂,有助于实现肿瘤的诊断。
现在许多研究通过MnO2纳米片负载不同类型的抗癌药物或复合不同的纳米材料,构建多种治疗方式协同作用并以MRI诊断为指导的多功能纳米药物诊疗体系。以下综述了MnO2纳米片在肿瘤光动力治疗、化学动力学治疗、光热治疗以及化疗中的应用。
3.1 基于MnO2纳米片的癌症光动力治疗
光动力治疗(Photodynamic therapy, PDT)是指在O2存在的条件下,光激发光敏剂产生活性态氧(Reactive oxygen spieces, ROS)致使肿瘤细胞发生细胞凋亡或坏死而产生杀伤力的一种癌症治疗方法。与传统疗法相比,PDT因其系统毒性低和选择性高而成为近年来抗肿瘤治疗的研究热点[32-33]。
Zeng等[34]制备了具有广泛NIR吸收和pH依赖降解性的超薄MnO2纳米片。用聚乙二醇环精氨酸-甘氨酸天冬氨酸三肽(PEG-cRGD)修饰后,将MnO2纳米片作为光热剂和纳米载体封装二氢卟吩e6(Ce6)用于癌症靶向光热治疗(PTT)和PDT(如图3)。正如预期的那样,MnO2-PEG-cRGD纳米片表现出高的Ce6负载能力(351 mg·g-1)、较高的光热转化性能(37.2%)和优异的稳定性。这些纳米片还表现出pH和NIR诱导的Ce6释放。此外,MnO2纳米片可以通过与酸性微环境中的H2O2反应而降解,从而能够原位升高氧浓度,逆转肿瘤缺氧。由于这些良好的性质和cRGD介导的肿瘤靶向能力,制备的MnO2-PEG-cRGD/Ce6纳米复合材料可以被α-vβ-3(αvβ3)整合素过度表达的前列腺癌PC3细胞有效摄取,并在660 nm NIR激光下获得良好的治疗效果,这也通过体外研究得到了验证。
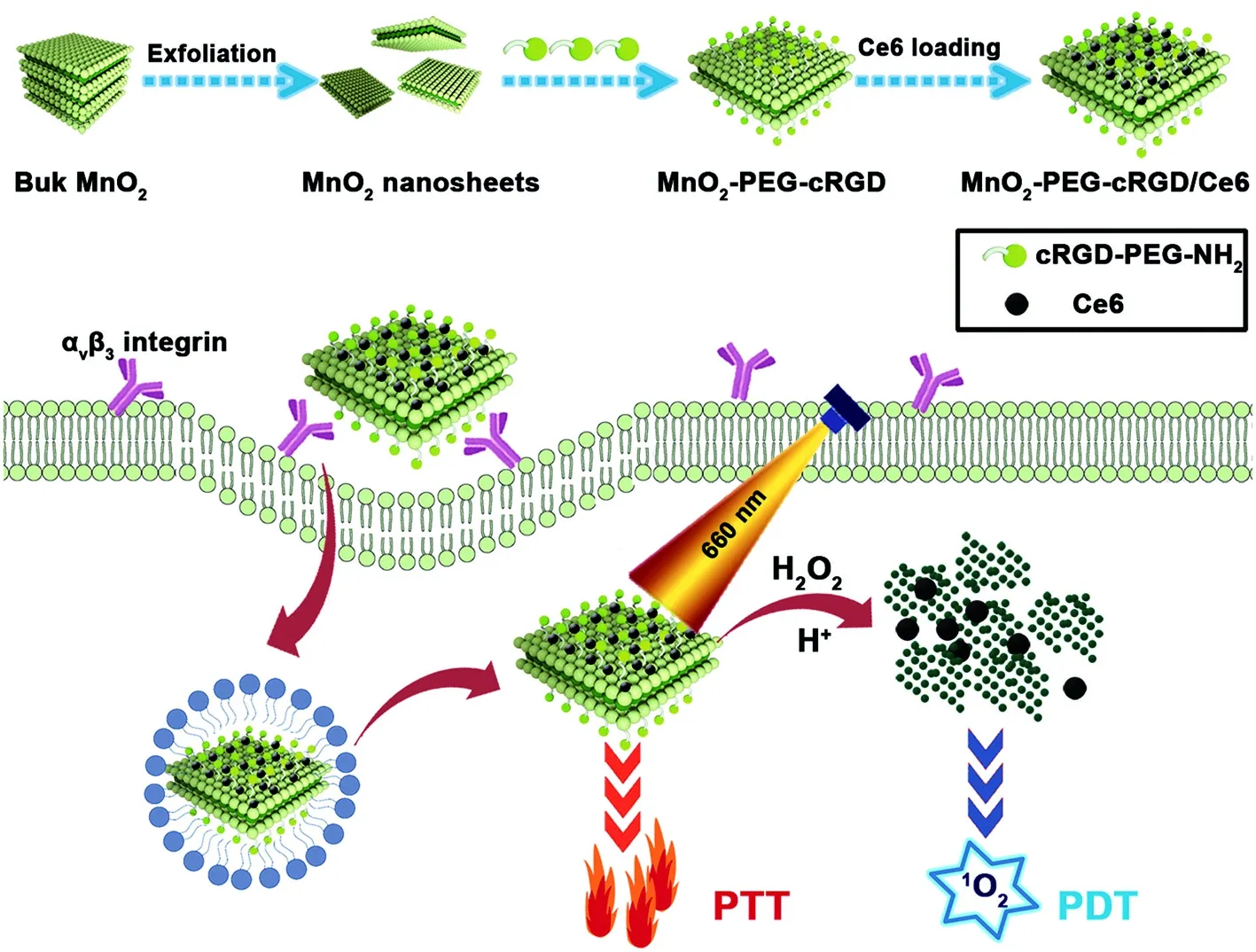
图3 MnO2-PEG-cRGD纳米片在肿瘤诊疗中的应用[34]
3.2 基于MnO2纳米片的癌症化学动力学治疗
化学动力学疗法 (Chemodynamic therapy, CDT) 是一种新兴的抗癌手段,通过过氧化物酶样催化、金属催化或过渡金属基芬顿反应,增强细胞内ROS。过渡金属(Fe、Cu 和 Mn)衍生物通过与肿瘤微环境中的H2O2、GSH发生芬顿反应产生毒性羟基自由基 (·OH)对肿瘤细胞产生杀伤力[35]。与PDT相比,CDT无需光照和O2的存在,有利于深层缺氧肿瘤的治疗。
Wang等[36]开发了一种核壳等离子体纳米材料(Au@MnO2-DNA),该材料由AuNP核心和MnO2纳米片外壳组成,外层装饰有荧光团修饰的DNA。基于等离子体纳米颗粒独特的光学性质和壳体MnO2的氧化性,散射信号和荧光(FL)信号的变化与GSH的表达水平有关,在光学显微镜设备上成功实现了一键切换的双模成像分析。同时,MnO2与GSH反应产生的Mn2+产物不仅作为智能化学动力学药物,引发芬顿样反应,实现癌细胞的CDT,而且缓解了细胞内GSH在癌症治疗中的副作用。
3.3 基于MnO2纳米片的癌症光热治疗
光热治疗(Photothermal therapy, PTT)是指用NIR照射具有光热转换性质的材料,通过热消融杀死肿瘤细胞的一种治疗方法。PTT作为一种非侵入性的癌症治疗方法近年来被广泛用于肿瘤治疗中。
Li等[37]利用MnO2纳米片和葡萄糖氧化酶(GOX)的协同作用和高反应性的优点,构建了多功能MPDA@MnO2-MB-GOX纳米放大器,用于增强PTT,PDT和饥饿治疗。在肿瘤微环境(TME)中,介孔聚多巴胺(MPDA)表面的MnO2纳米片可与内源性H2O2反应生成O2以缓解肿瘤缺氧,从而提高PDT和GOX催化的功效。在GOX催化下葡萄糖的消耗将增强TME的酸度,增加细胞内H2O2浓度,从而促进MnO2纳米片产生O2,形成有效的级联反应,最大限度地提高功能剂的功效。此外,MPDA在808 nm激光照射下产生的热量可以加速化学反应,从而进一步提高协同治疗效果。体外/体内结果强调,通过用功能纳米系统调节不利的TME可以促进癌细胞的死亡并抑制肿瘤,这突出了制得的MPDA@MnO2-MB-GOX纳米材料克服光疗局限性的前景。
3.4 基于MnO2纳米片的癌症化学治疗
化疗是癌症治疗最主要的手段。然而高细胞毒性的化疗药物通过非选择性诱导细胞凋亡或坏死对正常组织会产生明显的副作用,这是当前化疗的主要障碍之一[38]。现在对化疗的研究主要是为了增强其选择性,降低机体耐药性。
Zhao等[39]制造了基于DNA适配子和MnO2纳米片的GSH和腺苷-5′-三磷酸(ATP)双敏感纳米平台,可用于抗肿瘤药物控释和MRI。利用DNA可调性,将AS1411适配体结合核素(一种在肿瘤相关内皮细胞上特异性表达的蛋白质)与ATP适配体及其cDNA一起加载抗癌药物DOX。在MnO2纳米片和AS1411适配子的帮助下,形成的DNA-DOX复合物被递送到肿瘤区域。然后,在ATP适配体和GSH的协同作用下,实现了肿瘤细胞中药物的按需释放。研究发现,如果没有MnO2纳米片的结构被GSH破坏,即使在ATP存在下,DOX也几乎无法释放。同样,如果没有ATP,即使有GSH作用,DOX也无法释放。进一步将Mn2+的MRI能力和化学治疗相结合,实现了抑制肿瘤生长和成像的改善效果。
4 总结和展望
综述了MnO2纳米片在生物传感和生物医学中的应用研究进展,介绍了MnO2纳米片在生物传感、生物成像和癌症治疗方面的应用。虽然近年来对MnO2纳米片的研究越来越广泛,但与GO等二维纳米材料相比,其在生物医学领域的应用研究仍处于起步阶段。此外,尽管MnO2的毒性较低,但其药物代谢动力学机制、细胞摄取机制和长期毒性等生物相容性相关的研究仍然不够完善。今后对于MnO2纳米片的研究,除了探寻其对于生物有机体达到更高治疗效果的措施之外,还应关注MnO2纳米材料的生物毒性和生物代谢降解途径,以确保用药安全。
