过渡金属硫/氧化物在碱性电解水制氢中的应用进展
2022-12-09杨春明
汪 青,向 前,杨春明
(湖南师范大学化学化工学院,中国 长沙 410081)
氢能具有能量密度高、燃烧产物清洁以及可再生等优点,被认为是传统化石燃料最理想的替代性能源[1]。目前,获取氢能的方法主要包括:传统化石燃料重整制氢[2],生物技术制氢[3],以及电解水制氢[4]等。传统化石燃料重整制氢是目前工业制氢的主流[5],但其以有限的化石燃料为原料,且在制氢过程中易产生CO2及SO2等环境污染物,不利于实现可持续发展,因此限制了该方法的广泛应用[6]。生物技术制氢是通过生物学方法从可再生能源(水、有机废水以及生物质)[7]中获取氢气,该技术条件温和、原料丰富,是一种有效的制氢方法,但该技术制备的氢气产量低且纯度不高,无法达到工业化生产要求。电解水制氢以水为原料,制备氢气纯净且对环境友好,已成为现阶段使用最广的制氢方法[8]。目前,水分解制氢主要有两种成熟技术路线:碱性电解水技术与质子交换膜电解水技术。质子交换膜电解水技术(PEM)以酸性溶液为电解质,具有运转电流密度高、耗能低且能较好地与可再生能源发电波动相匹配等特点,具备产业化、规模化发展条件[9]。然而除小部分贵金属外,大部分催化剂在强酸条件下工作不稳定,极大地限制了PEM电解水技术大规模使用[10]。与PEM相比,碱性电解水技术采用氢氧化钾水溶液为电解质,除贵金属外,非贵金属催化剂(如Ni, Co, Mn)也能在碱性条件下稳定使用,可有效地降低催化材料成本[11,12]。人类对于电解水的研究已经超过230年,但电解水制氢产量却只占总产氢量的4%。出现这一现象主要是因为目前的水分解技术还面临能源效率低与成本高等问题。因此,研发成本低廉、地壳丰度高且析氢活性高的电催化剂迫在眉睫。过渡金属硫/氧化物具有储量高、成本低且催化活性和稳定性高等特点而备受能源工业的青睐[13]。本文将综述过渡金属硫/氧化物作为电催化析氢材料的研究进展。
1 碱性电解水制氢
1.1 碱性电解水原理
电解水装置主要包括电源、阴极、阳极以及电解液[14]。其工作原理是:水在通电的条件下,在阴极得到电子被还原产生氢气发生析氢反应(HER),在阳极失去电子被氧化产生氧气发生析氧反应(OER)。在不同的电解液中阴阳极所发生的反应各不相同,在碱性溶液中电解水阴阳极所涉及的反应如下:
阴极: 2H2O+2e-→H2+2OH-,
阳极: 4OH-→H2O+O2+4e-。
在标准状况下,水分解的理论势垒为1.23 V[15]。但由于活化势垒的存在,通常会导致水分解势垒增大[16]。活化势垒由催化剂/电解质界面处催化活性位点对H*中间体的吸附吉布斯自由能决定,且受到HER过程中电子转移、溶液欧姆电阻和接触电阻的影响[17]。因此,需要通过外部施加一定电位来克服该过程,才能使水发生电解反应。
1.2 碱性电催化析氢
碱性电催化析氢是还原水分子产生氢气的过程,相较于析氧反应,析氢反应涉及两电子转移,反应动力学较快。根据目前研究者所探讨的反应机理,该反应存在两种途径:Volmer-Heyrovsky以及Volmer-Tafel。具体涉及的反应如下:
Volmer: M+H2O+e-→M-H*+OH-,
Heyrovsky: M-H*+H2O+e-→M+H2+OH-,
Tafel: 2M-H*→2M+H2。
式中:M为电催化析氢活性材料,M-H*为催化剂表面上的可吸附氢原子。
不论析氢过程按照哪种路径进行,H*中间体都会全程参与HER反应,因而HER反应速率在很大程度上受H*中间体与催化剂相互作用力的影响。因此,吉布斯吸附自由能将作为评估电催化活性的重要参数。依据Sabatier原则[18],对于一个理想的HER催化剂,其与H*中间体彼此的作用力既不能过强也不能过弱,中等强度的作用力不仅可以促进电荷/质量传递,而且有利于H2快速脱附,可整体降低HER反应的势垒。
2 提高析氢电催化性能策略
由Sheng等人[19]总结的各类金属材料的吉布斯自由能火山图,可知铂是碱性环境中析氢活性最高的电催化剂,但由于其成本高昂、存量稀缺等原因,限制了其进一步商业推广。因此,开发成本低廉、丰富度高的过渡金属基催化剂来代替贵金属Pt催化剂进行高效析氢反应成为目前的研究热点。在众多过渡金属化合物中,过渡金属硫化物以及氧化物由于资源丰富、结构独特以及可控的电子特性,成为研究者广泛探讨的高活性HER催化剂[20,21]。本文在总结过渡金属硫/氧化物的最新研究进展之前,先讨论提高催化剂HER活性的6种有效策略,即缺陷工程、相结构工程、非金属掺杂、金属掺杂、复合工程和形貌工程。
2.1 缺陷工程
缺陷工程可调节纳米材料的电子结构,是提高材料电催化HER活性的有效途径[22]。到目前为止,氧缺陷是报道最多的阴离子缺陷,广泛应用于电催化HER材料的设计中。Ling等人[23]使用表面应变工程策略,通过拉伸应变优化CoO纳米棒(NRs)的电子结构以产生氧缺陷,从而提高其在碱性环境中的HER活性。具有丰富氧缺陷的CoO NRs电极在碱性溶液中显示出接近Pt/C材料的高HER活性,主要归因于该催化剂中存在的氧缺陷可促进水的解离和对H*中间体吸附能力的优化。受此启发,Zhang等人[24]通过阳离子交换法制备了具有丰富氧缺陷的NiO纳米棒(见图1)。通过在NiO纳米棒中引入氧缺陷成功优化了NiO NRs的电子结构,增强了该材料的导电性,加快了电子转移能力,从而有效提升碱性HER催化活性。除了在氧化物中可以引入缺陷外,在硫化物中同样也可引入缺陷来调控电子结构,以实现硫化物催化剂析氢性能的提高。Xie等人[25]开发了一种在MoS2超薄纳米片中引入可控缺陷的新策略来提高MoS2的析氢性能。在超薄纳米片中大量缺陷的存在导致催化惰性基面部分破裂,更多活性边缘位点暴露,产生的析氢活性位点数量是原有MoS2纳米片活性位点的13倍,有利于析氢活性的提高。

图1 (a) NiO NRs电极设计示意图,不同催化剂在1 mol·L-1 KOH溶液中(b) HER极化曲线和(c) Tafel图[24](版权所有2018, Nano Energy)
2.2 相结构工程
除在材料中引入缺陷外,过渡金属基材料本身的相结构工程也可以提高材料的电催化析氢活性。2013年,Lukowski等人[26]证明了1T金属相的MoX2(X=S, Se)较2H半导体相的MoX2(X=S, Se)具有更快的电极动力学、更高的电导率以及更多的催化活性位点,从而表现出优异的电催化HER活性,因此研究人员致力于开发新的策略来获得更多1T金属相的MoX2[27]。值得注意的是,MoX2的1T金属相属于亚稳态,很容易转化为更稳定的2H半导体相[28]。然而,通过常规方法(如:通量法、碱金属插层法、水热法等)只能获得横向尺寸小于10 μm的混合金属相和半导体相纳米材料[28,29],严重影响了金属相MoX2的电学性质及其应用前景。近期,Yu等人[30]合成了横向尺寸可达数百微米的高纯度金属相1T′-MoX2(X=S, Se)晶体。该晶体具有扭曲八面体配位结构,且可通过热退火和激光照射实现从1T′-MoS2到2H-MoS2的相变。电化学测试结果表明,1T′-MoS2的基面对HER反应具有积极作用,在-400 mV的过电位下,电流密度可达到6 070 A·m-2,是目前基于MoS2电极材料性能最佳的电催化剂之一。
2.3 金属元素掺杂
在某些情况下,由过渡金属(如二元/三元金属化物)组合构建的金属化合物具有比单一金属化合物更出色的电催化性能[31]。金属掺杂是构建多元金属化合物的有效策略。最近,Jiang等人[32]通过热分解剥离法从具有层状结构的CeCO3OH中制备二维氧化铈纳米片,同时,额外的钴掺杂剂促进了氧化铈纳米片中氧空位的形成,进而优化了氢结合/水解离能力,并增加了催化活性位点。因此,二维Co掺杂的CeO2纳米片在碱性HER中表现出优异的催化性能,在过电位低至-132 mV时可提供1 000 A·m-2的高电流密度,优于Pt/C材料。Feng等人[33]通过电化学法将金属Cu纳米点(NDs)引入Ni3S2纳米管(NTs)中(见图2),由于Cu和Ni3S2之间的电子相互作用导致Cu NDs带正电,Ni3S2NTs带负电,既可促进水的吸附和活化,又可削弱催化剂表面形成的S-Hads键,进而实现其对H*中间体的吸附/解吸能力的最优化,加快Volmer-Heyrovsky步骤。因此,Cu NDs/Ni3S2NTs-CFs电催化剂表现出优异的HER催化性能。同样,鉴于二元金属化合物存在有效的协同作用,表现出高效的析氢活性,预示着三元金属化合物也可展示出巨大的HER潜能。Ling等人[34]通过Ni和Zn双金属掺杂对CoO材料进行电子结构调控,使得其从HER惰性材料转变为高析氢活性材料。在该催化剂中,Ni元素主要聚集在主体氧化物(CoO)表面氧空位周围,为氢中间体键合提供了理想的电子表面结构,而Zn元素则分布在主体氧化物的内部用于调节电子结构以增强导电性能。结果表明:双金属掺杂的Ni, Zn-CoO纳米棒在-53 mV的过电势下可实现100 A·m-2的电流密度。该性能优于目前文献报道的大多数金属氧化物,表明双金属掺杂是提高电催化活性的有效策略。
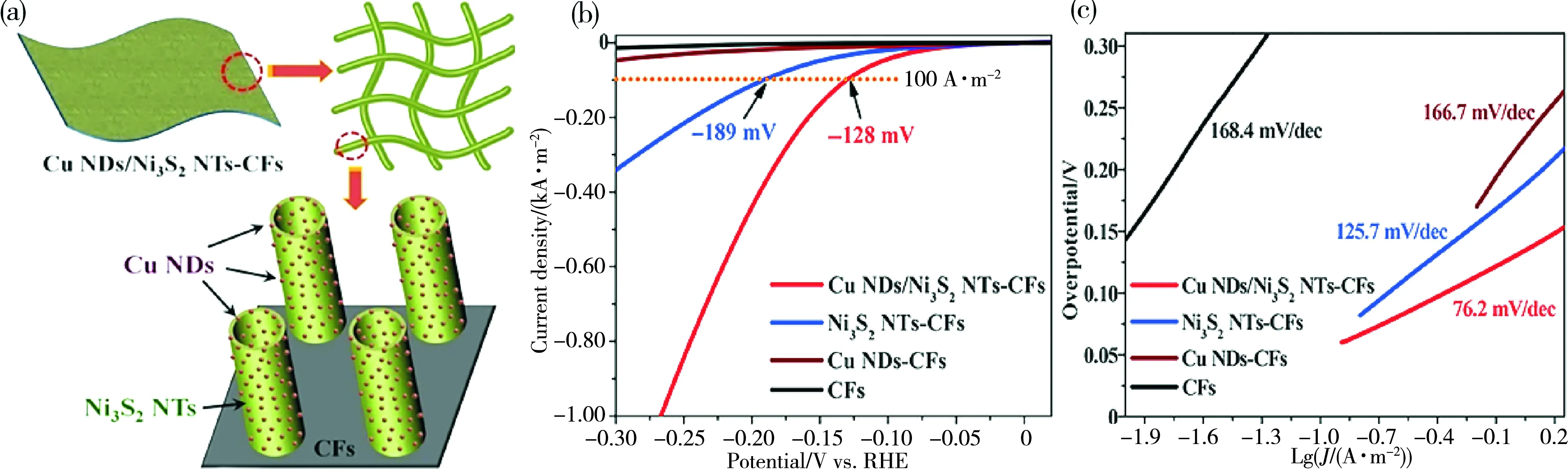
图2 Cu/Ni3S2电极的 (a)设计示意图,不同催化剂在1 mol·L-1 KOH溶液中的(b) HER极化曲线和(c) Tafel图[33](版权所有2018, J Am Chem Soc)
2.4 非金属元素掺杂
除金属掺杂外,在材料中引入非金属杂原子(N, F, S)也可有效地调整材料电子结构来提高其在碱性环境中的HER性能。Kou等人[35]通过一步氨处理在泡沫镍上原位制备N掺杂的Ni3S2自支撑电极材料。氨处理既引入了杂原子N作为额外活性位点,又可产生具有较低H*中间体吸附自由能的新活性界面。有效地促进了Ni3S2的HER催化性能。最近,Zhong等人[36]通过氟离子取代和阳极氧化诱导非晶化策略来增强CoO的HER活性。部分O2-位点被氟离子取代,可诱导相邻Co位点的电荷重新分布,促进水的解离并削弱对H*中间体的吉布斯吸附自由能,从而实现该材料的最佳HER活性。除了上述电子效应外,非金属掺杂还可以用于调节金属氧化物的结晶度。Yu等人[37]通过简单的室温离子交换策略,将电负性小的硫原子掺入结晶氧化钴(CoOx)中,以产生结构紊乱(见图3)。与结晶形式相比,S-CoOx催化剂的无序性使低氧配位和富集的缺陷位点增加,从而赋予了S-CoOx电极在碱性环境中对HER具有优异的催化活性。
2.5 复合工程
通常,通过复合工程结合而成的两种或两种以上的材料往往具有“协同”作用而表现出更高的析氢活性。Hu等人[38]通过将MoS2纳米片与NiCo-LDH杂化耦合得到MoS2/NiCo-LDH异质结构。通过密度泛函理论计算表明,MoS2和NiCo-LDH形成的异质界面可促进H*和H2O在MoS2以及NiCo-LDH上的化学吸附,从而加速了其在碱性电解质中整体的HER动力学过程。该材料仅需-78 mV的低过电位即可在碱性环境中驱动100 A·m-2的电流密度,相较于单一材料MoS2与NiCo-LDH表现出更高的析氢活性。最近,Zhu等人[39]通过在单层2D-XS2(X=Mo, W)纳米片上可控生长不同种类的3d金属(Ni, Co, Fe, Mn)氢氧化物,开发了一系列2D杂化碱性HER电催化剂(见图4)。结合实验和理论研究表明,M*(OH)x(M*=Ni, Co, Fe, Mn)与2D-XS2(X=Mo, W)的杂化耦合可有效降低析氢反应势垒,加速HER动力学过程,从而实现其在碱性环境中的HER性能的提高。

图3 S-CoOx电极 (a)设计示意图,不同催化剂在1 mol·L-1 KOH溶液中(b) HER极化曲线和(c) Tafel图,(d) S-CoOx稳定性测试[37](版权所有2020, Nano Energy)
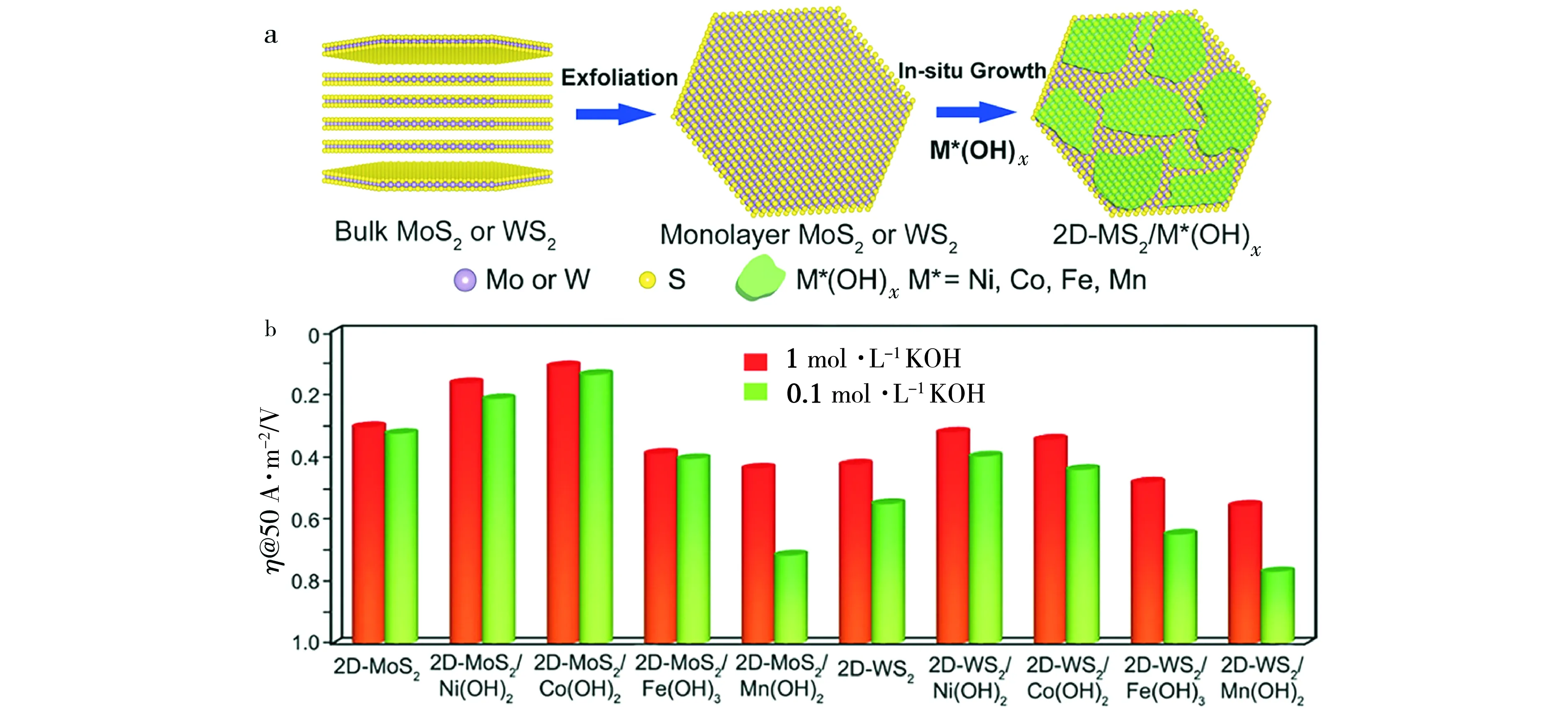
图4 2D-XS2/M*(OH)x电极 (a)设计示意图,(b)不同催化剂在0.1或1 mol·L-1 KOH溶液中对应的析氢过电位(50 A·m-2) [39](版权所有2018, Adv Mater)
2.6 形貌调控工程
除上文概述的调节电极材料内在活性策略外,通过设计过渡金属化合物的形态(例如,纳米结构或孔结构)产生更多活性位点,是提高催化性能的另一有效策略。Jin等人[40]采用溶剂热-煅烧退火处理策略在泡沫镍(NF)上原位生长超薄多孔MoO2纳米片(NS),相较于用传统方法合成的MoO2材料,该材料表现出更高的碱性HER活性。在电催化过程中,多孔结构的设计对提高材料的催化性能至关重要,因为多孔材料不仅能为反应提供更多的催化活性位点,且能为电解质渗透、电子转移以及气体释放提供有效的途径[41]。近期,Luo等人[42]通过反胶束模板法合成了具有介孔(20~40 nm)的MoO3-x催化材料,该材料能促进HER过程中的质量传输和电荷转移,在酸性和碱性条件下表现出非常活跃且稳定的析氢性能(耐用性>12 h)。Liu等人[43]通过热解-氧化-硫化耦合策略在碳布(CC)上构建了一种由二维Mo2S纳米片外部修饰,Co原子锚定氮、硫共掺杂碳纳米管(CoSAs-NS-CNTs)连接,超小型CoS2纳米点内部封装的3D自支撑双界面混合异质集成电极(见图5),该电极材料的双界面通过CoSAs-NS-CNTs为矢量电子传输CoS2→CoSAs-NS-CNTs→MoS2创建了有效的电子转移途径,提高了电极材料的整体电导率。此外,CoSAs-NS-CNTs内外表面高度分布的MoS2纳米片以及CoS2纳米点不仅为反应提供了丰富的活性位点,且有效地阻止了MoS2纳米片与CoS2纳米点的聚集和腐蚀,使得该材料在析氢反应中具有出色的活性和稳定性。
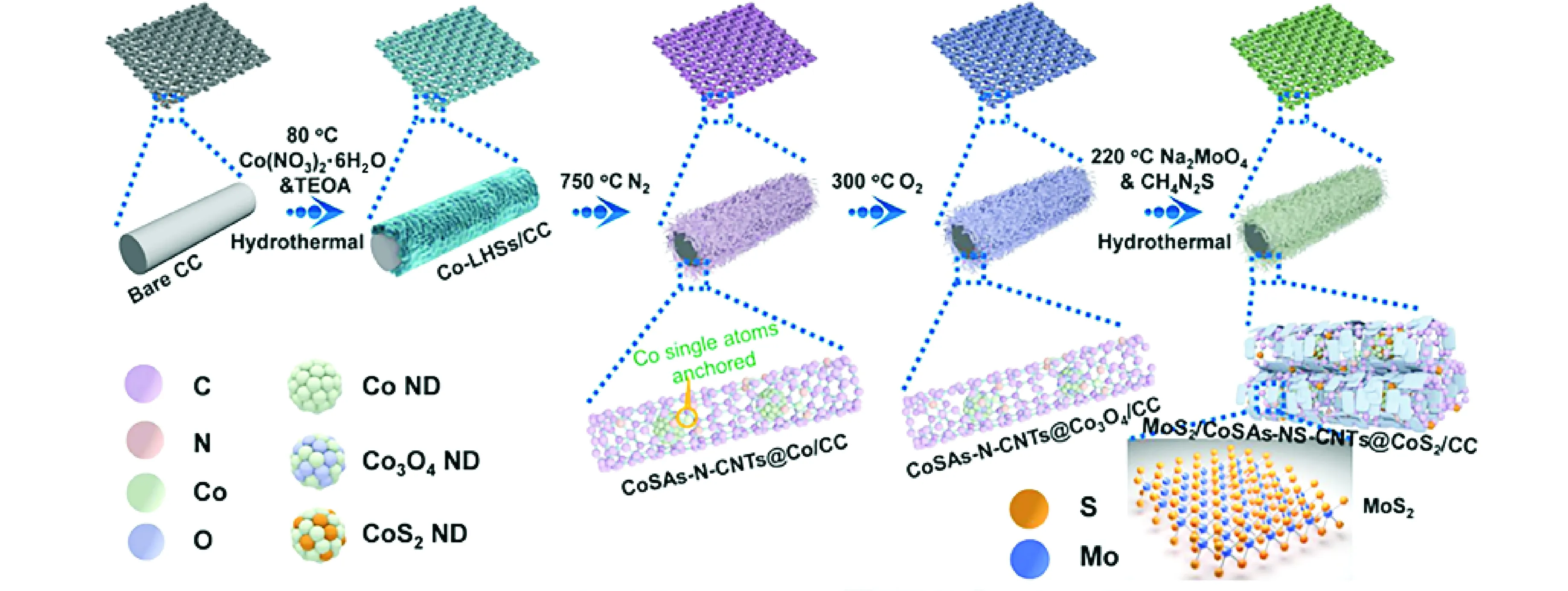
图5 MoS2/CoSA-NS-CNTs@CoS2/CC电极制备示意图[43](版权所有2021, Appl Catal B-Environ)
3 电催化析氢反应催化剂
3.1 过渡金属硫化物
3.1.1 2D-TMS (MS2, M=Mo, W) MoS2和WS2独特的二维S-M-S三原子层状结构有利于暴露更多边缘活性位点,促进材料对H*中间体的吸附。密度泛函理论计算表明,Mo在MoS2(101)边缘的ΔGH值为0.08 eV,接近于Pt(0 eV)[44],预示着其具有与Pt基材料相当的析氢性能。此外,MS2通常比相应的氧化物具有更好的导电性,且一些分层的MS2材料可显示出金属特性,而成为电催化领域的明星材料[45]。Wang等人[46]通过自模板策略开发了一种N掺杂MoS2纳米晶体多孔碳网络结构(N-MoS2/CN),N掺杂可以激活MoS2边缘位点,且多孔碳网络结构与N-MoS2纳米晶体的协同作用可为析氢反应提供更多活性位点。因此,N-MoS2/CN表现出优异的HER活性,是最好的MoS2基HER电催化剂之一。
WS2的结构及电子排布与MoS2十分相似,也可作为析氢电催化剂的有效成分之一。2012年,Wu等人[47]通过简单球磨-硫化策略以WO3和S为起始原料,制备了新型的WS2纳米片催化材料。由于球磨的预处理,使得WS2具有独特的松散堆积层结构,为析氢反应提供了高度暴露的边缘活性位点。Han等人[48]通过调控WS2层数、S空位以及丰富边缘位点来实现基于弯曲WS2纳米片在纳米晶衍生的介孔石墨烯中的外延生长,以获得高内在析氢活性的WS2@rGO催化剂(见图6)。由于结构、应变、S空位以及边缘位点的协同作用,使得WS2@rGO电极在HER中表现出类Pt性能。


图6 WS2@rGO电极 (a)设计示意图,不同催化剂在1 mol·L-1 KOH溶液中(b) HER极化曲线和(c) Tafel图(版权所有2020, Adv Mater)
NixSy(NiS, Ni3S2, Ni7S6)具有与钴硫化物相似的特性,如价态丰富、成本低廉、环境友好。因此也得到了研究者们广泛的关注[52]。Jiang等人[53]通过微波辅助法制备了3种晶体构型的硫化镍(NiS,NiS2,Ni3S2)电极材料并研究其析氢催化性能。电化学测试研究(见图7)表明,Ni3S2具有最高的HER活性,这归因于其独特的表面化学性质以及良好的电导率。Tong等人[54]采用一步热溶剂法,以泡沫镍为自支撑材料与镍源,硫粉为硫源,添加十六烷基三甲基溴化铵和水合肼作为溶剂,有效地控制Ni3S2纳米片原位外延生长在纳米棒上,该材料独特的3D同质结构为析氢反应提供了大量的催化活性位点,展现出杰出的电催化析氢活性。Wang等人[55]考虑到NiS和Pt3Ni组分之间的协同作用,构建了一个既有利于促进水解离(NiS)又有利于H*中间体向H2转化(Pt3Ni)的异质结构Pt3Ni/NiS,由该方法制备的Pt3Ni/NiS电催化剂在很宽的pH值范围内均具有优异的HER活性。优化后的Pt3Ni/NiS材料在达到372 A·m-2的大电流密度下显示出-70 mV的低过电位,超过了商业Pt/C材料在碱性环境中的HER活性。

图7 NiS, NiS2, Ni3S2电极在1 mol·L-1 KOH溶液中(a) HER极化曲线和(b-d) Tafel图[53](版权所有2016, Catal Sci Technol)
在众多由不同化学计量组成的硫化铁(FexSy)中,黄铁矿FeS2具有多种晶型,可通过形貌工程调控实现高析氢活性,常常被作为HER电催化剂[56]。Jasion等人[57]通过调整前驱体溶液中的铁硫比例n(Fe)∶n(S),合成了不同形态的FeS2(一维线和二维圆盘)并对其进行电催化性能研究。电化学结果表明,二维圆盘FeS2结构比一维线结构展示出更优的析氢性能,且该材料具有长达125 h的电催化析氢稳定性,得益于二维材料比一维材料具有更多的电催化活性位点,加快了电解液渗透速度,有效利用电极材料的内部活性位点以实现析氢性能的提高。介孔材料是一种三维材料,较二维材料更容易暴露催化活性位点,是电催化领域中的明星材料。Miao等人[58]通过溶胶-凝胶法获取前驱体Fe2O3,随后通过硫化处理成功制备具有大量介孔结构的FeS2纳米颗粒。该材料独特的介孔结构使得FeS2比商业FeS2具有更大的表面积和丰富的活性位点,在-96 mV低过电位下可实现100 A·m-2的电流密度。此外,DFT计算也表明介孔FeS2具有丰富的活性界面,与H2O分子具有很强的结合力,有助于H2O分子快速吸附在电极表面,加快其在碱性电解质中HER反应动力学过程。由此可知,在导电模板上生长材料形成介孔结构是加速HER动力学过程的有效策略。
3.2 过渡金属氧化物
3.2.1 单金属氧化物 过渡金属氧化物(TMO)因成本低、本征活性高和稳定性强等优点,为开发具有高效电催化作用的析氢催化剂提供了广阔的前景[59]。由单一过渡金属组成的过渡金属氧化物是金属氧化物家族中最常见的氧化物,如NiO, CoO, TiO2, MoO3, WO3, MnO2及CeO2等。目前研究者已通过多种方法实现金属氧化物作为HER电催化剂的高效活性[60]。如Guo等人采取自嵌入模板策略,通过在微观尺度上模拟气凝胶结构,成功地将尺寸可控的TMO纳米粒子组装成表面富集碳物质的3D网状结构TMO@C-QA(见图8)[61]。经过实验分析,Co3O4@C-QA得益于气凝胶互连结构的自嵌入模板的使用,加快了材料的电子传输而表现出高电导率以及优异的电化学活性。

图8 Co3O4@C-QA电极 (a)设计示意图,不同催化剂在1 mol·L-1 KOH溶液中(b) HER极化曲线和(c) Tafel图[61](版权所有2020, Adv Funct Mater)
3.2.2 尖晶石型金属氧化物 尖晶石型金属氧化物可用AB2O4的通式表示,其中A表示四面体位置的二价过渡金属离子,而B表示占据八面体位置的三价过渡金属离子。A和B位可以被相同的元素(如Co3O4)或不同的元素(如NiCo2O4)占据。由于易于合成、成本低廉和成分可调,尖晶石氧化物在电催化方面引起了研究者们极大的兴趣。Zhu等人[62]通过电化学牺牲模板法制造了具有分级孔隙率的中空Co3O4微管阵列(Co3O4-MTA)。该阵列具有中空内部和多孔壳,在碱性条件下对HER表现出极高的催化活性,具有低起始过电位和高电流密度。Peng等人[63]开发了一种“吸附-煅烧-还原”策略(见图9)来制备一系列具有丰富氧空位多壳空心结构的独特项链状尖晶石氧化物(NiCo2O4, CoMn2O4, NiMn2O4)。与原始NiCo2O4相比,还原后的样品显示出更好的HER活性,在1 mol·L-1KOH中表现出-135 mV的过电位和52 mV·dec-1的Tafel斜率。表明通过“吸附-煅烧-还原”获取氧空位是提高催化材料析氢性能的有效策略。此外,尖晶石氧化物的HER催化能力也可以通过传统的掺杂策略得到提升[64]。
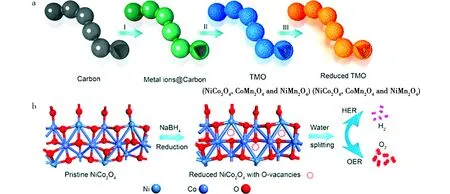
图9 R-TMO电极 (a)设计示意图,(b) 还原后NCO表面产生氧空位缺陷示意图[63](版权所有2018, J Am Chem Soc)
3.2.3 金属(氧)氢氧化物 过渡金属(氧)氢氧化物是一种层状金属氧化物,具有成本低、比表面积大、碱稳定性好、电子分布独特等特点而具有较大的析氢应用前景[65]。最近,Zhang等人[66]通过一锅水热法合成了由二维薄片组装的Fe取代分级VOOH空心球纳米材料,优化后的VOOH-3Fe在碱性溶液中于100 A·m-2下显示出-93 mV的低过电位。根据DFT理论计算发现,与Fe掺杂前VOOH的电化学活性位点相比,Fe掺杂后VOOH的电化学活性位点可产生更优的吉布斯吸附自由能,增强了该催化剂在碱性环境中的析氢活性。Li等人[67]通过简单电化学沉积法使用阴离子(S2-)掺杂来提高CoOOH的HER活性,由于掺杂后Co原子的t2g轨道状态发生改变而导致CoOOH导电性增强。此外,在电化学过程中原位生成的新组分CoO(OH)1-xSx也可以进一步提高金属(氧)氢氧化物的HER性能。
4 结论与展望
电解水制氢是目前使用广泛的制氢方法之一,但由于其通常需要外加催化剂来降低析氢反应势垒,因此,高活性析氢催化剂的研发显得尤为重要。目前,过渡金属硫/氧化物因其成本低廉、导电性良好、稳定性较高,被认为是有效的电催化析氢材料。本文简要概述了电催化析氢过程机理,总结了几种提高过渡金属基化合物析氢活性的策略并分类讨论了过渡金属硫化物与氧化物材料的合成方法及其电催化活性。
基于以上分析,过渡金属基析氢催化剂日后研发趋势具有以下特点:(1)优良的析氢催化剂具有较多的催化活性位点及较低的电荷转移阻抗。自支撑材料避免了黏合剂的使用,能有效降低电极电荷转移阻抗,为反应产生尽可能多的催化活性位点;(2)为能满足工业化生产要求,稳定性对于析氢催化剂是至关重要的,元素掺杂以及复合工程是提升材料稳定性的有效方法;(3)考虑到对环境以及对电催化剂本身的影响,今后电解水分解介质的发展倾向于中性介质、条件温和。因此,制备出更多适用于中性环境的析氢催化剂是目前的大趋势。基于过渡金属硫/氧化物的析氢催化剂的研究还需进一步深入,尤其是关于如何避免催化材料在长时间工作下催化效能下降或失活等现象。结合以上提高材料析氢活性的策略,可为将来制备成本低廉、高效稳定的新型电催化剂,实现可持续规模化制氢及清洁利用提供思路。
